3 Onemocnění hrudní stěny a pohrudnice
3.1 Anatomie hrudní stěny a pleurální dutiny
Hrudník má tvar komolého kužele ohraničeného horní hrudní aperturou, muskuloskeletálními komponentami hrudního koše a dolní hrudní aperturou. Horní hrudní apertura topografcky, ne anatomicky, odděluje krční prostor od hrudníku, má ledvinovitý tvar, tvoří ji manubrium sterna, kostoklavikulární skloubení, první dvě žebra a tělo 1. hrudního obratle. Horní hrudní aperturou probíhá řada důležitých struktur (jícen, trachea, tepny oblouku aorty, přítoky horní duté žíly, brániční, bloudivé a vratné nervy). Kupula pleurální a apex plíce na obou stranách dosahují nad úroveň horní hrudní apertury, jsou kryty částí hluboké krční fascie (suprapleurální, Sibsonovy). Kostěná část hrudního koše je tvořena hrudní kostí, která se skládá z rukojeti, těla a mečíku. Rukojeť (manubrium sterni) je skloubena s klíčky a chrupavkami prvních žeber. Tělo (corpus) hrudní kosti artikuluje s 2.–7. žebrem. Mečík (processus xiphoideus) je chrupavčitý, osifkuje po 30. roce života. Nikdy neosifkující osteochondrální junkce (a kostovertebrální klouby) dovolují ventilační pohyby hrudní stěny. Prvních 7 párů žeber nazýváme pravými, protože jsou skloubeny přímo se sternem. Osmá, devátá a desátá žebra označujeme jako nepravá, protože jejich chrupavky spoluutvářejí žeberní oblouk, na sternum se neupínají. 11. a 12. pár žeber je volný, tato žebra artikulují pouze s příslušnými obratli. Bránice odděluje hrudník od břišní dutiny na úrovni mečíku, žeberního oblouku, 12. páru žeber a 12. obratle (dolní hrudní apertura).
Dutina hrudní je zevnitř vystlána parietální pleurou (pohrudnicí), která kryje kupulu jako pleura cervikální, žebrům odpovídá pleura kostální, bránici diaragmatická, mediastinu pak mediastinální. Pohrudnice přechází v oblasti plicních hilů a plicního ligamenta na plíci, kterou pokrývá včetně interlobárních zářezů jako pleura viscerální (poplicnice). Mezi oběma pleurami je štěrbinovitý prostor vyplněný nepatrným množstvím serózní pleurální tekutiny, která dovoluje plíci klouzat v hrudním koši během respiračních pohybů. V klidu je v pleurální dutině negativní tlak přibližně –5 cm H20, který může při usilovném nádechu klesnout až na –60 cm H2O, při Valsalvově manévru lze vyvinout přetlak kolem + 40 cm H20. Při klidové respiraci osciluje tlak v pleurálním prostoru mezi –15 a 0 cm H2O.
3.2 Onemocnění hrudní stěny
3.2.1 Vrozené vady a deformity
Vrozené vady hrudníku postihují nejčastěji přední hrudní stěnu, dělíme je do čtyř skupin:
- vpáčený hrudník (pectus excavatum),
- ptačí hrudník (pectus carinatum),
- Polandův syndrom,
- rozštěp sterna (včetně ectopia cordis).
3.2.1.1 Vpáčený hrudník (pectus excavatum)
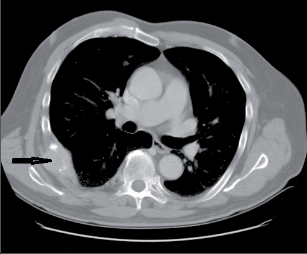
Jedná se o nejčastější vrozenou deformitu hrudníku s incidencí přibližně 1/400 narozených. Je 4× častější u chlapců, většina onemocnění je diagnostikována v prvních letech života. Patofyziologickým podkladem této vady je angulace a deprese dolní části sterna s dorzální angulací příslušných ventrálních úseků žeber. Deformace nemusí být symetrická, častou komorbiditou je skolióza, dokonce jsou popsány kombinace pectus carinatum a excavatum. Příčina této vady není jednoznačně vysvětlena, uvažuje se o chybném růstu žeberních chrupavek v období fetálního růstu a o nefyziologickém tahu vazů spojujících vnitřní plochu sterna s bránicí. Vrozené deformity hrudníku jsou častější u pacientů s Marfanovým syndromem, lze předpokládat souvislost s chybným vývojem mezenchymálních tkání. Klinicky se vada projevuje různě hlubokým vpáčením dolní části přední hrudní stěny, manubrium sterna a artikulace prvních dvou žeber jsou vždy v normální pozici. Diagnostika není složitá, deformita je patrná na první pohled, už proto s sebou nese i vedlejší psychosociální aspekty (deprese, sociopatické poruchy zvýrazněné zejména během adolescence). Další vyšetření jsou nutná pro indikaci výkonu. Na CT lze poměřit Hallerův index (poměr mezi šířkou hrudníku a sternovertebrální distancí), pokud je větší než 3,5, je operace indikována. Vpáčený hrudník bývá asociován s arytmiemi a prolapsem mitrální chlopně, z tohoto důvodu je nutné podrobné kardiologické vyšetření, zátěžový test a vyšetření plicních funkcí.
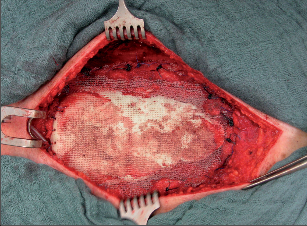
Terapie: Konzervativní léčba (rehabilitace, dechové cviky) má zřetelný efekt naprosto výjimečně a je rezervována jen pro nejlehčí asymptomatické formy. Byla popsána řada korekčních operačních postupů, za typický je možné považovat extrapleurální kombinaci korekční osteotomie v místě největší angulace sterna, subperichondrální resekce žeberních chrupavek a fixaci takto mobilizovaného segmentu sterna v požadované pozici Kirschnerovými dráty či dlahou (obr. 1).
V posledních letech byla Nussem vypracována miniinvazivní metoda, která je založena na nekrvavé repozici vpáčeného segmentu sterna pomocí speciálního elevatoria s fixací retrosternální dlahou z bodového přístupu za kontroly videotorakoskopické optiky (obr. 2, 3).
3.2.1.2 Ptačí hrudník (pectus carinatum)
Tato vrozená deformita je méně častá, okolnosti vzniku jsou stejně málo prozkoumány jako u pectus excavatum, obviňováno je přerůstání předních částí žeberních chrupavek vedoucí ke kýlovité protruzi sterna. Podle lokalizace protruze rozeznáváme typ chondrogladiolární a chondromanubriální, vada může být symetrická i asymetrická, s různě zřetelnou rotací sterna. Symptomatologie je minimální, největším problémem adolescentů je estetický dojem a z toho plynoucí psychosociální potíže. Diagnostika je klinická, CT, event. 3D rekonstrukce může zobrazit kontury hrudníku a nasměrovat okolnosti reparace. Chirurgická intervence přináší dobré výsledky, jednotlivé kroky jsou podobné jako u pectus excavatum: 1–2 korekční osteotomie sterna a resekce žeberních chrupavek (u chondromanubriálního typu už od 2. chrupavky), které dovolují depresi sternálního segmentu do odpovídající polohy, a různé modifikace metod fixujících sternum v potřebné poloze na nezbytnou dobu.
3.2.1.3 Polandův syndrom
Jedná se o vzácné onemocnění charakterizované hypoplazií až aplazií struktur přední stěny hrudní, provázenou často anomáliemi prsu a prstů. Závažnost projevů může kolísat od pouhé hypoplazie sternální porce velkého pektorálního svalu při zachovaném skeletu až po úplnou aplazii obou prsních svalů provázenou chyběním předních úseků 2.–5. žebra a spojenou s impresí hrudní stěny. Příslušný prs může být hypoplastický nebo úplně chybět, včetně bradavky. Součástí syndromu jsou deformity prstů (brachydaktylie, syndaktylie). Při méně závažných defektech není rekonstrukce nutná, pouze u dívek je vhodná augmentace (symetrizace) prsu za předpokladu stabilní hrudní stěny. Pokud chybí segment přední hrudní stěny, je indikována rekonstrukční operace za použití žeberních štěpů z druhé strany či cizího materiálu. Vzhledem k obvyklému chybění či hypoplazii měkkých tkání se zde uplatňují metody plastické chirurgie (posuny svalových laloků, modelace prsu).
3.2.1.4 Rozštěp sterna (včetně ectopia cordis)
Vrozené vady sterna jsou vzácné, ale mohou mít dramatický obraz a kritický vývoj. Dělíme je na tyto entity:
- rozštěp sterna,
- cervikální ektopie srdce,
- hrudní ektopie srdce,
- torakoabdominální ektopie srdce.
Při rozštěpu sterna je srdce ve své správné anatomické pozici. U cervikální ektopie prolabuje srdce defektem horní poloviny sterna, často je spojeno s hlavou. U hrudní ektopie je srdce vytlačeno defektem sterna dopředu, není kryto měkkými tkáněmi.U torakoabdominální ektopie je srdce kryto a dislokováno do abdominální dutiny defektem bránice.Reparace rozštěpu sterna je snadná u novorozenců,kdy elasticita hrudníku dovoluje přímou suturu sterna drátem či syntetickým vstřebatelným vláknem bezvyvolání útlaku srdce. V pozdějším věku je náprava složitější, lze si vypomoci parasternálními chondrotomiemi, které dovolí aproximaci obou sternálních polovin. V případě nutnosti lze využít autologní štěpy z chrupavek a žeber. Implantace cizího materiálu se nedoporučuje z důvodu vyššího rizika infekčních komplikací a problémů daných dalším vývojem skeletu. Řešení srdeční ektopie je podstatně náročnější,a to z důvodu nedostatku měkkých tkání, resp. kůže ke krytí srdce, často totiž bývá přítomen i defekt břišní stěny. Samotná operace je většinou dvoudobá, v první době je srdce kryto kožním nebo muskulokutánním lalokem, ve druhé době se reponuje srdce a reparuje defekt přední stěny hrudní. Navzdory úspěchům perinatologie a novorozenecké chirurgie bývá ale pooperační průběh často nepříznivý díky kompresi srdce při jeho krytí a přidruženým (nejen srdečním) vadám. Určitým preventivním řešením takových stavů je dokonalá prenatální diagnostika a případné ukončení těhotenství.
3.2.2 Syndrom horní hrudní apertury
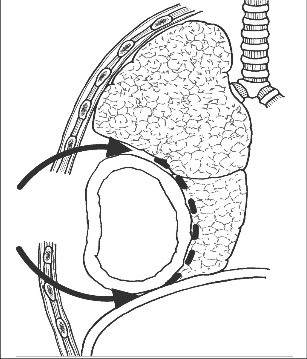
Syndrom horní hrudní apertury je soubor příznaků daných útlakem podklíčkových cév a brachiálního plexu v cervikoaxilárním průběhu v anatomicky definovaných úžinách. Dříve měl řadu podtypů a synonym (skalenový syndrom, hyperabdukční syndrom, syndrom prvního nebo krčního žebra, kostoklavikulární syndrom). Protože se však symptomatologie jednotlivých entit překrývá, stejně jako jejich anatomické a patofyziologické podklady, používá se dnes obecný pojem syndrom horní hrudní apertury (thoracic outlet syndrom). Cervikoaxilární tunel, kterým přecházejí cévy a nervové struktury na paži, dělí průběh 1. žebra na dvě části: proximální, která se dále dělí na kostoklavikulární prostor a skalenový trojúhelník, a distální, vlastní axilu. K útlaku neurovaskulárních struktur predisponují oba oddíly proximální části. Kostoklavikulární prostor je ohraničen klíčkem a prvním žebrem, úpon m. scalenus ant. ho dělí na anteromediální část, kudy probíhá podklíčková žíla, a posterolaterální část s průběhem tepny a brachiálního plexu. Prostor ohraničený průběhem m. scalenus anterior a medius, kaudálně limitovaný 1. žebrem, kterým prostupuje plexus brachialis a tepna pod klavikulu, se nazývá skalenový trojúhelník (obr. 4).
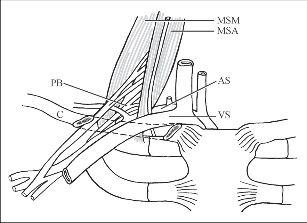
Obr. 4
Skalenový trojúhelník
(AS – a. subclavia, VS – v. subclavia, MSA – m. scal. anterior, MSM – m. scal. medius, PB – plexus brachialis, C – clavicula)
Příčin komprese nervověcévního svazku je mnoho, nejčastější jsou anatomické (zúžení kostoklavikulárního prostoru nebo skalenového trojúhelníku), vrozené (krční žebro, hypertrofie proc. transversus7. obratle, zdvojené či rudimentární první žebro, vazivové pruhy mezi těmito strukturami) nebo traumatické (zlomeniny klíčku, 1. žebra). Symptomatologie je dána útlakem cév nebo častěji nervů, může být kombinovaná. Typickými projevy jsou parestezie a bolesti postižené končetiny vyjádřené více v inervační oblasti n. ulnaris. Komprese podklíčkové tepny způsobuje chlad končetiny, hypestezii, snadnou unavitelnost a difuzní bolesti. Příznaky žilní obstrukce jsou méně časté díky četným kolaterálám do povodí v. jugularis, typický obraz (cyanóza, teplý otok, rozšíření podkožních žil, bolest) má akutní trombóza podklíčkové žíly. Všechny příznaky se obvykle manifestují nebo zhoršují při abdukci paže a hyperextenzi krku. Diagnostika není jednoduchá. Kromě pátrání po skeletálních abnormitách (RTG, CT, MRI) lze použít klinické testy, které sledují oslabení či vymizení pulzu na art. radialis:
- skalenový test – nádech, extenze krku, otočení hlavy na stranu,
- kostoklavikulární test – vojenský postoj – ramena dozadu a dolů,
- hyperabdukční test – hyperabdukce paže do 180 stupňů.
Největší význam má vyšetření neurofyziologické, resp. elektromyografické – sledování rychlosti přenosu potenciálů ulnárním nervem (ulnar nerve conduction velocities – UNCV). Normální rychlost je 72m/s, snížení pod 70 m/s je příznakem nervové dysfunkce. Terapie může být konzervativní: fyzioterapie, rehabilitace. Pokud nevede k úspěchu (UNCV zůstává pod 60m/s a přetrvávají potíže), je indikována chirurgická intervence. Bylo vypracováno mnoho sofistikovaných postupů pro operace krčního žebra, elongovaných příčných výběžků či skalenových svalů. Postupně se ukázalo, že základním a společným anatomickým podkladem většiny problémů je první žebro a že jeho odstranění (a případná resekce krčního žebra) vede k úspěchu asi u 90 % nemocných. Zbývající otázka (jakým přístupem) byla vyřešena ve prospěch transaxilární resekce, která dává nejlepší přehled a nejméně komplikací. V případě reintervence je k prvnímu žebru, resp. jeho zbytku, obvyklý zadní transmuskulární přístup.
3.2.3 Zánětlivá onemocnění hrudní stěny
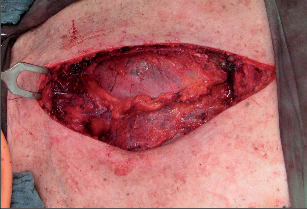
Hrudní stěna může být postižena zánětem buď v celé tloušťce, nebo se inflamace omezuje na jednotlivé vrstvy. Průběh zánětu kůže, podkoží a měkkých tkání se neliší od podobných onemocnění jinde na těle, postižení skeletu má své typické konsekvence. Spektrum patogenů je široké, většinou lze vykultivovat stafylokoky, streptokoky, E. coli, pseudomonády, dříve byly časté tuberkulózní infekce, i dnes nalezneme aktinomykózu či bakteroidy. Diagnostika flegmonózního zánětu měkkých tkání je klinická (teplota, zarudnutí, otok, bolest), laboratorní (leukocytóza, elevace CRP), při podezření na lokalizovaná ložiska (abscesy) a k vyloučení komunikace např. s pleurální dutinou je indikováno sono, případně CT. Abscesy se mohou vyvinout pod silnou vrstvou svalů (subpektorální) či pod lopatkou (subskapulární), tehdy je klinická symptomatologie spíše celková, lokální nález nepřesvědčivý, pomoc zobrazovacích metod je nezbytná. Primární infekt skeletu (sternum, žebra, chrupavky) je extrémně vzácný, bývají popisovány sternoklavikulární osteoartritidy u diabetiků. Daleko častěji se setkáváme se zánětlivým postižením pevných struktur hrudní stěny po kardiochirurgické nebo torakochirurgické operaci. Nejčastější takovou komplikací je infikovaná dehiscence sterna po kardiochirurgických výkonech, kde k rozvoji osteomyelitidy přispívá devaskularizace sterna daná odběrem mammárního svazku a časté komorbidity (ateroskleróza, diabetes) (obr. 5). Osteomyelitida žebra po torakotomii není častá. Inflamace se může rozšířit do hrudní stěny podél stehů, hrudních drénů nebo podél laloků při fenestraci hrudníku. Léčba zánětu měkkých tkání spočívá v řádné drenáži, excizi nekrotických tkání a v případě flegmonózního postižení s celkovými příznaky také v podání účinné antibiotické terapie. Postižení skeletu má většinou prolongovaný průběh a vyžaduje resekci postižených kostí a chrupavek. V případě osteomyelitidy sterna bývá ztráta tkání významná a ke slovu přicházejí metody rekonstrukční chirurgie (stabilizace sterna a vyplnění defektu muskulokutánním lalokem). V poslední době byla řada takových defektů úspěšně zhojena pomocí uzavřeného drenážního systému (vacuum closed therapy, VAC).
Mondorova choroba (aseptická flebitida podkožních žil přední stěny hrudní) ani Tietzeho syndrom (aseptické zduření prvních žeberních chrupavek) mezi infekční záněty nepatří a chirurgickou léčbu obvykle nevyžadují.
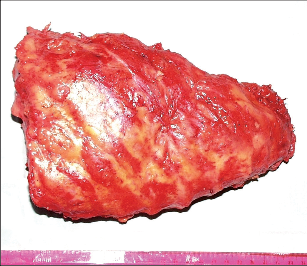
3.2.4 Nádory hrudní stěny
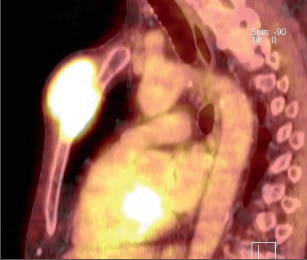
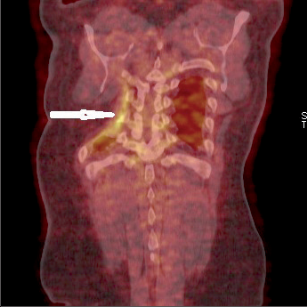
Primární nádory hrudní stěny jsou vzácné, daleko častěji nalézáme v hrudním skeletu metastázy nádorů jiné primární lokalizace (karcinom ledviny, prsu, prostaty, plic) (obr. 6). Neobvyklé není ani přímé prorůstání nádorů plic či prsu do hrudní stěny, stejně jako lokální recidiva těchto tumorů v hrudní stěně. Primární novotvary hrudní stěny zahrnují širokou škálu benigních i maligních mezenchymálních neoplazií, méně početné jsou epitelové nádory a hemoblastomy. Přehled nejčastějších primárních diagnóz:
benigní nádory:
- osteochondrom
- chondrom
- lipom
- fibrom
- neurilemom
semimaligní nádory
- desmoid
maligní nádory:
- maligní histiocytom
- plazmocytární myelom
- lymfom
- Ewingův sarkom
- liposarkom
- leiomyosarkom
- rhabdomyosarkom
- chondrosarkom
- osteosarkom
- neurofibrosarkom
- hemangiosarkom
Osteochondrom je nejčastějším benigním kostním nádorem, představuje asi 50 % benigních nádorů žeber. Formuje se v dětství a jeho růst pokračuje až do ukončení kostní maturace. Vyrůstá z kortexu jako exostóza v oblasti metafýz žeber a je kryt chrupavčitou čepičkou. Bolestivý nádor rostoucí i v dospělosti hrozí malignizací, musí být odstraněn.
Chondrom je také poměrně častý. Je tvořen lalůčky hyalinní chrupavky, nejčastěji vyrůstá v oblasti předních kostochondrálních junkcí. Jeho odlišení od lowgrade chondrosarkomu je obtížné až nemožné, vždy musí být resekován v bezpečných hranicích.
Desmoid bývá nejčastěji lokalizován na hrudníku, v oblasti ramenního pletence a subskapulárně. Typicky obaluje nervové struktury a cévy horní hrudní apertury, paže a krku. Je tvořen vřetenitými buňkami, vyrůstá ze svalů a fascií a šíří se podél nich. Po nekompletním odstranění torpidně recidivuje, nemetastázuje. Recidivy je nutné řešit reexcizí, enkapsulaci důležitých struktur radioterapií.
Maligní fibrózní histiocytom je nejčastějším zhoubným nádorem hrudní stěny. Objevuje se mezi 5.–7. deceniem. Je tvořen vřetenitými fibroblasty v lobulárních či rohožkovitých formacích, mezi kterými jsou vmezeřeny jednojaderné histiocyty a osteoklasty. Vyznačuje se radiorezistencí a chemorezistencí, jediným řešením je dostatečně široká resekce.
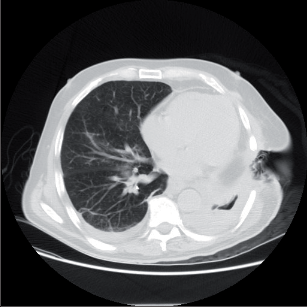
Chondrosarkom je jeden z častějších zhoubných tumorů žeber (obr. 7). Vyrůstá nejčastěji z předních kostochondrálních junkcí. Je vzácný u mladších lidí, většinou nebolestivý a pomalu rostoucí. Histologické rozlišení mezi chondrosarkomem a chondromem je obtížné, i nejistá léze musí být resekována dostatečně široce.
Rhabdomyosarkomy jsou nádory nižšího a dětského věku, rostou rychle, často jsou regresivně změněny (nekrózy, krvácení). Chovají se invazivně, často metastázují. Léčba je kombinovaná (chirurgie následovaná radioterapií a kombinovanou chemoterapií).
Ewingův sarkom je primitivní kulatobuněčný neuroektodermální tumor (PNET). Jedná se o nejčastější malignitu hrudní stěny u dětí. Typické pro nádor jsou periostální formace novotvořené kostní tkáně. Šíří se dřeňovou dutinou, proto je nutná exstirpace celého postiženého žebra a dalších žeber nad a pod lézí. Je vysoce maligní, časně metastázuje, proto po operaci následuje ozáření a kombinovaná chemoterapie, která je indikovaná i pro léčbu diseminovaných nádorů.
Klinicky jsou nádory hrudní stěny většinou asymptomatické, zejména v počátečních stadiích. Později se projevují jako hmatná, pomalu rostoucí nádorová masa s příznaky danými uložením (bolesti, interkostální neuralgie, parézy nervů, syndrom horní duté žíly). Diagnóza je založena na klinickém vyšetření (řada nepokročilých nádorů nemusí být hmatná) a na zobrazovacích metodách. MRI má výhodu přesnější diferenciace od okolních (zejména vaskulárních a nervových) struktur. Protože však většinou pátráme i po eventuálních metastázách či případném primárním nádoru, je výhodnější CT nebo PETCT. Léčba nádorů hrudní stěny je preferenčně chirurgická. Před definitivním řešením je požadována validní biopsie, která vyloučí nechirurgická onemocnění (lymfomy, metastázy nepoznaného původu). Bioptický kanál (punkční či chirurgický) musí být zahrnut do plánu definitivní resekce. Efekt chemoterapie a radioterapie je limitován, v adjuvantním režimu lze indikovat radioterapii při pozitivních nebo nejistých resekčních liniích. Léčba generalizovaných stavů je systémová.
3.2.5 Operační výkony na hrudní stěně
3.2.5.1 Resekce hrudní stěny
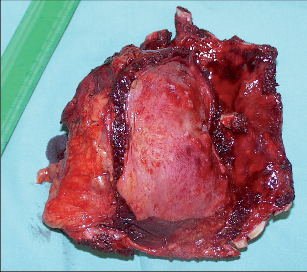
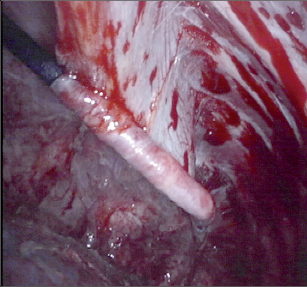
Pro primární nádory hrudní stěny platí čtyřcentimetrový rozsah makroskopických negativních resekčních linií. Další zásadou je resekce nejméně jednoho nepostiženého žebra nad a pod makroskopickým nádorem. Stejné zásady platí pro direktní invazi nádorů plic či prsu do hrudní stěny. U benigních lézí a sekundárních novotvarů jsou tolerovány dvoucentimetrové bezpečnostní linie. Kožní incize bývá vedena nad tumorem, měla by zaujímat bioptický kanál a v případě infiltrace patřičný bezpečnostní lem. Nepostižené extratorakální svaly by měly být šetřeny, stejně jako jejich cévní zásobení pro event. následnou rekonstrukci (m. latissimus dorsi, m. pectoralis major), vlastní svaly hrudní stěny (interkostální) jsou součástí resekovaného bloku. V případě primárního maligního nádoru nebo direktní invaze plicního karcinomu do hrudní stěny začíná explorace rozsahu postižení otevřením pleurální dutiny z torakotomie mezižebřím pod nebo nad prvním nepostiženým žebrem. Provede se palpační ověření lokálního rozsahu nádoru a stanovení bezpečných resekčních linií (obr. 8). Tuto fázi lze doplnit nebo nahradit videotorakoskopickou revizí. Pokud není zašlá pohrudniční dutina, je přehled většinou výborný. I v případě direktní penetrace nádoru do plic nebo naopak lze takto vymezit bezpečný rozsah resekce dostatečně přesně. Po vymezení resekčních linií probíhá vlastní resekce většinou zdola v tomto sledu:1. přerušení interkostomuskulární junkce nad okrajem 2. nepostiženého žebra,2. transsekce bloku hrudní stěny ve ventrálních a dorzálních liniích v odpovídající vzdálenosti od tumoru,3. protětí posledního úseku hrudní stěny nad prvním nepostiženým (resp. 1. anatomickým) žebrem. Interkostální svazky ventrálně i dorzálně je třeba během resekce bezpečně ligovat. Infiltrované struktury a tkáně podezřelé z invaze (pleura, plíce, perikard, bránice, svaly, lopatka) je třeba resekovat en bloc v zájmu kompletní (R0) resekce.V případě nádorů typických intramedulární propagací (Ewingův sarkom) je třeba postižená žebraresekovat celá (protětí v chrupavčité části ventrálněa exartikulace dorzálně).
3.2.5.1.1 Rekonstrukce
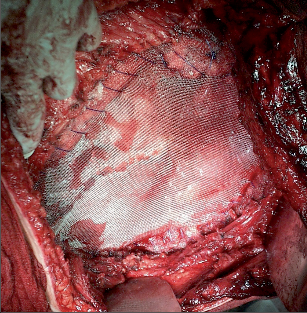
Rekonstrukce hrudní stěny není nutná u malých defektů, resekci jednoho žebra lze řešit perikostální suturou nebo pomocí perikostálních laloků sousedních žeber. Defekty subskapulárně do výše 4. žebra nemusí být rekonstruovány, protože jsou kryty lopatkou a jejím masivním svalstvem. Pokud dolní okraj resekovaného segmentu dosahuje do nižších mezižebří, hrozí zapadání lopatky do defektu, rekonstrukce je nutná. V dorzálních partiích a v laterální konvexitě hrudníku nemusí být rekonstrukce stabilní, samotná polypropylenová síťka stabilizuje hrudní stěnu většinou uspokojivě (obr. 9, 10).V případě resekcí předního segmentu hrudníku je kosmetický i funkční defekt natolik významný, že je rigidní rekonstrukce (například sendvičovou polypropylenovou síťkou s kostním cementem) metodou volby. Ke stabilizaci záplaty lze samozřejmě využít kovové (titanové) dlahy či autotransplantáty žeber. Následuje rekonstrukce měkkých tkání, nejčastěji posunem plochých svalů z okolí (m. latissimus dorsi, m. pectoralis major, m. rectus abdominis, m. trapezius). Pokud se nedostává kůže, jsou tyto svaly transponovány v podobě muskulokutánních laloků.
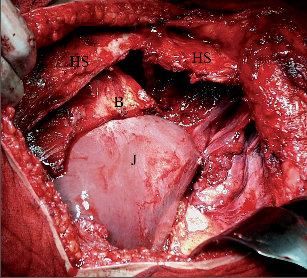
3.2.5.2 Resekce sterna
Sternum má zásadní podíl na mechanice dýchání, proto je vhodné alespoň část kosti, jeli nepostižená, ponechat (obr. 11).
Spolu s resekovanou hrudní kostí je zvykem resekovat odpovídající žeberní chrupavky, případně i části ventrálních úseků žeber (obr. 12).
Pokud to rozsah infiltrace dovoluje, výhodou je zachování alespoň jednoho vnitřního mammárního cévního svazku pro případnou další rekonstrukci lalokem přímého břišního svalu.
Rekonstrukce chybějící přední stěny hrudní by měla být rigidní (sendvič polypropylen/kostní cement, polymetylmetakrylátová destička, pevná síťka+ autotransplantáty žeber či titanové dlahy) (obr. 13,14).
V případě septických defektů (poststernotomická osteomyelitida) je primární rigidní rekonstrukce obtížná, používá se kombinace osteosyntézy (resuturadráty, dlahy), VAC systému s případnou odloženou rekonstrukcí měkkých tkání svalovými laloky či omentem.
3.2.5.3 Torakoplastika
Torakoplastikou označujeme odstranění žeber z hrudní stěny dovolující její trvalý kolaps, který slouží k obliteraci chronických dutin či infikovaných zbytkových prostorů (chronické kaverny, postpneumonektomické empyémy). Tato metoda byla kdysi stěžejním krokem kolapsoterapie tuberkulózy. Díky efektivní chemoterapii byla torakoplastika téměř eliminována z operačního rejstříku jako výkon velmi náročný a mutilující, zatížený vysokou morbiditou a mortalitou. Přesto i v současnosti existuje skupina nemocných, u kterých může být odpovídající torakoplastika definitivním řešením závažného a komplikovaného stavu. Torakoplastiky dělíme na:
- intrapleurální,
- extrapleurální,
- plombáže,
- limitované torakoplastiky.
3.2.5.3.1 Intrapleurální torakoplastika
Byla vypracována Schedem. Přístupem byla dlouhá U incize měkkých tkání, která vytvořila široký lalok kůže a extraskeletálních svalů hrudní stěny (m. latissimus, m. serratus ant.). Tímto lalokem byla po resekci žeber, interkostálních svazků a parietální pleury kryta takto vzniklá široká ranná plocha (kolabovaná plíce nebo mediastinum). Tato operace vedla k těžké deformitě hrudníku, anestezii odpovídající hrudní a břišní stěny, k pooperačním střevním paralýzám, doznala řady modifikací, v současnosti už se nepoužívá.
3.2.5.3.2 Extrapleurální torakoplastika
Používá se dodnes. Za klasickou je považována Alexandrova třístážová operace, při které se v několikatýdenních intervalech odstraňují žebra od přední stěny a pohrudnice axilární čáry až k hlavičkám (1.–3., 4.–7., 8.–11.). Při totální torakoplastice se odstraňuje prvních 11 žeber, při parciální 10 a méně. Při rozšířené jsou navíc resekovány i přední úseky horních žeber v zájmu dosažení lepšího kolapsu apikálních lézí. Při Alexandrově operaci jsou žebra resekována subperiostálně, kolaps hrudní stěny je uspokojivý, ponechaný periost žeber umožňuje vznik kostních regenerátů, které časem torakoplastiku stabilizují. Vedou se spory, zda resekovat první žebro, jehož odstranění spolu s resekcí transverzálních výběžků horních hrudních obratlů vede k vážným skoliózám a poruchám hybnosti ramenního pletence. Tento krok může být uspokojivě nahrazen apikolýzou (tedy uvolněním apexu plíce a měkkých tkání kaudálně směrem k obliterované dutině). Nevýhodou této operace je déletrvající instabilita hrudní stěny.
Jinou alternativou k řešení apikálních lézí je Björkova osteoplastická operace, při které jsou stupňovitě resekovány dorzální úseky proximálních žeber v narůstající délce tak, aby mohly být fixovány drátem k žebru kaudálně od ložiska, které je třeba zkolabovat.
3.2.5.3.3 Plombáže
Jedná se o operace, kdy dutinu kolabujeme extrapleurálně, extrafasciálně či extraperiostálně uloženým materiálem (parafín, vlastní krev, vazelínová gáza, silikon, tuk, metakrylátové kuličky). S vypracováním technik omentoplastiky a myoplastiky ztratily plombáže cizím materiálem význam. Andrewsova torakomyoplastika je určena k řešení menších povrchně uložených infekčních ložisek. Sestává ze subperiostální resekce žeber nad dutinou, otevření ložiska lůžkem žebra a kyretáže nekrotické a granulační tkáně. Následuje fixace pleuromuskuloperiostálního laloku do spodiny dutiny početnými U stehy.
3.2.5.3.4 Limitované torakoplastiky
Slouží ke zmenšení infikovaných zbytkových prostorů po (při) resekcích plíce. Žebra jsou resekována v nezbytném rozsahu tak, aby nebyla ohrožena stabilita hrudní stěny a neprojevilo se paradoxní dýchání (obr. 15).
3.3 Onemocnění pleury
3.3.1 Pleurální výpotek
Patologické nahromadění tekutiny v pleurální dutině se nazývá fluidotorax, podle charakteru výpotku může jít o hydrotorax (serózní tekutina), pyotorax či empyém (hnis, zánětlivý výpotek), hemotorax (krev) či chylotorax (chylus). Výpotek označujeme za transsudát, pokud obsahuje méně než 30 g bílkoviny na litr a má specifickou váhu menší než 1,016. Vyššími hodnotami obou veličin je charakterizován exsudát. Pokud je v dutině pohrudniční zároveň vzduch, mluvíme o fluidopneumotoraxu, podle charakteru výpotku může jít např. o hemopneumotorax či pyopneumotorax.
3.3.2 Pneumotorax
Pneumotorax (PNO) je klasifikován jako akumulace vzduchu v pohrudniční dutině, které odpovídá kolaps příslušné plíce.
- Sekundární spontánní pneumotorax (SSPNO) je důsledkem preexistující plicní nemoci – chronické obstrukční choroby plicní, plicního emfyzému, plicní fibrózy, tuberkulózy apod.
- Traumatický pneumotorax je důsledkem úrazového děje, při kterém je poraněna hrudní stěna, případně tracheobronchiální strom, plíce nebo jícen.
- Iatrogenní pneumotorax je důsledkem invazivních léčebných postupů, kanylace horní duté žíly a transparietální biopsie plic jsou nejčastějším vyvolávajícím dějem. Zvláštní formou je terapeutický pneumotorax používaný dříve ke kolapsoterapii plicní tuberkulózy.
Pokud není porušena hrudní stěna, považujeme pneumotorax za uzavřený. Penetrující poranění hrudní stěny způsobují pneumotorax otevřený. Pokud se léze v hrudní stěně, průdušce či plíci chová ventilovým způsobem, to znamená, že při nádechu se do pleurální dutiny dostává porce vzduchu, která nemůže být za výdechu evakuována, hovoříme o pneumotoraxu tenzním. Defekt hrudní stěny větší, než je průřez průdušnice, hrubým způsobem narušuje mechaniku dýchání, při nádechu proudí vzduch dovnitř poraněného hemitoraxu a způsobuje přesun mediastina na zdravou stranu, při výdechu je mezihrudí naopak přetlačováno na stranu poraněnou. Tomuto jevu se říká vlání mediastina. Plíce postižené strany je kolabovaná, plicní parenchym druhé strany také nepracuje, pouze neefektivně sleduje pohyby hrudní stěny a bránice. Jedná se o závažný, život ohrožující stav, podobně jako v případě tenzního pneumotoraxu. Oba tyto stavy považujeme za náhlé příhody hrudní. Zatímco hlavní příčinou respiračního selhání u otevřeného pneumotoraxu je porucha mechaniky dýchání, v případě tenzního pneumotoraxu dominuje porucha návratu žilní krve k srdci. Nasávání a akumulace vzduchu v pohrudniční dutině ventilem v hrudní stěně (nebo v tracheobronchiálním stromu) vedou k postupnému stlačení příslušné plíce k hilu, konečným důsledkem je přetlačení mediastina na protější stranu působící útlak, resp. angulaci a zaškrcení obou dutých žil a kompresi druhé plíce.
Jako kompletní označujeme pneumotorax s úplným kolapsem plíce. Částečný PNO vzniká tehdy, kdy je plíce udržována v částečném rozvinutí srůsty. Plášťovým pneumotoraxem rozumíme malou akumulaci vzduchu v pohrudniční dutině se separací pohrudnice/poplicnice menší než 2,5 cm.Klinické projevy nekomplikovaného PNO jsou nevýrazné a nespecifické: bolest na hrudníku, dušnost, kašel. Vážnost jejich manifestace narůstá s tíží případného onemocnění plic a mírou kolapsu plíce. Nejvážnější symptomatologii (dušnost, cyanóza, zvýšená náplň krčních žil, celková deteriorace, tachykardie, kardiorespirační selhávání) má tenzní pneumotorax. Průběh může být perakutní, je dán přetažením mediastina na nepostiženou stranu, útlakem nepostižené plíce, velkých žil a nízkotlakých srdečních oddílů.
Diagnostika je klinická (hypersonorní poklep, vymizení dýchacích fenoménů, menší dýchací pohyby na postižené straně). K potvrzení stačí zadopřední, event. i bočný skiagram hrudníku. CT slouží spíše k posouzení změn plicního parenchymu, je přínosnější až po reexpanzi plíce. V diferenciální diagnóze je třeba pomýšlet na objemné plicní buly, plicní cysty nebo brániční herniaci. Terapie může být konzervativní, u asymptomatických nemocných s plášťovým pneumotoraxem pouze observace, případně jednorázová aspirace, u symptomatických nemocných hrudní drenáž. U nemocných se sekundárním pneumotoraxem na podkladě neřešitelné malignity má místo chemická pleurodéza, stejně jako u nemocných inoperabilních z jiných důvodů. Prevence recidivy u nemocných v riziku (potápěči, letci) a terapie recidiv je až na výjimky chirurgická. Základem je revize a ošetření zdroje úniku (např. apikální resekce, staplerová sutura), neméně významné je dosažení pevné pleurodézy, dnes většinou videotorakoskopicky kombinací apikální pleurektomie a mechanické pleurodézy (pleurabraze kostální a diafragmatické pleury). V této podobě lze očekávat asi 95–97% úspěšnost intervence. První pomocí u tenzního pneumotoraxu je bezprostřední drenáž nebo alespoň punkce hrudníku širokou jehlou. Aktivní sání není podmínkou, chlopeň nebo alespoň vodní ventil jsou vhodné.
3.3.3 Empyém
Hrudní empyém je nahromadění hnisu v pohrudniční dutině. Může jít o neohraničený proces postihující celou pohrudniční dutinu (empyema completum), nebo je hnisavá kolekce v pohrudniční dutině ohraničena (empyema saccatum). Lokalizované empyémy jsou nejčastěji uloženy nástěnně dorzobazálně, paramediastinálně, parakardiálně, supradiafragmaticky nebo v interlobárních štěrbinách (obr. 16).Etiologicky se jedná vždy o komplikaci jiného onemocnění, podle vyvolávajícího původce je dělíme na:
- empyém nespecifický,
- empyém specifický,
- empyém mykotický,
- empyém parazitární,
- empyém smíšený.
Nadpoloviční většina empyémů vzniká jako komplikace pneumonie (parapneumonický empyém), asi třetina vzniká v důsledku nitrohrudních operací nebo úrazů hrudníku, méně časté jsou další příčiny (perforace jícnu, bronchiektázie, sekvestrace plicní, parazitární či specifické empyémy).
Průběh empyému dělíme do tří typických stadií:
- stadium exsudativní,
- stadium fibropurulentní,
- stadium organizace (fibrotorax).
V první, exsudativní fázi, která trvá 1–2 týdny, dochází k průniku bakterií do původně sterilního parapneumonického exsudátu a k inflamatorním změnám parietální, méně viscerální pleury. Zpočátku tekutý výpotek získává na koncentraci bílkovin a fibrinua stává se viskózním, resp. gelatinózním.
Druhé, fibropurulentní stadium trvá opět asi 1–2 týdny, je charakterizováno leukocytární zánětlivou reakcí, tvorbou typického hnisu a ukládáním silných fibrinových náletů zejména na parietálnía diafragmatické pleuře.
Nakonec, ve stadiu organizace, dochází k vytvoření silné pyogenní membrány, do fibrinových depozit prorůstají fibroblasty, jimi produkovaná kolagenní vlákna postupně svrašťují slupku empyému do pevné vazivové desky, u totálního empyému až úplného krunýře utlačujícího odpovídající plíci. Granulační tkáň postihuje do nevelké hloubky i subpleurální plicní parenchym a mezižeberní tkáně. Postupné vyzrávání vazivové tkáně, které začíná asi třetí týdenod vzplanutí infekce pleurálního prostoru, končí asipo 5–8 týdnech uvězněním plíce v hemitoraxu, který je zmenšen přesunem mediastina na postiženou stranu, elevací bránice a zúžením mezižebří. Důsledkem je určitý, u kompletního empyému vážný limit ventilačních parametrů.Klinické příznaky empyému většinou navazují na předchozí pneumonické projevy. Rekurence febrilií, dušnost, zchvácenost, pleurální bolest, váhový úbytek, tachykardie spolu s přetrváváním či nárůstem laboratorních parametrů zánětu (sedimentace, leukocytóza, CRP) indikují zado-přední a bočný rentgenogram. Při sporném nálezu je vhodné CT vyšetření k posouzení rozsahu a lokalizace empyému event. k cílení drenáže. Definitivní důkaz lze získat pomocí diagnostické punkce nebo přímo drenáží. Makroskopický průkaz hnisu, pozitivní bakteriologický nález, pokles pH ve výpotku pod 7,2 a nízká hladina glukózy ve výpotku jsou typickými známkami empyému.Vždy je třeba odebrat vzorek exsudátu k mikrobiologickému vyšetření na nespecifickou aerobní i anaerobní a specifickou infekci i na plísně.Empyém vázaný na perforaci zažívacího traktu (Boerhaaveův syndrom, poleptání jícnu, perforace jícnových anastomóz či tubusu žaludku po náhradě jícnu), resp. jeho příčinu lze prokázat pomocí ezofago(gastro)grafie vodnou kontrastní látkou, endoskopické vyšetření je rizikové. Průkaz bronchopleurální píštěle či dehiscence pahýlu průdušky je naopak obvykle bronchoskopický.
Parapneumonický empyém je nejčastěji vyvolán stejnými mikroorganismy jako samotná pneumonie (Strept. pneumoniae, Staph. aureus, Strept. pyogenes, Klebsiella sp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus species, Escherichia coli, Enterobacter, u aspirací a u imunokompromitovaných nemocných jsou častější gramnegativní bakterie – Bacteroides, Peptococcus, Peptostreptococcus, Fusobacterium, většinou v kombinaci).
V prvních dvou stadiích je možná konzervativní léčba, která spočívá v rychlé evakuaci hnisavé kolekce, lokální debacilaci dutiny, potlačení infekce systémovou léčbou a v rychlé reexpanzi plíce. Drenáž se provádí nejlépe pod sonografickou či CT navigací, jedním nebo více silnými drény. Po založení drenáže je výhodné aktivní sání i s vyšším podtlakem a proplachy empyémové dutiny antiseptickými roztoky (obr. 17). Pokud je exsudát hustý, lze k degradaci fibrinu použít lokálně aplikovaná fibrinolytika (streptokinázu, urokinázu, hyaluronidázu). S rozvojem miniinvazivních metod nabývá v časných stadiích empyému na významu videotorakoskopie či videoasistovaná hrudní chirurgie, jejichž největším benefitem je jednorázová a rychlá mechanická toaleta (debridement) empyémové dutiny. Ve třetím stadiu empyému je konzervativní i VTS/VATS léčba povětšinou nemožná nebo neúspěšná, pak je namístě definitivní chirurgická léčba (fenestrace, empyémektomie, pleurektomie/ dekortikace, raritně i torakoplastika) (obr. 18).
Posttraumatický empyém se v řadě aspektů liší od klasických parapneumonických afekcí. Většinou je důsledkem zbytkového hemotoraxu, proto nemívá časnou exsudativní fázi. Bývá dobře a pevně ohraničený, pouhá drenáž málokdy vede k uspokojivému vyhojení.Pooperační (poresekční) empyém bývá často spojen s bronchopleurální píštělí. Pokud je netěsnost prokázána na úrovni lobárního bronchu, lze dosáhnout úspěchu konzervativním postupem (drenáž, reexpanze plíce), resuturou bronchu nebo dokončující resekcí ve velké většině případů. Nejobávanější komplikací hrudní chirurgie je tzv. postpneumonektomický empyém. Ten může vzniknout i samostatně, ale častěji je spojen s píštělí či dehiscencí pahýlu kmenové průdušky. Dehiscence pahýlu bronchu má specifickou symptomatologii. Projevuje se vykašláním většího množství sangvinoletního sputa, které je obvykle spojeno s poklesem hladiny tekutiny v operovaném hemitoraxu patrným na rentgenogramu. Častěji bývá na pravé straně a u diabetiků. Četnost této komplikace se odhaduje na 1–15 % pneumonektomií, letalita dosahuje 50 %. Akutním řešením, resp. první pomocí je řádná drenáž pohrudniční dutiny silným drénem nebo založení pleurostomie (torakoskomie) a polohování na operovanou stranu. Cílem je zabránit zatékání infikovaného obsahu pleurální dutiny do dehiscentní průdušky při inspiraci, které vede pravidelně k pneumonii kontralaterální plíce s fatálními důsledky.Časné píštěle lze potom řešit resuturou (z důvodu obykle krátkého pahýlu obtížně), resekcí bifurkace (při empyému s jasným rizikem), uzávěrem bronchu muskuloplastikou či omentoplastikou nebo obliterací pohrudniční dutiny torakoplastikou.U pozdních píštělí s chronickým empyémem lze kombinovat uzávěr průdušky muskuloplastikou či omentoplastikou s obliterací zbytkové dutiny pomocí torakoplastiky.
3.3.4 Hemotorax
Hemotorax je nahromadění krve v pleurálním prostoru. Netraumatický hemotorax je velmi vzácný. Příčinou mohou být metastatické či tuberkulózní postižení pleury, vrozené i získané poruchy koagulace (hemofilie, antikoagulační terapie, trombocytopenie), nemoci nitrohrudních cév (ruptura hrudní aorty), katameniální hemotorax vzniká v souvislosti s menstruací či syndromem hrudní endometriózy. Daleko nejčastější příčinou hemotoraxu je trauma hrudníku (viz kapitola traumatologie hrudníku), včetně iatrogenních poranění (hrudní punkce, drenáže, kanylace centrálních žil, plicní biopsie).Symptomatologie hemotoraxu je nespecifická a je většinou dána komorbiditami či spíše přidruženými poraněními. Na nitrohrudní krvácení ukazuje úrazový děj směřující na horní polovinu těla, šokový stav, dušnost, hypotenze, vymizelé dýchací fenomény a pohyby na postižené straně hrudníku, zkrácený poklep, případně krepitace skeletu hrudního koše.
Hemotorax je klinicky a rentgenologicky zjistitelný při objemu nad 250 ml. U asymptomatických nemocných s negativním rentgenogramem se doporučuje opakovat snímek v intervalu 6–12 hodin. Při sporném nálezu odkryje CT i minimální PNO či malé množství tekutiny. Revidovat ránu se nedoporučuje pro nebezpečí způsobení PNO a riziko kontaminace pleurální dutiny. V případě prokázaného PNO či nálezu akumulované tekutiny u penetrujícího poranění je indikována hrudní drenáž. Je to nejlepší prevence reziduálního hemotoraxu, která dovoluje sledovat trend krvácení v čase a případně indikovat revizi.Hemotorax dělíme na:
- malý hemotorax (do 500 ml),
- střední hemotorax (od 500 do 1500 ml),
- velký hemotorax (nad 1500 ml akumulované krve).
Masivní krvácení z hrudního drénu vyžaduje torakotomii, minimální trvající odpad z drénu může být ošetřen torakoskopicky za předpokladu hemodynamické stability. Indikace torakotomie ve vztahuk evakuovanému množství krve je trvale diskutována.Emergentní torakotomie je obvykle indikována, pokud odpad krve do drénu přesáhne:
- jednorázově 1500 ml,
- 300 ml ve třech hodinách následujících po zavedení drénu.Přísnější autoři dokládají, že mortalita rapidně stoupá při celkové sekreci nad 1500 ml za 24 hodin.Dosažení tohoto množství tedy považují za indikaci revize.
Naprostá většina plicních poranění vyžadující chtorakotomii je ošetřitelná za cenu minimální ztráty parenchymu (koagulace, přešití, prošití staplerem či neanatomické plicní resekce, tkáňová lepidla). Anatomické resekce jsou vynucené u těžkých lacerací s nereparovatelným postižením sekundárních hilových struktur. Pneumonektomie je oprávněná pouze při vyčerpání všech dostupných prostředků k záchraně plíce, jako ultimum refugium je provázena vysokou mortalitou. U stabilních nemocných je alternativou konzervativního postupu videotorakoskopie s ověřením, ev. ošetřením zdroje krvácení, toaletou pohrudniční dutiny a cílenou drenáží.Poranění jiných nitrohrudních struktur je diskutováno v kapitole traumatologie hrudníku.
3.3.5 Chylotorax
Chylus (lymfa, míza) je specificky zbarvená tělní tekutina (smetanově bílá, někdy charakteru bílé kávy), obsahující více jak 1,1 g triglyceridů v jednom litru hrudního výpotku. Dále obsahuje chylomikrony, cholesterol, ionty, bílkoviny a buněčné elementy (zejména lymfocyty). Za vysoký podíl tuků v chylu jsou zodpovědné intestinální mízovody, které se spojují s lumbálními mízovody do cisterna chyli, odkud vychází ductus thoracicus. Hrudní mízovod vstupuje do hrudníku skrze hiatus aorticus, klade se vpravo mezi aortu, obratlová těla, v. azygos a stoupá pravým mediastinem asi do výše Th6. Odtud směřuje šikmo vzhůru za aortální oblouk na levou stranu zadního mediastina, přibírá bronchopulmonální a mediastinální mízní cévy (většinou pouze levostranné), pokračuje mezi tracheu a jícen a obloukem ústí do angulus venosus sinister). Lymfa z pravého hemitoraxuje obvykle drénována do slabšího ductus lymphaticus dexter, který končí v angulus venosus dexter.Chylotorax je nahromadění chylu (mízy) v pohrudniční dutině. Vzniká porušením celistvosti mízovodu úrazem či přetlakem na kterékoli úrovni jeho průběhu. Poranění distálního mízovodu se tedy projevuje pravostranným výpotkem, poranění proximálně od Th5 levostranným výpotkem, oboustranný chylotorax není častý.Chylotorax dělíme na:
- traumatický,
- iatrogenní,
- netraumatický,
- kongenitální,
- inflamatorní,
- nádorový,
- jiný.
Nejčastěji pozorujeme iatrogenní chylotorax v souvislosti v nitrohrudní operativou, tato komplikace může provázet jakoukoli nitrohrudní operaci, stejně jako výkony v oblasti podklíčku, nadklíčku, kupuly pleurální a dolní poloviny krku vlevo. Po abdominálních operacích (lymfadenektomie, operace na bránici) se chylotorax vyskytuje zřídka. Méně často vzniká chylotorax v souvislosti s tupým či penetrujícím poraněním hrudníku nebo krku, perinatální poranění jsou vzácná.
Netraumatický původ mají výpotky dané nádorovou infiltrací mediastina hemoblastomy, plicními, jícnovými nebo jinými mediastinálními novotvary. Chylotorax obvykle provází plicní lymfangiomyomatózu, může komplikovat tuberkulózu, sarkoidózu, plicní a mediastinální mykózy, mediastinitidu či parazitární infekce. Kongenitální původ chylotoraxu daný anomálií či aplazií mízovodu je vzácný.Symptomatologie chylotoraxu bývá většinou nevýrazná, je dána postupným útlakem mediastinálních struktur, pokud je poranění duktu při neporušené pleuře. Častěji se projevuje dušnost z útlaku plíce při primární komunikaci duktu s pohrudniční dutinou či po sekundárním provalení chylomu z mediastina do pohrudniční dutiny. Akutní průběh a vznik tenzního chylotoraxu je vzácný. Vzhledem k delšímu průběhu mízovodu vpravo je častější pravostranný výpotek, oboustranný chylotorax je vzácný. V diagnostice má kromě obvyklých kroků (klinické vyšetření, makroskopické posouzení výpotku) prioritu biochemie. Hodnoty triglyceridů nad 1,1 g/l ve výpotku a vyšší koncentrace cholesterolu ve výpotku než v séru ukazují na chylotorax. Po déletrvající drenáži pak lze v séru zaznamenat hypolipidemii, hypoproteinemii, hypokalemii a pokles počtu lymfocytů. CT pomůže vyloučit případnou mediastinální patologii, lymfografie má při primární diagnostice význam limitovaný. U pooperačních stavů je třeba počítat s určitým bezpříznakovým intervalem, daným obvykle parenterální nebo málo tučnou perorální výživou. Typický chylózní charakter hrudního sekretu je pak konstatován až po plné perorální zátěži, k potvrzení lze použít například perorálně podanou smetanu.Terapie chylotoraxu může být konzer vativní, po plicních resekcích, kdy bývají poraněny menší lymfatické cévy, bývá úspěšná asi ve ¾ případů. U poranění kmene mízovodu (např. po resekcích jícnu, operacích aorty) je úspěšnost konzervativní léčby nižší. Základními kroky jsou beztuková dieta, lépe kompletní přerušení perorálního příjmu a plná parenterální výživa, hrudní drenáž a pečlivá monitorace vnitřního prostředí. Při denní ztrátě tekutin hrudním drénem musí být deplece tekutin, albuminu a elektrolytů pečlivě substituována. Pokus o konzervativní léčbu by neměl trvat déle než 14 dní, protože hrozí těžká hypoproteinemie a rozvrat vnitřního prostředí. Přísnější autoři doporučují operovat již po 7 dnech neustávající chylózní sekrece z drénovaného hemitoraxu.Chirurgická léčba spočívá ve vyhledání mízovodu (nebo přímo jeho léze) a v jeho podvazu. I u levostranných výpotků většinou volíme přístup zprava, protože mízovod je častěji poraněn ve svém distálním průběhu. Necílená ligatura pravidelně vede ke zhojení i u poranění v proximální části. K identifikaci ductus thoracicus, resp. úniku lymfy může posloužit podání200 ml smetany či olivového oleje enterální sondou před zahájením operace. Za stejným účelem se aplikovala metylenová modř subkutánně, která zbarvila chylus, bohužel také okolní tkáně, což v konečném důsledku hledání mízovodu spíše komplikovalo. Vlastní ligatura může být cílená na vyhledaném duktu, pokud není nalezen, lze masivně podvázat nebo prošít veškeré tkáně mezi aortou, jícnem a v. azygos, obvykle zprava, cestou torakotomie, videotorakoskopicky nebo videoasistovaně. Úspěch lze očekávat asi v 80–90 % případů. Vlevo v horním mediastinu lze ductus thoracicus vyhledat na jícnu mezi páteří, obloukem aorty a levou podklíčkovou tepnou. Tato cesta se využívá, pokud chylotorax vznikl v souvislosti s intervencí v horním mediastinu, retroklavikulárně nebo na krku. Extratorakálně lze ductus thoracicus podvázat, prošít či zaklipovat transhiatálně laparoskopicky či otevřenou cestou.Alternativně nebo jako metodu doplňující lze provést pleurektomii, po které se chylus snáze vstřebává velkou rannou plochou a posléze dojde k obliteraci pohrudniční dutiny a pleurodéze. U maligních nejen chylózních výpotků lze provést talkovou pleurodézu, talek může být nahrazen Bleomycinem.
3.3.6 Nádory pleury
Pleura bývá postižena maligním mezoteliomem, sekundárními novotvary v rámci generalizace nitrohrudních i extratorakálních nádorů, zřídka bývá diagnostikován solitární fibrózní tumor pleury, jiné neoplazie pleuru postihují jen výjimečně.
3.3.6.1 Maligní mezoteliom
Maligní mezoteliom je nádor vycházející z mezotelové výstelky pleurální dutiny, při svém růstu vytváří uzlovitá ložiska rozesetá difuzně po parietální i viscerální pleuře, která postupně splývají a vedou k výraznému nádorovému ztluštění pleury. Může indukovat maligní výpotek nebo naopak obliteraci pleurálního prostoru, infiltraci perikardu, mediastina, hrudní stěny, extratorakálně obvykle nemetastázuje. Z histologického hlediska jej dělíme na:
- epiteloidní mezoteliom,
- sarkomatoidní mezoteliom,
- bifázický mezoteliom,
- desmoplastický mezoteliom.
Grading se u mezoteliomu neuvádí, TNM klasifikace odráží postižení parietální, viscerální pleury, infiltraci plíce, resekabilitu, extratorakální šíření, lymfadenopatii a vzdálené metastázování. Je prokázána kauzální souvislost mezi tímto onemocněním, expozicí azbestu a opičím virem SV40. Předpokládá se, že incidence tohoto novotvaru bude stoupat nejméně do roku 2020, medián přežití je mezi 6–12 měsíci. Klinické příznaky jsou nespecifické, bolest na hrudi, dušnost, v 80 % bývá v době diagnózy přítomen výpotek, v laboratoři trombocytóza. RTG, CT, případně PETCT zobrazí výpotek nebo uzlovité ztluštění pleury, definitivně rozhoduje biopsie pleury (cílená či necílená, pleuroskopická, torakoskopická).
Základním léčebným postupem je chirurgická resekce – pleuropneumonektomie. Méně radikální je pleurektomie, případně dekortikace. Po těchto operacích se může rozvinout systémová nemoc, proto bývá léčba obvykle kombinovaná – v adjuvantním nebo neoadjuvantním režimu. V poslední době se preferují multimodální postupy – chirurgie a/nebo radioterapie kombinovaná s chemoterapií, biologickou léčbou, imunoterapií či hypertermickou cytostatickou léčbou. Ve vybraných centrech a na selektovaných souborech pacientů lze dosahovat překvapivě dobrých výsledků. U nemocných ve stadiu III a IV je metodou volby chemoterapie. V současnosti se používá pemetrexed v monoterapii či kombinaci nebo kombinovaná chemoterapie na bázi antracyklinů či platiny.
3.3.6.2 Solitární fibrózní tumor pleury
Jedná se o relativně vzácný nádor vycházející ze submezotelové mezenchymální tkáně většinou viscerální, vzácněji parietální pleury. Je tvořen vřetenitými buňkami uspořádanými do snopců oddělených fibrózním stromatem. Je obvykle stopkatý, často asymptomatický. Objemnější nádory se projevují dušností, kašlem, bolestí na hrudi a únavností, což je způsobeno útlakem plíce a mediastinálních struktur. V diagnostice hraje rozhodující úlohu CT a transparietální biopsie. Terapie je chirurgická – odstranění přístupem odpovídajícím velikosti tumoru s resekcí vaskulární stopky, která většinou vychází z plíce. Obvykle je považován za benigní, recidivy jsou vzácné. Asi 10% tumorů se chová zhoubně, za kritéria malignity se považují mitotická aktivita (více jak 4 mitózy v 10 polích), přítomnost nekróz a výpotku, vysoká celularita a pleiomorfie buněk.
3.3.6.3 Metastatické nádory pleury
Pleura bývá nejčastěji postižena adenokarcinomem plic, prsu, ovaria. Méně častý je pleurální rozsev nádorů štítné žlázy, pankreatu, ledviny, žaludku, tračníku, rekta a mezenchymálních maligních novotvarů. Při difuzním postižení pleury je mnohdy obtížné odlišit tyto neoplazie od nediferencovaných forem mezoteliomu nejen opticky, ale i za použití imunohistochemické analýzy. Ke stanovení správné diagnózy je nezbytná validní biopsie, u solitárních lézí a při kontrole primárního nádoru je možné chirurgické odstranění. Typickým postupem je však paliace obvyklého nádorového výpotku talkovou pleurodézou.
3.4 Operační výkony při onemocnění pohrudnice
3.4.1 Pleurodéza
Pleurodéza je operace, kterou se snažíme dosáhnout pevného srůstu mezi parietální a viscerální pleurou, resp. obliterace pleurálního prostoru. U benigních onemocnění se provádí v rámci terapie spontánního pneumotoraxu spolu s revizí plíce a případným uzávěrem zdroje úniku vzduchu, většinou torakoskopicky. Pevné pleurodézy lze dosáhnout pleurabrazí, tedy skarifikací nástěnné a brániční pleury smotkem prolenové síťky nebo abrazní kuličkou či kartáčkem. Výjimečně se u benigních lézí používá chemická pleurodéza koncentrovanou (40%) glukózou, dříve tetracyklinem, termická pleurodéza se provádí koagulací, biologická aplikací vlastní krve do pleurální dutiny. U maligních výpotků je cílem pleurodézy trvalá obliterace pleurální dutiny. Zde spoléháme na talkovou chemickou pleurodézu, prováděnou většinou také torakoskopicky. Obvykle vystačíme se dvěma porty (pro optiku a talkovou trysku). Předpokladem úspěchu je dokonalé odsátí výpotku, uvolnění celé plíce, pudráž kostální, diafragmatické a mediastinální pleury a dokonalá reexpanze plíce. Talek indukuje aseptický zánět, operace selhává, pokud pevná nádorová pleura nedovoluje dokonalé rozvinutí plíce zaručující déletrvající kontakt obou pleurálních listů.
3.4.2 Pleurektomie
Pleurektomie je odstranění pleury chirurgickou cestou. Nejčastěji se provádí v zájmu dosažení obliterace pleurální dutiny při sekundární prevenci recidiv spontánního pneumotoraxu, často bývá kombinována s pleuroabrazí či jinou formou pleurodézy. Provádí se v rozsahu celé kostální pleury (pleurektomie totální), v horní polovině hrudníku (proximálně od v. azygos vpravo resp. od výše oblouku aorty vlevo) jako pleurektomie subtotální, nebo jako pleurektomie apikální, kdy je odstraněna pouze pleura v kupule a zbylá pleura kostální a brániční je ošetřena pleurabrazí. Pleuru je možné oddělit od endotorakální fascie tupou preparací vcelku jednoduše bez většího krvácení, proto je výhodné využít miniinvazivní chirurgii (VTS/VATS) (obr. 19).
Zvláštním typem operace je tzv. radikální pleurektomie, používaná v terapii lokalizovaných forem maligního mezoteliomu. Jejím principem je dosáhnout v první etapě pevného srůstu parietální a viscerální pleury, proto se jako iniciální krok provádí v rámci diagnostické operace talková pleurodéza. V odstupu několika týdnů se indikuje vlastní operace, kdy je odstraněna postižená parietální, brániční a mediastinální pleura spolu s přirostlou pleurou viscerální, včetně pleury vystýlající interlobia. Jedná se o šetrnější alternativu extrapleurální pneumonektomie. Jde o čistě cytoreduktivní operaci, ale při radikální pleurektomii je šetřen plicní parenchym, tento benefit vyvažuje do jisté míry vyšší „radikalitu“ extrapleurální pneumonektomie. Provádí se otevřenou cestou, cílem je tupě, event. i ostře uvolnit ztluštělou parietální, brániční a mediastinální pleuru ve smyslu pleurektomie v celé ploše pleurální dutiny až k plicnímu hilu, odkud pak preparace pokračuje na pleuru viscerální, kterou je nutné postupně sloupnout z celého povrchu postižené plíce, včetně interlobárních štěrbin. Někdy je výhodnější opačný postup: pokud je srůst parietální a viscerální pleury dostatečně pevný, lze proniknout ostře těsně pod viscerální pleuru a plíci uvolnit kompletně v této rovině disekce až k plicnímu hilu na způsob subpleurální dekortikace. Tato fáze je většinou sledována kontrolovatelným krvácením a únikem vzduchu z dekortikované plíce. Potom se dokončí vlastní pleurektomie oddělením obou srostlých pleurálních listů od hrudní stěny, mediastina a bránice. Velké opatrnosti je třeba při izolaci hilových a mediastinálních cévních struktur (vpravo horní dutá žíla, v. azygos, vlevo zejména odstupy interkostálních cév z descendentní aorty), vhodné je šetřit brániční nerv.
3.4.3 Dekortikace
Vlastní dekortikací rozumíme odstranění pyogenní membrány empyému z povrchu plíce při zachování neporušené viscerální pleury. Vzhledem k časovým faktorům vyzrávání vaziva empyémové kapsy je provedení poměrně snadné mezi 4.–8. týdnem od vzniku empyému, později je „atraumatická“ dekortikace za šetření viscerální pleury podstatně obtížnější až nemožná. Tehdy si lze vypomoci mřížkovitými nářezy ztluštělé poplicnice analogicky jako u konstriktivní perikarditidy, které dovolí alespoň částečnou reexpanzi plíce. Pokud je ale plíce „zazděná“ do pevné hroudy, lze se spoléhat na fakt, že periferní oblasti plicního parenchymu jsou dlouhodobým kolapsem málo vzdušné a dekortikaci je možné provést pod úrovní viscerální pleury jako u maligního mezoteliomu. Při šetrném střídání ostré a tupé preparace jekapilární krvácení nevelké stejně jako alveolární únik. Dostatečná reexpanze je nejlepší prevencí recidivy empyému, stejně jako vydatná drenáž pohrudniční dutiny po operaci. Pokud dekortikovaná plíce nejeví tendenci rozvinout se do celé dutiny pohrudniční, je někdy nezbytné připojit k dekortikaci/pleurektomii limitovanou torakoplastiku. Pokud se podaří provést pleurektomii/dekortikaci celé empyémové kapsy bez jejího otevření (většinou u lokalizovaných empyémů), hovoříme o empyémektomii (obr. 20).
3.4.4 Pleurostomie
Vytvoření hrudního okénka resekcí jednoho až dvou žeber na nejnižším bodě empyémové dutiny představuje první pomoc a někdy i definitivní řešení postpneumonektomického empyému, stejně jako řešení nekolikvovaných špatně drénovatelných či septovaných empyémů u rizikových pacientů, kteří nemohou být léčeni náročnějším způsobem (pleurektomie/dekortikace, torakoplastika). Od doby, kdy byla pleurostomie zavedena do praxe, doznala tato metoda řady modifikací, ale základní principy, široké otevření pleurální či empyémové dutiny resekcí dvou žeber v nejnižším bodě a fixace kůže k parietální pleuře dovolující snadné převazy, zústavají platné dodnes (obr. 21).
3.4.5 Extrapleurální pneumonektomie
Extrapleurální pneumonektomie je v kombinovaném protokolu metodou volby léčby I. a II. stadia maligního mezoteliomu. Principem je odstranění plíce spolu s postiženou viscerální, parietální, mediastinální a brániční pleurou. Začátek operace je podobný pleurektomii pro fibrotorax, do správné vrstvy, tedy na úroveň endotorakální fascie, se lze dostat širokou torakotomií 6. mezižebřím s protětím 7., event. i 6. žebra v dorzálním průběhu. Cílem je uvolnit neporušený vak od hrudní stěny směrem k plicnímu hilu. Pravostranná operace: tupá preparace začíná směrem do kupuly, kde je třeba šetřit podklíčkovou žílu, plexus brachialis a n. recurrens. Po uvolnění pleurální kupuly se postupuje ventrálně k přechodu kostální a mediastinální pleury, kde je třeba zachovat mammární cévy, až nad horní dutou žílu a perikard. Dorzálně se uvolňuje paravertebrální pleura až k průdušnici a perikardu, je nutné vyhnout se poranění horní duté žíly a v. azygos, n. phrenicus může být obětován. Jícen je nutné od pleurálního vaku oddělit a vypreparovat zadní plochu plicního hilu a průdušku. Pak se postupuje stejným způsobem až do kostofrenického úhlu, po uvolnění kostodiafragmatického pleurálního záhybu je nutné uvolnit pleuru od bránice, většinou nelze jinak než za cenu cirkulární resekce bránice. Výhodný je extraperitoneální postup, ne vždy je však proveditelný. Kruh disekce okolo bronchovaskulární stopky uzavíráme preparací kostomediastinálního pleurálního úhlu až na laterální stěnu osrdečníku. V této fázi, pokud to nebylo nutné již dříve, se resekuje postižený perikard široce kolem žilních ústí, resp. od ústí dolní duté žíly až nad ústí horní duté žíly, takto lze vypreparovat plicnici transperikardiálně vpravo od horní duté žíly v Allisonově recessu nebo mezi dutou žílou a aortou v recessu Thielově. Cévní struktury ošetřujeme typicky. Přerušení průdušky je posledním krokem resekční fáze, k uzávěru používáme stapler a pokračující suturu. Zbývá rekonstruovat bránici a perikard, obě struktury lze nahratit ePTFE záplatou, kterou je třeba na perikardu fenestrovat (obr. 22).
Vlevo začíná operace analogicky uvolněním pleurálního vaku do kupuly, do předního mediastina za šetření mammárního svazku a dozadu až k páteři. Opatrnosti si zaslouží oblouk aorty a jeho větve, n. vagus, který obsahuje i vlákna vratného nervu, v. hemiazygos, probíhající po přední ploše oblouku aorty, při preparaci kostovertebrálního pleurálního záhybu descendentní aorta a její interkostální odstupy. Distální jícen je třeba od preparátu oddělit ostře nebo tupě. Další postup už je analogický jako vpravo: extraperitoneální resekce bránice, resekce perikardu, ošetření hilových cév, přerušení a uzávěr bronchu, rekonstrukce bránice a perikardu, hrudní drenáž. Ve specializovaných centrech v kombinovaných protokolech dosahuje pětileté přežití po extrapleurální pneumonektomii pro mezoteliom intervalu mezi10–20 %, epiteloidní varianta je prognosticky příznivější.
3.5 Literatura
- Barker WL. Thoracoplasty. Chest Surg Clin N Am.1994;4:593.
- Becker HD, Hohenberger W, Junginger T, SchlagPM. Chirurgická onkologie. Praha: Grada Publishing; 2005.
- Fiala P, Musil J, et al. Onemocnění pleurálníhoprostoru. Praha: Galén; 2008.
- Kolek V, Kašák V, Vašáková M, a kol. Pneumologie. Praha: Maxdorf; 2011.
- Pafko P. Základy speciální chirurgie. Praha: Galén; 2008, doc. MUDr. Eliška Sovová, Ph.D., MBAs. 385.
- Pafko P, Lischke R, et al. Plicní chirurgie. Operační manuál. Praha: Galén; 2010.
- Pearson GF, Cooper JD, Deslauriers J, Ginsberg RJ, Hiebert CA, Patterson GA, Urschel HC. Thoracic surgery. New York: Churchill Livingstone;2002.
- Pichlmaier H, Childberg FW. Thoraxchirurgie.Heidelberg: Springer; 2006.
- Procházka J. Resekce plic. Praha: SZN; 1954.
- Řehák F, Šmat V. Chirurgie plic a mediastina. Praha: Avicenum; 1986.
- Schützner J, Šmat V, a kol. Myasthenia gravis. Praha: Galén; 2005.
- Stolz S, Pafko P. Komplikace v plicní chirurgii.1. vydání. Praha: Grada Publishing; 2010.