6 Diagnostika a léčba onemocnění prsu
Ženský prs je od pradávných dob vnímán jako symbol ženství a ženské krásy. Tento párový orgán vlivem hormonů podléhá změnám od narození, puberty ke změnám způsobeným graviditou a kojením až k přechodu. Během této doby se mění objem a tvar, dochází k degenerativním změnám žlázového parenchymu. Prsní žláza může být postižena řadou onemocnění, mezi nejčastější a nejzávažnější patří rakovina prsu.
6.1 Anatomie prsu
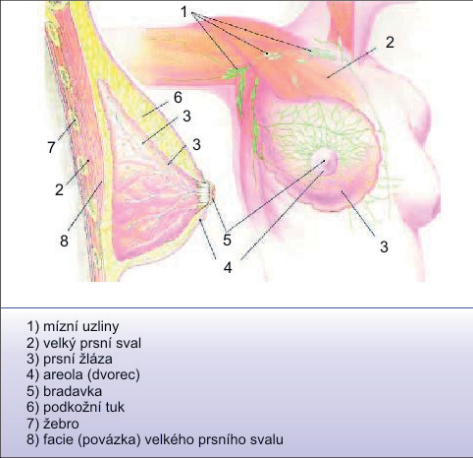
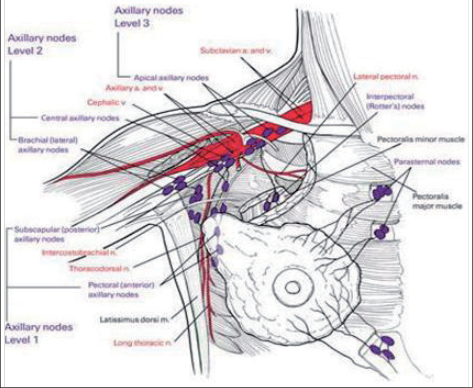
Mléčná žláza (obr. 1) je párový orgán, který je lokalizován na hrudníku ve 3.–6. mezižebří. Na vrcholu prsu je areola. Areola je cirkulární, tmavě pigmentovaná oblast o průměru 3–5 cm kolem bradavky. Bradavka je mírně vyvýšená a ústí zde mlékovody (15–20), které přicházejí z hloubi prsu. Na periferii areoly jsou malé Montgomeryho tuberkuly. Během laktace vylučují maz v oblasti bradavko-areolárního komplexu a brání bradavku před macerací. Pod epitelem jsou myoepiteliální buňky s kontraktilní výbavou reagující na oxytocin, které umožňují vyloučení mléka. Prs se vyvíjí od puberty pod vlivem mamotropních hormonů. Parenchym prsní žlázy leží mezi podkožním tukem, fascií pektorálního svalu a m. serratus anterior. Normální dospělá žláza sestává z epitelových a stromálních elementů. Epitel vytváří sérii větvících se duktů, které se spojují ve funkční jednotku mléčné žlázy: lalok–lobus. Mléčná žláza se skládá z 15–20 laloků. Hlavní laloky se dělí na lalůčky a dále na alveoly. Tato konečná struktura se nazývá duktolobulární jednotka, je hormonálně citlivá a je základní laktující jednotkou. Stroma se skládá z tukové a fibrózní tkáně. Stroma tvoří převážnou část objemu tkáně prsu. Přemostění mezi kůží a hluboko uloženou fascií tvoří Cooperova ligamenta, která spoluutvářejí kostru prsu. Nádory, které infiltrují Cooperova ligamenta, mohou způsobit vtažení kůže. Deformace povrchu prsu a vtažení kůže pak může upozornit na nádorové onemocnění. Axilární uzliny jsou rozděleny podle lokalizace a vztahu k pektorálnímu svalu na tři etáže: I. etáž – laterálně od m. pectoralis minor, II. etáž– dorzálně a III. etáž – uložena mediálně. Rotterovy a interpektorální uzliny jsou uloženy mezi velkým a malým pektorálním svalem. Intramamární uzliny jsou uloženy na laterálním okraji prsní žlázy a axily. Převážná část lymfy je odváděna do axilárních uzlin. Menší část, avšak ze všech kvadrantů, také do uzlin podél art. mammaria interna. Omezená drenáž lymfy je vedena také přímo do supraklavikulárních uzlin.
6.2 Benigní onemocnění prsní žlázy
Ne všechna onemocnění a nálezy v prsu jsou zhoubného charakteru.Benigní onemocnění prsu můžeme rozdělit do několika skupin:
Vrozené vady
Z vrozených vad prsu je relativně častý výskyt (až u 5 % populace mužů i žen) přídatné bradavky a méně častěji přídatné žlázy. Tyto odchylky se vyvíjejí obvykle v průběhu mléčné lišty (obr. 2). Chirurgické odstranění je indikováno při obtížích (např. bolest) či z kosmetických důvodů.Hypoplazie prsu je v podobě mírné velikostní stranové asymetrie poměrně častá. Jako kosmetickou závadu ji pak řeší plastický chirurg, když je rozdíl ve velikosti prsů velký a ženě vadí. Velmi vzácně se může vyskytnout ageneze mléčné žlázy, která může být provázena i deformitou hrudníku. Polandův syndrom je charakterizován nevyvinutím velkého a malého prsního svalu, žeber, chyběním bradavky a prsní žlázy, bývá spojen i se syndaktylií a brachydaktylií. Stav vyžaduje rekonstrukci hrudní stěny a hypoplastické prsní žlázy.
Záněty prsní žlázy
Terminologicky rozeznáváme záněty prsní bradavky (telitida) nebo prsní žlázy (mastitida), akutní a chronické, nespecifické a specifické (tbc, lepra, aktinomykóza atd.). Z praktického hlediska jsou důležité záněty v puerperiu, mimo šestinedělí jsou vzácnější.
Puerperální mastitida vzniká většinou krátce po porodu v souvislosti s kojením a vznikem drobných ragád bradavky, odkud se infekce šíří kanalikulární cestou a vzniká mastitis parenchymatosa. Původcem je nejčastěji zlatý stafylokok. Zánět má charakter flegmóny, která se projevuje zarudnutím a bolestivostí prsu, později může dojít k vývoji abscesu, kdy palpačně zjišťujeme fluktuaci. Dle lokalizace rozlišujeme absces subkutánní, subareolární, intrači retroglandulární, nebo dokonce retromamární. Diagnosticky může přispět vedle typických příznaků a palpačního nálezu i vyšetření ultrazvukem. Základem léčby je podávání antibiotik, odsávání mléka, při tvorbě abscesu na prvním místě punkční drenáž, a pokud je nedostatečná, tak klasická incize s drénem.
Fibrozněcystická mastopatie – FCM (benigní dysplazie, cystofibróza)
Jedná se o hormonálně dependentní proces. Proliferace epitelu, vaziva a tvorba cyst.
Příčinou je stimulace žlázy cyklickými změnami hormonů, výrazné v premenopauze, kdy relativně převažuje vliv estrogenů při poklesu vlivu gestagenů, nejčastěji ve 4. až 5. deceniu. Po menopauze spontánně regreduje. Subjektivně je pociťována bolest, cyklická mastodynie větší premenstruálně, palpačně zjišťujeme neostře ohraničené uzlíky. Někdy je patologická sekrece z prsu. Je možné hormonální ovlivnění obtíží podáním gestagenů a antigonadotropinů. V diferenciální diagnostice je důležitý výsledek mamografie a sonografie a zejména při nejisté diagnóze je indikována biopsie prsu se stanovením diagnózy.
Nodulární adenóza (adenosis tumor)
- častý benigní proliferativní proces v mléčné žláze – postihuje jak duktální, tak lobulární epitel, epitelproliferuje uvnitř duktů, doprovází jej fibróza,
- může být asymptomatická nebo hmatné ložisko – dobře ohraničené, zcela benigní, nezvyšuje riziko vzniku ca,
- sklerozující adenóza – benigní, ale napodobuje histologicky karcinom, hmatná tuhá rezistence,
- apokrinní adenóza – varianta adenózy s apokrinní metaplazií epitelu, napodobuje ca,
- mikroglandulární adenóza – vzácná, sestává z drobných tubulů, může růst infiltrativně.
Duktální hyperplázie
- proliferace duktálního epitelu v distendovaných vývodech bez výrazné dysplazie,
- vzniká u dospělých žen každého věku (většinou však u žen mezi 35–60 lety),
- makroskopicky bývá bez příznaků, klinicky nemá žádné specifické dg. znaky, na mamografii není vidět, může být součásti FCM.
- Duktální hyperplazie atypická
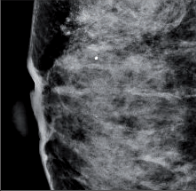
- charakteristická je proliferace duktálního epitelu s dysplazií mírného až těžkého stupně v distendovaných vývodech, může být provázena mikrokalcifikacemi, které jsou vidět na mamografii,
- 4–5krát vyšší riziko vzniku ca.
- Kolumnární hyperplazie
- proliferace vysokého cylindrického epitelu, který v jedné řadě nebo více řadách vystýlá lumen dilatovaných duktů, může být provázena dysplazií,
- vztah ke karcinomu má pouze kolumnární hyperplazie s atypií – nízké riziko vzniku ca.
Benigní – nezhoubné nádory prsu
Benigní nádory jako papilom, benigní fyloidní tumory – například fibroadenom, cystosarkom – jsou nádory, které se nešíří do okolních tkání a jejich chirurgické odstranění se provádí při nejisté diagnóze či pro subjektivní obtíže, pokud je působí.
Intraduktální papilom
- Je to epiteliální nádor, lokalizovaný v ductus lactiferus subareolárně. Roste solitárně uvnitř dilatovaného mlékovodu, většinou menší než 2 mm. Hlavním příznakem je patologická, často krvavá sekrece z prsní bradavky, vzácně vtažení bradavky. Maligní zvrat s rizikem do 10 %.
- Dg: RTG – duktografie, cytologické vyšetření sekretu.
- Th: Mikrodochektomie, u starších žen exstirpace duktů.
Fibroadenom
- Je to nejčastější benigní nádor, obvykle u mladých žen (20–30 let), tuhý, dobře ohraničený, opouzdřený, volně pohyblivý, dosahuje různé velikosti. Mikroskopicky jde o smíšený nádor sestávající z mezenchymální a epiteliální komponenty.
- Dg: fyzikální vyšetření, RTG mamografie, UZ, biopsie.
- Th: exstirpace.
„Giant“ fibroadenom
- Je to fibroadenom větší než 5 cm. Rozlišuje se forma adolescentní a perimenopauzální.
- Dg a Th jako u fibroadenomu.
Benigní fyloidní nádor (cystosarcoma phylloides)
- Výskyt nejčastěji kolem 35. roku života, klinicky je ve většině případů benigní, ale může recidivovat a maligně se zvrhnout – pak je charakteristický rychlý růst a přeměna stromatu v sarkom.
- Dg: fyzikální vyšetření, RTG, USG, biopsie.
- Th: exstirpace – prostá, eventuálně radikální modifikovaná mastektomie při bioptické nejistotě.
Tubulární adenom
- Benigní, dobře ohraničení nádor, který se skládá z tubulárních struktur z epiteliální a myoepiteliální vrstvy buněk, u mladých žen.
Laktační adenom
- Varianta v těhotenství a období laktace.
Adenomyoepiteliom
- Nádor, který sestává z proliferace myoepitelií kolem tubulárních struktur lemovaných duktálními epiteliemi. Nádor se vyskytuje v každém věku, je vzácný.
- Makro – většinou dobře ohraničený.
- Prognóza – ve většině případů benigní, vzácně může recidivovat a změnit se maligně.
Myofibroblastom prsu
- Benigní, dobře ohraničený nádor, který sestává z vřetenitých buněk odpovídajících myofibroblastům mamárního stromatu.
- Makro – pomalu rostoucí, solitární hmatný uzel, opouzdřený, 1–3 cm v průměru.
Sekrece z bradavky
Patologická sekrece z prsu je poměrně častá stížnost žen vyšetřovaných v mamární poradně. Jedná se o třetí nejčastější obtíže po hmatných resistencích v prsu a bolestech prsů. Vyskytuje se u 3–10 % žen s obtížemi prsů. Poměrně často sekreci z bradavky pozorují ženy zejména v premenopauzálním období. Sekrece může být spontánní, nebo se projevuje až po zatlačení na bradavku či prs. Příčinou tohoto stavu může být karcinom, intraduktální papilom, benigní dysplazie či ektazie duktů. Sekrece může být jednostranná, oboustranná, serózní či serosanguinolentní. Hemoragická sekrece neznamená přímou diagnózu karcinomu. Maligní podklad může mít i nekrvavý výtok. Každou sekreci z prsu je nutno podrobně vyšetřit, zvláště pokud se jedná o výtok z jednoho duktu, nezávisle na charakteru sekrece. Oboustranný výtok je spíše hormonálního původu. Posuzujeme, jestli se jedná o sekreci provázenou současně hmatnou reistencí v prsu. Sledujeme vztah k menstruaci. Ke stanovení diferenciální diagnózy je využívána sonografie a mamografie, duktografie a cytologický rozbor sekretu. Negativní výsledek nevylučuje karcinom. Duktoskopie je u nás nedostupná. Definitivní diagnóza, a tím konečné vyloučení maligního onemocnění, je obvykle stanoveno exstirpací secernujícího duktu, včetně ev. rezistence. Karcinom prsní žlázy je diagnostikován asi v 10 % secernujících duktů. Před výkonem tlakem na dvorec či prs identifikujeme ústí secernujícího duktu, do něhož zavedeme jemnou kovovou sondu a eventuálně zavedeme kanylu a aplikujeme barvu. Z radiálního či obloukovitého řezu na hranici areoly nacházíme označený duktus, který exstirpujeme. U starších žen odstraňujeme centrální dukty.
6.3 Karcinom prsu
6.3.1 Etiologie a rizikové faktory
Etiopatogeneze karcinomu prsu není zcela jasná. V dnešní době jsou však známé určité faktory, které zvyšují riziko vzniku této nemoci.
Genetické faktory
Přibližně 5–10 % karcinomů prsu je podmíněno geneticky. Nejčastěji pozorované mutace jsou v oblasti genu BRCA1 a BRCA2. Gen BRCA1 je lokalizován na 17. chromozomu a je spojen až s 85% celoživotním rizikem karcinomu prsu. Gen BRCA2 je lokalizován na 13. chromozomu a je spojen až s 84% celoživotním rizikem karcinomu prsu. Oba geny jsou autozomálně dominantní s různou penetrací. To znamená, že gen je přenášen oběma pohlavími, ale někteří členové rodiny přes přítomnost genu neonemocní. U syndromu Li-Fraumeni je příčinou mutace tumor supresorického genu p53, což způsobuje zvýšené riziko onemocnění různými karcinomy, mezi nimi i karcinomem prsu.
Familiární výskyt karcinomu bez průkazu výše uvedených genů
Rizikovým faktorem je výskyt karcinomu prsu v osobní či rodinné anamnéze (matka, sestra, babička), zejména v případě výskytu nádoru u žen mladších 40 let a bilaterálně, a to bez průkazu výše uvedených genů.
Hormonální faktory
Vznik karcinomu prsu může být podmíněn delší expozicí estrogenů. Je to časná menarche, pozdní menopauza, první gravidita po 30. roce života, krátká laktace, dlouhé užívání kombinace estrogenů a gestagenů (v rámci substituční léčby), nuliparita. Orální kontraceptiva se dnes za rizikový faktor nepovažují.
Dietní faktory
Alkohol, zvýšený příjem tuků v dětství a dospívání, váhový nárůst spojený s nedostatkem fyzické aktivity rovněž zvyšují riziko vzniku karcinomu prsu. U postmenopauzálních žen je nadměrná tuková zásoba spojena s vyšší plazmatickou koncentrací z androgenních prekurzorů.
Premaligní změny prsu
V mléčné žláze dochází během života k řadě strukturálních poruch charakterizovaných změnami v zastoupení a struktuře stromatu, myoepiteliálních buněk a vývodového epitelu. Tyto změny však nemají jednoznačně prokazatelnou kauzální souvislost se vznikem karcinomu, s výjimkou vystupňované proliferace epitelu se strukturálními a cytologickými atypiemi, které se označují jako tzv. atypické duktální a lobulární hyperplazie.
Vliv zevního prostředí
Významným rizikem je ionizující záření zvláště před 40. rokem života, například ozařování pro Hodgkinovu chorobu.
Naproti tomu za protektivní faktory jsou považovány:
- těhotenství před 20. rokem věku – jedná se o těhotenství končící porodem,
- fyzická aktivita,
- kojení,
- příznivé působení vitaminů C, D, E.
6.3.2 Výskyt karcinomu prsu
Rakovina prsu zaujímá první místo mezi zhoubnými nádory u žen jak v České republice, tak ve většině vyspělých zemích, její výskyt se postupně zvyšuje.
Výskyt v ČR
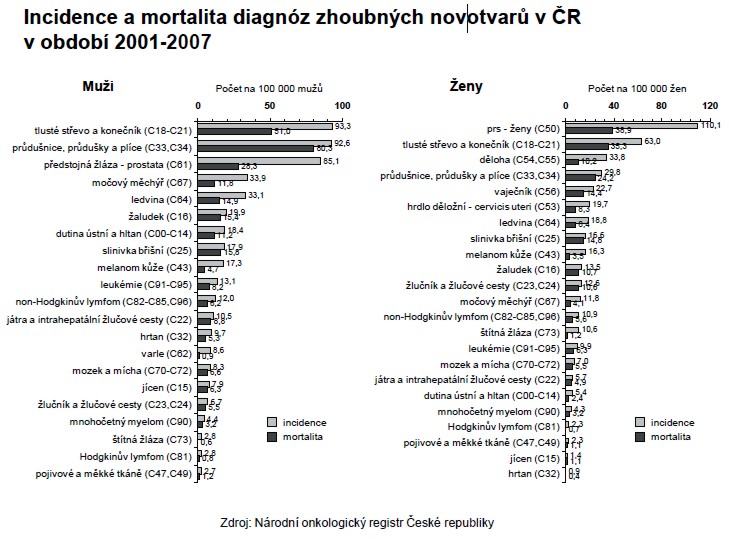
Graf 1 – Incidence a mortalita zhoubných nádorů v ČR dle NOR
(Zdroj: Národní onkologický registr České republiky)
V roce 2007 představoval zhoubný novotvar prsu 18,9 % všech nově diagnostikovaných malignitv ženské populaci. V roce 2007 dosáhl počet nově diagnostikovaných nádorů prsu u žen počtu 6500,což představuje incidenci 122,7 nádorů na 100 tisíc žen. Celkem 55 506 žen žilo na konci roku 2007 s diagnózou karcinomu prsu, prevalence činila 1047,6 na 100 tisíc žen. Vysoká incidence nádorů prsu je pozorována ve všech vyspělých zemích světa, především v zemích severní a západní Evropy a Severní Ameriky. ČR zaujímá 26. místo v počtu nově diagnostikovaných nádorů na 100 tisíc žen a 72. místo v počtu úmrtí na 100 tisíc žen. Je to nejčastější příčina úmrtí na nádorové onemocnění u žen. V roce 2007 zemřelo na zhoubný novotvar prsu 1680 žen, tedy 31,7 ze 100 tisíc žen. Zatímco incidence mezi roky 1995–2007 vzrostla o 32 %, ve stejném období mortalita naopak o 6 % klesla. Nejčastějším typem zhoubného novotvaru prsu je duktální karcinom (75,1 %), lobulární karcinom (14,0 %). V posledním období, kdy postupně docházelo k rozvoji screeningového programu, došlo k dalšímu výraznému zvýšení I. stadia z 29 % v roce 2001 na 40 % v roce 2007.
6.3 Karcinom prsu
6.3.3 Epidemiologické údaje dle národního onkologického registru (NOR)
V České republice je již od sedmdesátých let minulého století veden Národní onkologický registr. Z jeho údajů vyplývá vysoký zdravotní i společenský význam karcinomu prsu, který je nejčastějším maligním onemocněním u žen, jak je patrné z grafu č. 1.
6.3.4 Klasifikace karcinomu prsu
Podle invazivity rozlišujeme:
Neinvazivní karcinomy
Duktální karcinom in situ a lobulární karcinom in situ, které se šíří místně ve tkáni prsu a nemetastázují.
Duktální karcinom in situ má několik histopatologických podtypů. Existuje minimálně 6 klasifikací duktálního karcinomu in situ, které vyhodnocují další ukazatele prognózy, jako je rozsah nekróz a jizvení. Všechny klasifikace udávají 3 stupně malignity. Mikroinvaze u duktálního karcinomu in situ je definována v TNM klasifikaci. U mikroinvazivního nádoru se nádorové buňky šíří přes bazální membránu do okolních tkání v rozsahu nepřesahujícím do 1 mm. Lobulární karcinom in situ se klinicky neprojevuje, je zpravidla vedlejším nálezem při operacích nebo biopsiích prsu.
Invazivní karcinomy
- Duktální karcinom
Zahrnuje rozsáhlou skupinu nádorů odvozenou z maligní proliferace epitelu vývodového systému prsní žlázy. - Lobulární karcinom
Vychází z maligní proliferace epitelu lobulů terminální duktulolobulární jednotky. Bylo popsánovíce typů. - Medulární karcinom
Hodnocení vychází ze striktních histologickýchkritérií, kterými se liší od duktálního karcinomu.
Je chakterizován atypickými pleomorfními buňkami, vysokou mitotickou aktivitou a nepřítomností intraduktální komponenty. - Papilární karcinom
Vzniká maligní transformací intraduktálního papilomu. - Tubulární karcinom
Velmi dobře diferencovaný karcinom obsahující aspoň 90 % tubulárních formací. - Pagetova choroba bradavky
Toto onemocnění popsal James Paget v roce 1874.Projevuje se svěděním a pálením bradavky nebopovrchní erozí či ulcerací. Představuje přibližně asi1 % všech karcinomů prsu. Mikroskopicky je charakterizován přítomností tzv. Pagetových buněk,což jsou velké světlé buňky s hojnou cytoplazmoua velkým jádrem, které infiltrují epitel bradavky.Tyto buňky jsou nádorové a pocházejí z dobře diferencovaného duktálního karcinomu (nebo DCIS,který je lokalizován v duktech retroareolárně). Nádor je často léčen jako ekzém nebo infekce a diagnóza bývá zpožděná. U všech nálezů Pagetovychoroby bradavky je nutno prokázat – vyloučit –přítomnost a rozsah průvodního karcinomu. Může se ale také jednat jen o onemocnění bradavky. Pacientky je nutné pečlivě došetřit. - Inflamatorní (zánětlivý) karcinom
Zánětlivý karcinom je klinickou jednotkou a nejmalignějším typem nádoru. Tvoří asi 3 % všech karcinomů. Klinicky se projevuje zvětšením a erytemem prsu (peau d’orange), lymfedemém kůže prsu a teplejší kůží. Tyto zánětu podobné změny mohou vést často k mylné diagnóze infekce. Klinicky ani na mamografii nemusí být nález ložiska.Nápadný je jen lymfedém kůže. Mikroskopicky se jedná o variantu duktálního karcinomu nediferencovaného, který se šíří lymfatickými cévami. V čase diagnózy bývají již přítomné metastázy v regionálních lymfatických uzlinách. Diagnóza je stanovena biopsií žlázy a kůže prsu. Infiltrace lymfatických cév kůže nemusí být ale vždy prokázána, a přesto se jedná dle klinického nálezu o inflamarorní typ karcinomu. Chirurgická léčba u tohoto typu nádoru není primárně indikovaná a následuje až po neoadjuvantní terapii. Prognóza inflamatorního karcinomu je nepříznivá. Pětileté přežití je pouze asi u 30 % pacientek.
TNM klasifikace je založena na popisu anatomického rozsahu onemocnění (tab. 1):- T – rozsah primárního nádoru,
- N – nepřítomnost či přítomnost a rozsah metastáz v regionálních uzlinách,
- M – nepřítomnost či přítomnost vzdálených metastáz.
| Tabulka 1 TNM klasifikace |
|
| TX | primární nádor nelze hodnotit |
| T0 | bez známek primárního nádoru |
| Tis | karcinom in situ: intraduktální karcinom nebo lobulární karcinom in situ |
| T1 | nádor 2 cm nebo méně v největším rozměru |
| T1mic | mikroinvaze 0,1 cm nebo méně v největším rozměru |
| T1a | větší než 0,1 cm, ne však více než 0,5 cm v největším rozměru |
| T1b | větší než 0,5 cm, ne však více než 1 cm v největším rozměru |
| T1c | větší než 1 cm, ne však více než 2 cm v největším rozměru |
| T2 | nádor větší než 2 cm, ne však více než 5 cm v největším rozměru |
| T3 | nádor větší než 5 cm v největším rozměru |
| T4 | nádor jakékoliv velikosti s přímým šířením do stěny hrudní nebo kůže |
| T4a | šíření na stěnu hrudní |
| T4b | edém, ulcerace kůže hrudníku nebo satelitní uzly v kůži téhož prsu |
| T4c | kritéria 4a a 4b dohromady |
| T4d | zánětlivý (inflamatorní) karcinom |
| N – regionální mízní uzliny | |
| NX | regionální mízní uzliny nelze hodnotit (např. dříve odstraněné) |
| N0 | v regionálních mízních uzlinách nejsou metastázy |
| N1 | metastázy v pohyblivé stejnostranné axilární mízní uzlině (uzlinách) |
| N2 | metastázy ve stejnostranné axilární mízní uzlině (uzlinách), které jsou fixované navzájem nebo k jiným strukturám |
| N3 | metastázy ve stejnostranných mízních uzlinách podél a. mammaria interna |
| M – Vzdálené metastázy | |
| MX | vzdálené metastázy nelze hodnotit |
| M0 | nejsou vzdálené metastázy |
| M1 | vzdálené metastázy |
| pN – regionální mízní uzliny | |
| Patologická klasifikace vyžaduje resekci a histologické vyšetření alespoň dolních axilárních mízních uzlin (I. etáž). Taková resekce má standardně zahrnovat 6 a více mízních uzlin. | |
| pNX | regionální mízní uzliny nelze hodnotit (nebyly odebrány k vyšetření nebo byly odstraněny dříve) |
| pN0 | v regionálních mízních uzlinách nejsou metastázy |
| pN1 | metastázy v pohyblivé stejnostranné axilární uzlině (uzlinách) |
| pN1a | pouze mikrometastázy (žádná větší než 0,2 cm) |
| pN1b | metastázy v mízní uzlině (uzlinách), alespoň jedna větší než 0,2 cm |
| pN1b1 | metastázy v 1–3 mízních uzlinách, alespoň jedna větší než 0,2 cm, ale všechny menší než 2 cm |
| pN1b2 | metastázy ve 4 a více mízních uzlinách, alespoň jedna větší než 0,2 cm, ale všechny menší než 2 cm |
| pN1b3 | šíření nádoru přes pouzdro mízní uzliny, ne větší než 2 cm v největším rozměru |
| pN1b4 | metastázy v mízních uzlinách 2 cm nebo více v největším rozměru |
| pN2 | metastázy ve stejnostranných axilárních mízních uzlinách, fixované navzájem nebo k jiným strukturám |
| pN3 | metastázy ve stejnostranných mízních uzlinách podél a. mammaria interna |
| Tabulka 2 – Rozdělení karcinomu prsu na klinická stadia | |||
| Stadium 0 | Tis | N0 | M0 |
| Stadium I | T1 | N0 | M0 |
| Stadium IIA | T0T1T2 | N1N1N0 | M0M0M0 |
| Stadium IIB | T2T3 | N1N0 | M0M0 |
| Stadium IIIA | T0T1T2T3 | N2N2N2N1 N2 | M0M0M0M0 |
| Stadium IIIB | T4 jakékoliv T | jakékoliv N N3 | M0 M0 |
| Stadium IV | jakékoliv T | jakékoliv N | M1 |
Rozdělení na klinická stadia 0, I, IIA,B, IIIA,B a IV sdružuje podrobnou TNM klasifikaci do poměrně homogenních skupin podle délky přežívání (tab. 2)
Rozlišujeme:
- stadium 0 karcinom in situ,
- časné stadium onemocnění prsu,
- lokálně pokročilé stadium – bez vzdáleného rozsevu,
- pokročilé – s prokázanými vzdálenými metastázami.
Prediktivní a prognostické faktory
Mezi dobře definované prognostické faktory u karcinomu prsu patří velikost nádoru a postižení uzlin.
Prediktivní faktory naproti tomu determinují odpověď určitého nádoru na specifickou léčbu. V současné době jasně definovaným prediktivním faktorem u karcinomu prsu je exprese hormonálních receptorů.
Význam prognostických faktorů spočívá v určení, která pacientka potřebuje adjuvantní léčbu, zatímco prediktivní faktory indikují, jaká adjuvantní léčba je pro danou pacientku nejvhodnější. Kromě velikosti nádoru a postižení uzlin jsou za nepříznivé prognostické faktory považovány zvýšená exprese HER2/neu a peritumorózní vaskulární invaze. Nadměrná exprese HER2 (HER2-pozitivita) je spojována s obzvláště agresivním onemocněním a špatnou prognózou. Jedná se často o nízce diferencované nádory. Karcinomy prsu představují spektrum chorob s různým maligním potenciálem, etiopatogenezí, prognózou i způsobem terapie. Ke klasickým parametrům, které jsou posuzovány při volbě terapeutického postupu, patří zejména histologický typ nádoru, stupeň diferenciace, velikost nádoru, vzdálenost nádoru od resekčních okrajů, stavpostižení regionálních lymfatických uzlin a přítomnost vzdálených metastáz. Neodmyslitelnou součástí komplexního histopatologického vyšetření jsou také informace o expresi hormonálních receptorů (ER-estrogenových, PR-progesteronových) proliferačních antigenů (Ki-67) či některých dalších proteinů (p53, HER2/neu). Výrazné rozšíření palety diagnostických metod v oblasti molekulární biologie a genetiky s sebou přineslo nové možnosti léčby zejména v oblasti biologické terapie léky zaměřenými proti membránovému receptoru HER2/neu.
Hodnocení exprese HER2/neu
Vedle již historicky známého významu exprese hormonálních receptorů (estrogenových, progesteronových), který má nejen význam prognostický, ale také predikuje odpověď na antihormonální terapii, se v posledních letech nedílnou součástí rutinního histopatologického vyšetření každého nově diagnostikovaného karcinomu prsu stalo vyšetření proteinu HER2/neu (HER2). Ten patří mezi membránové receptory ze skupiny HER (human epidermal growth factor receptor). HER2 je transmembránový receptor o molekulové hmotnosti 185kDa, jehož intracelulární doména vykazuje tyrosinkinázovou aktivitu a ovlivňuje celou řadu dějů, zejména buněčný růst. HER2 je za normálních okolností přítomen v každé epiteliální buňce prsní žlázy v počtu asi 20 000 molekul.U nádorů, které vykazují overexpresi HER2, jsou v jedné nádorové buňce přítomny až 2 miliony těchto receptorů. Tato overexprese je ve většině případů důsledkem amplifikace genu na 17. chromozomu, méně často pak důsledkem polysomie chromozomu17. Důsledkem zmnožení receptoru na membráně nádorových buněk je zvýšení proliferační aktivity tumoru, jeho agresivní chování a statisticky významně kratší celkové přežití (do progrese i celkové přežití), bez ohledu na postižení uzlin. Exprese HER2 koreluje s některými dalšími prognostickými faktory – velikostí nádoru, vysokým proliferačním indexem a nízkým stupněm diferenciace nádoru.V terapii a diagnostice invazivního karcinomu prsu došlo v posledních letech k velkému vývoji a dnes již je nedostačující pouhé dělení na lobulární a duktální karcinom. Studium genového či proteinového profilu nádoru pro nově vyvíjenou cílenou biologickou terapii objevilo, že karcinomy prsu lze na základě těchto profilů poměrně spolehlivě rozdělit do dvou skupin, karcinomy s luminální a s bazální diferenciací, které se zcela zásadně liší.Finálně byly vyčleněny čtyři základní skupiny:
- karcinomy s luminální diferenciací A (ER/PR+, HER2-),
- karcinomy s luminální diferenciací B (ER/PR+, HER2+),
- nádory HER2/neupozitivní,
- bazální, nádory triplenegativní (ER/PR-, HER2-).
Luminání A karcinomy (patří mezi ně mj. velká většina lobulárních invazivních karcinomů) vykazují expresi hormonálních receptorů, nízkou proliferační aktivitu, nízký grade (1 nebo 2) a procento jejich recidivy je nízké. Luminální B karcinomy proliferují výrazně více, jsou hůře diferencované, vedle exprese hormonálních receptorů exprimují také HER2 a častěji recidivují. Důsledkem zmnožení receptoru na membráně nádorových buněk je zvýšená proliferační aktivita tumoru, jeho agresivní chování a statisticky významně kratší celkové přežití (do progrese i celkové přežití), bez ohledu na postižení uzlin. Exprese HER2 koreluje s některými dalšími prognostickými faktory – velikostí nádoru, vysokým proliferačním indexem a nízkým stupněm diferenciace nádoru. Karcinomy HER2 typu jsou charakteristické amplifikací HER2 onkogenu při negativitě estrogenového receptoru, při vysoké proliferaci. Bez biologické léčby nepříznivá prognóza. Obvykle dobrá odpověď na chemoterapii. Vyšší grade.Karcinomy bazálního typu se obvykle vyskytují u žen s BRCA mutací, často u mladých žen, mají vysoký grade a nepříznivý klinický průběh.Pozitivita HER2 je prediktorem odpovědi na léčbu humanizovanou monoklonální protilátkou proti tomuto receptoru – trastuzumabem (Herceptin) či nověji malomolekulárním blokátorem tyrozinkinázové aktivity receptoru – lapatinibem (Tyverb). Pro zahájení terapie těmito léky je proto vyžadováno potvrzení overexprese/amplifikace HER2 v nádorových buňkách. To lze prokázat v zásadě dvěma principiálně odlišnými metodami – buď na úrovni proteinu pomocí imunohistochemie (IHC), nebo na úrovni kopie genu metodou in situ hybridizace (fluorescenční in situ hybridizace – FISH, chromogenní in situ hybridizace – CISH, in situ hybridizace s impregnací stříbrem– SISH). IHC je poměrně jednoduchá a levná, snadno proveditelná, jde o metodu časově nenáročnou, ale hrozí poměrně významné riziko falešně negativních i falešně pozitivních výsledků. U nádorů je hodnocena nádorová exprese proteinu ve škále 0–3, kdy vzorky 0 a 1+ jsou považovány za negativní, vzorky 2+ za hraniční a 3+ za silně pozitivní. Metodika in situ hybridizace je složitější, podstatně časově náročnější, vyžaduje nákladnější vybavení. Test je několikanásobně dražší a preparáty připravené pro vyšetření pomocí FISH mají velmi omezenou životnost. Na druhou stranu prakticky neexistují falešně pozitivní ani falešně negativní výsledky tohoto vyšetření. Metoda FISH má vyšší senzitivitu i specificitu než IHC. Exprese HER2 by měla být standardně vyšetřována u každého nově diagnostikovaného invazivního karcinomu prsu.
Nové podskupiny karcinomu prsu
Triple negativní karcinom prsu (TNBC) je nádor bez pozitivity estrogenních, progesteronových a HER2 receptorů. Představuje malou část všech invazivních karcinomů prsu, přesto je velmi významný pro svou agresivitu a špatnou prognózu. Triple negativních karcinomů prsu (TN) je asi 10–20 % ze všech případů, ale představují nepoměrně větší procento mezi metastatickými karcinomy prsu a mezi úmrtím na karcinomy prsu. Triplenegativní(ER/EP-, HER2-) nádory jsou zvláštní, zcela nově definovanou skupinou karcinomů prsu. Tzv. bazaloidní karcinomy (basal-like) exprimují markery diferenciace směrem k myoepiteliím. Jde o nádory agresivní, se špatnou prognózou. Kvůli své vysoké proliferační aktivitě tvoří poměrně velkou část intervalových karcinomů. Antihormonální léčba je u nich neúčinná, stejně jako terapie trastuzumabem. Je u nich častá overexprese EGFR. Léčebnou volbou je zde zatím chemoterapie. Bazaloidní karcinomy se podstatně častěji vyskytují u mladších žen a vykazují zárodečné mutace v genech BRCA1/2, signifikantně častěji jsou spojeny s přítomností metastatického postižení uzlin. Většina karcinomů prsu spojených s mutací BRCA1 genu má charakteristiky TNBC. Přibližně 80–90 % z nich má negativní hormonální receptory a méně než 5 % exprimuje HER2. Z tohoto důvodu by u pacientek s diagnózou TNBC mladších 50 let měla být vyšetřena mutace BRCA1. Pokud žena s mutací BRCA1 onemocní karcinomem prsu, většinou jde o basal-like molekulární subtyp. Nicméně většina basal-like tumorů vzniká u žen bez mutace tohoto genu. Některé charakteristiky jsou však společné. Patří sem například mutace p53, exprese EGFR a z terapeuticky důležitých charakteristik je to senzitivita k poškození DNA (a z toho vyplývající senzitivita k látkám způsobujícím DNA poškození, jako jsou alkylační činidla). Pokud je DNA buňka bez mutace BRCA poškozena například platinovými deriváty během terapie, dojde k její reparaci, a tak k rezistenci. U BRCA1 mutace tato reparační schopnost buňce chybí a dochází k jejímu letálnímu poškození.
6.3.5 Příznaky onemocnění
Rakovina prsu nebývá v začátcích provázena bolestmi a nepůsobí ani jiné obtíže. Ženy většinou nacházejí nebolestivou bulku, resistenci nebo nepravidelnost v prsu. Hmatný útvar na prsu může být provázen vtažením kůže v místě nádoru. Kůže prsu může mít charakter pomerančové kůry. Objevují se změny tvaru a velikosti prsu, deformace bradavky, výtok z bradavky, změny barvy kůže a ulcerace v místě nádoru. Průvodní příznaky karcinomu prsu jsou výrazem již pokročilého nádoru nebo jeho generalizace. Pokud se projeví některý z uvedených příznaků, měla by žena co nejdříve vyhledat praktického lékaře, ošetřujícího gynekologa nebo specialistu chirurga-mamologa.
6.3.6 Diagnostika nádorů prsu
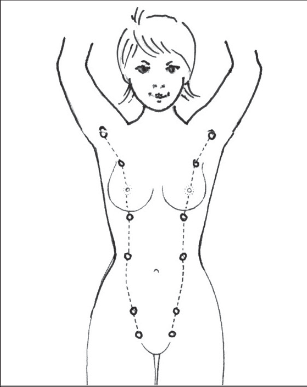
- Samovyšetření prsů ženou je nutné jednou za měsíc, a to po ukončení menstruace.
- Vyšetření prsů ošetřujícím lékařem nebo gynekologem.
- Mamografický screening v ČR je hrazen z prostředků zdravotního pojištění dle vyhlášky 372/2002 Sb., kterou se mění vyhláška 56/1997 Sb., jež stanoví obsah a časové rozmezí preventivních prohlídek. Tato vyhláška nabyla účinnosti dne 15. srpna 2002. Preventivní mamografické (MG) vyšetření se provádí u žen ve věku od 45 let ve dvouletých intervalech. Povinnost odeslat ženu jedenkrát za 2 roky k preventivní (screeningové) mamografii má gynekolog a praktický lékař. Na screeningovou mamografii má možnost odeslat ženu i chirurg z mamologické ambulance.
Stanovení diagnózy nádoru prsu
Anamnéza
Fyzikální vyšetření
Při fyzikálním vyšetření klademe důraz na popis vlastního nálezu: velikost v cm, umístění podle kvadrantů v prsu. Posuzujeme vztah a ohraničení rezistence vůči okolí a její charakter při palpaci a pohyblivost. Hodnotíme kůži nad tumorem, změny barvy, palpační bolestivost, stav bradavek a sekreci z bradavky. Současně vyšetřujeme a hodnotíme nález v obou axilárních jamkách a nadklíčkových prostorech.
Diagnostické metody neinvazivní
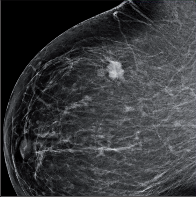
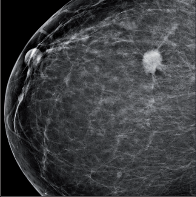
- Mamografie – základní radiodiagnostická vyšetřovací metoda u žen s klinickými příznaky onemocnění prsu i u asymptomatických žen. Jako jediná metoda je schopna detekovat mikrokalcifikace (obr. 3a, b, c, d, e, f ).
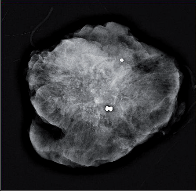
Ultrasonografie – jde o metodu vhodně doplňující mamografii. U mladých, těhotných a kojících žen je zobrazovací metodou první volby. Je spolehlivá především pro diagnostiku cystického onemocnění prsu (obr. 4).
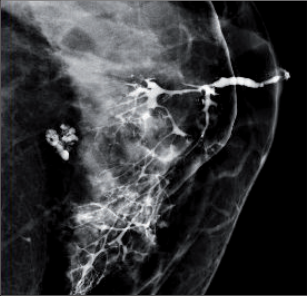
Duktografie – je doplňující metoda v případě patologické sekrece z bradavky. Jedná se o aplikaci kontrastní látky do dilatovaného mlékovodu a následnou mamografii (obr. 5). - Magnetická rezonance prsu (MR), mamoscintigrafie – provádí se pouze výběrově, jedná se o vyšetřovací metody se speciálními indikacemi – např. denzní prsy, vyloučení multicentricity nádoru, kontrola nálezu po neoadjuvantní chemoterapii, odlišení jizvy po operaci prsu od nádorové recidivy, dispenzarizace vysoce rizikových žen.
- CT (výpočetní tomografie prsu) – je indikovaná k posouzení vztahu nádoru k okolním tkáním, především při eventuálním prorůstání do stěny hrudní. V diagnostice diseminace je možné také využít PET/CT.
- RTG plic, tomografie jater, scintigrafie kostí – vyšetřovací metody používané k vyloučení postižení vzdálených orgánů metastatickým procesem.
K invazivním vyšetřovacím postupům patří:
- Tenkojehlová aspirační cytologie – FCNA (fine needle aspiration cytology): získaný buněčný nátěr je odeslán na cytologické vyšetření. Vyšetření vyžaduje zkušeného cytologa.
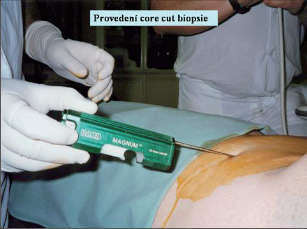
- Core cut biopsie CCB – odběr tkáně prsu speciální silnou jehlou pro histologické vyšetření (obr. 6).
Odebírá se větší množství vzorků – obvykle 12–15. Výhodou biopsie je, že po celou dobu zůstává jehla na místě a při biopsii jsou za asistence vakua odsávány po jehle i tkáňové tekutiny, takže po biopsii zůstává většinou jen malý hematom. Indikací ultrazvukové vakuové biopsie jsou obtížně proveditelné core needle biopsie pro uložení a velikost ložiska, rebiopsie pro nejasný výsledek, mikrokalcifikace a poruchy architektoniky žlázy.Původní technika využívá 1–2 mm širokou „tru cut“ jehlu, která je asi 1–2 cm od špičky opatřena zářezem. Do jehly vnikne tkáň, která je odříznutá válcem s ostrými okraji, který se posunuje po jehle. Variantou této metody je vakuová biopsie. Vakuová biopsie prsu je speciální biopsií, určenou především pro vybrané případy. Tato biopsie se provádí pod USG anebo stereotaktickou kontrolou. Speciální silnější jehla se po znecitlivění místa vpichu zavede do prsu a odebírané vzorky jsou po jehle transportovány z prsu ven.
Laboratorní a další doplňující vyšetření
Vyšetření hematologické a biochemické a nádorových markerů C 15–3 a CEA. Vyšetření nádorových markerů nepřispívá k časné diagnostice, ale má význam především v pooperačním sledování k detekci recidiv onemocnění a vzniku metastáz. Doplnění dalších zobrazovacích vyšetření ostatních orgánů, které se mohou stát sídlem metastáz, především rentgenový snímek hrudníku, ultrasonografie břicha a scintigrafie skeletu.
6.3.7 Chirurgická léčba karcinomu prsu
Výkony na prsu pro nádorové onemocnění
Do devadesátých let minulého století byly standardním řešením ablační výkony. Vzhledem k zavedení mamárního screeningu, pokrokům v diagnostice, novým chirurgickým technikám a moderní onkologické léčbě je dnes možno provádět přibližně v 70 % případů prs šetřících operace.
Konzervativní – prs šetřící – výkony
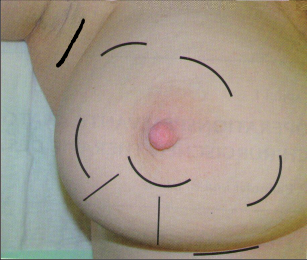
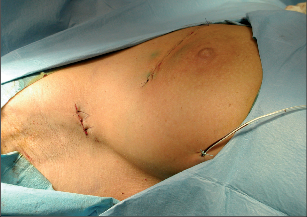
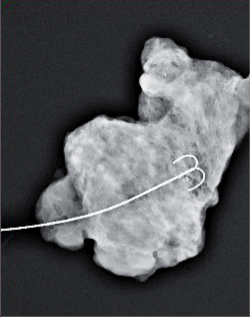
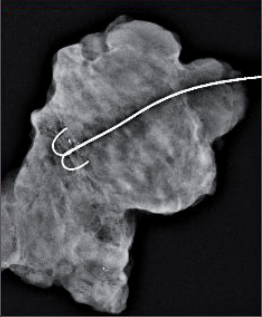
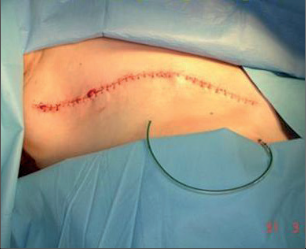
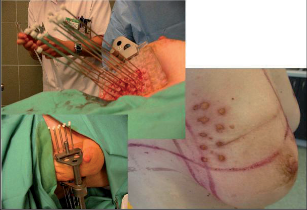
Při konzervativním, prs zachovávajícím výkonu se provádí vlastně exstirpace tumoru s lemem zdravé, tumorem nepostižené tkáně. Terminologicky je výkon označován jako tumorektomie, lumpektomie či segmentární resekce. Větším výkonem je kvadrantektomie – žláza je resekována v rozsahu kvadrantu prsu s resekcí kůže nad tumorem a pektorální fascie na spodině. Pro přístup k nádoru a z důvodu výsledného kosmetického efektu je důležité vedení přístupových řezů na prsu (obr. 7, 8, 9). Původně užívané radiální řezy většina chirurgů opouští a dává přednosti v horní i dolní hemisféře prsu řezům cirkulárním z důvodů lepšího kosmetického výsledku. Poměrně přijatelné jizvy jsou zpravidla i po radiálních řezech v dolních kvadrantech. Řez by měl být umístěn co nejvíce nad hmatnou lézí. Při nehmatných nálezech je pro chirurga pomůckou předoperační značení nádoru (zavedením drátku s kotvičkou k označení místa nádoru, značení barvou nebo radioaktivní látkou pod mamografickou či sonografickou kontrolou) (obr. 10).
Nádor by měl být resekován en bloc s bezpečnostním okrajem okolní tkáně – makroskopicky 10 mm. Zásadně by linie řezu neměla probíhat nádorem. Doporučená mikroskopická minimální vzdálenost u invazivních nádorů je 1–2 mm. U duktálního ca in situ byla doporučována vzdálenost 10 mm vzhledem k intraduktální propagaci nádoru, a v tom případě nebyla nutná následná radioterapie. Na setkání expertů všech oborů podílejících se na léčbě karcinomu prsu v roce 2010 byla tato doporučovaná vzdálenost nyní snížena na 2 mm, ale vždy následuje radioterapie. Otázka resekčních okrajů je stále zkoumána a diskutována. Všeobecné pravidlo o bezpečné vzdálenosti není stanoveno. Musíme přihlížet k individuálním rizikovým faktorům – histologickému typu nádoru, stavu receptorů, extenzivní intraduktální komponentě, angioinvazi, věku pacientky. Při hodnocení lemu zdravé tkáně také velmi záleží na zpracování a odečtení vzorku patologem. U prs záchovných operací je možné provést histologické vyšetření resekčních okrajů rychlým peroperačním vyšetřením (kryostatové vyšetření). Důležité je pečlivé označení orientace preparátu chirurgem. Peroperačně se do lůžka tumoru aplikují titanové klipy k usnadnění zaměření následné radioterapie – aplikace boostu do lůžka tumoru. Operace na prsu musí být vždy doplněna stejnostranným výkonem v axile – biopsie sentinelové uzliny nebo disekce axily. Standardně se po prs šetřících operacích provádí radioterapie prsu.
Kontraindikace k prs šetřícím operacím dělíme na absolutní a relativní.
- Mezi absolutní patří:
- přání pacientky,
- gravidita,
- zánětlivý karcinom prsu,
- předchozí ozáření prsu nebo hrudníku,
- pozitivní resekční okraje po opakovaném chirurgickém zákroku,
- žádná odpověď na neoadjuvantní chemoterapii,
- multicentrický karcinom v rozdílných kvadrantech,
- rozsáhlé mikrokalcifikace maligního charakteru.
- relativními kontraindikacemi jsou:
- multicentricita a multifokalita nádoru,
- kolagenózy a revmatická onemocnění,
- nepoměr velikosti tumoru a prsu.
Velkými klinickými studiemi (Veronesi, Fischer) byla jednoznačně prokázána stejná délka přežití pacientek po prs záchovných operacích jako po radikálních operacích při podstatně lepší kvalitě života.
Onkochirurgické výkony
Spojují principy resekčních a plastických výkonů. Rozšiřují možnosti chirurgické léčby na prsu.
Ablativní operační výkony
- Radikální mastektomie – sec. Halsted: při této operaci se kromě prsu odstraní oba pektorální svaly, tuková a lymfatická tkáň všech tří stupňů axily technikou en block. Odstraňuje se i thorakodorzální nervově-cévní svazek a n. thoracicus longus.
- Modifikovaná radikální mastektomie – sec. Madden: při tomto druhu mastektomie se provádí kromě odstranění žlázy s kůží prsu a fascií pektorálního svalu také lymfadenektomie první a druhé etáže axily. Zůstane neporušen torakodorzální svazek a n. thoracicus longus. Elipsoidní kožní incize se lokalizuje zpravidla šikmo směrem k axilární řase nebo napříč. Dnes je tento typ operace standardně prováděným ablačním výkonem (obr. 11). Modifikace výkonu je kůži šetřící mastektomie, při které se odstraní prsní žláza spolu s dvorcem a bradavkou a přes prodloužený řez směrem zevně a nahoru se pak provede axilární disekce.
- Prostá mastektomie – odstranění prsní žlázy včetně cirkumaleolárního komplexu bez operace v axile. Provádí se v případě duktálního karcinomu in situ a při karcinomu u starších a rizikových žen.
- Subkutánní mastektomie – odstranění celé prsní žlázy s ponecháním kožního krytu a cirkumaleolárního komplexu, může být provedena v jedné době s vložením implantátu. Je indikována u duktálního karcinomu in situ a profylakticky u nosiček genu BRCA-1, BRCA-2.
- Sanační mastektomie je indikována u lokálně pokročilých rozsáhlých exulcerovaných tumorů, kde je zapotřebí vzniklý defekt rekonstruovat různými druhy plastiky, jako jsou kožní laloky a muskulokutánní laloky.
Metoda sentinelové biopsie (SLNB)
Jedná se o velmi šetrnou operaci v podpaží prováděnou u časných stadií karcinomu prsu (T1, T2 – do 3 cm velikosti nádoru). Biopsie sentinelové uzliny je alternativou axilární disekce u časného karcinomu prsu. Odběr sentinelové uzliny můžeme indikovat v případě klinicky i ultrazvukem potvrzeného negativního nálezu v axile. Sentinelová uzlina je první spádová uzlina v lymfatickém povodí nádoru. V průměru jsou odstraněny dvě uzliny. Praxe při technice odběru sentinelové uzliny vychází z teorie, že pokud je tato první spádová (strážná uzlina) bez přítomnosti nádorových buněk, pak i zbývající uzliny nejsou nádorovými buňkami postiženy.Pro identifikaci sentinelové uzliny se používají dvě metody: značení uzliny radiokoloidem a barvením.
1. Označení této uzliny/uzlin se provádí aplikací radiofarmaka do bezprostřední blízkosti nádoru na oddělení nukleární medicíny v den operace nebo jeden den před operací. Nejčastěji používanou radioaktivní látkou je v Evropě Tc 99 nanokoloid. Tato radioaktivní látka je vychytávána zmíněnou sentinelovou uzlinou a na oddělení nukleární medicíny je při lymfoscintigrafii zobrazena – tzv. mapping (obr. 12). Při vlastní detekci uzliny si pomáháme peroperačně detektorem gama-záření, který zachycuje vyšší intenzitu radioaktivity v sentinelové uzlině. Po odstranění sentinelových uzlin klesá radiace v axile na hladiny nižší, než je 10% radiace sentinelové uzliny. Peroperačně je uzlina hodnocena patologem zmrzlým řezem a cytologickými nátěry. V případě zjištění maligního postižení uzliny je nutno doplnit kompletní disekci axilly.
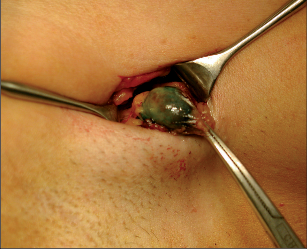
2. Na operačním sále se v úvodu operace do okolí nádoru vpravuje speciální modré barvivo – Patent Blue a provádí se lehká masáž prsu. Použití barviva zvyšuje úspěšnost identifikace sentinelové uzliny. Preparací v podpažní jamce vyhledáváme modře zbarvenou sentinelovou uzlinu (obr. 13).Kombinací obou metod detekce sentinelové uzliny dosahujeme senzitivity 95 %.
Axilární disekce
Je standardním chirurgickým operačním výkonem v axile u karcinomu prsu. Představuje odnětí tukově lymfatické tkáně axily s uzlinami I. a II. etáže. Je používán i pojem exenterace axily.
Odběr uzlin III. etáže axily se běžně neprovádí, protože se prudce zvyšuje riziko následného lymfedému končetiny (obr. 14). Pacientky s masivním postižením lymfatických uzlin v axile jsou indikovány předoperačně k neoadjuvantní chemoterapii. Tukově lymfatická tkáň axily obsahuje 30–40 uzlin. Počet je variabilní a snižuje se s věkem. Bývá nižší i u pacientek po neoadjuvatní chemoterapii. Při operaci je nutno odebrat a vyšetřit minimálně 10 uzlin. Preparace v axile musí být šetrná, s ponecháním nervus thoracicus longus a torakodorzálního nervově-cévního svazku, vhodné je šetření interkostobrachiálních nervů a mediálního pektorálního nervu. Axilární disekce je hlavně operace stagingová, která má četné pooperační komplikace, a proto je nyní u časného karcinomu nahrazována biopsií sentinelové uzliny. Nejvážnější komplikací axilární disekce je lymfedém končetiny a přilehlé části stěny hrudní. Rovněž časté jsou bolesti a poruchy citlivosti na mediální straně paže. Starší pacientky jsou ohroženy pooperačním omezením hybnost v kloubu ramenním.
Rekonstrukční výkony po operaci prsu
Rekonstrukce prsu po mastektomii je neoddělitelnou součástí komplexní péče o ženy s nádorem prsu. Rekonstrukční operace provádí plastický chirurg. Představují rozsáhlé spektrum operačních výkonů pro zlepšení kvality života ženy.
Chirurgická léčba při recidivě onemocnění a vzdálených metastázách
Při lokální recidivě karcinomu je indikováno radikální odstranění nádoru s krytím defektu prostou suturou či metodami plastické chirurgie. Úspěšně lze s dlouhodobým dobrým efektem odstranit i vzdálené metastázy, např. do plic a mozku či jater. Tuto problematiku řeší příslušné specializované obory. Je samozřejmé, že i v těchto případech je chirurgická léčba součástí komplexní terapie.
Lymfedém – komplikace komplexní léčby karcinomu prsu
Porucha lymfatické drenáže je závažnou komplikací komplexní léčby karcinomu prsu, protože postihuje ženy v produktivním věku. Často je právě lymfedém důvodem dlouhodobě snížené kvality života. Lymfedém, nebyl-li zastižen a léčen v počátečním stadiu, je poruchou chronicky progredující, která vede k chronickým změnám postižených měkkých tkání, které mohou vyústit až do jejich fibrotické přestavby.V České republice se podařilo vytvořit pod vedením České lymfologické společnosti síť lymfologických pracovišť. Nejčastěji jde o lymfedém horní končetiny, lymfedém může postihovat i prs (v případě konzervativních chirurgických výkonů), axilu, hrudní stěnu a oblast lopatky. Různý stupeň lymfedému paže po provedené axilární lymfadenektomii I. a II. etáže a/nebo následné radioterapii se objeví až u 56 % léčených žen. Pravděpodobnost vzniku lymfedému paže roste s rozsahem chirurgického výkonu v axile a kombinací axilární lymfadenektomie a radioterapie. Disekce pouze sentinelové lymfatické uzliny redukuje vznik lymfedému horní končetiny. Příčinou je odstranění nebo ozáření lymfatických uzlin a lymfatických cév v oblasti axily. Další příčinou může být fibrotická přestavba měkkých tkání operované a ozářené axily. U lymfedému se jedná o vysokoproteinový otok způsobený zmenšenou transportní a proteolytickou kapacitou lymfatického systému v postižené oblasti.
- Akutní lymfedém vzniká obvykle jako bezprostřední reakce na operaci anebo ozáření. Jeho výskyt je méně častý na horní končetině, ale častý v oblasti prsu v souvislosti s jeho radiací.
- Chronický lymfedém je charakterizován pozvolným nástupem.
- Fibróza měkkých tkání se vyvíjí u chronického lymfedému jako konečné stadium patologických procesů pojivové tkáně.
- Stadia a komplikace lymfedému:
- stadium – latentní lymfedém,
- stadium – reverzibilní lymfedém,
- stadium – ireverzibilní lymfedém,
- stadium – elefantiáza.
- Diagnóza
Důraz je kladen především na diagnostiku časnýchstadií lymfedému. Zásadní význam má pečlivá anamnéza, informace o provedené lymfadenektomiinebo radioterapii. U akutních stavů, kdy dominujícím příznakem je otok, stojí v popředí především diferenciální diagnóza mezi postižením lymfatického a žilního systému. Vhodné je provést ultrasonografické vyšetření hlubokého žilního systému paže, podpaží a podklíčkové žíly a lymfografii horníkončetiny, která určí místo a rozsah blokády. - Léčba
Za standard léčby lymfedému je dnes celosvětově považována „komplexní dekongestivní terapie“doplněná dlouhodobou farmakoterapií. Zahrnuje manuální a přístrojovou lymfodrenáž, kompresivní bandáže a speciální cvičení. Medikamentózní léčba diuretiky je obsoletní. Flavonoidy mají své pevné místo v léčbě žilních onemocnění. U některých je dokumentován též vliv na lymfatický systém. Proteázy mohou zasahovat přímo do patofyziologie progredující lymfatické insuficience svým proteolytickým a fibrinolytickým efektem. Úlohu mohou sehrát u latentního stadia. Nedodržení léčebného režimu, přetížení, úraz, zánět apod. ihned poruší dosaženou rovnováhu a znovu se objeví městnání v měkkých tkáních.Používají se i chirurgické metody, které řeší poruchy lymfatické drenáže náhradou lymfatik. Výsledky ale nejsou příliš povzbudivé. Za optimální přístup k diagnostice a terapii sekundárního lymfedému považujeme jeho záchyt v latentním stadiu a zahájení časné komplexní léčby. Po zvládnutí akutního lymfedému nebo stabilizaci lymfedému chronického je vždy nezbytné pokračovat v udržovací léčbě s trvalou dispenzarizací. Důležitá je prevence (zabránění poranění končetiny, kompresivní a škrtící oděvy, odběry krve z končetiny, aplikace léků do končetiny, měření TK na operované končetině, spáleniny, opalování a jiné).
Kvalita chirurgické péče
Chirurgové se vždy zabývali hodnocením kvality chirurgické péče. Mezi požadavky na kvalitní onkochirurgickou péči patří hlavně provedení tzv. R0 resekce, tj. radikální odstranění tumoru, adekvátní lymfadenektomie a snaha o zábranu rozsevu nádorových buněk v průběhu operace. Mezi hodnocená kritéria dlouhodobě patří sledování pooperační úmrtnosti, frekvence časných i pozdních komplikací, nutných reoperací, recidiva maligního onemocnění a přežívání po léčbě. V posledních letech se do popředí při hodnocení kvality v medicíně dostává nový pohled. Koncepce hodnocení kvality v medicíně a stejně tak v chirurgii dnes vychází z předpokladu, že se zvyšujícím se počtem operací stoupá i kvalita výsledků („High volume hospitals“). V roce 2006 byla v ČR ustanovena Komplexní onkologická centra (Věstník MZ částka 6, srpen 2006), která jsou schopna zajistit nemocným se zhoubnými nádory komplexní péči (onkochirurgie, radioterapie, chemoterapie). V současné době obdrželo v ČR tuto akreditaci od MZ ČR 13 center. Do těchto center je zatím koncentrována jen radioterapie a jsou zde koncentrováni vybraní nemocní pro chemoterapii a biologickou léčbu. Onkochirurgické operace jsou v České republice zatím prováděny na poměrně velkém počtu pracovišť. U zhoubných nádorů prsu je v ČR ročně v průměru provedeno 4728 primárních operací (průměr za léta 2001–2005). Z údajů v Národním onkologickém registru vyplývá, že operace byly v tomto období prováděny na více než 100 pracovištích, ale jen na 34 z nich bylo provedeno více než 40 operací za rok. Lze tedy říci, že jen menšina splňuje kritéria léčebných zařízení „High volume hospitals“, zbytek nemocných je operován na odděleních s menší frekvencí prováděných operací. Velmi závažným zjištěním je skutečnost, že pětileté přežívání u stejných stadií karcinomu prsu značně kolísá na různých pracovištích v závislosti na počtu provedených operací v neprospěch pracovišť s malou frekvencí prováděných výkonů. Česká chirurgická společnost a Sekce onkochirurgie České onkologické společnosti spatřují priority pro budoucnost v racionální koncentraci onkochirurgických operací na menší počet chirurgických pracovišť spolupracujících a koordinovaných z onkocenter, odpovídající finanční zajištění náročných onkochirurgických výkonů na těchto pracovištích a zařazení onkochirurgie mezi oficiální specializace.Vlastní zkušenosti: Autorka této kapitoly se dlouhodobě zabývá problematikou prsu, je členkou poradny pro choroby prsu a interdisciplinární indikační komise a v posledních pěti letech operovala na dvou pracovištích (Nový Jičín, Vítkovice) ročně v průměru 300 pacientek s karcinomem prsu. Tato pracoviště jako jedna z mála v ČR splňuji kritéria „High volume hospitals“.
6.3.8 Chemoterapie
Na základě podrobného předoperačního stagingu, korigovaného operačním nálezem a histopatologickým vyšetřením nádoru, je stanovena nejoptimálnější léčba, jejíž součástí může být podání systémové chemoterapie – látek s protinádorovým účinkem. Systémová chemoterapie využívá protinádorového účinku vybraných chemických látek. Chemoterapie slouží k likvidaci mikrometastáz a nádorových buněk tzv. minimální reziduální nádorové choroby. Chemoterapie je zpravidla podávána na základě prognostických faktorů, podle kterých je stanoveno riziko onemocnění. Přínos adjuvantní chemoterapie je největší u pacientek s pozitivními uzlinami. Zásadní cytostatika jsou antracykliny, taxany a cyklofosfamid. Podávají se ve formě infuzí do žíly ve 3–4týdenních intervalech. Chemoterapeutických režimů je celá řada. Terapie je často provázena řadou nežádoucích účinků, které ošetřující onkolog nemocné detailně vysvětlí s ohledem na konkrétní režim. Dnes existuje celá řada velmi účinných léků k tlumení vedlejších nežádoucích účinků (nevolnost a zvracení). Součástí aplikace chemoterapie jsou i pravidelná laboratorní vyšetření, podle kterých se řídí další léčba. Chemoterapie se opakuje v určitých intervalech (cyklech) a trvá 6–8 měsíců. U pokročilých nádorů je možné podat chemoterapii ještě před operací (neoadjuvantní chemoterapie). Smyslem tohoto postupu je zmenšení nádoru a převedení inoperabilního nádoru v operabilní a usnadnění prs zachovávajícího výkonu. Adjuvantní chemoterapie je podávána až po chirurgickém výkonu a je stanovena na základě klinického stadia určeného operací a podrobným histopatologickým vyšetřením nádoru.
Léčebné možnosti TNBC (triple negativní karcinomy prsu)
Multidisciplinární přístup k ženám s karcinomem prsu výrazně zlepšil výsledky léčby a TNBC v tomto ohledu není výjimkou. V terapii se uplatní chirurgie, radioterapie i chemoterapie. Při neoadjuvantní chemoterapii je mnohem vyšší procento pCR (patologická kompletní odpověď) než u nádorů non-TNBC. Dosažení pCR je důležitým prognostickým faktorem. Pacientky s TNBC, které nedosáhnou pCR, mají významně horší prognózu než non-TNBC se stejnou odpovědí k neoadjuvanci. Chemoterapeutických režimů byla vyzkoušena celá řada, standardní jsou režimy obsahující antracykliny s taxany sekvenčně nebo konkomitantně, jak v neoadjuvantním, tak v adjuvantním podání (např. TAC, AC-T). Při recidivě onemocnění TNBC, ať už lokální nebo metastatické onemocnění, je další volba terapie velmi svízelná, protože dosud neexistuje žádný prediktivní faktor. Histopatologický stupeň diferenciace nádoru – Grading G1,2,3,4 (G1 – nejlepší prognóza, G4 – nejhorší prognóza), nález angioinvaze, lymfangioinvaze, perineurální šíření a nekrózy v nádoru zhoršují prognózu. Vyšetření hormonálních receptorů testuje možnost ovlivnění nádoru hormonální léčbou, pozitivita estrogenních a progesteronových receptorů je pozitivním faktorem.
6.3.9 Radioterapie
radioterapie neboli léčba zářením doplňuje chirurgický výkon. Úkolem radioterapie je aplikovat maximální dávky záření do určeného místa, aby došlo ke zničení patologického ložiska při minimálním poškození zdravé tkáně. Účinek záření je ovlivněn schopností regenerace buněk po poškození ionizujícím zářením. Buňky radiosenzitivní mají velmi omezenou schopnost regenerace a poškození buněk způsobuje jejich smrt. Odolnost buněk na záření hodnotíme jako radiosenzitivitu. Radiosenzitivita je úměrná mitotické aktivitě a nepřímo stupni diferenciace. Úspěšnost léčby vychází z celkové dávky záření a velikosti nádorů. U větších nádorů musí být vyšší dávka. Ideální případ je aplikace záření v jednom sezení, což často není možné pro riziko poškození okolních tkání, proto je dávka podávána ve více sezeních. Okolní zdravá tkáň má větší schopnost regenerace mezí jednotlivými dávkami než vlastní nádor. Klasická frakcionace je 5 frakcí týdně po 2 Gy celkem 5–7 týdnů. Počet frakcí může být menší při vyšší dávce anebo naopak větší při nižší dávce. Pro určení objemů záření je nutné pomocí zobrazovacích metod zjistit rozsah nádorů (CT, MR, PET/CT). Vlastní terapie využívá 3D konformní radioterapie, která umožňuje minimální poškození okolní tkáně. Hlavním zdrojem záření jsou v současnosti lineární urychlovače.
Zdroje záření
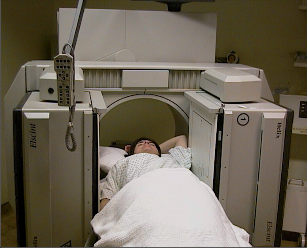
- Zevní radioterapie je ozařování z jisté (větší) vzdálenosti od ložiska, záření proniká přes kůži. Celý prs je ozařován v poloze na zádech s horními končetinami nad hlavou (obr. 15).
- Brachyterapie je ozařování z krátké vzdálenosti.
Zdroj záření je umístěn do blízkosti nádoru nebo přímo do nádoru. Brachyterapie se provádí v celkové anestezii a doba hospitalizace nepřesáhne 3 dny (obr. 16). Samotná brachyradioterapie je nový postup peroperační aplikace záření u vybraných nádorů. Nejedná se zatím o standardní postup. Výhodou je zkrácení léčby, snížení objemu ozáření zdravé okolní tkáně lůžka tumoru.
Adjuvantní radioterapie po konzervativních výkonech
Adjuvantní radioterapie je standardní součástí terapie po konzervativních výkonech. Významně snižuje riziko vzniku lokálních recidiv. Záření je aplikováno denně na celý prs v celkové dávce 50 Gy po dobu 5 týdnů (25 frakcí). Dávka je zvyšována (boost) o 10–16 Gy u rizikových nádorů (mladý věk, G3, velké nádory, těsné okraje) a u pozitivních nádorů až na 20 Gy. Navýšení dávky je možné provést brachyterapií.
Invazivní karcinom
Radioterapie je vždy aplikována u invazivního karcinomu. Výjimkou mohou být vybrané nádory u starších pacientek. Radioterapie je zaměřena na oblast celého prsu a dle nálezu na ozáření nadklíčkových a podklíčkových uzlin III. etáže.1. Negativní axilární uzliny. Radioterapie prsu a boost.2. 1–3 pozitivní uzliny. Ozáření prsu a boost do lůžka nádoru a uzlin III. etáže, nadklíčkových a podklíčkových uzlin dle dalších rizikových faktorů.3. 4 a více pozitivních uzlin – radioterapie na prs s cíleným ozářením lůžka a nadklíčkových, podklíčkových uzlin a uzlin III. etáže.
Duktální karcinom in situ
Radioterapie byla individuálně aplikována dle van Nyus prognostického faktoru na základě konsenzu odborníků z roku 2010 a je indikována prakticky u všech nálezů.
Adjuvantní radioterapie po mastektomii
Indikace adjuvantní chemoterapie po mastektomii se řídí rizikem vzniku lokální recidivy. Za rizikové faktory jsou považovány nádory větší než 5 cm, infiltrace kůže, stěny hrudníku, těsné okraje, mladý věk, multicentrické a multifokální nádory, nádory s vysokým počtem pozitivních uzlin. Axila je ozářena pouze při neúplném odstranění uzlin I. a II. etáže. Pokud je provedena disekce axily, jsou ozářeny pouze uzliny III. etáže.Ozáření nebolí a působí pouze místně, tedy v ozařované oblasti. K nejčastějším nežádoucím účinkům patří kožní reakce, která může mít různý stupeň od lehkého zčervenání až po olupování kůže. Ke konci ozařování se objevuje ztmavnutí kůže, které přetrvává hodně dlouho.
Speciální indikace radioterapie
- Kurativní radioterapie
U pacientek, u kterých není možnost provést chirurgický výkon (velikost nálezu, nesouhlas s chirurgickým výkonem, celkový stav neumožňujícíchirurgický výkon, průvodní onemocnění). - Neoadjuvantní radioterapie
V současností se nejedná o standardní postup. Výjimkou může být inflamatorní karcinom. - Bilaterální karcinom
Ozáření obou prsů pro oboustranný karcinom. - Paliativní radioterapie
Dosažení regrese nádoru nebo metastáz.
Nežádoucí reakce po radioterapii
- Akutní postradiační reakce začínají během ozařovací série a mohou přetr vávat i několik týdnů po ukončení radiace. Projevují se erytemem, deskvamací. Maximum se objevuje v kožních záhybech submamární rýhy.
- Chronické postradiační reakce se objevují po měsících i letech po ukončení radioterapie. Projevují se jako zvýšená pigmentace, dermatitidy, podkožní fibróza, edém, lymfedém horní končetiny.
- Postižení vzdálených orgánů. Následkem radioterapie může být akutní pneumonitida, ischemická choroba srdeční, ezofagitida, hypotyreóza, postižení brachiálního plexu, osteoradionekróza ramenního kloubu.
6.3.10 Hormonální léčba
Exprese hormonálních receptorů nádorovými buňkami umožňuje ovlivnění progrese nádoru. Terapií se odstraní jeho růstový faktor – estrogeny. Možnost dosáhnout remise souvisí s denzitou hormonálních receptorů. V neselektivních souborech dosahuje hormonoterapie remise u 30 % pacientek a zastavení progrese u 40 %.
Možnosti eliminace účinku estrogenů
- Ablativní: odstranění či vyřazení z funkce žlázy produkující příslušný hormon – ovaria.
- Chirurgická kastrace – ovarektomie, stále má své místo, neboť její účinek je rychlý a ekonomicky nejúspornější.
- Radiační kastrace, zejména v případě, kdy chirurgická není možná.
- Farmakologická kastrace – podání agonistů GnRH.
- Kompetitivní: kompetice o vazební místo na estrogenní receptory buňky.
- Léčba antiestrogeny – tamoxifen.
- Novějším lékem je fulvestrant, který se vážena estrogenové receptory a způsobuje jejichzánik.
- Inhibiční: blokáda biosyntézy estrogenů.
- Neselektivní inhibitory aromatázy, způsobujei pokles kortizolu, což vyžaduje substituci.
- Selektivní inhibitory aromatáz, neblokují hydroxilace ostatních steroidních hormonů.
- Nesteroidní: anastrozol, letrozol.4. Steroidní: formestan, exemestan.
- Aditivní: podávání farmakologických dávek gestagenů, androgenů i estrogenů.
- Spočívá v podání farmakologických dávek gestagenů – zpětná blokáda předního laloku hypofýzy s poklesem produkce gonadotropinů (FSH, LH) a také ACTH, např: Megace, Provera.
6.3.11 Biologická léčba
Rozsáhlé genetické a molekulárně biologické výzkumy v posledních letech přinesly řadu nových poznatků v léčbě maligních nádorů, které se promítají do diagnostiky i do léčby karcinomu prsu. Nové trendy jsou reprezentovány biologickou léčbou, kterou se rozumí podávání biologických preparátů, které jsou označovány jako monoklonální protilátky a jsou namířené proti určitým strukturám v buňce. Na rozdíl od cytostatik působí pouze na buňky, které danou strukturu obsahují. Biologické léky, které působí na dráhu HER-2-receptoru, patří nyní k nejefektivnější biologické léčbě nádorů. Velmi účinným představitelem biologické léčby je trastuzumab, který výrazně prodlužuje přežívání pacientek. Jedná se o monoklonální protilátku namířenou proti HER-2-genu. Trastuzumab je účinný u nádorů, které nadměrně produkují HER-2-gen. Jedná se o 15–20 % karcinomů prsu. Trastuzumab je považován na největší přínos v adjuvantní léčbě karcinomu prsu. Další biologický lék k léčbě nádorů s amplifikací HER-2-genu je lapatinib. Má jiný mechanismus účinku než trastuzumab. Proto je účinný i u nádorů, u kterých selhala léčba trastuzumabem. Je podáván perorálně a má dobrý průnik do CNS, je více toxický. Nově pro léčbu karcinomu prsu je schválen bevacizumab, který ovlivňuje angiogenezi. Je to protilátka, která se váže na vaskulární růstový faktor endotelií, neutralizuje ho, a zabraňuje tím novotvorbě cév.V roce 2001 byl založen na popud výboru ČOS registr pacientek s HER-2-pozitivním karcinomem, kterým byl podán trastuzumab. Registr sleduje správnost indikace, počty nemocných, hodnotí výsledky a bezpečnost léčby. Biologická léčba je soustředěna do komplexních onkologických center/skupin, jejichž status je dán Věstníkem MZ ČR. V ČR je léčeno trastuzumabem přibližně 14 % nemocných s karcinomem prsu. Dle literárních údajů se vyskytuje HER-2-pozitivita ve 20–30 % případů karcinomu prsu.
6.3.12 Význam komplexní léčby
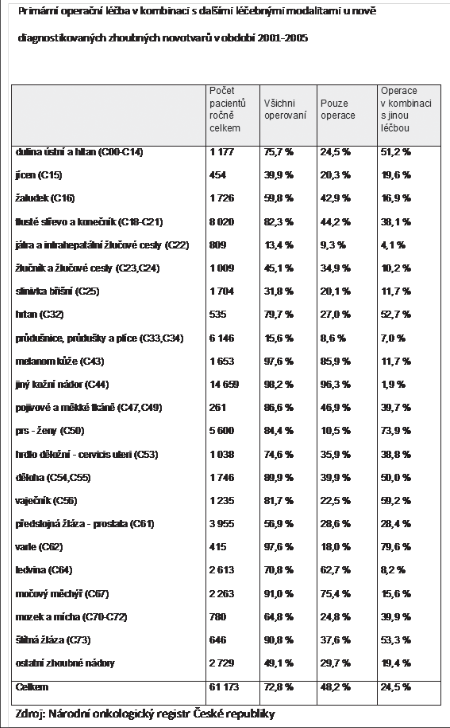
Adjuvantní léčba (radioterapie, chemoterapie, hormonoterapie) probíhá většinou ambulantně. Hospitalizace je nutná pouze v případě komplikací terapie nebo při velké vzdálenosti bydliště pacientky od centra, kde onkologická terapie probíhá. V terapii všech maligních nádorů je velmi důležitá komplexní léčba a nádory prsu nejsou výjimkou. Velký pokrok v terapii karcinomu prsu je výsledkem kombinace chirurgické a komplexní onkologické léčby. Údaje Národního onkologického registru, které jsou v následné tabulce, potvrzují, že multimodální léčbu u karcinomu prsu využívá téměř 74 % pacientek (Tab. 3).
6.3.13 Rehabilitace
Rehabilitace je součástí primární komplexní péče o pacientky s karcinomem prsu. U příznivě zvládnutého onemocnění zvláště u mladých pacientek je důležitý brzký návrat do zaměstnání. Rehabilitace je významnou součástí terapie, která pomáhá kompenzovat somatický a psychický dopad onemocnění na ženu. rehabilitace je individuálně sestavená, vychází z charakteru a rozsahu vlastního onkologického onemocnění (fyzického i psychického stavu pacientky). Nedílnou součástí v léčebné strategii je včasná a odborně vedená fyzioterapie po operačním zákroku na prsu a v podpaží. Cílem je obnovení správného dýchání, normální pohyblivosti ramenního kloubu a horní končetiny na operované straně. Ve cvičení je vhodné pokračovat i po ukončení léčby. Pozdní nebo dokonce žádná fyzikální rehabilitace se může podílet na vzniku lymfedému horní končetiny, který pak negativně ovlivňuje celkový stav pacientky. Další možností komplexní rehabilitace je lázeňská léčba. V současnosti pacientka může do dvou let od ukončení komplexní terapie absolvovat lázeňskou léčbu na náklady zdravotních pojišťoven. V ČR jsou pro tuto diagnózu doporučovány Mariánské lázně, Františkovy lázně, Karlovy Vary. Cílem rekondičních pobytů je zvýšit fyzickou kondici účastníků, psychickou odolnost, sebedůvěru a posílit sociální vazby.
Protetické pomůcky
- Paruky: Ženy léčené chemoterapií často dočasně ztrácejí vlasy. I když jde o změnu vzhledu přechodnou, bývá traumatizující.
- Epitézy: Jsou zdravotní pomůcky, kterými nahrazujeme ztrátu prsu nebo upravujeme pooperační změny. Obnovují přirozený vzhled prsů a umožňují plnou pohybovou i společenskou aktivitu. K epitézám je možno využít i doplňků. Jedná se o bradavky, podprsenky a plavky.
- rekonstrukce prsu po ablaci: Po ablaci prsu je možné provést rekonstrukci prsu. Operační postupy je možno rozdělit na rekonstrukce spojené s implantací (vnitřním vložením) mamární náhrady a rekonstrukce vlastní živou tkání z jiného místa pomocí laloků – z místa hrudníku, břišní stěny a hýždí. Rekonstrukce provádí plastický chirurg.
6.3.14 Občanská sdružení podporující pacientky
V dnešní době existuje celá řada občanských sdružení organizující pacientky léčené s nádorovým onemocněním prsu (Liga proti rakovině, ONKO-AMAZONKY apod.). Tato sdružení si kladou za cíl psychickou a sociální podporu pacientek, organizaci rekondičních pobytů. Umožňují kontakty s ženami, které se léčí na stejnou diagnózu, a tak je umožněna neformální výměna zkušeností a vzájemná podpora.
Občanská sdružení dobrovolných onkologických organizací usilují o zvýšení kvality života onkologických pacientů a řešení jejich psychosociálních, sociálních, právních i společenských problémů. Organizují odborné besedy se zdravotníky, rekondiční pobyty pro členy a jiné sociální a společenské programy. Organizace jsou regionální i celostátní. Mamma Help je příkladem celostátně působící organizace s mnohaletou tradicí, která neustále rozšiřuje svoji činnost a působiště v rámci české republiky. Regionální organizace na severní Moravě jsou např. Klub Naděje ve Frýdku-Místku, Klub INNA v Havířově, Onkologický klub ISIS v Opavě, Klub Amazonek v Ostravě, Liga proti rakovině v Šumperku, Klub Onko Duha ve Vsetíně.
6.3.15 Dispenzarizace
Dispenzarizace začíná po ukončení komplexní léčby nádorového onemocnění prsu.
Časové schéma
- první rok: dispenzarizační prohlídky každé 3 měsíce,
- druhý až třetí rok: prohlídky dvakrát do roka,
- třetí až pátý rok: jedenkrát do roka,
- po pěti letech: doporučení dispenzarizační prohlídky jednou do roka doživotně.
Součásti dispenzarizačního vyšetření: klinické vyšetření, vyšetření nádorových markerů, RTG plic, mamografie či ultrazvuková vyšetření prsu a jizev, scintigrafie kostí, ultrazvuk jater, gynekologické vyšetření. Ne všechna vyšetření jsou prováděna při každé kontrole. Úkolem těchto kontrol je časné odhalení lokální recidivy onemocnění, duplicity nádoru či vzniklé vzdálené metastázy.
6.4 Jiné zhoubné nádory prsu
Vzácně se v prsu vyskytují i jiné zhoubné nádory než karcinom.
Sarkomy
Stromální sarkom z mamárního stromatu, lokalizovaného v lobulech a kolem vývodů, je hormonálně dependentní.Většina ostatních sarkomů prsu má identickou histologickou strukturu jako běžné sarkomy měkkých tkání, tj. leiomyosarkom, liposarkom, osteogenní sarkom, chondrosarkom, fibrosarkom, neurogenní sarkom a maligní fibrozní histiocytom. Ve zvýšené frekvenci se v prsu vyskytuje angiosarkom. Celkově však sarkomy nepředstavují ani 1 % ze všech zhoubných nádorů prsu.Samostatnou problematiku má angiosarkom po mastektomii, který vzniká v terénu lymfostázy.
6.5 Karcinom prsu u mužů
Karcinom prsu u mužů je poměrně vzácný (asi 1 % všech karcinomů prsu). Vyskytuje se spíše u starších mužů v šestém až sedmém deceniu. Etiologické faktory nejsou příliš objasněny, nápadná je však souvislost se zvýšenou hladinou estrogenů. Klinicky se nádor projevuje jako nenápadné retromamilární zduření. Přestože je nádor snadno přístupný, často se onemocnění diagnostikuje až v pokročilejším stadiu při rozvoji uzlinových metastáz. Obecně horší prognóza než u žen vyplývá z vyššího stadia onemocnění v době stanovení diagnózy. Histologicky převažuje duktální karcinom, lobulární typ je raritní. V diagnostice se uplatňují stejné postupy jako u karcinomu u žen. Na základě klinického vyšetření, mamografie, sonografie je provedena biopsie, která prokáže karcinom. Terapie je multimodální a řídí se stejnými principy jako terapie karcinomu u žen.
6.6 Použitá a doporučená literatura
- Abrahámová J, Povýšil C, Horák J. Atlas nádorů prsu. 1. vyd. Praha: Grada Publishing; 2000.
- Becker HD, Hohenberger W, Juninger T, Schlag PM. Chirurgická onkologie. Praha: Grada Publishing; 2005.
- Coufal O, Faith V. Chirurgická léčba karcinomu prsu. Praha: Grada Publishing; 2011.
- Daneš J, a kol. Základy mamografie. Praha: X-Egem s. r. o; 2002.
- Dražan L, Měšťák J. Rekonstrukce prsu po mastektomii. Praha: Grada Publishing; 2006.
- Duda M, Hartl P, Hartlová M, Strážnická J. Záchovné operace u karcinomu prsu. Rozhl Chir. 1997;76:605–608.
- Duda M, Žaloudík J, Ryska M, Dušek L. Chirurgická léčba solidních nádorů v České republice. Rozhl Chir. 2010; 89(10):588–593.
- Duda M, Ryska M, Žaloudík J. Specializace v chirurgické onkologii v České republice. Rozhl Chir. 2010; 89(10): 619–624.
- Gatěk J, Hnátek L, Dudešek B, et al. Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi. Rozhl Chir. 2008;87:180–185.
- Kaufmann M, Morrow M, Minckwitz G. Locoregional Treatment of Primary Breast Cancer. Cancer. 2010;116:1184–1191.
- Kaufman M, von Minckwitz G, Bear D, et al. Recommendation for an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: new perspectives. 2006. Ann Oncol. 2007;18:1927–1934.
- Konopásek B, Petruželka L. Karcinom prsu. 1. vyd. Praha: Galén; 1997.
- Krag D, Anderson S, Julian T, et al. Sentinellymphnode resection compared with conventional axillary lymph-node dissection in clinically node-negative patient with breast cancer: overall survival findings from the NSABP B-32 randomized phase 3 trial. Lancet Oncology. 2010; 11: 927–933.
- Lyman G, Giuliano A, Somefield M, et al. American society of clinical oncology guideline recommendation for sentinel node biopsy in early-stage breast cancer. J Clin Oncol. 2005;23:7703–7720.
- Neoral Č, Bohanes T. Biopsie sentinelové uzliny. Praha: Galén; 2012.
- NIH Consensus Conference Treatment of Early-Stage Breast Cancer JAMA. 1991; 265:391–395.
- Norton J, et al. Surgery Basic Science and Clinical Evidence. New York: Springer Verlag; 2001.
- Pavlišta D, a kol. Neinvazivní karcinomy prsu. Praha: Maxdorf; 2008.
- Schwartz G, Giuliano A, Veronesi U, et al. Proceedings of the consensus conference on the role of sentinel lymph node biopsy in carcinoma of the breast. 2001 Apr 19–22; Philadelphia Pennsylvania. Cancer. 2002;94:2542-2551.
- Schwartz G, Hortobagyi G. Proceedings of the Consensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast. 2003 Apr 26–28; Philadelphia Pennsylvania. The Breast. 2004;10:273–294.
- Schwartz G, Veronesi U, Clouhg K, et al. Proceedings of the Consensus Conference on Breast Conservation. 2005 Apr 28–May 1; Milan, Italy. Cancer. 2006;10:242–250.
- Singletary SE. Surgical margins in patients with early-stage breast cancer treated conservation therapy. Am J Surg. 2002;184: 383–393.