7 Klasické operační postupy v hrudní chirurgii
7.1 Klínovitá resekce
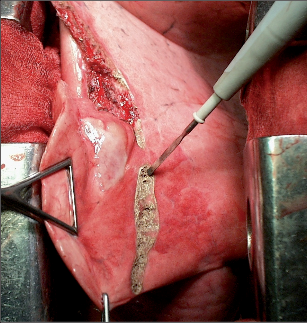
Klínovitá resekce má od dob Tuffiera (1891) přibližně stejnou podobu. Na desuflovanou plíci se naloží klínovitě svorky (Péanovy, cévní apod.). Pod svorkami se prošije plicní tkáň jednotlivými matracovými stehy, úsek plíce mezi svorkami se resekuje a po povolení svorek se resekční linie ještě přešijí pokračujícími stehy. Reziduální krvácení či únik se ošetří dodatečnými stehy nebo koagulací. Tímto způsobem lze odstranit menší periferní ložiska nejlépe při hranách plicních laloků. Ložiska větší velikosti vzdálenější od okrajů plíce a hlouběji v parenchymu nejsou k tomuto typu výkonu vhodná. V dnešní době se nejčastěji provádí za použití diatermokoagulace nebo (endo)staplerů (obr. 1).
7.2 Precizní excize (precision excision)
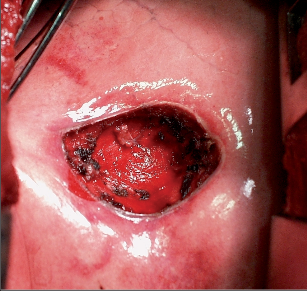
Precizní excize spočívá v pečlivé preparaci podél interlobulárních sept kráterovitě od povrchu plíce či z interlobia směrem k centrální bronchopulmonální stopce lalůčku či excidovaného subsegmentu a v následné excizi vymezené části plicního parenchymu. Reziduální kavita pak má tvar komolého kuželu směřujícího hrotem k bronchopulmonální stopce excidovaného subsegmentu. Ve stěnách kavity by tedy neměly být poraněny větší průdušky ani tepénky, pouze centrální struktury příslušné excidované části plíce jsou centrálně prošity a přerušeny, disekce šetří interlobulární žilky. Pokud se preparace daří v anatomických hranicích subsegmentu, nebývá po takové excizi větší únik vzduchu ani krvácení ze stěn dutiny. Za takové situace není třeba kavitu uzavírat ani lepit, přináší to více komplikací než užitku (obr. 2). Pokud jsou však poraněny větší průdušky nebo cévy, je nutno ošetřit je dodatečnými opichovými ligaturami a dutinu uzavřít spirálovým stehem stoupajícím od spodiny k povrchu plíce nebo hlubšími parenchymatózními stehy.
7.3 Termoablace
Okrajový význam má metoda termoablace (radiofrekvenční ablace) plicních nádorů. Principem je zavedení speciální sondy do plicního nádoru, která účinkuje na principu mikrovlnné trouby: teplo vyvinuté na konci sondy přehřeje nádorovou tkáň v definovatelném perimetru od hrotu sondy. Dojde k tepelné destrukci bílkovin v kulovité zóně určené umístěním hrotu sondy a silou a délkou působení vysokofrekvenčních kmitů. Přes značně optimistické první reference o použití této metody u inoperabilních plicních nádorů je třeba zdůraznit, že se jedná o metodu hrubě paliativní, která nemůže nahradit chirurgickou resekci tam, kde je indikovaná a proveditelná.
7.4 Segmentektomie
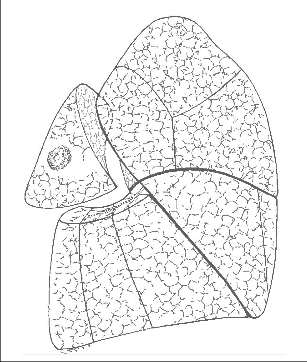
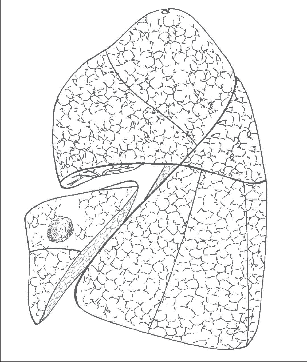
Segmentální resekcí rozumíme odstranění jednoho nebo více bronchopulmonálních segmentů na podkladě anatomické disekce v intersegmentálních hranicích (obr. 3, 4). Z anatomických souvislostí vyplývá, že průduška i tepna segmentu jsou anatomicky jasně definovány a jejich bezpečná identifikace a ligatura či sutura jsou základním výchozím manévrem segmentektomie. Každý segment má většinou jednu nebo více intrasegmentálních žil probíhajících paralelně s bronchem, pro samotný výkon však mají význam pouze podružný. Žilní krev z bronchopulmonálních segmentů je drénována do intersegmentálních žil vždy ze dvou či více sousedících segmentů. Tato vaskulatura musí být při segmentektomii zachována, protože zabezpečuje žilní drenáž z ponechaných segmentů. Neuvážené podvazy intersegmentálních žilních kmenů mohou vést k infarzaci plíce a dalším druhotným komplikacím. Intersegmentální rovina s ponechaným intersegmentálním žilním větvením je nejlepším dokladem správně volené hranice resekce. První segmentektomii provedl v roce 1939 Churchill. Overholt v roce 1951 zpracoval chirurgickou problematiku resekce jednotlivých segmentů obou plicních křídel. Samotný postup byl vypracován pro zánětlivá onemocnění, zejména pro tuberkulózu a bronchiektázie. Obě tyto afekce byly typické bilaterálním výskytem a multisegmentálním postižením, v předantibiotické éře byla chirurgie šetřící plicní parenchym často jediným kurativním řešením. Hlavním cílem segmentálních resekcí bylo odstranit ireverzibilně změněnou tkáň za maximálního šetření zbylého parenchymu, u tuberkulózy navíc nedovolit hyperinflaci zbylé plíce, ve které by se reaktivovala dřímající ložiska. V plicní onkochirurgii doposud platilo pravidlo, že lobektomie je nejmenším výkonem pro plicní karcinom, to kardiorespirační funkce a operační nález dovolují. Segmentální resekce byla akceptovatelná, pokud mohl být nádor odstraněn s bezpečným lemem nepostižené plíce a ventilační rezerva nemocného limitovala větší výkon. U nemocných bez omezení respirační rezervy je segmentektomie nyní považována za dostatečně radikální i u nemalobuněčného karcinomu ve stadiu T1N0. Oproti extraanatomickým a staplerovým resekcím respektuje anatomické a fyziologické hranice bronchopulmonálního segmentu, včetně jeho lymfatické drenáže. Dovoluje také odstranit cíleně uzliny daného segmentu (lymfadenektomie uzlin sekundárního hilu, interlobia, plicního hilu a mediastina je samozřejmou součástí každé operace pro karcinom). V průběhu segmentektomie mohou být samozřejmě vhodně aplikovány staplery např. na nevytvořené fissury, na širší parenchymové můstky. Nicméně základní manévr, podvaz průdušky a arterie a oddělení vlastního segmentu tupou preparací při současné trakci za periferní části těchto proťatých struktur, je hlavním principem takové operace. Typickou segmentektomií je odstranění apikálního segmentu dolního laloku, obvyklou bisegmentektomií je lingulektomie, operace analogická střední lobektomii vpravo, segmentektomie z dolních laloků nejsou obvyklé, většinou se odstraňují všechny bazální segmenty en bloc.
7.5 Lobektomie
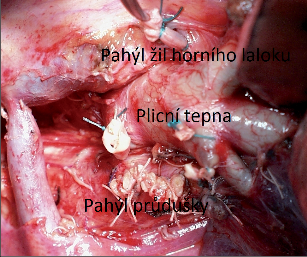
Lobektomie je nejčastějším typem operace pro plicní karcinom. Z onkologického hlediska je dostačující pro malé a periferní karcinomy bez lymfatické či hematogenní diseminace. U nemocných s limitem respirační rezervy či porušenými kardiálními funkcemi představuje přijatelný kompromis i pro tumory větší nebo uložené centrálněji – často i v podobě bronchonebo angioplastické resekce. Kromě lymfadenektomie uzlin plicního hilu a mediastina má zásadní význam také pečlivá lymfadenektomie intrapulmonálních a interlobárních uzlin. Kromě onkologických indikací je lobektomie přijatelným řešením pokročilých benigních plicních onemocnění, například bronchiektázií, emfyzému, intralobárních sekvestrací, pokud není možné stav vyřešit resekcí menšího rozsahu. Obvyklým přístupem do hrudníku je laterální torakotomie 4.–5. mezižebřím. Podélná mediastinotomie z přední strany obnaží plicní hilus, kde lze často pouhým tahem za plíci dorzálně šetrnou preparací identifikovat jednotlivé struktury plicní. Dalším krokem je rozpolcení mezilalokových rýh. Hlavní interlobium je možné většinou rozdělit lehce a anatomicky přesně, vedlejší interlobium se preparuje stejně snadno, je-li anatomicky utvářeno. Často je však jeho hranice naprosto nezřetelná, pročež je nutno postupovat trpělivě tupou preparací. Pokud jsou však interlobia zašlá a nepřehledná a jejich preparace není bezpečná, východiskem z nouze může být preparace a protětí cévních struktur i průdušky horního laloku s následným oddělením resekované plíce trakcí na způsob segmentektomie dle Overholta. Samozřejmě lze k protětí interlobárních struktur použít stapleru, což je způsob sice elegantní, ale finančně náročný. Následuje podvaz jednotlivých segmentálních tepen daného laloku, v případě dolních lobektomií arteriálního kmene pro dolní lalok. Dalším krokem je identifikace a podvaz žil příslušného laloku. V případě horní lobektomie vpravo je nutné bezpodmínečně šetřit žíly středního laloku. Nevědomá (nepoznaná) ligatura žil středního laloku vede k infarzaci středního laloku s vážnými až fatálními důsledky. Průduška je poslední strukturou fixující lalok. Protětím lobárního bronchu a jeho uzávěrem stehy či staplerem je dokončena resekce (obr. 5).
Lokální poměry vpravo někdy vyžadují odstranění dvou laloků, horního a středního, pak hovoříme o horní bilobektomii vpravo, nebo středního a dolního, potom se jedná o bilobektomii dolní.
7.6 Pneumonektomie
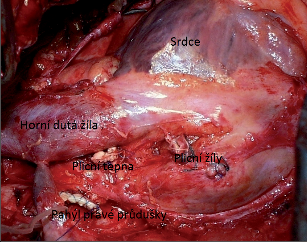
Nekomplikovaná pneumonektomie zejména vlevo patří mezi jednodušší výkony. Jde o amputaci orgánu, jehož jednoduchá stopka je přesně definována. Ošetření jednotlivých struktur je v nekomplikované situaci běžnou rutinou. Naopak při infiltraci plicního hilu nádorem, který prorůstá i do mimoplicních struktur nebo infiltruje extrapulmonální úseky struktur plicní stopky, může být pneumonektomie neobyčejně svízelná až nemožná. V současné době je pneumonektomie rezervována pro pokročilé plicní karcinomy, které nejsou dostatečně řešitelné radikálně menšími resekčními výkony (obr. 6).
Pro zánětlivá onemocnění, jako jsou např. bronchiektázie či tuberkulóza, a pro jiné nezhoubné plicní léze je pneumonektomie řešením naprosto výjimečným a neobvyklým, a to již déle než půl století, od objevu účinných antibiotik a chemoterapeutik. Výjimkou jsou zcela zanedbané stavy, kdy je plíce kompletně zničena například bronchiektáziemi či atelektázou za nezhoubným tumorem a kdy nelze předpokládat ani částečnou restituci plicního parenchymu. V těchto, budiž znovu zdůrazněno, zcela výjimečných případech pneumonektomie znamená ve své podstatě pouze odstranění škodlivého arteriovenózního zkratu v plíci. Po takových operacích lze někdy paradoxně zaznamenat zlepšení spirometrických parametrů dané přesunem mediastina na operovanou stranu a kompenzatorním rozvinutím kontralaterální plíce. Klasickým přístupem k pneumonektomii je posterolaterální torakotomie 4. nebo 5. mezižebřím. Následuje explorace pleurální dutiny a plíce. Je nutné přesvědčit se o účelnosti a proveditelnosti operace při zachování předpokladu příznivého pooperačního průběhu a onkologické radikality. Poznání maligní pleurální diseminace většinou nečiní potíže a může být ostatně stanoveno už před torakotomií – torakoskopicky. Pokud pleurální rozsev předpokládáme, torakoskopií začínáme. K ověření resekability torakoskopický přístup nestačí, zejména v případech, kdy nádor prorůstá do extrapleurálních struktur. Definitivní závěr může být učiněn až po pečlivém posouzení lokálního nálezu na plicnici, hlavním bronchu, plicních žilách a na strukturách mediastina, které lze operovat pouze za cenu vyššího rizika, než může být přínos rozsáhlého zákroku. Možnost peroperační biopsie uzlin i resekčních linií je zásadním požadavkem. V případě pneumonektomie pro karcinom lze akceptovat tento časový sled podvazu, resp. přerušení jednotlivých struktur plicní stopky: 1. plicní tepna, 2. plicní žíly,3. bronchus. Principiálně by měly být z hlediska možné diseminace maligních buněk při manipulaci s nádorem podvázány nejprve plicní žíly. Toto riziko však nebylo jednoznačně potvrzeno a navíc takový postup v některých situacích není ani možný, obvykle je ligována tepna jako první struktura plicního hilu. Uzliny dolního kompartmentu lze odstranit před podvazem dolní plicní žíly, uzliny bifurkační při preparaci bronchu, uzliny horního mediastinálního kompartmentu nakonec po definitivním ošetření průdušky. Operační výkon končí kontrolou těsnosti bronchiální sutury, pečlivou hemostázou, toaletou dutiny pohrudniční a založením jednoho silného hrudního drénu, který je sveden pod hladinu tekutiny. Jeho mylné napojení na aktivní sání může vést k fatálním komplikacím.
7.6.1 Pneumonektomie s intraperikardiálními podvazy plicních cév
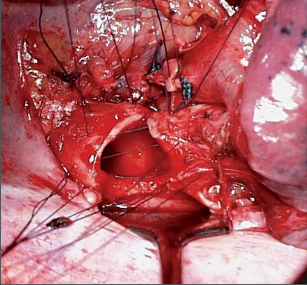
Nepříznivý operační nález si někdy vynutí intraperikardiální preparaci plicních cév. Většinou je tomu tak u centrálních plicních karcinomů, které infiltrují hilové struktury plíce až k srdci, z nich častěji plicnici a horní plicní žílu. Dolní plicní žíla bývá takovou infiltrací postižena vzácněji. Otevření perikardu se není třeba u operací pro zhoubný nádor obávat. Intraperikardiální preparace (obr. 7) struktur plicního hilu může až nečekaně usnadnit identifikaci a podvaz plicní tepny a plicních žil, při nutnosti resekce levé síně či infiltrovaného ouška je intraperikardiální přístup samozřejmou podmínkou. V nepřehledné situaci může otevření perikardu navíc ušetřit čas a umožňuje vyhnout se rizikové preparaci a poranění zejména plicní tepny a jejích prvních segmentálních větví v situaci, kdy je kmen plicnice infiltrován tumorem či přitažen k perikardu. Perikard po discizi neuzavíráme zcela vodotěsně z důvodu prevence možné tamponády. Ponechaný otvor v perikardu však nesmí být tak veliký, aby dovolil luxaci srdce.
7.7 Bronchoplastické plicní resekce
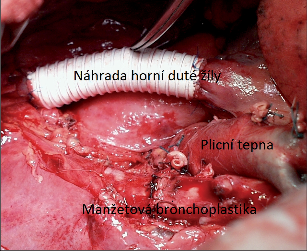
Zahrnují excizi části stěny bronchiálního systému s následnou rekonstrukcí. Pokud je spolu s resekcí stěny průdušky nutná i resekce pulmonální tepny, hovoříme o bronchovaskuloplastice (angiobronchoplastice). Operace na bronchiálním systému byly původně vypracovány pro řešení pozánětlivých a postspecifických striktur dýchacích cest. Prosté bronchotomie sloužily a dodnes slouží k řešení benigních nádorů dýchacích cest. První bronchoplastickou manžetovou (sleeve) resekci pro karcinom provedl v roce 1952Allison. Postupem času díky antibiotické a tuberkulostatické léčbě a pokrokům intervenční bronchologie takřka vymizely chirurgické intervence na průduškách pro inflamatorní striktury. Iatrogenní traumata průduškového stromu jsou po zavedení flexibilních bronchoskopů rovněž raritní. Řadu benigních novotvarů dýchacích cest lze také řešit endoskopicky. Proto jsou indikace bronchoplastických operací pro benigní afekce dnes vzácné. Naopak s rozšířením indikačního spektra u bronchogenního karcinomu počet bronchoplastických výkonů podstatně narostl. U tzv. parenchym šetřících operací jsou dnes bronchoplastiky prováděny zejména u nemocných, kterým není z důvodů limitované kardiorespirační rezervy možné provést onkologicky indikovaný výkon (pneumonektomii) a lokální nález, resp. infiltrace bronchu nedovoluje nález řešit prostou lobektomií (bilobektomií).
Rozeznáváme dva základní typy bronchoplastik:
- klínová (wedge) excize bronchiální stěny s direktnísuturou,
- manžetová (sleeve) resekce segmentu průduškys anastomózou mezi centrálním a periferním pa-hýlem.Nohl Olser označuje jako bronchoplastiku také
- vytvoření laloku bronchiální stěny ke krytí defektupo excizi,
- implantaci bronchu do trachey.Kombinace bronchoplastiky a resekce plicnice se pak nazývá
- bronchovaskuloplastika (angiobronchoplastika).
7.7.1 Klínovitá (WEDGE) plastika
U nádorů infiltrujících odstup horního (středního) bronchu lze provést klínovitou excizi ústí infiltrované části průdušky a takto vzniklý klínovitý defekt uzavřít příčnou suturou (obr. 8).
Je třeba mít na paměti, že při každé klínovité bronchoplastice dochází v místě sutury k určité angulaci, která je tím větší, čím širší je báze klínu. Do určité míry to není na škodu, protože plíce zbylá po horní lobektomii či bilobektomii se přesune kraniálně, což samo o sobě způsobí určitou změnu osy průdušky. Potíže mohou nastat tehdy, když je úhel wedge bronchoplastiky příliš tupý a navíc se dovnitř do lumina klene kýl sutury, ať už je dán sliznicí nebo chrupavkou. Následná mukostáza může vést k atelektáze, která může skončit dehiscencí sutury. Pokud by byla průduška po wedge plastice příliš angulovaná, je lepší provést reexcizi průdušky ve smyslu manžetové resekce.
7.7.2 Manžetová (SLEEVE) plastika
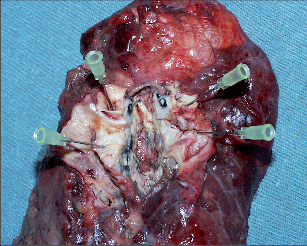
Jsou to operace, při kterých se exciduje tubulární segment průdušky (pravidelně s odstupem lobárního bronchu) a centrální a periferní pahýl průdušky se anastomozují (obr. 9).
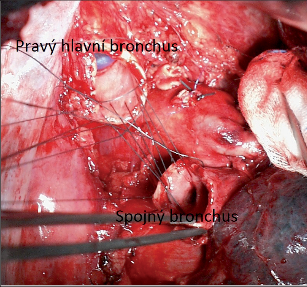
Vpravo je obvyklá resekce manžety s odstupem horního lobárního bronchu, resekce manžety s odstupem středního lobárního bronchu nebo resekce úseku průdušky zahrnujícího ústí obou těchto průdušek. U nádoru dolního laloku, který dosahuje k ústí středního bronchu, lze střední lalok ušetřit tak, že je resekční linie vedena až na spojném bronchu, střední bronchus protnut ve zdravé tkáni (pokud možno před větvením) a všit do spojného bronchu. Dalším typem bronchoplastiky vpravo je dolní bilobektomie rozšířená na pravostrannou hlavní průdušku s následnou implantací horního bronchu do trachey.
Vlevo je situace poněkud složitější. Hlavní bronchus je sice delší, ale oblouk aorty ztěžuje anastomózu, pokud je třeba ji naložit více centrálně. Pokud by byla sutura anastomózy zpod oblouku nepřehledná nebo nemožná, je třeba mobilizovat a odsunout oblouk aorty. Obvyklým typem ,,sleeve“ bronchoplastiky vlevo je horní lobektomie rozšířená o resekci části levého hlavního bronchu. Také tzv. obrácená bronchoplastická resekce hlavního bronchu vlevo je možná: dolní lobektomie je rozšířena o resekci části hlavní průdušky a levý horní bronchus je všit do zbytku hlavní průdušky.
7.7.3 Plastika defektu po excizi lalokem ze stěny bronchu
Karcinomy pravého horního a pravého hlavního bronchu mají vzácně tendenci přerůstat karinu doleva. Pak je nutná karinální resekce. Častěji infiltrují proximálním směrem laterální stěnu trachey a ponechávají mediální stěnu hlavního a intermediálního bronchu zdravou. Tehdy je možné vytvořit z mediální stěny pravého a hlavního bronchu lalok, obrátit jej proximálně a překrýt jím defekt vzniklý excizí postižené zevní stěny průdušnice.
7.8 Angioplastické operace na plicní tepně
První tangenciální resekci plicní tepny ošetřil přímou suturou Allison v roce 1952. Vzhledem k anatomickým souvislostem se angioplastiky plicní tepny provádějí nejčastěji při odstupech horních segmentálních arterií vlevo (70 %), vpravo (20 %), zbylých 10 % připadá na levou i pravou plicní tepnu a její distální úseky.
Rozeznáváme tyto typy angioplastik :
- excize stěny a přímá sutura,
- excize stěny a plastika defektu záplatou,
- manžetová resekce tepny a přímá sutura,
- manžetová resekce tepny a rekonstrukce cévní náhradou,
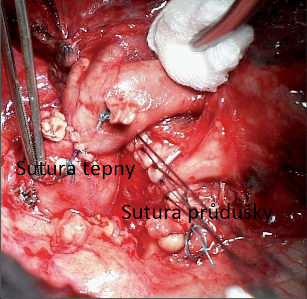
- kombinace s bronchoplastikou: angiobronchoplas-tika (obr. 10).
Indikace angioplastiky jsou analogické indikacím bronchoplastik, tedy kompletní resekce tumoru tak, aby byla vyloučena pneumonektomie, a to nejen u nemocných s limitem respirační rezervy. Peroperační ověření negativity resekčních linií je nutností, stejně jako ověření negativity uzlin interlobia a ponechané plíce. Pooperační mortalita bronchoplastických a angioplastických operací se pohybuje mezi 2–12%. Je to dáno tím, že jde o náročnější operaci prováděnou obecně u rizikovějších pacientů. Mezi časné komplikace bronchoplastik řadíme pneumonie, atelektázy, empyém. Pozdní komplikace jsou striktury, bronchopleurální a bronchovaskulární píštěle. Jejich incidence by neměla přesahovat 5 %. Stejně často se vyskytují trombotické komplikace angioplastických výkonů. Fatální důsledky může mít bronchovaskulární píštěl. Kombinovaná bronchovaskuloplastika k ní má řadu predisponujících faktorů, takže interpozice vitální tkáně mezi obě sutury je nanejvýš vhodná. Použít lze interkostomuskulární lalok, cíp perikardu, omentum apod.
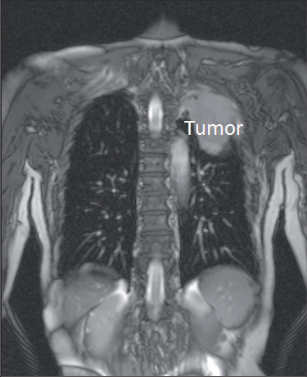
7.9 Operace Pancoastova tumoru
Nádor apexu plíce s typickou klinickou symptomatologií popsal v roce 1932 Pancoast. Jeho charakteristickými znaky jsou bolest vystřelující do paže, Hornerův syndrom, destrukce žeber a atrofie svalů ruky. Jde o karcinom, který v prostoru kupuly pleurální infiltruje proximální žebra, dolní kořeny brachiálního plexu, krční sympatikus a případně subklavikulární cévní svazek. Až do 50. let minulého století byl tento nádor považován za inoperabilní, od této doby se však datují první zmínky o operacích Pancoastova tumoru a o jejich dlouhodobých výsledcích. Nicméně Pancoastův tumor se všemi rozvinutými příznaky je operabilní naprosto výjimečně. V běžné klinické praxi se tímto termínem rozumí každý tumor apexu plíce s neurologickou symptomatologií (obr. 11). Pokud jsou vyloučeny vzdálené metastázy a mediastinální lymfadenopatie, není infiltrace žeber ani míšních kořenů jednoznačnou kontraindikací operace. Indukční radiochemoterapie patří u Pancoastova tumoru ke standardnímu postupu.
Při radikálním postupu se obvykle odstraňují tyto struktury:
- První žebro, event. zadní porce 2. a 3. žebra a části příslušných obratlů.
- Míšní kořeny Th1 případně C8, sympatická ganglia, vč. ganglion stellatum.
- Horní plicní lalok (případně apikální segment, extraanatomická resekce z hrotu).
- Podklíčkové cévy, jsou-li infiltrovány.
- Mediastinální a krční (skalenické, supraa infrakla-vikulární) uzliny.
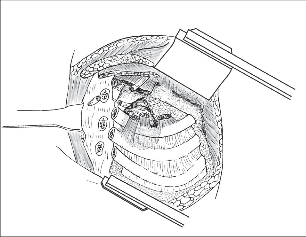
Podle postižení jednotlivých struktur je třeba volit přístup: Zadní přístup dle Shawa a Paulsona k apikálním tumorům je považován za klasický, dovoluje bezpečné ošetření všech postižených struktur horní hrudní apertury, snad jen s výjimkou podklíčkové žíly (obr. 12).V roce 1993 popsal Dartevelle kombinovaný cervikotorakální přístup a později samostatný cervikální transklavikulární přístup k nádorům apexu plíce. Rekonstrukce defektu hrudní stěny v rozsahu 3 žeber situovaného dorzálně, který je dostatečně kryt lopatkou a jejím svalstvem, není nezbytná. Při resekci 4 žeber je o rekonstrukci třeba uvažovat, ještě větší resekce hrozí zapadáváním lopatky do hrudníku, proto je nutné takový defekt krýt. Předním přístupem se odstraňuje jedno, dvě nebo výjimečně tři žebra. Defekt hrudní stěny není veliký, ale protože navíc chybí klavikula, je vhodné jej opět překrýt protézou. Operace apikálních lézí mají specifické komplikace odlišné od jiných plicních resekcí. Likvoreu v důsledku poranění míšních obalů je nezbytné řešit okamžitou revizí. Se vzrůstající radikalitou výkonu přibývá neurologických symptomů. Resekce kořenu Th1 je snášena dobře většinou bez motorického deficitu. Resekce Th1 a C8 (truncus inferior plexus brachialis) vede k atrofické paralýze svalů předloktí a drobných svalů ruky, je však adekvátní cenou za odstranění bolestí z prorůstání tumoru. Hornerův syndrom je spíše kosmetickou záležitostí. Chylotorax někdy provází preparaci v oblasti levostranného venózního úhlu.
7.10 Problematika rozšířených plicních resekcí
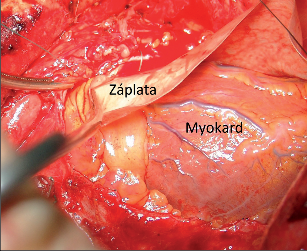
Plicní nádory mohou během svého růstu infiltrovat sousední struktury a orgány. Takové nádory jsou potom považovány za lokálně pokročilé až lokálně inoperabilní (T3, T4 dle TNM klasifikace), a to podle toho, zda je mimoplicní struktura postižená nádorem odstranitelná relativně snadno nebo naopak obtížně resekovatelná, případně neodstranitelná. Jedná se o poměrně nesourodou skupinu tumorů od jednoduše řešitelných periferně rostoucích karcinomů infiltrujících hrudní stěnu či bránici až po centrální léze postihující srdce, velké cévy, obratle či jícen, kde je úspěch operace vázán na možnost uspokojivé rekonstrukce jedné či více okolních struktur. Základním předpokladem úspěchu takové operace je možnost kompletního odstranění nádoru, včetně okolních postižených struktur ve zdravé tkáni, tedy R0 resekce. Nicméně osud i kompletně resekovaných nemocných není radostný, zhoršuje se s postižením jednotlivých etáží lymfatických uzlin. U nemocných ve stadiu T3N0 je sice pětileté přežití přibližně 50 %, ale už při T3N1 klesá na 20 % a u nemocných s parametry T3N2, T4 a u nekompletně resekovaných nedosahuje ani 10 %. V rámci předoperační rozvahy musí proto být s maximální možnou jistotou vyloučeny metastázy. Maligní mediastinální lymfadenopatie je obecně kontraindikací operace, nicméně moderní protokoly indukční terapie ve velkém procentu dosahují parciální nebo úplnou remisi v primárním nádoru a (nebo) v uzlinách. V takové situaci je indikován restaging a zvažována operace. Z chirurgického pohledu lze indikace rozšířených resekcí rozdělit podle klasifikace TNM. Parametru T3 odpovídá infiltrace struktur, které nemají vitální význam a jejichž funkcenemusí být bezpodmínečně nahrazena. Sem řadíme infiltraci hrudní stěny, bránice, infiltraci vyjmenovaných mediastinálních struktur (mediastinální pleura, perikard, n. phrenicus, v. azygos, vlastní plicní tepna). Dále sem patří infiltrace hlavního bronchu méně než 2cm od kariny a infiltrace struktur kupuly pleurální při Pancoastově tumoru (plexus brachialis, proximální žebra, subklavikulární cévní svazek, krční sympatikus).Nádory T4 dělí Grunewald (2000) na potenciálně resekabilní (infiltrace horní duté žíly, kariny, dolní části průdušnice, levé předsíně) – T41 a na definitivně neresekabilní (infiltrace jícnu, obratlů, maligní pleurální či perikardiální výpotek) – T42.
7.10.1 Operace nádorů s parametrem T3
Pokud je zasažena pouze parietální pleura, je možné extrapleurální oddělení plíce od hrudní stěny, posouzení resekční linie a v případě pozitivity dokončení resekce hrudní stěny. Odhadnout, zda je postižena pouze parietální pleura, je obtížné, stejně jako vyšetřit resekční linii v celé ploše. Morbidita vázaná na resekci hrudní stěny je nevýrazná ve srovnání s rizikem lokální recidivy, proto v případech, kdy nejde o evidentní pozánětlivou adhezi plíce k hrudní stěně, je bloková resekce plíce a segmentu hrudní stěny metodou volby. Inkompletní resekce dává neuspokojivé výsledky, ani její zajištění radioterapií nebo radiochemoterapií tento stav významně nezlepší. Výskyt nádorů infiltrujících bránici je vzácný. V případě T3N0 je dlouhodobé přežití stejné jako v případě postižení hrudní stěny. Často však zůstává takový nádor dlouho nepoznán, pro rentgenology skryt za stínem bránice, a bývá diagnostikován až ve stadiu generalizace. Pouhá lymfatická diseminace do uzlin plíce zhoršuje prognózu významně, nemocní s nádory infiltrujícími bránici a mediastinální lymfadenopatií přežívají 5 let od operace zcela výjimečně. Nádory prorůstající do mediastina postihují nejčastěji mediastinální pleuru, mediastinální tuk a hlavní plicní cévy. Průměrné pětileté přežití resekovaných se blíží 30 % nezávisle na tom, zda jde o nemocné s N0 či N1 lymfadenopatií. Základním negativním prognostickým parametrem je nekompletnost resekce. Nádory infiltrující hlavní bronchus je možné také resekovat kompletně. Pak mají šanci na přežití opět blízkou 40 %, jde-li o N0, a 30%, jde-li o N1. Apikální léze Pancoastova typu lze odstranit kompletně s předpokladem pětiletého přežití okolo 40 % v případě N0. Průměrné přežití v neselektovaných souborech je kolem 30%. N2 lymfadenopatie, postižení brachiálního plexu nad kořen C8 a předoperačně prokázaná intraspinální propagace kontraindikují operaci. T3N2 nádory mají obecně velmi špatnou prognózu. V případě mnohočetného postižení uzlin mediastina je pětileté přežití pod 10%. Mediastinální lymfadenopatie rozpoznaná až při operaci a postižení pouze jedné mediastinální uzliny (single-nodal involvement) dávají asi 20% šanci na pětileté přežití.
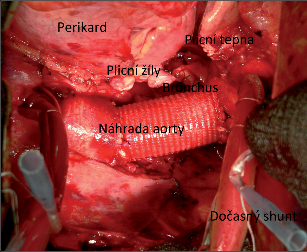
7.10.2 Operace nádorů T4
Podle Grunewalda (2000) jsou T4 nádory potenciálně resekabilní (infiltrace horní duté žíly, kariny, dolní části průdušnice, levé předsíně) – T41, na rozdíl od definitivně neresekabilních (infiltrace jícnu, obratlů, maligní pleurální či perikardiální výpotek) – T42. Poměrně značné riziko operační (až 20%) je vysokou cenou za šanci na delší přežití. V případě karinálních resekcí lze dosáhnout pětiletého přežití přes 20%. Ostatní struktury lze řešit chirurgicky s šancí jen nepatrně menší za předpokladu, že mediastinální uzliny nejsou postiženy a nejsou prokázány vzdálené metastázy (obr. 16). Z výše uvedených skutečností plyne, že III. stadium plicní rakoviny, stadium lokálně pokročilé nemoci, je nutno léčit kombinovanými protokoly, ve kterých má chirurgie nezastupitelnou roli: v selektovaných případech umožňuje okamžitou lokální kontrolu tumoru, která je cestou radioterapie dosažitelná obtížněji a chemoterapií neuskutečnitelná. Tak jako je těžko představitelný úspěch systémové terapie bez lokální kontroly tumoru, tak výskyt recidivy až v 80% případů po samotné operaci zcela jasně ukazuje, že bez systémové léčby má chirurgie smysl jen u ojedinělých nemocných v tomto stadiu (obr. 13, 14, 15).
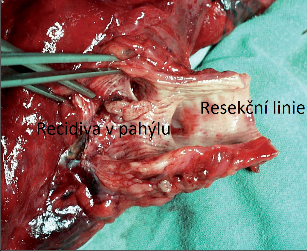
7.11 Reoperace plicních nádorů
Chirurgická reintervence je indikovaná u nemocných s lokální recidivou nádoru, a to pouze za předpokladu, že stav pacienta a jeho ventilační rezerva takový výkon dovolují a byla vyloučena generalizace. Nádor může lokálně recidivovat v pahýlu bronchu, v uzlinách, na pleuře nebo v hrudní stěně, na bránici, na perikardu a také jako solitární metastáza ve zbylém laloku. Jen pečlivá reevaluace ventilačních funkcí pomůže rozhodnout, zda je retorakotomie a reresekce únosná (obr. 16). Vzhledem k tomu, že v operovaném hrudníku lze očekávat sekundární změny po předchozí operaci, nelze obvykle počítat s výkonem menším, než je dokončující pneumonektomie. U nemocných s hraničním rizikem je vhodnou a bezpečnou alternativou radioterapie. Také radiofrekvenční ablace má údajně dobré výsledky, další možností u centrálnějších lézí je endobrachyterapie, u lokalizované recidivy lze zvážit cyber-knife.
7.12 Transplantace plic
Transplantace plic je metodou volby léčby konečných stadií nemocí plicního parenchymu. První transplantace v experimentu na psu byla provedena v roce 1947 (Děmichov). Člověku byla transplantována plíce poprvé v roce 1963, stejně jako řada dalších operací byla bez naděje na déletrvající úspěch (Hardy). Teprve zavedení účinné imunosuprese a zdokonalení managementu chronické rejekce, resp. obliterující bronchiolitidy dalo transplantovaným nemocným šanci na dlouhodobé přežití. První úspěšná allotransplantace plíce byla provedena nemocnému s plicní fibrózou v roce 1983 v Torontu.
7.12.1 Indikace
K transplantaci plic jsou indikováni nemocní s předpokládaným limitem přežití 12–24 měsíců daným základním onemocněním. Další indikační kritéria jsou:
- klinicky a fyziologicky závažné onemocnění,
- neefektivní nebo nedostupná konzervativní (medikamentózní) terapie,
- závažná limitace běžné denní aktivity,
- adekvátní srdeční funkce bez koronární sklerózy,
- rehabilitovatelní nemocní bez nutnosti trvalé hospitalizační péče,
- akceptovatelný stav nutrice,
- odpovídající psychosociální a emocionální profil.
Transplantace plic může být provedena jako jednostranná, bilaterální současná z jednoho přístupu (torakosternotomie) či bilaterální sekvenční ze dvou přístupů (dvě torakotomie). Vzhledem k častému nepoměru velikosti pohrudniční dutiny příjemce a objemu plíce dárce a nedostatku štěpů nemusí být transplantována celá plíce, ale jen jednotlivé laloky na jednu nebo obě strany (split metodika). Metoda transplantace jednotlivých laloků se používá také u příbuzenských transplantací. Při současném kardiálním onemocnění mohou být transplantovány plíce en-bloc se srdcem (transplantace srdce-plíce).Nejčastější indikaci k transplantaci představuje chronická obstrukční plicní nemoc, zejména ve fázi pokročilé emfyzematózní přestavby plíce, a deficit alfa-1 antitrypsinu. Onemocněním, vedoucím bez transplantace plic k bronchiektatické destrukci plic a fatálnímu selhání plicních funkcí ve 2. nebo 3. deceniu, je cystická fibróza. Dalšími typickými nemocemi vedoucími k transplantaci plic jsou plicní fibrózy, sarkoidóza, plicní hypertenze, obliterující bronchiolitidy.Dárcovská problematika je široká, nedostatek vhodných orgánů vede k odběrům od marginálních dárců nebo s nebijícím srdcem a k lalokovým transplantacím. Ideální donor by měl mít tyto parametry:
- věk pod 55 let, bez preexistující plicní nemoci,
- normální rentgenogram hrudníku a bronchoskopický nález,
- adekvátní parametry výměny plynů,
- negativní virologický screening (HBV, HCV, HIV)
- shoda v AB0 systému,
- odpovídající objem plíce dárce a hrudníku příjemce.
7.12.2 Technika provedení
7.12.2.1 Explantace plíce dárce
Nejčastěji probíhá jako součást multiorgánového odběru, po podání kardioplegie a promytí orgánů perfuzním roztokem se explantuje buď celý blok srdce, obě plíce, velké cévy mediastina, trachea, nebo jednotlivě srdce a každá plíce. Pokud je v plánu transplantovat jednotlivé orgány různým příjemcům, největší spory bývají vedeny o délku plicního žilního ústí (na úrovní předsíně). Plicní štěp toleruje 2 hodiny teplé ischemie (preparace, perfuze, chlazení) a 4 hodiny studené ischemie (explantace, transport). Zásadním požadavkem je oba časy minimalizovat.
Transport
V ideální situaci je explantace plíce a samotnátransplantace synchronizována na jednom pracovi-šti. V českých podmínkách je to situace výjimečná,rychlý transport z místa odběru na místo transplanta-ce v intervalu studené ischemie se pak děje nejčastějivrtulníkem.
7.12.2.2 Implantace plíce
Preferovaným přístupem je torakotomie, pro sekvenční bilaterální transplantaci oboustranné anterolaterální torakotomie. Před pneumonektomií příjemce je nutné, aby plíce dárce byla připravena k implantaci, během operace jsou ponechány co nejdelší hilové struktury a peribronchiální tkáň ke krytí anastomózy. Hilové struktury jsou pak anastomózovány end-to-end, většinou pokračujícími stehy v pořadí bronchus, tepna, žíly společným ústím na levou síň. Před došitím žilní anastomózy je nutné štěp odvzdušnit tepennou krví. Při unilaterální transplantaci se lze většinou obejít bez mimotělního oběhu, v případě bilaterálních transplantací a samozřejmě společné transplantace srdce a plic je extrakorporální cirkulace nezbytnou podmínkou.
7.12.2.3 Transplantace od žijících dárců
Principem je transplantace dvou dolních laloků od dvou žijících dárců, pravého doprava a levého doleva, s nulovou mortalitou a 20% morbiditou pro dárce.
7.12.2.4 Split transplantace
Znamená rozdělení plíce dárce na jednotlivé laloky a jejich implantaci buď pro nekorespondenci velikosti pohrudniční dutiny příjemce a celé plíce dárce nebo pro nedostatek štěpů k transplantaci.
7.12.3 Imunosuprese
Revolučním krokem bylo zavedení cyklosporinu A v 80. letech minulého století, které dovolilo úspěšný rozvoj transplantací parenchymatózních orgánů. V současné době se po transplantaci plic většinou používá trojkombinace imunosupresivních léků:
- kortikoidy,
- inhibitory calcineurinu a T-lymfocytární proliferace (cyklosporin, tacrolimus, sirolimus, everolimus),
- inhibitory syntézy purinů (azathioprin, mofetil).
Současně s imunosupresí je indikována profylaxeoportunních infekcí: pro virové infekce v pooperač-ním období, pneumocystóza vyžaduje prevenci do-životní.
7.12.4 Rejekce
Primární dysfunkce štěpu může nastat až u čtvrtiny transplantovaných, je většinou důsledkem ischemie a reperfuze štěpu, má vysokou (asi 30%) mortalitu. Léčba spočívá v agresivní ventilační podpoře za použití PEEP a oxidu dusnatého a podávání prostacyklinu. V případě neúspěchu konzervativní terapie je indikována ECMO (extrakorporální membránová oxygenace).Akutní rejekce je u plic daleko častější než u jiných orgánových transplantací. Probíhá většinou v prvních 3 měsících po operaci, symptomy jsou dyspnoe, hypoxemie, subfebrilie, leukocytóza. Transbronchiální plicní biopsie může pomoci rozlišit rejekci a infekční komplikace. Z léčebných postupů lze vybrat dle závažnosti změnu imunosuprese, inhalaci imunosupresiv, antilymfocytární séra, extrakorporální elektroforézu a celotělové ozáření. Rizikem akutní rejekce je přechod do chronického průběhu.Chronická rejekce je základním faktorem limitujícím přežívání štěpu, v různé závažnosti je diagnostikována asi u poloviny transplantovaných přežívajících 5 let. V mikroskopickém obraze lze pozorovat fibrózu a jizvení malých dýchacích cest – obliterující bronchiolitidu.
7.12.5 Přežití
Perioperační mortalita v zavedených centrech nepřesahuje 10%, pětileté přežití je popisováno mezi 50 a 65%.
7.13 Literatura
- Becker HD, Hohenberger W, Junginger T, Schlag PM, editors. Chirurgická onkologie. Praha: Grada Publishing; 2005.
- Cahan WG, Watson WL, Pool JL. Radical pneumonectomy. J Thorac Surg. 1951;22:476–483.
- Ginsberg RA. Atlas of clinical oncology. Lung cancer. Hamilton: BC Decker Inc; 2002.
- Grunenwald DH. Surgery for advanced stage lun cancer. Semin Surg Oncol. 2000;18:137–142.
- Klein J. Chirurgie karcinomu plic. Praha: GradaPublishing; 2006.
- Mathisen DJ, Grillo HC. Carinal resection forbronchogenic carcinoma. J Thorac Cardo VascSurg. 1991;102:16–23.
- Nakahara H, Ohno K, Matsumura A. Extendedoperation for lung cancer invading the aortic archand superior vena cava. J Thorac Cardiovasc Surg.1989;97:428–433.
- Pafko P. Základy speciální chirurgie. Praha: Ga-lén; 2008.
- Pearson GF, Cooper JD, Deslauriers J, Gins-berg RJ, Hiebert CA, Patterson GA, Urschel HC.Thoracic surgery. New York: Churchil Livingstone; 2002.
- Pitz CC, Brutel de la Riviere A, van Swieten HA, Westermann CJJ, Lammers JWJ, Bosch JMM. Results of surgical treatment of T4 non-small cell lung cancer. Europ J Cardio Thorac Surg. 2003;24:1013–1018.
- Pichlmaier H, Schildberg FW. Thoraxchirurgie.Heidelberg: Springer; 2006.
- Price-Thomas C. C onser vative resection ofthe bronchial three. J R Coll Sulg Edinb. 1956;1:169–173.
- Procházka J. Resekce plic. Praha. SZN; 1954.
- Rendina EA, Venuta F, De Giacomo T, Cicco-ne AM, Ruvolo G, Coloni GF, Ricci C. Inductionchemotherapy for T4 centrally located non-smalllung cancer. J Thorac Cardiovasc Surg. 1999;117:225–229.
- Řehák F, Šmat V Chirurgie plic a mediastina. Praha: Avicenum; 1986.
- Tsuchiya R, Asamura H, Kondo H. Extended re-section of the left atrium, reat vessels, or both forlung cancer. Ann Thorac Surg. 1994;57:960–965.