11 Neuromuskulární poruchy jícnu
11.1 Definice a historie ezofagokardiální achalázie
Ezofagokardiální achalázie (EKA) (achalázie jícnu, achalázie kardie) je funkční onemocnění celého jícnu, charakterizované úbytkem až nepřítomností jícnové peristaltiky, postupnou dilatací jícnu a současně neschopností normální relaxace dolního jícnového svěrače během polykacího aktu. Jde o nejčastější a nejznámější, byť ne jedinou, neuromuskulární poruchu jícnu. O dalších typech těchto poruch je pojednáno v podkapitole 11.7 Diferenciální diagnostika.
Prvního nemocného s dilatací jícnu bez anatomické překážky popsal v roce 1874 Willis a podrobněji onemocnění charakterizovali Purton (1821), Mayo (1828) a Hannay (1833). Rozpornost ve výkladu etiopatogeneze onemocnění vedla k užívání celé řady dnes již převážně opuštěných názvů [1]: kardiospazmus – Huss 1842, Mikulicz 1882, primární muskulární atonie jícnu – Rosenheim 1899, (kongenitální) idiopatická dilatace jícnu – Sievers 1903, Langmead 1929, frenospazmus – Jackson 1922, aperistaltika ezofagu – Brazil 1955, aganglionární nebo amyenterická achalázie – Adams 1964.
Název achalázie navrhl poprvé Perry (1913), když Hurst hledal pojem pro vyjádření příčiny této choroby [2]. Přestože i toto označení postihuje jen jeden z charakteristických znaků onemocnění – neschopnost relaxace DJS – název se vžil a je dnes všeobecně užíván.
11.2 Patologicko-anatomické nálezy
U nemocných s EKA byly nalezeny morfologické změny svaloviny a plexus myentericus jícnu, vagových nervů a mozkového kmene.
Již makroskopicky je patrná dilatace hrudního ezofagu se svalovou hypertrofií, která přechází v nezbytnělý, několik centimetrů dlouhý terminální úsek jícnu. Mohou být přítomny i známky stagnační ezofagitidy. Histologická vyšetření stěny jícnu u nemocných s EKA, provedená na našem pracovišti na počátku 50. let minulého století, prokazovala následující změny [3]: 1. Úbytek až nepřítomnost gangliových buněk v intramurálním myenterickém plexu. 2. Výraznou hypertrofii svaloviny, zvláště cirkulární vrstvy, přičemž nepoměru mezi zbytněním vnitřní a zevní vrstvy ubývalo směrem orálním. 3. Různý stupeň fibrózy, zvláště vnitřních svalových snopců, při malém zmnožení vaziva v mezisvalové vrstvě. Tento jev byl pokládán za druhotný, nastávající až ve zbytnělé svalovině. 4. Přítomnost tkáňových žírných buněk jako důsledek chronicky zánětlivých změn, které byly vždy v různém stupni ve svalovině nalezeny.
Na změny v Auerbachově plexu jako první upozornil Brown a Kelly. Hurstem a Rakem byly považovány za příčinu vzniku achalázie [2]. Tyto nálezy byly potvrzeny i pozdějšími vyšetřeními [4]. Opakovaně byla rovněž popsána hypertrofie jícnové svaloviny a její současné degenerativní změny [5].
Již v roce 1900 upozornil Rosenheim, že poškození nn. vagi může být příčinou vzniku EKA. Prvními, kdo popsali achalázii při současné degeneraci obou bloudivých nervů, byli Kraus (1902) a Heyrovsky (1913). Pozdější Cassellova vyšetření elektronovým mikroskopem prokázala degenerativní změny v drobnějších vagových vláknech inervujících jícen [5]. Rovněž zjištění časté poruchy vagové fáze žaludeční sekrece u nemocných s EKA svědčí pro možnost poškození vagové inervace [6]. Kimurou (1929) a Cassell (1964) prokázali degenerativní změny v oblasti vagových jader v prodloužené míše u nemocných s EKA [5].
11.3 Etiopatogeneze
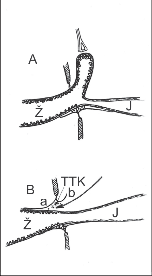
Obr. 1
Schematické znázornění vagové inervace jícnu. Šipky ukazují možné primární poškození uplatňující se v etiopatogenezi vzniku onemocnění.
A – centrální nervový systém,
B – n. vagus,
C – plexus myentericus a hladká svalovina jícnu
Příčina onemocnění je dosud neznámá. Kongenitální a traumatický původ je málo pravděpodobný. Ojediněle byl popsán familiární výskyt onemocnění. Nejpravděpodobnější je získaná etiologie následkem infekčního nebo toxického poškození svaloviny jícnu nebo spíše různých etáží vagové inervace (obr. 1). Tuto teorii podporuje vznik poruchy funkce jícnu v průběhu chronického stadia Chagasovy choroby, která je velmi častá v Jižní Americe. Projevy onemocnění jsou shodné s obrazem achalázie. Příčinou je poškození gangliových buněk plexus myentericus neurotoxinem Trypanosoma cruzi [7, 8, 9]. V našich podmínkách se uvažuje o možnosti toxického působení enterovirů, autoimunním procesu, lokálním ischemickém poškození nervových struktur i o důsledku poleptání jícnu žíravinou. Známa je manifestace choroby po psychickém či fyzickém stresu. Jde však spíš o psychoneurotické ovlivnění dosud asymptomatického onemocnění.
O složitosti etiologie EKA svědčí skutečnost, že se dosud nepodařilo vytvořit dokonalý experimentální model tohoto onemocnění. Byly prováděny experimentální zásahy do vagové inervace různých etáží. K tomu přistupují klinické zkušenosti s různými typy vagotomie. Význam inervace sympatikem se ukazuje pro funkci jícnu jako málo významný [10]. Teprve vysoká cervikální vagotomie vede k těžké poruše motility jícnu, avšak při současném snížení tonusu DJS, což neodpovídá obrazu achalázie [11, 12, 13]. Určitého úspěchu při vytvoření experimentálního modelu bylo dosaženo jen stereotakticky a elektrolytickým zásahem do nervových jader vagu v prodloužené míše u koček a psů [14]. Byly prováděny i četné pokusy o lokální poškození myenterického plexu fyzikálními prostředky [15] nebo místní ischemizací [16]. Interpretace vzniklých mikroskopických a funkčních změn ale nebyla jednoznačná a nepodala přesvědčivý důkaz o významu Auerbachova plexu při vzniku funkčních poruch jícnu. Řada studií však potvrdila úbytek, degenerativní a zánětlivé změny ganglií.
Dnešní znalosti svědčí pro to, že EKA je neuromuskulární poruchou funkce jícnu, lokalizovanou na některé etáži vagové inervace nebo ve svalovině jícnu, jejíž etiologii zatím neznáme (obr. 1).
Nové pohledy na etiopatogenezi achalázie přinesly poznatky o vlivu gastrinu na funkci DJS. Z četných teorií o patogenezi achalázie byl nejobecněji přijat výklad Hurstův [2], který hlavní příčinu onemocnění viděl v neschopnosti relaxace DJS v důsledku degenerativních změn až vymizení gangliových buněk jícnu. Dnes víme, že nejde jen o tuto poruchu, ale že nemoc postihuje celý ezofagus a inervační oblast nn. vagi. Změny myenterického plexu mohou být někdy omezeny jen na část jícnu nad DJS a jsou závislé na délce trvání onemocnění, což připouští výklad až druhotného poškození gangliových buněk.
11.4 Patofyziologická charakteristika
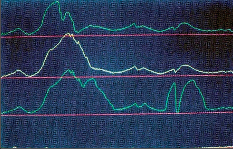
I když poruchu jícnové motility je možno registrovat i rentgenologickým a rentgenokinematografickým vyšetřením, umožnila detailní posouzení funkčních poruch jícnu až jícnová manometrie. U EKA je mimo deglutinaci tlak v jícnu mírně zvýšen, což se přičítá svalové hypertrofii a zbytkům potravy v ezofagu. Během polykacího aktu je registrována značně nižší tlaková amplituda peristaltických vln, která se snižuje úměrně s narůstající dilatací jícnu. Odpovídá to postupnému úbytku primární a sekundární peristaltiky. Naproti tomu se množí simultánní, nepropulzivní, tzv. terciární kontrakce neovlivňující posun potravy, které vznikají zvláště v dolní polovině jícnu. Tyto stahy začínají často současně na více místech jícnu najednou v návaznosti na polknutí nebo spontánně (repetitivní kontrakce). Doba jejich trvání je až dvojnásobná proti normální peristaltické vlně a je známá rentgenologům jako pilovité pseudodivertikulózní zářezy na jícnu. Dalším charakteristickým znakem achalázie je zvýšení klidového tonu DJS proti zdravým jedincům. Není však bez zajímavosti, že u některých nemocných s typickým obrazem onemocnění mohou být tlakové hodnoty normální [20, 21] (viz kapitola 6 Diagnostika, tab. 1 a obr. 1). Během polykacího aktu nedochází k úplné a koordinované relaxaci DJS [22]. Využití moderních manometrických postupů [23, 24] umožňuje maximálně zpřesnit diagnostiku achalázie a rozlišit i určité subtypy dle manometrické charakteristiky. Manometrie se rovněž významně uplatňuje při hodnocení provedené léčby [25].
Již řadu let je známo a v radiodiagnostice využíváno zvýšení kontrakcí jícnu po aplikaci cholinergního mecholilu. Výzkumy přinesly poznatky o hormonálním a farmakologickém ovlivnění funkce DJS a bylo zkoumáno i jejich působení u EKA (tab. 1).
| Tab. 1 Vliv různých farmak na klidový tonus DJS u EKA podle Wienbecka [26] |
||
| Zvyšující | Snižující | Bez účinku |
|
|
|
.
- ! výrazný vliv
- ? nejistý vliv
.
Podle těchto poznatků může být příčinou EKA i zvýšená citlivost DJS na gastrin, zvláště při současné poruše inervace jícnu. Podobně jako u RNJ byly i zde činěny pokusy o farmakologické ovlivnění onemocnění [20, 27, 28]. Složitost a nedořešenost celé této problematiky však zatím nedovolila – s výjimkou diagnostiky – efektní praktické léčebné využití těchto poznatků, jak je o tom dále pojednáno v kapitole 11.8.2.
Některé práce popisující výskyt achalázie u příbuzných – jednovaječných dvojčat, sourozenců, dětí a rodičů [29, 30, 31] – vedly k úvaze o možné genetické predispozici. Jiná pozorování však přímý geneticky podmíněný výskyt nepotvrzují [32].
1.5 Epidemiologie
Již do počátku 20. století bylo podle Neumanna popsáno asi 70 případů onemocnění achalázií a jejich počet v dalších letech podle publikací zejména z Evropy a Severní Ameriky narostl na několik tisíc. Méně početnější jsou zprávy z ostatních kontinentů, s výjimkou Jižní Ameriky a zejména Brazílie, kde však jde o postižení jícnu v rámci Chagasovy choroby [7, 8]. Šetření o skutečné incidenci onemocnění v populaci je málo. Erlam a spolupracovníci udávají v letech 1935–1964 v Rochesteru výskyt 0,6 na 100 000 obyvatel za 1 rok, v Lundu ve Švédsku (1951) uvádí Malm 1–2/100000/rok a zpráva z Liverpoolu (1963) udává 1/100 000/rok [1]. Sami jsme za 10 let (1970–1979) operovali 15 nemocných z okresu Olomouc (asi 200 000 obyvatel), což odpovídá incidenci 0,75/100 000/rok. Všechna tato šetření vycházela převážně jen z operovaných nemocných a omezených lokalit a neodpovídají moderním požadavkům zjišťování incidence onemocnění. Stejně jako Ellis [1] i novější šetření [33] obvykle udávají výskyt 1 onemocnění na 100 000 obyvatel a 1 rok. Naproti tomu v africkém Zimbabwe je incidence uváděna několikanásobně nižší [34]. Je pochopitelné, že u benigního, chronického onemocnění, jakým achalázie je, převyšuje prevalence několikanásobně incidenci. Ve Walesu a Irsku je prevalence achalázie udávána v rozmezí 7,1–13,4/100 000 [35].
11.6 Klinický obraz a diagnostika
11.6.1 Věk, pohlaví a symptomatologie
![Obr. 2 – Věkové rozvrstvení nemocných s EKA operovaných na I. chirurgické klinice v Olomouci v letech 1948 až 1982 [37, 38] Obr. 2 – Věkové rozvrstvení nemocných s EKA operovaných na I. chirurgické klinice v Olomouci v letech 1948 až 1982 [37, 38]](https://eportal.chirurgie.upol.cz/portal_final/wp-content/uploads/2013/03/Image_311.png)
Obr. 2
Věkové rozvrstvení nemocných s EKA operovaných na I. chirurgické klinice v Olomouci v letech 1948 až 1982 [37, 38]
Podle většiny publikovaných sestav je poměr mužů a žen u achalázie přibližně stejný, nebo lehce převažují ženy [36]. Při vyhodnocení naší sestavy 256 operovaných s EKA v Olomouci z let 1948–1982 šlo o 124 mužů (48 %) a 132 žen (52 %). V následujících letech přibylo žen. Ze 119 operovaných od roku 1970 činil podíl žen již 59 %.
Achalázie je onemocněním typickým spíše pro střední a mladší věk [37]. Pouze 15,6 % operovaných z naší sestavy bylo starších než 60 let (obr. 2) [38].
Onemocnění se může vyskytnout i v kojeneckém a dětském věku [38], ale podíl operovaných mladších 15 let nepřesahuje v uveřejněných sestavách 5 %. Mezi našimi nemocnými bylo 8 dětí ve věku od 6 do 13 let, což představuje 3 % operovaných.
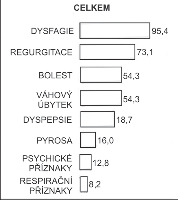
Frekvence udávaných obtíží u našich nemocných je patrná z obr. 3. Vedoucím symptomem, i když často ne iniciálním, je dysfagie, obvykle dolního typu. Nemocní udávají váznutí sousta za dolní částí sterna, u menšího počtu je přítomna porucha polykání tekutin při neporušeném polykání tuhé stravy (paradoxní dysfagie) [38].
.
Dalším příznakem je bolest, která bývá v počáteční fázi onemocnění častější než dysfagie. Je zpravidla lokalizována za sternem nebo v epigastriu, méně často iradiuje do krku, úst či boku. Od pocitu diskomfortu je vystupňována v různě silnou tlakovou, pálivou či řezavou bolest. Záchvaty prudké bolesti jsou zejména charakteristické pro tzv. vigorózní achalázii (viz subkapitola o diferenciální diagnostice 11.7). Typickým příznakem EKA je regurgitace obsahu jícnu. Někdy bývá nemocnými zaměňovaná se zvracením, které je však zcela výjimečné. Regurgitovaný obsah z jícnu na rozdíl od zvracení není natráven a neobsahuje žaludeční štávy. V počátku onemocnění je regurgitace způsobena ještě aktivními stahy jícnu, v pozdějším období při atonii a dilataci ezofagu jde o pasivní přetékání obsahu do dutiny ústní. Je častá v noci a zejména u dětí musí „příznak polštáře potřísněného zbytky jídla“ vést k podezření na EKA. Regurgitace vede k aspiraci potravy do plic a vzniku respirační symptomatologie, která je charakteristická pro onemocnění dětí [39] a nejpokročilejší stadia s mohutnou dilatací jícnu. Úbytek hmotnosti úzce souvisí s dysfagií a bolestí a dosahuje nezřídka několika desítek kilogramů. Začátek potíží je často náhlý a navazuje na rozčilení, psychickou či fyzickou stresovou situaci, která zhoršuje i další průběh choroby. V tomto ohledu je jistě zajímavý zvýšený výskyt EKA v průběhu druhé světové války a po ní [3].
11.6.2 Diagnostika
Při podezření na achalázii či jinou funkční poruchu jícnu je nejdůležitějším vyšetřením kontrastní rentgenová pasáž jícnem, doplněná manometrií a endoskopií. Další vyšetření, jako CT, scintigrafie či endosonografie, nejsou obvykle nutná, s výjimkou složitější diferenciální diagnostiky či v rámci řešení vědeckých projektů. Kontrastní pasáž umožňuje posouzení základních morfologických ukazatelů, včetně jícnové peristaltiky. Detailní posouzení motility jícnu a přesnou diferenciální diagnózu jednotlivých funkčních poruch jícnu však umožní jen jícnová manometrie (obr. 4), jak je o tom blíže pojednáno v kapitole 6 Diagnostika. Při endoskopickém vyšetření lze snadno projít přes kardii do žaludku, protože zúžení v této oblasti, dobře patrné na rentgenu, je pouze funkční. Význam endoskopie je v posouzení slizničních změn, kde může být přítomná stagnační ezofagitida a především je důležité, zvláště u pokročilých achalázií, vyloučit karcinom jícnu.
.
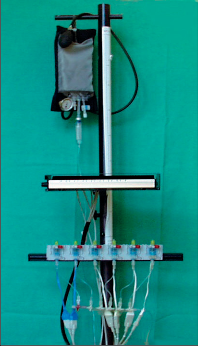
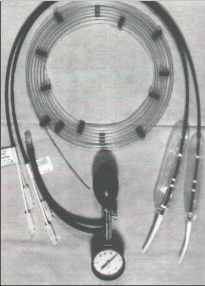
Obr. 4c
Aparatura pro perfuzní manometrii užívaná od 90. let minulého století v Olomouci – shora tlaková manžeta s manometrem, přístroj Polygraf, systém převodníků registrujících tlakové změny z registračních katétrů, vpravo – multiluminózní katétry k zavádění do jícnu, záznamy jsou grafy z funkční laboratoře chirurgické kliniky v Olomouci
11.6.3 Klasifikace
Na základě rozboru subjektivních obtíží nemocných (Plumer) [40], rentgenologického nálezu (Carlson) [1] a klinicko-rentgenologického hodnocení [41] bývá onemocnění klasifikováno na 3–4 stadia. Pro klinickou potřebu je nejvhodnější a nejčastěji užívané rozdělení slučující aspekty klinického i paraklinického vyšetření:
I. stadium
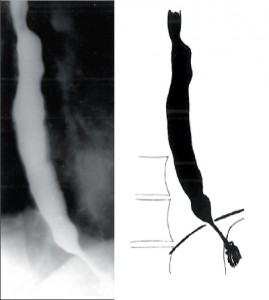
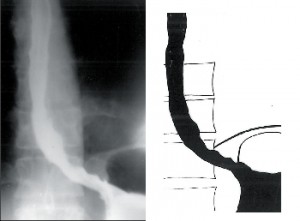
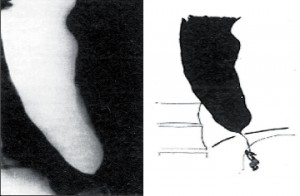
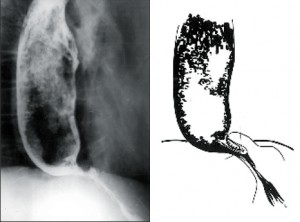
Jícen není dilatován (do 4cm), objevuje se diskoordinace motility, simultánní kontrakce a zpravidla není přítomna žaludeční bublina. Klidový tonus DJS je obvykle zvýšen. Nemocní udávají bolesti, přidružuje se dysfagie, regurgitace a po čase dochází k úbytku hmotnosti (obr. 5).
II. stadium
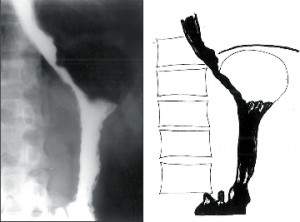
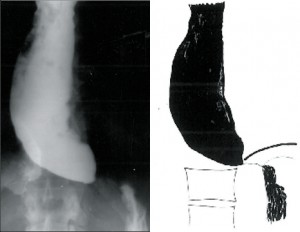
Dochází k postupné dilataci jícnu (4–6cm), úbytku primární i sekundární peristaltiky a zmnožení terciárních kontrakcí. Často může být přítomna žaludeční bublina. Klidový tonus DJS je zpravidla zvýšen. Intenzita obtíží zpočátku narůstá, ale s přibývající dilataci jícnu ubývá bolestivých pocitů i dysfagie a častější se stává regurgitace (obr. 6).
.
III. stadium
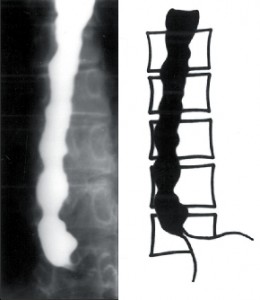
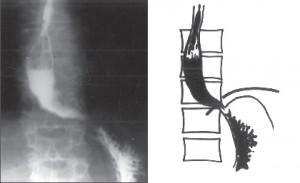
Zvětšuje se dilatace jícnu, který je výrazně elongován a v terminálním stadiu esovitě prověšen a vytváří typický obraz sifonu, kladoucího se na pravou bránici. Již na prostém rtg snímku hrudníku rozšiřuje stín jícnu pravou konturu mediastina a často je v něm patrná hladina tekutiny. Jícen je přeměněn v atonický vak bez peristaltiky a v manometrickém záznamu se objevují jen ojedinělé simultánní stahy. S narůstající dilatací jícnu ubývá dysfagie, ale zvětšuje se pasivní regurgitace a nebezpečí respiračních komplikací. Toto nejpokročilejší stadium onemocnění bývá označováno jako dolichomegaezofagus (obr. 7).
Někdy bývá užíváno rozdělení na kompenzovanou a dekompenzovanou formu EKA [3, 42]. V počátku onemocnění dochází ke svalové hypertrofii a jícnová peristaltika, i když je narušená, se snaží o vyprázdnění jícnu. Během druhého stadia dochází postupně k dekompenzaci, svalovina jícnu ztrácí svou kontrakční schopnost a ve třetím stadiu se jícen přeměňuje na atonický dilatovaný orgán.
Zvláštní formou onemocnění je tzv. vigorózní achalázie, charakterizovaná zvýšenou motilitou jícnu, častými segmentálními spazmy, které jsou nemocnými pociťovány jako intenzivní retrosternální bolest [43]. Jícen není dilatován a často je normální klidový tlak v oblasti DJS (viz podkapitola 11.7, tab. 4).
V klinické praxi je přesné rozdělení podle stadií mnohdy problematické a často hovoříme o přechodu jednotlivých stadií. Rozdělení našich nemocných v sestavě 245 operovaných podle pokročilosti onemocnění uvádí tab. 2 [38, 44].
| Tab. 2 Rozdělení 245 operovaných podle stadia onemocnění |
|||
| Stadium onemocnění | Počet nemocných | ||
| I. | 29 (12 %) | ||
| II. | I. -II. | 22108 | 130 (53 %) |
| III. |
II. – III. megaezofagus |
28 29 29 |
86 (35 %) |
.
11.6.4 Průběh a komplikace
Vyvíjí-li se onemocnění zásadně vždy všemi stadií, není zcela jisté. Vcelku lze říci, že existuje korelace mezi délkou anamnézy a pokročilostí onemocnění, není však absolutní, jak to potvrzují četné zkušenosti [36] (tab. 3).
| Tab. 3 Vztah mezi stadiem choroby u 222 operovaných a délkou anamnézy v letech v době operace (38,44) |
|||
| Stadium | Počet | Délka anamnézy od–do průměr | |
| I. | 27 | 4 měs. – 16 r. | 3 r. |
| II. | 122 | 3 měs. – 48 r. | 6 r. |
| III. | 73 | 3 měs. – 30 r. | 8 r. |
.
Pozorování jednotlivých nemocných v průběhu let potvrdilo postupnou progresi onemocnění [45]. Naopak i při dlouholeté anamnéze se můžeme setkat s počáteční formou EKA [46]. V tomto ohledu nemá proto jistě absolutní platnost Adamsův (1961) odhad, že I. stadium trvá obvykle 3 měsíce až 3 roky a II. stadium 10–15 let [40]. Není ani konstantní závislost mezi stupněm obtíží a rentgenologicky zjištěným stadiem choroby u jednotlivých nemocných.
Mezi komplikace EKA patří až v 10 % závažné respirační onemocnění [47]. Vznik chronické bronchitidy, bronchopneumonie, abscesů a fibrózy plic ohrožuje zejména děti [39] a nemocné v pokročilém stadiu onemocnění. Frekvence respiračních obtíží u našich nemocných činila vcelku 8,2% a ve III. stadiu onemocnění 15 %. U řady nemocných s EKA byly popsány i kostní a kloubní komplikace v podobě revmatoidní artritidy a osteoartropatie. Rozvoj těchto změn je přičítán těžké plicní infekci v pokročilém stadiu onemocnění [41].
Nejzávažnější komplikací je vznik karcinomu v achalatickém jícnu. Jeho výskyt je desetkrát častější než v normální populaci a věk těchto nemocných je v průměru o deset let nižší [48, 49]. Nejčastěji je nádor lokalizován ve středním jícnu a histologicky jde o spinocelulární typ. Je-li prognóza karcinomu jícnu všeobecně velmi špatná, platí to dvojnásob o karcinomu v achalatickém jícnu. Pro jeho pozdní rozpoznání je provedení resekčního výkonu možné jen výjimečně [50, 51]. Právem je proto nutné považovat pokročilou EKA za prekancerózu a je oprávněný požadavek Wienbeckův, aby tito nemocní byli pravidelně endoskopicky kontrolováni [26]. Jen tak je možno zlepšit včasnost diagnózy a neutěšenou prognózu těchto sekundárních karcinomů, u nichž doba přežití jen zřídka přesahuje 1 rok [52]. Mezi našimi 256 operovanými jsme pozorovali karcinom v achalatickém jícnu pětkrát (2 % výskytu). Jen jednou mohla být provedena radikální resekce. Krvácení z jícnu musí vždy vést k podezření na maligní onemocnění, protože jako důsledek stagnační ezofagitidy je krajně vzácné. Může však být následkem refluxní ezofagitidy a vředu jícnu.
11.7 Diferenciální diagnostika
Moderními diagnostickými metodami, zejména manometrií, lze rozlišit mimo achalázii řadu dalších poruch motility jícnu [53, 54]. Z dalších vzácnějších funkčních poruch jícnu je nutno odlišit především následující stavy:
Pro tzv. vigorózní achalázii jsou charakteristické zejména záchvaty prudké bolesti a silné simultánní kontrakce těla jícnu [55].
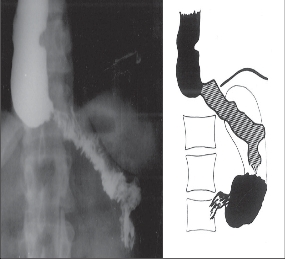
Difuzní spazmus jícnu [56] byl poprvé jako samostatná jednotka popsán a odlišen od EKA v roce 1934. Etiopatogeneze onemocnění je podobná jako u achalázie, svalovina jícnu je hypertrofická, ale není zmenšen počet gangliových buněk v nervových pleteních. V typickém obraze je onemocnění charakterizováno dysfagií a retrosternálními bolestmi a vyskytuje se spíše u starších nemocných. Rentgenologicky a manometricky je prokazatelná porucha motility jícnu. Amplituda peristaltických vln, které trvají déle, je značně vyšší. Stahy jsou převážně neperistaltické a repetitivní a rentgenologicky vzniká typický obraz funkčních pseudodivertiklů, označovaných jako „kadeřavý nebo vývrtkový jícen“ (obr. 8).
| Tab. 4 Diferenciální diagnostika EKA, difuzního spazmu jícnu a vigorózní achalázie. Upraveno podle Sandersona a spolupracovníků [43] |
|||
| Příznak | Achalázie | Difuzní spazmus | Vigorózní achalázie |
| Bolest | nezvykle | téměř vždy | častá |
| Obstrukce | vždy | někdy | téměř vždy |
| Regurgitace | obvykle | vzácně | častá |
| Retence | častá | nikdy | častá |
| Neurotizace | nezvykle | téměř vždy | občas |
| Rentgenový nález | |||
| Difuzní dilatace | obvykle | nikdy | občas |
| Segmentální spazmy | nezvykle | často | obvykle |
| Reakce na mecholyl | téměř vždy | nikdy | někdy |
| Manometrie | |||
| DJS – tonus | zvýšen | často zvýšen | normální |
| DJS – relaxace | nemožná | normální | nemožná |
.
Relaxace sfinkterů je v typických případech zachována. Diferenciální diagnostika proti EKA vyplývá z tab. 4. Názory na léčbu jsou značně rozdílné [26]. Užívá se psychoterapie, sedativní a spazmolytická medikace, pneumatická dilatace DJS, aplikace botulotoxinu [57].
Chirurgická léčba spočívá v dlouhé extramukózní ezofagokardiální myotomii prodloužené na střední a dolní jícen a gastroezofageální úsek [58, 59]. U některých nemocných je rozlišení mezi EKA a difuzním spazmem obtížné a vyskytují se názory, že jde o předstupeň achalázie, ve kterou může difuzní spazmus jícnu časem přejít [60]. Zatímco současný výskyt skluzné hiátové hernie a achalázie je vzácností, uvádí Heitman současnou koincidenci difuzního spazmu jícnu a skluzné hiátové hernie u jedné třetiny nemocných, obvykle při současné hypertonii DJS [26].
Jako dyschalázie je označována atypická forma EKA [61] s přítomností peristaltických kontrakcí nebo normálních relaxací DJS. Jindy je takto charakterizována přechodná forma mezi EKA a difuzním spazmem jícnu [45].
Syndrom hypertenzního DJS byl popsán Codem a spolupracovníky [62] v roce 1960. Část těchto nemocných má současně ostatní znaky difuzního spazmu jícnu a jde o vzácnou nozologickou jednotku [63].
Mezi nespecifické funkční poruchy jícnu se zařazuje celá řada poruch motility ezofagu identifikovaných na základě užití moderních manometrických metod, kdy zjištěné poruchy jícnové peristaltiky nelze zařadit mezi přesněji definované nosologické jednotky.
Jako presbyezofagus bývají označovány změny motility postihující jícen ve vyšším věku [37]. Charakteristický je úbytek primární peristaltiky, častější neperistaltické simultánní kontrakce a zpomalené vyprazdňování jícnu, jenž je často dilatován. Změny postihují především dolní třetinu ezofagu a tonus DJS zůstává zpravidla normální. O příčinách vzniku presbyezofagu není dosud příliš mnoho známo. Určitou roli zde hraje úbytek intramurálních ganglií ve vyšším věku. Pro tyto změny nemusíme najít žádný korelát v subjektivních obtížích. Jindy však mohou hrát roli v diferenciální diagnostice při podezření na některé funkční onemocnění jícnu.
Některá systémová onemocnění postihující neuromuskulární struktury mohou být rovněž provázena funkčními poruchami jícnu. Patří mezi ně i sklerodermie. Etiologie je neznámá a hlavním příznakem je sklerotizace kůže podmíněná zvýšeným ukládáním vaziva. Při postižení jícnu, projevujícím se dysfagií, dochází k ochabnutí a dilataci ezofagu a insuficienci DJS s následným gastroezofageálním refluxem, jenž dále zhoršuje narušenou funkci jícnu [64]. Jako sekundární achalázie či pseudoachalázie bývají označovány stavy, kdy obraz achalázie vyvolá jiné onemocnění systémové nebo onemocnění přímo poškozující stěnu jícnu, např. karcinom ezofagokardiální junkce [65].
11.8 Léčení
11.8.1 Indikace a možnosti
Léčba EKA je zaměřena na zmenšení tlakové bariéry v oblasti DJS. Jde o symptomatickou léčbu postihující nejdůležitější faktor způsobující špatné vyprazdňování jícnu. Žádný užívaný postup není schopen plně ovlivnit celkově narušenou motilitu jícnu. Přes dlouholeté zkušenosti nebylo dosaženo jednoty, zda je vhodnější dilatace nebo chirurgická léčba a která z nich má být užita primárně.
Zřejmou indikací k operativnímu léčení je EKA v dětském věku, vigorózní achalázie a stavy spojené s jiným onemocněním, jako je hiátová hernie, cholelitiáza a vředová choroba gastroduodena, které je možno současně vyřešit. Důvodem k operaci je podezření na karcinom jícnu či kardie, opakovaný neúspěch dilatací a obtíže v nejpokročilejším stadiu onemocnění.
Názorové rozpory se týkají především prvního a druhého stadia choroby. Dilatacím, prováděným hlavně gastroenterology a intervenčními radiology, nelze upřít řadu výhod podložených i dosaženými velmi dobrými výsledky již v první polovině 70. let minulého století. Proto gastroenterologové a někteří chirurgové přijali zásadu, že dilatace má být primárním léčebným postupem u EKA [26, 66, 67]. Na druhé straně není bez zajímavosti, že pracovníci Mayo kliniky [1] se po dlouholetých zkušenostech s dilatační léčbou v letech 1950–1967 u 407 nemocných přiklonili k primární chirurgické léčbě, kterou stejně jako Belsey [64] propagovali od roku 1948 i olomoučtí chirurgové [3, 45, 68, 69]. Na čí straně je pravda, neprokázaly do současnosti jednoznačně ani další studie, srovnávající obě metody na základě exaktního předoperačního a pooperačního vyšetření, hodnocení stadia onemocnění a dosažených výsledků.
11.8.2 Medikamentózní a psychiatrická léčba
Zjištění, že tonus DJS je možno ovlivnit farmakologicky, otevřelo i nové terapeutické perspektivy. Aplikace cholinergních preparátů, nitroglycerinu, amylnitritu, glukagonu, prostaglandinů, blokátorů kalciových kanálů (nifedipin) a jiných farmak může krátkodobě ovlivnit obtíže nemocných. Tyto preparáty mohou být využity ke krátkodobému ovlivnění obtíží, dlouhodobých léčebných výsledků se zatím nepodařilo dosáhnout [27, 28, 70, 71, 72, 73]. Nejnověji byl testován pro tyto účely Sildenafil (Viagra), jehož podání vede jen ke krátkodobému poklesu tlaku DJS s nástupem účinku asi za 15 minut po podání a perzistujícím efektem asi jednu hodinu [74]. Stejně tak bylo docíleno jen krátkodobého efektu psychoterapií a hypnózou [75].
11.8.3 Dilatace
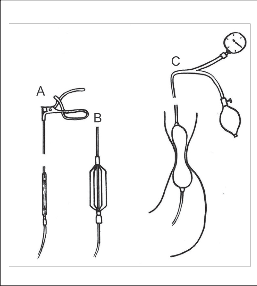 Obr. 9a, b, c
|
Cílem dilatační léčby je násilné roztažení svalového pláště dolního jícnu a dosažení disrupce cirkulárních svalových vláken v oblasti DJS, s následným poklesem svalového tonu, registrovaného poklesem tlakových hodnot při manometrickém vyšetření. Historicky se užívaly kovové mechanické dilatátory, z nichž nejznámější byl Starckův aparát [76]. Přístroj sestával z několika kovových branží upevněných na vodicí sondě, které se po zavedení do oblasti terminálního jícnu pomocí mechanického zařízení ve vodicí sondě roztáhly na způsob deštníku a násilně dilatovaly DJS. Byla vyvinuta řada modifikací tohoto přístroje až po flexibilní variantu (obr. 9).
Mechanické dilatátory byly nahrazeny balonkovými pneumatickými dilatátory, u kterých se stejného efektu dosáhlo nafouknutím gumového balonku upevněného na sondě, podobně jak tomu bylo u známé Sengstaken-Blakemorovy sondy k tamponádě krvácejících jícnových varixů. První dilatátor tohoto typu navrhl Russel [69] v roce 1898. Balon se plní vzduchem nebo vodou a pomocí manometru je možno dózovat tlak. Tohoto principu využívají i dnešní moderní dilatační katétry. Dilatace se provádějí jednorázově nebo v opakovaných sezeních a poloha sondy se kontroluje rentgenologicky. Při dilataci může nemocný pociťovat bolest a může docházet k mírnému krvácení z místa dilatace.
Výsledky dilatační léčby
Dilatační léčba achalázie má již dlouhou historii. Podle souhrnné statistiky devíti autorů z let 1951–1974, uveřejněné Wienbeckem [26, 46] a zahrnující 1279 nemocných s dobou sledování od 2 do 11 roků, bylo dosaženo výborných až velmi dobrých výsledků v 59–81 %, uspokojivých v 9–23 % a neuspokojivých v 6–30 %. Sám Wienbeck však upozorňuje, že výsledky byly zpracovány podle rozličných kritérií a s různou pečlivostí, některé jen na základě dotazníkových akcí. Je-li dilatace nutno provádět opakovaně, jsou výsledky podstatně horší [77], a dojde-li k recidivě, je tomu obvykle do půl roku, pozdější recidivy jsou vzácné. Pneumatické dilatátory jsou zatíženy menším počtem komplikací ve srovnání se staršími rigidními. Nejobávanější komplikací je perforace [26] jícnu s frekvencí mezi 1–9 %. Z těchto důvodů je doporučována po každé dilataci rentgenová kontrola ezofagu vodným roztokem kontrastní látky. Kompletní perforace jícnu při endoskopickém vyšetření či po dilataci je závažnou příhodou [78]. Údaje v odborné literatuře o zhojení těchto perforací po konzervativní léčbě se týkají spíše jen drobných slizničních trhlin nepronikajících extraezofageálně, zjištěných při rentgenové kontrole. Starší literatura udávala mortalitu dilatací [79] 0,5 % a frekvence pooperačního GER pod 10 %. Za prediktor úspěchu dilatace lze považovat tlak v oblasti DJS po dilataci. Při hodnotách 10 mm Hg a méně lze očekávat dlouhodobou remisi, zatímco hodnoty nad 20 mm Hg svědčí pro to, že pacient nebude mít benefit z této léčby [80]. Při neúspěchu dilatace se další opakování nedoporučuje, protože pacienti nezlepšení po primární dilataci nemají významnou naději na zlepšení po opakovaných sezeních [81]. Novější údaje o úspěšnosti dilatací jsou uváděny ve velmi širokém rozmezí 32–98 % [81].
Dilatace se těší stálé oblibě zejména u gastroenterologů, protože jde o poměrně miniinvazivní výkon, který je možno v sedaci provádět ambulantně pod endoskopickou či rentgenologickou kontrolou a má většinou bezprostřední dobrý efekt při minimu komplikací. Na rozdíl od chirurgické léčby, jak to dokládáme dále, existuje málo informací o dlouhodobých výsledcích. Dlouhodobé výsledky dilatací prezentuje West se spolupracovníky [82], po 5 letech byla úspěšná léčba jen u 50 % nemocných a po 15 letech jen u 40 %. Sabharwal uvádí dobrý efekt dilatace po selhání myotomie [83], naproti tomu další práce prezentují dobré výsledky myotomie po selhání dilatací [84, 85].
11.8.4 Léčba botulotoxinem
V roce 1994 prezentoval Pasricha se spolupracovníky účinek botulotoxinu na DJS u achalázie [86]. Prokázal, že endoskopicky intrasfinktericky aplikované injekce botulotoxinu do čtyř kvadrantů jícnu v oblasti DJS, obdobnou technikou jako u skleroterapie, vedou k poklesu tlaku v oblasti DJS o 33 % a zlepšují dysfagii u 66 % nemocných s achalázií po dobu 6 měsíců. Od té doby byla zveřejněna řada zkušeností s touto metodou, včetně srovnání s dalšími léčebnými možnostmi [81]. Zkušenosti ukazují na menší efekt botulotoxinu u pacientů s achalázií, kde jsou vyšší hodnoty tlaku v oblasti DJS (70 mm Hg) [87], a brzký návrat obtíží. Dle práce Zaninotta a spolupracovníků [88] obtíže recidivovaly ve 40 % po roce a v 66 % po dvou letech. Zkušenosti chirurgů poukazují na sekundární jizevnaté změny ve stěně jícnu po aplikaci botulotoxinu, což ztěžuje následné provedení myotomie a vede k většímu riziku komplikací v podobě perforace sliznice během výkonu. Publikované práce však tuto skutečnost jednoznačně nepotvrzují, a tak tato otázka zůstává nadále kontroverzní [54, 89, 90, 91].
Vzhledem k popsaným zkušenostem se léčba achalázie botulotoxinem jeví jako vhodná pro starší a rizikové pacienty, kteří nejsou schopni tolerovat náročnější léčbu s trvalejším efektem.
11.8.5 Chirurgické léčení
11.8.5.1 Historie
V následujícím přehledu uvádíme některé z navržených operačních postupů, z nichž většina má již jen historický význam [1, 70, 71].
Operační výkony je možno rozdělit do následujících skupin:
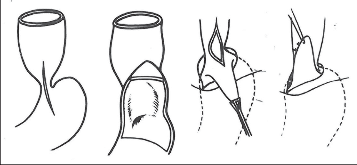
- chirurgická dilatace GES (obr. 10),
- kardioplastiky (obr. 11),
- ezofagogastroanastomózy (obr. 12),
- operace zmenšující dilatovaný jícen (obr. 13),
- vyřazení žaludku z pasáže jejunálním by-passem (obr. 14b,c),
- resekce GES a žaludku (obr. 14a,d a 15),
- resekce jícnu a kardie (obr. 16),
- jako zcela neúčinné v léčbě EKA se ukázaly výkony protínající ezofageální hiátus (Roepka 1914, Gregorie 1923) a destruující vagovou (Rieder 1929) a sympatickou inervaci (Knight a Adamson 1935).
Obr. 10
Chirurgická dilatace GES:
a) dilatace „bez konce“ při založené gastrostomii,
b, c) dilatace ze subkardiální gastrotomie,
d) dilatace bez otevření žaludku
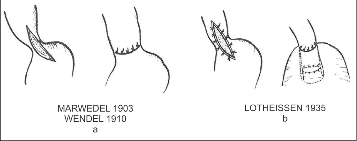
Obr. 11 – Kardioplastiky :
a) podle návrhu Marwedela provedl Wendel podélné protětí s příčnou suturou GES,
b) podélné protětí kardie s invaginací do žaludku

Obr. 12
Ezofagogastroanastomózy :
a) side-to-side anastomóza z abdominálního neb o hr udního (Sauerbuch) přístupu,
b) vytvoření anastomózy pomocí hmoždící svorky a současné gastrostomie,
c) anastomóza, resp. kardioplastika jako obdoba Finneyeho pyloroplastiky,
d) kombinace anastomózy s resekcí žaludku nebo trunkální vagotomií a pyloroplastikou ke zmenšení nebezpečí GER
Obr. 13
Operace zmenšující dilatovaný jícen:
a) podélná excize celé stěny jícnu s následnou suturou z extrap leurálního přístupu,
b) podélná plikace (zřasení) bez otevření jícnu zužujícího jeho lumen,
c) podélné zkrácení elongovaného jícnu z břišního nebo
d) krčního přístupu ezofagogastrickou nebo ezofagoezofageální invaginací
Obr. 14
Zmenšení dilatovaného jícnu:
a) segmentální resekce hrudního ezofagu (Pribram 1912) a současná myotomie. Výkony vyřazující žaludek:
b) jejunální by-pass, anterotorakální transpozice žaludku a krční gastrostomie,
c) využití Rouxovy kličky, které Allison doplnil anastomózou jejuna se zadní stěnou žaludku,
d) resekce GES a end-to-end anastomóza
Obr. 15
Resekční výkony :
a) resekce GES, orální části žaludku a pyloroplastika,
b) mo dif ikace předchozího s interpozicí jejunální kličky,
c) bipolární resekce žaludku. Resekce žaludku u těchto operací sledovala zmenšení nebezpečí GER
Obr. 16
Resekce jícnu a kardie:
a) náhrada jícnu žaludkem s kontinentní ezofagogastrickou spojkou (Nissen, Lortat-Jackob),
b) interpozice tenkého nebo
c) tlustého střeva
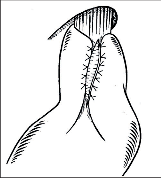
Extramukózní myotomii kardie pro léčbu EKA navrhl v roce 1901 Gottstein z Mikuliczovy kliniky. Poprvé byla provedena Hellerem v roce 1913, a to dvěma incizemi vpředu a vzadu. Myotomie byla 8 cm dlouhá, omezená hlavně na distální jícen. Proximálně zasahovala na dilatovaný ezofagus a distálně nepřesahovala GES [72]. Z Gottsteinova návrhu vycházela i Girardova kardioplastika (1914), která byla vlastně extramukózní myotomií, překrytou příčnou suturou svaloviny.
De Briune Groeneweld v roce 1918 modifikoval původní Hellerovy incize pouze v přední myotomii, o jejíž publicitu se zasloužil především Zaaijer [73].
Obr. 17
Ezofagokardiální myotomie:
a) původní Hellerův postup se dvěmi incizemi na přední a zadní stěně jícnu,
b) myotomie (kardioplastika) s příčným sešitím svaloviny bez porušení sliznice,
c) excize svalového pruhu v rozsahu myotomie,
d) ezofagokardiální myotomie se zanořením slizničního válce do jícnu, nebo je výkon možno doplnit fundoplikací
V dalších letech byla myotomie různými autory modifikována, především co se týká její délky. Tzv. krátká myotomie zasahuje proximálně 2cm na dilatovaný jícen s hypertrofickou muskulaturou, distálně končí nad GES. Dlouhá myotomie distálně přesahuje kardii několik cm na žaludek. U dlouhé myotomie se zvyšuje nebezpečí vzniku GER po operaci, ale nebezpečí recidivy dysfagických obtíží je menší, jak to experimentálně prokázal Ellis se spolupracovníky [74]. Řada autorů prováděla excizi svalového pruhu v rozsahu myotomie nebo mobilizaci svaloviny do stran od sliznice, která pak volně prolabuje do myotomie v rozsahu jedné čtvrtiny až poloviny obvodu slizničního válce. Superradikální variantou myotomie je resekce celého svalového pláště GES bez otevření lumen jícnu (obr. 17).
11.8.5.3 Taktika a technika myotomie a připojení antirefluxního výkonu
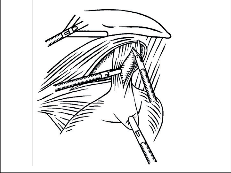
Operační postup v éře otevřené chirurgie: Dlouhá léta byla vedena diskuze o optimálním přístupu. Zastánci laparotomie postupovali souhlasně s původním návrhem Hellera [26, 66], jiní dávali přednost torakotomii [66, 75]. Za nejvhodnější přístup k dolnímu ezofagu byla i v Olomouci jak prof. Rapantem, tak prof. Šerým považována torakotomie lůžkem 8. žebra vlevo. Technika i rozsah myotomie byla detailně propracována, jak to znázorňují obr. 18, 19 a 20.
Abdominální cesta horní střední laparotomií s užitím Rochardova rozvěrače byla indikována jen u starých a rizikových nemocných a tam, kde bylo v plánu založení současně antirefluxní fundoplikace nebo řešení jiného intraabdominálního onemocnění. Teprve od poloviny osmdesátých let se více dávala přednost abdominálnímu přístupu pro jeho větší šetrnost pro nemocného [76].
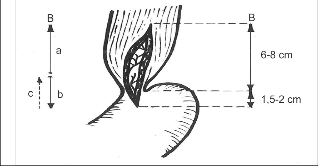
Ezofagokardiální myotomii je výhodné začít protětím jícnové svaloviny asi 2–3 cm nad kardií v oblasti hypertrofické svaloviny, nad zúženým spastickým úsekem, kde je separace sliznice od svaloviny nejlehčí. Vhodným nástrojem je zahnutý disektor a v dnešní době i harmonický skalpel. Oddělení svaloviny od sliznice aborálním směrem, zejména v místě kardie a na žaludku, je obtížnější a je zde největší nebezpečí vzniku perforace sliznice, zvláště při těžké stagnační ezofagitidě. Přechod jícnu v žaludek identifikujeme podle lividnějšího zbarvení sliznice žaludku, jsou obvykle i zřetelně patrné mukózní řasy s hojnými cévami paprsčitě se rozbíhajícími od kardie směrem na žaludek. K úspěchu myotomie je nezbytné provést ji 1,5–2 cm pod kardií. Je zbytečné prodlužovat příliš myotomii do oblasti hypertrofické atonické svaloviny.
.
Manometrické studie ukazují, že délka zvýšené tlakové zóny terminálního jícnu u EKA nikdy nepřesahuje 4 cm. Podle našich měření byla v průměru 26 mm. U difuzního spazmu jícnu nebo vigorózní achalázie je naopak nutné prodloužit myotomii orálním směrem co nejvýše. Krvácení z proťaté svaloviny se dříve stavělo ligaturami a koagulací v dostatečné vzdálenosti od sliznice. Koagulaci jsme pro nebezpečí vzniku nekrózy nepoužívali k hemostáze na sliznici. Zde je nejvhodnější přiložit horké longety nebo založit jemný podvaz. Myotomii lokalizujeme na ventrální cirkumferenci jícnu.
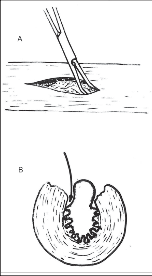
Komplikace: Nejzávažnější je perforace sliznice jícnu, jejíž nebezpečí je největší na ezofagokardiálním přechodu. Sliznice ošetříme pečlivou suturou atraumatickým stehem. Je vhodné všít cíp žaludečního fundu do dolní části myotomie ke svalovině na způsob Thalovy plastiky. Účelem tohoto postupu je plombáž poraněného místa a současně se uplatní i antirefluxní efekt.
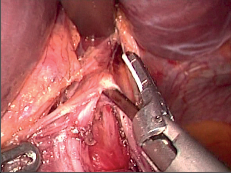
Současná operační taktika a technika: S rozvojem miniinvazivní endoskopické chirurgie od počátku devadesátých let minulého století se ezofagokardiální myotomie začala provádět laparoskopicky. Priorita se většinou přičítá Cuschierovi a spolupracovníkům již v roce 1990 [92]. tradiční zastánci hrudního přístupu prováděli zpočátku myotomii torakoskopicky, většinou se však přesvědčili podobně jako Ramaciato, že laparoskopický přístup je výhodnější [93]. Dnes již téměř dvacetileté zkušenosti a velký počet zveřejněných prací prokazují výhody laparoskopického přístupu proti klasické otevřené operaci a rovněž i proti torakoskopickému přístupu [90, 91, 94 až 106], laparoskopie se stala zlatým standardem pro myotomii u achalázie (obr. 21 a 22, videozáznam laparoskopické ezofagokardiální myotomie u ezofagokardiální achalázie je dostupný v elektronické verzi – viz tiráž knihy). Vlastní technika a rozsah myotomie zůstávají obdobné jako u otevřené operace, provádí se dlouhá myotomie přesahující na žaludek, k protětí svaloviny se užívají různé nástroje – nůžky, elektrokoagulační háček či harmonický skalpel, aniž by bylo prokázáno, že ta či ona technika je lepší. Při použití elektrokoagulace se nedoporučuje koagulovat v těsné blízkosti sliznice pro zvýšené nebezpečí možného vzniku perforace. Celá řada chirurgů si po dokončení myotomie kontroluje její kompletnost a neporušení sliznice peroperační ezofagoskopií. Velmi dobře lze takto přesně identifikovat gastroezo-fageální junkci a případně zbylá svalová vlákna, která je nutno ještě protnout (obr. 22d). U dostatečně zkušených laparoskopických chirurgů klesla nutnost konverze pod 5% a rovněž frekvence perforace sliznice nepřesahuje 4%.
Zatímco se zdá, že bylo dosaženo všeobecného konsenzu, pokud jde o přístupovou cestu k myotomii, řada dalších otázek zůstává stále otevřená.
.
Na prvním místě je to vhodnost připojení antirefluxního výkonu a jeho typu. Občasný vznik GER a jeho komplikací po myotomii vedl řadu chirurgů ke kombinaci myotomie s některou antirefluxní operací. Myotomie byla prováděna s vagotomií, popřípadě s pyloroplastikou [107], s ezofagogastropexí [108, 109], fundoplikací v provedení Nissen-Rossettiho nebo Belseyho a jejími různými variantami [110, 111] (obr. 23a). Stejný cíl sledovalo všití bráničního laloku do myotomie [112]. Jako antirefluxní doplněk Hellerovy myotomie je užívána i Thalova operace [113]. Jde vlastně o modifikaci neúplné fundoplikace, která byla původně navržena ke krytí perforace dolního jícnu a našla uplatnění v léčbě striktur terminálního ezofagu. Thalem je doporučována i k léčbě skluzných hiátových hernií. Principem je našití trojúhelníkového cípu, vytvořeného z přední stěny žaludečního fundu, na ventrální cirkumferenci jícnu do defektu po vzniklé myotomii (obr. 23b).
Otázka, zda a jaký antirefluxní výkon se má po myotomii připojit, nebyla jednoznačně zodpovězena ani v éře laparoskopické chirurgie. Byla provedena celá řada studií, kde byly srovnávány různé typy antirefluxních výkonů připojených k myotomii, aniž by byl zjištěn rozdíl v zábraně refluxu [90, 102 , 114]. Co je však pro taktiku chirurgické léčby obzvlášť důležité, je skutečnost, že ve většině prací nebyl zjištěn po myotomii signifikantní rozdíl ve výskytu GER, byla-li myotomie provedena s antirefluxním výkonem nebo bez něho. V recentní metaanalýze 21 studií v roce 1995 analyzoval Lyass se spolupracovníky [115] sestavu 532 pacientů, kde byla provedena myotomie s fundoplikací a 69 operovaných s myotomií bez fundoplikace. U obou skupin nebyl na základě klinických příznaků ani dle pH-metrického vyšetření zjištěn rozdíl ve výskytu refluxu. K obdobným výsledkům dospěly i další studie [95, 101, 116]. Tyto závěry se shodují s našími výsledky uvedenými dále při hodnocení sestavy operovaných klasickým otevřeným přístupem. Při rozhodování o připojení antirefluxního výkonu je třeba brát v úvahu i to, že v současnosti jsou k dispozici vysoce účinné blokátory protonové pumpy, kterými je možné zvláště mírnější obtíže z pooperačního refluxu úspěšně léčit.
11.8.5.4 Pokročilá ezofagokardiální achalázie
U pokročilé EKA je mimo obnovení pasáže GES nutno zvážit i možnost úpravy dilatovaného jícnu. Na počátku III. stadia onemocnění, po zhodnocení podrobného předoperačního vyšetření zkušeným odborníkem, lze pouhou myotomií dosáhnout někdy překvapivě dobrého zlepšení obtíží nemocného. V terminálním stadiu choroby při vytvoření dolichomegaezofagu, kde je předem malá naděje na úspěch myotomie, nebo po předchozí neúspěšné myotomii u pokročilého stavu je nutno se pokusit o jiné řešení.
V historickém přehledu operací u achalázie jícnu (podkapitola 11.8.5.1) jsou uvedené dnes již vesměs opuštěné, rozsáhlé, pro chirurga technicky náročné a pro nemocného zatěžující operace, které se snažily řešit problém související s velkou dilatací a atonií celého jícnu. Byly užívány gastroezofageální anastomózy, by-passové operace a resekce jícnu a žaludku. Operace sledující zmenšení objemu dilatovaného jícnu (plikace, segmentální resekce) samy o sobě neměly význam a jejich užití bylo možno připustit jen v kombinaci se současným řešením poruchy pasáže GES, jak to navrhl Ciaglia [117] (obr. 12 až 16 v kap. 11.8.5.1), který doplnil Hellerovu myotomii segmentální resekcí jícnu. Později se objevují zprávy o úspěšné kombinaci myotomie s modifikovanou technicky komplikovanou plikací jícnu [118].
Původně opuštěné gastroezofageální anastomózy [119, 120] (obr. 12 v kap. 11.8.5.1) doznaly svou renezanci v kombinaci s vagotomií a pyloroplastikou, čímž se částečně zmenšilo nebezpečí pooperačního GER. Z abdominálního přístupu se prováděly dva typy anastomóz: U Grondahlovy spojky se mobilizovaný fundus žaludku fixuje k jícnu a pak se řezem ve tvaru „U“ otevře jícen a žaludek za současného protětí GES. Anastomóza mezi jícnem a žaludkem se vytvoří podobně jako u Finneyho pyloroplastiky. Alternativním řešením je Heyrovského side-to-side anastomóza mezi jícnem a žaludečním fundem bez protětí kardie. V obou případech se výkon doplňoval trunkální vagotomií a pyloroplastikou.
Radikální léčba pokročilého dolichomegaezofagu je vyhrazena pro mladší nemocné v dobrém celkovém stavu s perspektivou dlouhodobějšího přežití. Spočívá v transhiatální resekci změněného jícnu a GES a jeho náhradě tubulizovaným žaludkem s ezofagogastrickou anastomózou na krku. Jedna z modifikací tohoto postupu byla vypracována v Olomouci Rapantem a Králíkem (viz kap. 9, obr. 33). Rozsáhlé zkušenosti s náhradou jícnu u benigních onemocnění byly na některých pracovištích získány i s užití tenkého [121] nebo tlustého střeva [122, 123]. Cílem všech těchto operací je mimo obnovení pasáže GES i zábrana GER.
Vedle náhrady jícnu tubulizovaným žaludkem se velké oblibě v Olomouci těšila i náhrada jícnu interpozicí kolon. Z počátku se prováděla interpozice krátkého úseku tlustého střeva z abdominotorokálního přístupu a někdy lze vystačit i s pouhou laparotomií. Po resekci kardie a dolní třetiny jícnu se k obnovení pasáže užívalo transverzum nebo levá flexura tračníku podle vhodnějšího cévního zásobení. Délka krátkého transplantátu byla asi 10–20 cm. Pasáž tlustým střevem byla obnovena end-to-end anastomózou, stejně jako horní spojka mezi jícnem a kolon. Dolní spojení transplantátu se žaludkem se obvykle zakládá end-to-side se zadní nebo přední stěnou žaludku podle toho, jak je to anatomicky výhodnější. Kardie se slepě uzavře. Obvykle se dává přednost izoperistaltickému vřazení kličky, ale není vyloučeno ani anizoperistaltické uspořádání, je-li to vhodnější pro cévní stopku a dobré rozvinutí transplantátu. Při náhradě atonického jícnu u pokročilé achalázie vývoj směřoval k subtotální resekci a náhradě celého jícnu s anastomózou vytvořenou na krku. Pak se při náhradě nejčastěji volí koloplastika z levé poloviny kolon. Operační přístup je z horní střední laparotomie a řezu před kývačem vlevo na krku, exstirpace se provádí transhiatálně a transponát se ukládá v zadním mediastinu (viz kap. 11.9.3).
11.9 Výsledky chirurgického léčení
11.9.1 Kritéria hodnocení
Výsledek léčení je nutno posuzovat v dlouhodobém odstupu a léčba by neměla nemocnému přinést pozdní nepříznivé následky, jako je např. gastroezofageální reflux. Velmi důležité musí být hodnocení výsledku léčby podle pokročilosti onemocnění. Zohlednit je třeba frekvenci komplikací a mortalitu užité metody.
Vyhodnocení výsledků jsme v minulosti prováděli u všech nemocných na základě klinického a rentgenologického vyšetření a od roku 1979 i podle manometrického nálezu. Pro zhodnocení úspěšnosti léčby má význam především zlepšení subjektivního stavu nemocného. Na základě pohovoru s nemocným jsme jej hodnotili takto:
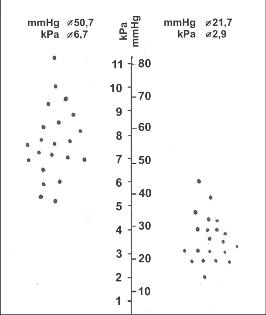
Obr. 24
Klidový tonus DJS u našich nemocných s EKA operovaných na počátku 80. let minulého století před (na grafu vlevo) a po ezofagokardiální myotomii (na grafu vpravo)
Výborný výsledek znamená úplné vymizení subjektivních obtíží, normalizaci hmotnosti a normální společenské a pracovní uplatnění.
Při velmi dobrém výsledku mohou přetrvávat drobnější obtíže, jako nutnost zapíjení některé stravy, zhoršení stavu při psychické a fyzické zátěži. Hmotnost je normální a nemocný není při vhodné úpravě životního režimu nijak společensky a pracovně omezen.
Uspokojivý výsledek je podstatné zlepšení předoperačních obtíží, přetrvává však občasná dysfagie nebo jsou příznaky GER. Došlo ke změně pracovní schopnosti a omezení v osobním životě.
Neuspokojivý výsledek představuje plnou recidivu obtíží nebo výrazné příznaky GER. Jiná situace je při hodnocení rentgenologickém. Za hlavní kritéria úspěšnosti je nutno považovat zlepšení průchodnosti GES a vyprazdňování jícnu. Známkou úpravy stavu je i přítomnost žaludeční bubliny, pokud před operací nebyla prokazatelná. Ve shodě s dřívějšími rentgenologickými studiemi [3, 68] lze očekávat zmenšení dilatace a zlepšení peristaltiky jícnu jen u 50–60 % nemocných, především u I. a II. stadia onemocnění (viz kap. 11.6.3, obr. 5, 6, a kap. 11.7, obr. 8). Závažným nepříznivým nálezem je průkaz významného GER. Manometricky je prokazován po úspěšné operaci pokles tlaku v oblasti DJS (obr. 24) a u počátečních stadií i zlepšení jícnové peristaltiky.
Uvedená kritéria hodnocení výsledku léčby ezofagokardiální achalázie je třeba uplatňovat i u nechirurgických léčebných postupů.
11.9.2 Léčebné výsledky ezogaokardiálních myotomií
V Olomouci byla věnována především zásluhou prof. V. Rapanta a Z. Šerého léčbě ezofagokardiální achalázie velká pozornost [3, 45]. Historickou zajímavostí je, že první operace achalázie byla v Olomouci provedena 17. 6. 1948, dříve než na Mayo klinice v Rochesteru, která se především díky pracím Ellise a jeho spolupracovníků stala po druhé světové válce světovým výzkumným centrem pro toto onemocnění [1]. Nemocní byli průběžně sledováni [3, 68, 69, 75, 124, 125]. Koncem 70. let a začátkem 80. let minulého století byly v Olomouci vyhodnoceny dlouhodobé výsledky chirurgické léčby achalázie. Ze souboru 256 operovaných jsme v roce 1982 mohli posoudit výsledky v odstupu 1 až 27 roků (průměrně 6 let od operace) u 231 nemocných (90 % celého souboru operovaných od roku 1948). Ezofagokardiální myotomie byla provedena u 208 nemocných, u 145 bez antirefluxního výkonu a u 63 v kombinaci s některou antirefluxní operací (nejčastěji Thalovou parciální fundoplikací či Nissen-Rossettiho fundoplikaci). U zbylých operací pro pokročilou či recidivující achalázii se jednalo o anastomózy a resekce. U myotomie bylo výborných a velmi dobrých výsledků dosaženo v 67,6 %, uspokojivých ve 29,6 % a neuspokojivých ve 2,8 %. Perforace sliznice nepřesahovala v našem souboru 4 % a operační letalita byla u myotomie nulová. Z tehdejších našich výsledků vyplynuly tyto důležité závěry [75, 76, 126, 127]:
- Podstatně lepších výsledků bylo dosaženo dlouhou myotomií prováděnou od roku 1967 – 2,8 % neúspěchu proti 23,3 % neúspěchu u myotomie krátké, prováděné před rokem 1967.
- Byly zjištěny zřetelně lepší výsledky u 1. a 2. stadia onemocnění proti stadiu 3.
- O výsledku operace nebylo rozhodnuto již v prvním roce po operaci, ale k podstatnému zhoršení obtíží či plné recidivě někdy došlo až za několik let po primárním výkonu. Nezbytné je proto trvalé sledování těchto nemocných.
- Pooperační gastroezofageální reflux byl nižší po krátké myotomii (1,3 %) a po dlouhé myotomii kolísal mezi 5 až 8 %. Nebylo podstatného rozdílu, byl-li k myotomii připojen antirefluxní výkon.
Od poloviny 80. let minulého století jsme všechny tyto zkušenosti uplatňovali v klinické praxi. V letech 1986 až 1994 jsme na II. chirurgické klinice LF UP a Fakultní nemocnice v Olomouci operovali 49 nemocných s ezofagokardiální achalázií s nulovou operační letalitou. Jedinou změnou v naší operační taktice bylo, že jsme začali dávat přednost přístupu z laparotomie, protože ta byla nemocnými lépe tolerována než torakotomie při možnosti myotomii provést stejně dokonale a bezpečně.
Po získání dostatečných zkušeností s laparoskopickými operacemi se i achalázie začala od poloviny 90. let minulého století operovat laparoskopicky. V období let 1995–1996 bylo laparoskopicky na II. chirurgické klinice v Olomouci operováno 11 nemocných a v dalších letech již otevřený přístup nebyl vůbec indikován [76, 128, 129]. Stejně tak se rozvíjel tento miniinvazivní přístup v léčbě achalázie na I. chirurgické klinice v Olomouci [130, 131, 132]. Vyhodnocení dlouhodobých výsledků laparoskopické myotomie v Olomouci je již úkolem současné generace jícnových chirurgů. Podle práce R. Aujeského, Č. Neorala a spolupracovníků, publikované v roce 2009 [132], provedli v posledních 11 letech laparoskopickou EKM doplněnou Thalovou parciální fundoplikací u 39 nemocných, u 2 byla následně pro pokročilost EKA nutná ezofagektomie a 1 ezofagofundoanastomóza. Pouze 2 operovaní vyžadují po operaci občasnou dilataci, ostatní jsou bez další léčby. Protože se vlastní podstata myotomie nezměnila, lze předpokládat, že dlouhodobé léčebné výsledky by měly být obdobné jako v éře otevřené chirurgie.
V zahraničí již byly publikovány výsledky několikatiletého sledování nemocných po laparoskopické myotomii. V práci Bessella a spolupracovníků z roku 2006 [94] byla hodnocena sestava 167 operovaných s průměrnou dobou sledování 4 roky a v práci Costantiniho a spolupracovníků z roku 2005 [97] byl hodnocen soubor 71 operovaných s průměrnou dobou sledování dokonce 7 roků. V obou případech byla myotomie doplněna Dorovou či Toupetovou semifundoplikací. Frekvence dysfagie byla uváděna v 18–23 % a reflux ve 12–34 %, zpravidla se však nejednalo o závažnou ezofagitidu.
11.9.3 Reoperace a pokročilá achalázie
Indikací k reoperaci po myotomii je především zhoršující se dysfagie a obtíže z GER, které nelze zvládnout konzervativní léčbou. Důvodů, proč primooperace EKA nevedla k úspěchu, může být několik: Původní myotomie byla svým rozsahem a technicky primárně nedostatečná nebo došlo ke srůstu – nežádoucímu zhojení okrajů myotomie. V obou případech je výsledkem nedostatečné zrušení tlakové bariéry mezi jícnem a žaludkem a přetrvávání, respektive recidiva poruchy pasáže GES. Jinou příčinou může být skutečnost, že myotomie byla indikována u příliš pokročilé EKA (dolichomegaezofagus), u níž ani dokonalá myotomie nedokáže zpravidla odstranit v důsledku těžké celkové poruchy funkce jícnu poruchu v pasáži. V prvních dvou stavech může přinést zlepšení technicky správná remyotomie. U pokročilého megaezofagu je pak indikován radikální resekční výkon s náhradou jícnu žaludkem nebo tlustým střevem (koloplastika), a pokud to stav nemocného nedovoluje, mohla by být řešením i paliativní anastomóza. Další příčinou neúspěchu může být pooperační GER. Jeho vznik je před operací obtížné předvídat. V dnešní době je moderní léčbou možno většinou reflux po myotomii zvládnout konzervativní léčbou. V řešení dysfagie může pomoci pooperační dilatace [83], většinou však nemá dlouhodobý efekt.
U nejpokročilejších stadií achalázie, kde se jícen mění v aperistaltický dilatovaný vak, obvykle nelze dosáhnout ezofagokardiální myotomií dobrých výsledků. Podle Ellise a Olsena lze i u nejpokročilejších stadií EKA dosáhnout dobrých výsledků tím, že se aperistaltický jícen, po zlepšení průchodnosti GES myotomií, vyprazdňuje jen gravitací [1]. S tím bohužel nekorespondují zkušenosti naše ani jiných autorů [8, 64, 117, 133, 134, 135]. Přijatelných výsledků jsme myotomií u megaezofagu dosáhli jen u části nemocných. Z těchto důvodů se pozornost obracela jiným směrem a v minulosti byly užívány rozsáhlé resekční a by-passové výkony, jak byly popsány v historickém přehledu operací. Dnes je v těchto případech indikována ezofagektomie.
Většími zkušenostmi s reoperacemi a resekčními výkony u pokročilé EKA disponuje jen málo pracovišt. Na Mayo klinice v Rochesteru bylo v letech 1949–1970 reoperováno 21 nemocných [136]. Z let 1970–1974 uveřejnil Ellis z Lahey kliniky zkušenosti s 11 reoperovanými [137]. Rozsáhlé zkušenosti se 70 reoperovanými uveřejnil Fekete a spolupracovníci [133]. Z novějších prací referuje o zkušenostech s 93 resekcemi jícnu u achalázie z pracoviště Orringera Devaney [138]. V 64 % operovali pro pokročilou achalázii, ve 29 % se jednalo o reoperaci po předchozím neúspěchu myotomie a v 7 % pro refluxní strikturu. Náhradu jícnu prováděli transhiatálně žaludkem, měli 2 pooperační úmrtí a v 71 % výborný pooperační výsledek. Výborné výsledky po resekci a náhradě jícnu levým kolonem u 19 nemocných s achalázií prezentuje Peters [139]. Obdobně v těchto případech doporučují resekci jícnu i další autoři [140, 141]. Volba operační metody musí u reoperací a pokročilých EKA vycházet z individuálního posouzení u každého nemocného, kde je možno volit mezi remyotomií, antirefluxním výkonem a resekcí jícnu s náhradou. Prevencí nutnosti komplikovaných reoperací by měla být včasná, technicky dokonalá myotomie na pracovišti s dostatečnými zkušenostmi a u nejpokročilejšího stadia achalázie zvážení resekčního výkonu již při primooperaci.
Zkušenosti s reoperacemi
V minulosti byly i prof. Rapantem v Olomouci užívány rozsáhlé resekční a by-passové výkony. I když bezprostřední výsledky byly mnohdy slibné [142, 143], pozdější zkušenosti ukázaly závažné důsledky pro nemocné v podobě refluxní ezofagitidy, agastrického syndromu a vzniku megaloblastické anémie. Týká se to především Wangensteenovy resekce, Ellisovy a Allisonovy operace. Do poloviny osmdesátých let minulého století byly u EKA získány poměrně značné zkušenosti s resekcemi jícnu a reoperacemi u achalázie. Bylo reoperováno 43 nemocných, u kterých bylo provedeno 52 výkonů. Čtyři nemocní byli operování primárně, případně i reoperováni jinde. Jednou bylo reoperováno 36 nemocných, dvakrát 5 nemocných a třikrát 2 nemocní. U 15 operovaných byla provedena remyotomie a u 13 nemocných byl přidán antirefluxní výkon pro prokázané známky GER nebo při nejistotě, nepodíli-li se na vzniku dysfagie. Resekce jícnu s náhradou tlustým střevem byla provedena u 8 nemocných, dvakrát bylo k náhradě užito jejunum a čtyřikrát žaludek. Jako paliativní řešení byly u pokročilé EKA založeny ezofagogastroanastomózy spolu s vagotomií a pyloroplastikou či resekcí žaludku u 8 nemocných. Rozsáhlé resekce či by-passové operace byly několikrát užity v 50. letech. Ve skupině reoperovaných jsme měli možnost posoudit dlouhodobé výsledky u 31 nemocných ze 43 operovaných. Odstup od operace byl v průměru 3,5 roku (1–12 roků). Výborných až velmi dobrých výsledků bylo dosaženo u 14 nemocných (45 %), uspokojivých u 15 (48 %) a neuspokojivých u 2 (7 %). Jeden nemocný po operaci zemřel (mortalita reoperací tedy byla 2,3 %). Je samozřejmé, že dosažené výsledky jsou u reoperací vzhledem k rizikovosti nemocných, pokročilosti onemocnění i obtížnosti prováděných výkonů podstatně horší než u primooperací. Poslední zkušenosti z reoperacemi z Olomouce publikoval v roce 1996 Neoral se spolupracovníky [144].
Zkušenosti s léčbou pokročilé achalázie
Pro nemocné jsou méně zatěžující ezofagogastrické anastomózy. V Olomouci byly užity u 24 operovaných. Bezprostředně zbaví nemocné dysfagie, ale jejich následkem je GER. Obtížím z refluxu měla zabránit současná resekce žaludku nebo později vagotomie a pyloroplastika. Ani tyto kombinace operací však reflux nevyloučí, ale sníží jeho nebezpečí a agresivitu. Ze 24 operovaných jsme mohli posoudit výsledek u 15 operovaných. Protože v 50. letech byly tyto spojky indikovány i u mladších lidí, měli jsme při kontrolách v 80. letech minulého století k dispozici i dlouhodobější výsledky. Přestože byl u všech kontrolovaných prokazatelný GER, hodnotilo svůj stav jako výborný 5 nemocných. Tři v odstupu jednoho roku od operace a dva, u nichž byla provedena současná resekce žaludku, v odstupu 20 let. Jako uspokojivý výsledek hodnotilo svůj stav 9 nemocných (u 3 byla současná resekce žaludku) v průměrném odstupu 15 roků od operace. Výraznější dysfagii neměli, ale vyskytovala se u nich různě závažná refluxní symptomatologie, někdy i se známkami krvácení z jícnu. Stav byl vždy zlepšen konzervativní léčbou. U jednoho nemocného byl výsledek neuspokojivý a pro vznik striktury anastomózy musel být po 7 letech reoperován. Podle těchto zkušeností by bylo možno považovat i dnes založení ezofagogastrické anastomózy za oprávněné zejména u starších nemocných, u nichž nemáme jinou volbu. U starších nemocných je agresivita žaludečního sekretu často snížená a nebezpečí z GER zmenšíme ještě současnou vagotomií a pyloroplastikou a následnou konzervativní léčbou. Tento výkon jsme s úspěchem užili ještě u několika starších nemocných v průběhu 80. let minulého století [37] (obr. 25).
Radikální léčba pokročilé EKA spočívá v resekci dilatovaného atonického jícnu a GES. Rekonstrukci pasáže je možno provést pomocí žaludku, tenkého střeva nebo interpozicí pomocí kolon. Taktika, kdy byla dříve prováděna pouze parciální resekce dilatovaného jícnu s interpozicí kratšího úseku kolon (obr. 26), byla později změněna, protože je lepší resekovat a nahradit celý atonický jícen (obr. 27).
Při kontrole operovaných v polovině 80. let minulého století bylo hodnoceno 19 nemocných (126). S výjimkou jednoho sedmdesátiletého muže byl výkon indikován vždy u mladších nemocných s průměrným věkem 35 let. Šestkrát šlo o primooperaci a třináctkrát o reoperaci. Indikací k reoperaci byla vždy dysfagie a u dvou pacientů byl zjištěn vřed, jednou v jícnu po předchozí myotomii a jednou v interponované kličce jejuna po modifikované Wangensteenově operaci provedené na jiném pracovišti. K náhradě jícnu byl 7× užit žaludek, 2× jejunum a 10× levé kolon. Jeden nemocný musel být po transpozici žaludku reoperován po dvou letech pro zúžení ezofagogastrické anastomózy. Doba sledování byla 1 až 27 roků. Výsledky byly hodnoceny jako výborné až uspokojivé v 89 %. Klinická symptomatologie z refluxu byla nevýrazná a při rtg vyšetření byl reflux vybaven jen za užití provokačních manévrů. Výsledky léčby pokročilé achalázie byly hodnoceny a publikovány i v dalších letech [145, 146, 147]. Při hodnocení výsledků náhrad jícnu tlustým střevem u 109 nemocných z let 1980–2005 na I. chirurgické klinice v Olomouci byla tato metoda užita u 6 nemocných s pokročilou achalázií s příznivým výsledkem [148].
11.10 Jaká je optimální léčba EKA
V současnosti existují v léčbě achalázie účinné konzervativní postupy, jako je aplikace botulotoxinu či dilatace jícnu, které se těší stálé oblibě zejména gastroenterologů [149, 150]. Nevýhodou především aplikace botuloxinu je krátkodobý efekt. U dilatace jícnu, metody používané více jak padesát let, je příznivý efekt podstatně delší, ale ani nejnovější studie propagující opakované tzv. on-demand dilatace zatím nedokládají opravdu dlouhodobou úspěšnost této léčby. Prospektivní multicentrická evropská studie z roku 2011, srovnávající laparoskopickou myotomii s dilatací, neshledala po dvou letech mezi oběma metodami signifikantní rozdíl. Po dilataci došlo u 12 % pacientů k natržení sliznice a u 4 % k perforaci. Všechny komplikace byly vyřešeny a nedošlo k žádnému úmrtí [151]. Z dřívějších studií je známo, že úspěšnost dilatace v delším časovém odstupu klesá pod 50 % [82]. Zatím nelze zaujmout stanovisko k perorální endoskopické myotomii, která byla sice publikována již v roce 1980 [152], ale především z obav z proniknutí infekce do mediastina nedoznala rozšíření. Pomocí jehlového nože se přes sliznici protínají cirkulární svalová vlákna v oblasti DJS. V poslední době se znovu objevily zprávy o užití této metody v Japonsku [153], kde byl proveden menší počet výkonů bez komplikací. Výkon vyžaduje stejně jako laparoskopie celkovou anestezii, časově je stejně náročný a vyhodnocení výsledků u většího počtu nemocných zatím není. Naproti tomu laparoskopická myotomie je v rukou zkušeného laparoskopického chirurga miniinvazivní metodou s morbiditou a mortalitou blížící se nule. Jde o jednodobé řešení s dlouhodobým výborným až uspokojivým výsledkem léčby, s výjimkou nejpokročilejšího stadia choroby, v 90 %. Myotomii není zpravidla třeba doplňovat antirefluxním výkonem. U nejpokročilejších stadií achalázie je dnes indikována ezofagektomie.
Volba léčebného postupu musí u každého nemocného vycházet z vysoce individuálního posouzení všech okolností. Není-li kontraindikace k operaci, jeví se laparoskopická ezofagokardiální myotonie jako optimální primární léčba s dlouhodobým příznivým efektem. Konzervativní terapie je pak vhodná pro starší a rizikové nemocné a pro pacienty odmítající operaci.
Literatura
- Ellis FH Jr, Olsen AM. Achalasia of the esophagus. Philadelphia: WB Saunders; 1969.
- Hurst AF, Rake GW. Achalasia of the cardia (so-called cardiospasm). Quart J Med. 1930;23:491–508.
- Šerý Z, Doubravský J, Dvořáček Č. Naše zkušenosti s léčbou tzv. idiopatické dilatace jícnu. Státní zdravotnické nakladatelství Praha; 1953.
- Smith B. The neurological lesion in achalasia of the cardia. Gut. 1970;11:388–391.
- Cassella RR, Brown AL Jr, Sayre GP, Ellis FH Jr. Achalasia of the oesophagus: Pathologic and etiologic considerations. Ann Surg. 1964;160:474–486.
- Elder JB, Gillespie G. The vagus and achalasia. Gut.1969;10:1045.
- Brasil A. Aperistalsis of the oesophagus. Rev Brasil Gastroent. 1955;7:21–44.
- Ferraz EM, Bacelar TS, Filho HAF, Lacerda CM, De Souza AP, Kelner S. Advanced Megaesophagus with Recurrent Dysphagia Following Initial Surgical Treatment. Int Surg. 1982;67(2):111–113.
- Ximenes M III. Surgical options in the treatment of the Chagas’ achalasia. Rev Saude DF. 2001;12:5.
- Greenwood RK, Schlegal JF, Code CF, Ellis FH Jr. The effect of sympathectomy, vagotomy and esophageal interruption of the canine gastro-esophageal sphincter. Torax. 1962;17:310–318.
- Binder HJ, Bloom DL, Stern H. The effect of cervical vagotomy on esophageal function in the monkey. Surgery. 1968;64:1075–1083.
- Butterfield WC, Massi J. Gastric reflux in colon interposition. J Thorac Cardiovasc Surg. 1972;64(2):222–234.
- Mann CV, Hardcastle JD. The effect of vagotomy on the human gastro-esophageal sphincter. Gut. 1968;9:688–695.
- Clifford DH, Pirsch JG, Mauldin ML. Comparison of motor nuclei of the vagus nerve in dogs with and without esophagel achalasia. Proc Soc exp Biol (N.Y.). 1973;142:878–882.
- Okamoto E, Iwasaki T, Kakutani T, Ueda T. Selective destruction of the myenteric plexus: Its relation to Hirschsprung’s disease, achalasia of the esophagus and hypertrophic pyloric stenosis. J Pediat Surg. 1967;2:444–454.
- Erlam RJ, Schlegel JF, Ellis FH Jr. Effect of ischemia of lower esophagus and esophagogastric function on carina esophageal motor function. J Thorac Cardiovasc Surg. 1967;54:822–831.
- Csendes A, Smok G, Braghetto I, et al. Gastroesophageal sphincter pressure and histological changes in distal esophagus in patients with achalasia of the esofagus. Dig Dis Sci. 1985;30:941.
- Csendes A, Smok G, Braghetto I, et al. Histological studie sof Auerbach’s plexus of the esophagus, stomach, jejunum, and colon in patiens with achalasia of the esophagus: correlation with gastric acid secretion, presence of parietal cells and gastrin emptying of solids. Gut. 1992;33:150.
- Cash BD, Wong RK. Historical perspective of achalasia. Gastrointest Endosc Clin N Am. 2001;11:221.
- Cohen S, Lipshutz W. Lower esophageal sphinceter dysfunction in achalasia. Gastroenterology. 1972;61:814–820.
- Dlouhý M, Duda M, Minařík L. Přínos jícnové manometrie pro chirurgii esofagogastrického spojení. Čs Gastroent Výž. 1982;36(8):411–414.
- Hietman P, Espinoza J, Csendens A. Physiology of the distal esophagus in achalasia. Scand J Gastroent. 1969;4:1–11.
- Shi G, Ergun GA, Manka M, Kahrilas PJ. Lower esophageal sphincter relaxation characteristics using a sleeve sensor in clinical manometry. Am J Gastroenterol. 1998;93:2373.
- Staiano A, Clouse RE. Detection of incomplete lower esophageal sphincter relaxation with conventional point-pressure sensors. Am J Gastroenterol. 2001;96:3258.
- Eckardt VF, Aingherr C, Bernhard G. Predictors of outcome in patients with achalasia treated by pneumatic dilatation. Gastroenterology. 1992;103:1732.
- Siewert RJ, Blum AL, Waldeck F, eds. Funktionsstörungen der Speiser hre. Berlin, Heidelberg, New York: Springer-Verlag; 1976.
- Cassela RR, Ellis FH Jr, Brown AL. Fine-structure changes in achalasia of the oesophagus. I. Vagus nerves. Ann Intern Med. 1975;83(3):390–401.
- Goyal RK, Mukhopadhyay A, Rattan S. Effects of prostaglandin E2 on the lower esophageal sphincter in normal subjects and patients with achalasia. Clin Res. 1974;22:358 (Abstrakt).
- Stein DT, Knauer CM. Achalasia in monozygotic twins. Dig Dis Sci. 1982;77:636.
- Bosher LP, Shaw A. Achalasia in siblings. Clinical and genetic aspects. Am J Dis Child. 1981;135:709.
- Frieling T, Berges W, Borchard F, et al. Family occurrence of achalasia and diffuse spasm of the oesophagus. Gut. 1988;29:1595.
- Eckrich JD, Winans CS. Discordance for achalasia in identical twins. Dig Dis Sci. 1979;24:221.
- Howard PJ, Maher L, Pryde A, et al. Five years prospective study of the incidence, clinical features, and diagnosis of achalasia in Edinburgh. Gut. 1992;33:1011.
- Stein CM, Gelfand M, Taylor HG. Achalasia in Zimbabwean blacks. S Afr J. 1985;67:261.
- Mayberry JF. Epidemiology and demographics of achalasia. Gastrointest Endosc Clin N Am. 2001;11:235.
- Harley HRS. Achalasia of the Cardia. Bristol: Wright; 1978.
- Duda M, Šerý Z, Dlouhý M, Gazárek F, Roček V, Řehulka M. Zur problematik der chirurgischen Behandlung von Funktionsstörungen der Speiseröhre im Alter. Chirurg. 1983;54(8):527–532.
- Burgetová O, Duda M, Šerý Z. Symptomatologie jícnových onemocnění. Čas Lék čes. 1984;123(32):983–988.
- Tachovsky TJ, Lynn HB, Ellis FH Jr. The surgical approach to esophageal achalasia in children. J Pediat Surg., 1968;3:226–231.
- Plummer HS. Cardiospasm. With a report of forty cases. JAMA. 1908;51:549–554.
- Adams CWM, Brin RHF, Ellis FG, Kauntze R, Trounce JR. Achalasia of the cardia. Guy Hosp Rep. 1961;110:191–236.
- Olsen AM, Holmann CB, Andersen HA. The diagnosis of cardiospasm. Dis Chest. 1953;23: 477–497.
- Sanderson DR, Ellis FH Jr, Schlegel JF, Olsen AM. Syndrome of Vigorous Achalasia: Clinical and Physiologic Observations. Dis Chest. 1967;52(4):508–517.
- Duda M, Šerý Z, Gazárek F, Dlouhý M, Roček V, Řehulka M, Burgetová O. Klinický obraz a diferenciální diagnostika ezofagokardiální achalazie. Čs Gastroent Výž. 1984;38(7–8):361–368.
- Rapant V. Achalasie jícnu. In: Mařatka Z, editor. Pokroky v gastroenterologii. Praha: Avicenum Zdravotnické nakladatelství; 1975.
- Wienbeck M, Heitmann P. Die pneumatische Dilatation zur Behandlung der Achalsia der Speiseröhre. Dtsch Med Wschr. 1973;98:814–825.
- Andersen HA, Holman CB, Olsen AM. Pulmonary complications of cardiospasm. J Amer Med Ass. 151:608–612.
- Seliger G, Lee T, Schwartz S. Carcinoma of the proximal esophagus. A complication of long standing achalasia. Amer J Gastroent. 1972;57:20–25.
- DiBaise JK, Quigley EMM. Tumor-related dysmotility: gastrointestinal dysmotility syndromes associated with tumors. Dig Dis Sci. 1998;43:1369.
- Rapant V, Šerý Z, Doubravský J, Dvořáček Č. Zwei Fälle von Speiseröhrenkrebs bei gleichzeitiger vorgeschrittener idiopathischer Speiseröhrendilatation. Zbl Chir. 1956;81:2355–2366.
- Šerý Z, Dvořáček Č, Doubravský J. Mnohotný karcinom v idiopaticky dilatovaném jícnu. Čas Lék čes. 1953;92(17):464–467.
- Lortat-Jacob JL, Richard CA, Fekete F, Testart J. Cardiospasm and esophageal carcinoma: Report of 24 cases. Surgery. 1969;66:969–975.
- Spechler SJ, Castell DO. Classification of esophagel motility abnormalities Gut. 2001;49:145.
- Patti MG, Gorodner MV, Galvani C, et al. Spectrum of esophageal motility disorders: implications for diagnosis and treatment. Arch Surg. 2005;140:442–449.
- Goldenberg SP, Burrel M, Fette GG, et al. Classic et vigorous achalasia: a comparison of manometric, radiographic, and clinical findings. Gastroenterology. 1991;101:743.
- Moersch HJ, Campt JD. Diffuse spasm of the lower part of the esophagus. Ann Otol. 1934;43:1165–1173.
- Storr M, Allescher HD, Rosch T, et al. Treatment of symptomatic diffuse esophageal spasmby endoscopic injection of botulinum toxin: a prospective study with long-term follow-up. Gastrointest Endosc. 2001;54:754.
- Ellis FH Jr, Olsen AM, Schlegel JF, Code CF. Surgical treatment of esophageal hypermotility disturbances. J Amer Med Ass. 1964;188:861.
- Eypasch EP, DeMeester TR, Klingman RR, Stein HJ. Physiologic assessment and surgical management of diffuse esophageal spasm. J Thorac Cardiovasc Surg. 1992;104:859–868.
- Di Marino AJ, Cohen S. Characteristic of lower esophageal sphicter function in symptomatic diffuse esophageal spasm. Gastroenterology. 1974;6:1–6.
- Moersch HJ, Code CF, Olsen AM. Dyschalasia of the esophagus. Coll Papers Mayo Clin. 1957;49:19–27.
- Code ChF, Schlegel JF, Kelley ML Jr, Olsen AM, Ellis FH Jr. Hypertensive gastroesophageal sphincter. Proc Staff Meet Mayo Clin. 1960;35:391–399.
- Bassotti G, Alunni G, Cocchieri M, et al. Isolated hypertensive lower esophageal sphincter. Clinical and manometric aspects of an uncommon esophagel motor disorder. J Clin Gastroenterl. 1992;14:285.
- Belsey R. Functional diseases of the esophagus. J Thorac Cardivoasc Surg. 1966;52(2):164–188.
- Liu W, Fackler W, Rice TW, et al. The pathogenesis of pseudoachalasia: a clinicopathologic study of 13 cases of a rare disorder. Am J Surg Pathol. 2002;26:784.
- Rossetti M. Achalasie de Ösophagus – Operative behandlung mit abdominaler Myotomie un Fundoplikationen. Zbl Chir. 1978;103(18):1180–1187.
- Ruland L, Sailer R, Günther D. Die Achalasie der Speiseröhre Frühund Spätergebnisse der Dehnungsbehandlung und der operativen Verfahren. Zbl Chir. 1981;106(16):1081–1089.
- Harašta M, Doubravský J, Rapant V. Zhodnocení Hellerovy operace u achalasie jícnu. Acta Univ Olomuc Fac Med. 1963;32:153–158.
- Šerý Z, Hiklová D, Doubravský J. Výsledky transthorakální esofagomyotomie u 40 nemocných s idiopatickou dilatací jícnu. Čs Gastroent Výž. 1957;11(4):276–281.
- Merendino KA, Varco RL, Wangesteen OH. Displacement of the esophagus into a new diaphragmatic orifice in the repair of para-esophageal and esophageal hiatus hernia. Ann Surg. 1949;129(2):185–197.
- Steichen FM, Heller E, Ravitch MM. Achalasia of the Esophagus. Surgery. 1960;47(5):846–876.
- Heller E. Extramuköse Cardioplastik beim chronischen Cardiospasmus mit Dilatation des Oesophagus. Mitt Grenzgeb Med Chir. 1913;27:141–149.
- Zaaijer JH. Cardiospasm in the aged. Ann Surg. 1923;77(5):515–617.
- Ellis FH Jr, Kiser JC, Schlegal JF, Earlam RJ, McVey JL, Olsen AM. Esophagomyoto- my for esophageal achalasia: Experimental, clinical and manometric aspects. Ann Surg. 1967;166(4):640–645.
- Šerý Z, Dlouhý M, Gazárek F, Duda M, Roček V, Řehulka M. Naše zkušenosti s chirurgickým léčením achalasie jícnu u 250 nemocných. Čs Gastroent Výž. 1982;36():243–254.
- Duda M. Ezofagokardiální achalazie. V: Duda M, Czudek S. Mininvazivní chirurgie. Třinec: Nemocnice Podlesí; 1996. s. 85–92.
- Olsen AM, Harrington SW, Moerch HJ, Andersen HA. The treatment of cardiospasm: Analysis of a twelve – year experience. J Thorac Cardiovasc Surg. 1951;22:164–187.
- Roček V, Duda M, Řehulka M, Doubravský J, Burgetová O. Diagnostika a léčba perforací jícnu. Čs Gastroent Výž. 1983;37(1):15–24.
- Vantrappen G, Hellemans J, editors. Diseases of the Esophagus. Berlin, Heidelberg, New York: Springer-Verlag; 1974.
- Eckard VF, Aignherr C, Bernard G. Predictors of outcome in patiens with achalasia treated by pneumatic dilatation. Gastroenterology. 1992;103:1732.
- Spiess AE, Kahrilas PJ. Treating achalasia: from whalebone to laparoskope. JAMA. 1998;280:638.
- West RL, Hirsch DP, Bartelsman JF, et al. Long term results of pneumatic dilatation in achalasia followed for more than 5 years. Am J Gastroent. 2002;97:1346.
- Sabharwal T, Cowling M, Dussek J, et al. Balloon dilatation for achalasia of the cardia: experience in 76 patients. Radiology. 2002;224:719.
- Ferguson MK, Reeder LB, Olak J. Results of myotomy and partial fundoplication after pneumatic dilatation for achalasia. Ann Thorac Surg. 1996;62:327.
- Dolan K, Zafirellis K, Fountoulakis A, et al. Does pneumatic dilatation affect outcome of laparoscopic cardiomyotomy? Surg Endosc. 2002;16:84.
- Pasricha PJ, Ravich WJ,Hendrix TR, et al. Treatment of achalasia with intrasphincteric injection of botulinum toxin. A pilot trial. Ann Intern Med.1994;121:590.
- Neubrand M, Scheurlen C, Schepke M, et al. Long-term results and prognostic factors in the treatment of achalasia with botulinum toxin. Endoscopy. 2002;34:519.
- Zaninotto ZG, Costantini M, Portale G, et al. Etiology, diagnosis and tretment of failures after laparoscopic Heller myotomy for achalasia. Ann Surg. 2002;235:186–192.
- Raftopoulos Y, Landreneau RJ, Hayetian F, et al. Factors affecting quality of life after minimaxy invasive Heller myotomy for achalasia. J Gastrointest Surg. 2004;8:233–239.
- Deb S, Deschamps C, Allen MS, et al. Laparoscopic esophageal myotomy fo achalasia: Factors affecting functional results. Ann Thorac Surg. 2005;80:1191–1194.
- Perrone JM, Frisella MM, Desai KM, et al. Results of laparoscopic Heller-Toupet operation for achalasia. Surg Endosc. 2004;18:1565–1571.
- Cuschieri A, Buess G. Introduction and Historical Aspects. In: Cuschieri A, Buess G, Perissat J, editors. Operative Manual of Endoscopic Surgery. Berlin-Heidelberg-New York: Springer Verlag; 1992.
- Ramacciato G, Mercantini P, Amodio PM, et al. The laparoscopic approach with antireflux surgery is superior to the thoracic approach for the treatment of esophageal achalasia. Experience of a single surgical unit. Surg Endosc. 2002;16:1431.
- Bessell JR, Lally CJ, Schloithe A, et al. Laparoscopic cardiomyotomy for achalasia: Long-term outcomes. Aust NZ J Surg. 2006;76:558–562.
- Bloomston M, Rosemurgy A. Selective application of fundoplication during laparoscopic Heller myotomy ensures favorable outcomes. Surg Laparosc Endosc Percutan Techn. 2002;5:309–315.
- Bonatti H, Hinder RA, Klocker J, et al. Long-term results of laparoscopic Heller myotomy with partial fundoplication for traetment of achalasia. Am J Surg. 2005;190:883–887.
- Costantini M, Zaninotto G, Guirroli E, et al. The laparoscopic Heller-Dor operation remains and effective treatment for esophagel achalasia a minimum 6-years folow-up. Surg Endosc. 2005;19:345–351.
- Hunter J, Trus TL, Branum GD, et al. Laparoscopic Heller myotomy and fundoplication for achalasia. Ann Surg. 1997;225:655–665.
- Kchajanchee Y, Kanneganti S, Leatherwood AEB, et al. Laparoscopic Heller myotomy with Toupet fundoplication: outcomes predictors in 121 consecutive patiens. Arch Surg. 2005;140:827–834.
- Rice TW, McKelvey AA, Richter JE, et al. A physiologic clinical study of achalasia: could Dor fundoplication be added to Heller myotomy? J Thorac Cardiovasc Surg. 2005;130: 1593–1600.
- Richards W, Torquati A, Holzman MD, et al. Heller myotomy versus Heller myotomy with Dor fundoplication for achalasia: a prospective randomized double-blind clinical trial. Ann Surg. 2004;240:405–415.
- Rossetti G, Brusciano L, Amato G, et al. A total fundoplication is not an obstacle to esophagel emptying after Heller myotomy for achalasia: results of long-term follow up. Ann Surg. 2005;241:614–621.
- Torquati A, Lutfi R, Khaitan L, et al. Heller myotomy vs. Heller myotomy plus Dor fundoplication: cost-utility analysis of a randomized trial. Surg Endosc. 2006;20:389393.
- Wright AS, Williams CW, Pellegrini CA, et al. Long-term outcomes confirm the superior efficacy of extended Heller myotomy with Toupet fundoplication for achalasia. Surg Endosc. 2007;21:713–718.
- Šmejkal O, Pazdro A, Smejkal M, Polanecký O. Operace achalazie jícnu-možné komplikace. Rozhl Chir. 2001;80(6):283–286.
- Kala Z, Procházka V, Marek F, Dolina J, Hep A, Kroupa R. Laparoskopická Hellerova operace. Rozhl Chir. 2006;85(7):357–360.
- Hawthorne HR, Frobse AS, Nemir P Jr. The surgical management of achalasia of the esophagus. Ann Surg. 1956;144(4):653–666.
- Jezioro Z, Piegza S, Misterka S. Chirurgiczne leczenie wpustu sposobom Hellera v odmianie Jezioro. Pol Przegl Chir. 1966;3:153–157.
- Lortat-Jacob JL, Binet JP, Maillard JN. La prévention des hémorragies digestives apres opération de Heller. Ass Franç Chir. 1956;58:162–164.
- Dor J, Humert P, Paoli JM, Noirclerc M, Aubert J. Traitement du reflux par la technique dite de Heller-Nissen modifiée. Presse méd. 1967;50:2563–2565.
- ekler J, Lhotka J. Modified Heller procedure to prevent postoperative reflux esophagitis in patients with achalasia. Am J Surg. 1967;113(2):251–254.
- Petrovsky BV. Cardiospasm and its surgical correction. Ann Surg. 1962;155(1):60–71.
- Hatafuku T, Maki T, Thal AP. Fundic patch operation in the treatment of advanced achalasia of the esophagus. Surg Gynecol Obst. 1972;134:617–642.
- Wright AS, Williams CW, Pellegrinii CA, et al. Long-term outcomes confirm the superior efficacy of extended Heller myotomy with Toupet fundoplication for achalasia. Surg Endosc. 2007;21:713–718.
- Lyass S, Thoman D, Steiner JP, et al. Current status of an antireflux procedure in laparoscopic Heller myotomy. Surg Endosc.2003;17:554–558.
- Finley C, Clifton J, Yee J, et al. Anteriorfundoplication decreases esophageal clearence in patiens undergoing Heller myotomy for achalasia. Surg Endosc.2007;12:2178–2182.
- Ciaglia P, Segal G. Segmental oesophagectomy. Ancillary procedure for advanced megaoesophagus with sigmoid elongation. J Thorac Cardiovasc Surg. 1962;44:44–50.
- Herfarth Ch, Mattes P, Heil Th. Die Oesophagus-Myoplicatur in der Behandlung der dekompensierten Achalasie. Chirurg. 1979;50(11):681–685.
- Grob M. Hiatushernien im Kindesalter. Langenbecks Arch Klin Chir. 1968;322 (Kongressbericht):370–378.
- Petersson GB, Bombeck CT, Nyhus IM. Influence of Hiatal Hernia on Lower Esophageal Sphincter Function. An Experimental Study. Ann Surg. 1981;193(2):214–220.
- Imre JM. Behandlung der Komplikationen des Refluxsyndroms und des sekundären Brachyösophagus. Zbl Chir. 1979;104(16):1040–1044.
- Belsey R. Reconstruction of the esophagus with left colon. J Thorac Cardiovasc Surg. 1965;49(1):33–55.
- Belsey R. Surgical treatment of gastro-oesophageal reflux and its complications. Acta Univ Olomus Fac Med. 1974;71:23–32.
- Rapant V, Králík J. Heller’s radical myotomy in the treatment of achalasia of the oesophagus. Bull Soc Intern Chir. 1968;27(6):656–662.
- Rapant V, Králík J. Thalova operace a její výsledky u pokročilých achalazií jícnu, stenózy dolního jícnu a refluxní ezofagitidy. Bratisl Lék Listy.1969; 51(2):129–140.
- Duda M. Chirurgische Behandlung der Funktionsstörungen der Speiseröhre. Olomouc: Univerzita Palackého v Olomouci; 1984.
- Šerý Z, Duda M, Gazárek F, Dlouhý M, Roček V, Řehulka M, Burgetová O. Myotomie v léčbě ezofagokardiální achalazie. Rozhl Chir. 1987;66(3):154–162.
- Duda M, Dlouhý M, Gryga A, Köcher M. Možnosti laparoskopických a torakoskopických operací v chirurgii jícnu a žaludku. In: Říha V, et al., editor. Endoskopická chirurgie. Sborník prací III. celostátní konference o laparoskopické chirurgii; 22.–23. 4. 1994; Benešov u Prahy. p. 74–79.
- Loveček M, Gryga A, Herman J, Švach I, Duda M. Peroperační diagnostické metody při operaci achalázie jícnu. První zkušenosti. Rozhl Chir. 2003;82(11):577–579.
- Aujeský R, Král V, Kojecký Z, Neoral Č. Současné možnosti léčby achalázie jícnu. Rozhl Chir. 2000;79(3):99–100.
- Neoral Č, Aujeský R. Miniinvazivní chirurgie v horních partiích GIT: state of the art. Miniinvaz Chir Endoskop Chir Súčasnosti. 2006;10(3+4):5–7.
- Aujeský R, Neoral Č, Král V, Dlouhý M, Vrba R, Vomáčková K. Achalázie jícnu z pohledu chirurga. Endoskopie. 2009;18(2):72–76.
- Fekete F, Breil PH, Tossen JC. Reoperation after Heller’s Operation for Achalasia and the Motility disorders of the Esophagus: A Study of Eighty-One Reoperations. Int Surg. 1982;67(2):103–110.
- Nemir P, Fallahnejad M, Bose B, Jakobowitz D, Frobese AS, Hawthorne HR. A Study of the Causes of Failure of Esophagocardiomyotomy for Achalasia. Am J Surg. 1971;121(2):143–149.
- Palmer ED. Treatment of Achalasia when the Heller operation has failed. Am J Gastroenterology. 1972;57:255–260.
- Patrick DL, Payne WS, Olsen AM, Ellis FH Jr. Reoperation for Achalasia of the Esophagus. Arch Surg. 1971;103:122–128.
- Ellis FH Jr, Gibb SP. Reoperation after esophagomyotomy for achalasia of the esophagus. Am J Surg. 1975;129:407–412.
- Devaney EJ, Lannettoni MD, Orringer MB, et al. Esophagectomy for achalasia: patient selection and clinical experience. Ann Thorac Surg. 2001;72:854.
- Peters JH, Kauer WK, Crookes PF, et al. Esophageal resection with colon interposition for end-staged achalasia. Arch Surg. 1995;130:632.
- Miller LS, Allen MS, Trastek VF, et al. Esophageal resection for recurrent achalasia. Ann Thorac Surg. 1995;60:922.
- Banbury MK, Rice TW, Goldblum JR, et al. Esophagectomy with gastrin reconstruction for achalasia. J Thorac Cardiovasc Surg. 1999;117:1077.
- Rapant V, Šerý Z, Doubravský J. Surgery of advanced idiopathic dilatations of the esophagus. Surgery. 1957;41(4):529–541.
- Tomšů M, Doubravský J, Harašta M, Rapant V. Chirurgie pokročilých achalasií jícnu. Acta Univ Olomuc Fac Med. 1963;32:159–164.
- Neoral Č, Jezdinská V, Král V, Aujeský R. Reoperace po Hellerově myotomii. Bratisl lek Listy. 1996;97(12):726–729.
- Králík J, Duda M. Etiopatogenetická terapie pokročilé achalázie jícnu. Čs Gastroent Výž. 1992;46(2):81–87.
- Králík J, Neoral Č. Die Resektionstherapie der fortgeschrittenen Achalasie der Speiseröhre. Biomed Pap Med Fac Palacky Univ Olomouc. 1992;131:343–352.
- Králík J, Dušková M, Dušek J, Neoral Č. Ezofagektomie bez torakotomie pro pokročilou achalázii jícnu. Rozhl Chir. 1994;73(2):51–58.
- Neoral Č, Aujeský R, Král V. Náhrada jícnu tlustým střevem – zkušenosti se 109 případy. Rozhl Chir. 2010;89(12):740–745.
- Martínek J, Špičák J. A modified method of botulinum toxin injection in patiens with achalasia: a pilot trial. Endoscopy. 2003; 35(10):841–844.
- Veselini E, Jarčuška P, Zakuciova M, Gombošova L, Janičko M. Liečba achalázie – súčasný prístup a vlastné zkušenosti. Gastroent Hepatol. 2012;66(2):116–124.
- Boeckxstaens GE, Annese V, de Varannes SB, et al. Pneumatic dilatation versus laparoscopic Heller’s myotomy for idiopathic achalasia. N Engl J Med. 2011;364(19):1807–1816.
- Ortega JA, Madureri V, Perez L. Endoscopic myotomy in the treatment of achalasia. Gastrointest Endosc. 1989;26(1):8–10.
- Inoue H, Minami H, Kobayashi Y, et al. Peroral endoscopic myotomy (POEM) for esophageal achalasia. Endoscopy. 2010;42(4):265–271.