9 Různé
MEDIKAMENTÓZNÍ TERAPIE PO CÉVNĚCHIRURGICKÝCH VÝKONECH A PO ENDOVASKULÁRNÍCH INTERVENCÍCH
Nemocní, kteří podstoupili výkon na cévním řečišti, vyžadují následnou optimalizovanou léčbu, která by měla modifikovat nebo eliminovat kardiovaskulární rizikové faktory, a tím preventivně ovlivnit progresi základního většinou aterosklerotického onemocnění. Doporučená léčba vychází z definicí American Heart Association a Evropské společností pro kardiologii. Je přihlédnuto k poznatkům vyplývajícím ze systematických literárních rešerší.
KARDIOVASKULÁRNÍ RIZIKOVÉ FAKTORY A JEJICH KONTROLA
- Léčba hyperlipidemie
Je indikována terapie statiny. Hladina LDL-cholesterolu by měla být pod 2,58 mmol/l. U nemocných s vysokým kardiovaskulárním rizikem je snaha dosáhnout hladiny pod 1,81 mmol/l. U nemocných s nízkou hladinou HDL cholesterolu, normálním LDL-cholesterolem a se zvýšenou hladinou triglyceridů je indikována současná terapie fibráty. - Léčba hypertenze
Pomocí antihypertensiv je třeba zajistit normotenzi 140/90 mm Hg u běžných nemocných. U diabetiků a u nemocných s chronickou ledvinnou nedostatečností je třeba upravit TK pod 130/80 mm Hg. Tatokorekce snižuje riziko infarktu myokardu, cévních mozkových příhod a srdečního selhání. Betablokátory nejsou kontraindikovány u nemocných s uzávěry periferního arteriálního řečiště. ACE blokátory lze použít u nemocných se symptomatickou i asymptomatickou formou onemocnění. - Léčba diabetes mellitus
Cílem antidiabetické léčby je dosáhnout hladinyHbA1C pod 7%. - Nikotinismus
Nemocní by se měli vzdát kouření. Je třeba využít možností odvykacích kůr a medikamentózních náhrad nikotinu. - Ovlivnění hladiny homocysteinu
Efektivita redukce hladiny homocysteinu pomocí kyseliny listové a vitaminu B12 nebyla u nemocných s aterosklerózou prokázána. - Antiagregační a perorální antikoagulační léčba
Efektivita antiagregační terapie je prokázána u sekundárních vaskulárních komplikací, jako jsou srdeční infarkt, cévní mozková příhoda nebo úmrtí z cévních příčin. Za vhodná antiagreganci a se považují kyselina acetylsalicylová v dávce 75–325 mg/den (většinou 100 mg/den) nebo alternativně clopidogrel v dávce 75 mg/den. Použití perorální antikoagulační léčby (antagonisté vitamínu K) se k profylaxi obecně nedoporučuje. - Obecná perioperační medikace (antiagregace, betablokátory, statiny)
Léčba kyselinou acetylsalicylovou se nemusí perioperačně přerušit. Doporučuje se vysadit léčbu clopidogrelem nejméně 1 týden před výkonem pro zvýšenou krvácivost. Je možnost převedení nemocných na kyselinu acetylosalicylovou. U nemocných s plánovaným chirurgickým výkonem na arteriálním řečišti pro aterosklerotické onemocnění se doporučuje nejméně 1 týden před výkonem nasadit betablokátory (tzv. peroperačně), které minimalizují riziko peroperační kardiální ischemie. To neplatí pro nemocné s absolutní kontraindikací k léčbě betablokátory. U nemocných s plánovaným chirurgickým výkonem na arteriálním řečišti pro aterosklerotické onemocnění se doporučuje nejméně 1 měsíc před výkonem (tzv. peroperačně) nasadit statiny. Jejich podání nesouvisí s hladinou cholesterolu v séru.Tato terapie minimalizuje riziko peroperační kardiální komplikace.
ANTIAGREGAČNÍ, ANTIKOAGULAČNÍ LÉČBA PO CÉVNĚ CHIRURGICKÝCH VÝKONECH A PO ENDOVASKULÁRNÍCH INTERVENCÍCH.
- Větve oblouku aorty (krkavice, subklavie, truncus brachiocephalicus, vertebrální a brachiální arterie)
- A. carotis – endovaskulární léčba: po ošetření karotické stenózy cestou PTA a stentu se doporučuje léčba kyselinou acetylsalicylovou a clopidogrelem. Terapie clopidogrelem začíná před výkonem, nejpozději den před výkonem tzv. loading dose 300 mg (potom 75 mg/den) a následně se po 4–12 týdnech vysazuje. Terapie kyselinou acetylsalicylovou je celoživotní.
- A. carotis – chirurgická léčba: po karotické endarterektomii je indikována celoživotní antiagregační léčba. Není však zřejmá optimální dávka kyseliny acetylsalicylové (resp. žádná studie ji nedefinovala).
- A. subclavia, truncus brachiocephalicus, a. vertebralis, a. brachialis – endovaskulární léčba: specifické doporučení terapie během endovaskulárního výkonu a po výkonu nelze vyslovit, protože nejsou k dispozici dostatečná data. Obecně lze doporučit trvalou léčbu kyselinou acetylsalicylovou s eventuálním krátkodobým doplněním clopidogrelem.
- A. subclavia, truncus brachiocephalicus, a. vertebralis, a. brachialis – chirurgická léčba: také pro chirurgickou léčbu nejsou dostatečné podklady. Lze použít zkušeností z chirurgie dolních končetin a doporučit po trombendarterektomii a po aloplastickém bypassu antiagregační léčbu. Po založení žilního bypassu lze doporučit perorální antikoagulační léčbu.
- Aorta (hrudní a břišní), včetně viscerálních a pánevních větví – endovaskulární léčba: doporučuje se trvalá antiagregační terapie, ev. výhody antikoagulační léčby nebyly prokázány.
- Aorta (hrudní a břišní), včetně viscerálních a pánevních větví – chirurgická léčba: doporučuje se trvalá antiagregační terapie, ev. výhody antikoagulační léčby nebyly prokázány.
- Infrainguinální výkony – endovaskulární: infrainguinální PTA se nebo bez stentu vyžaduje celoživotní terapii kyselinou acetylsalicylovou (75–325 mg/den). Při aplikaci stentu je vhodná 4–12týdenní terapie clopidogrelem. Předmětem výzkumu je otázka, zda dlouhodobé podávání clopidogrelu má význam v prevenci restenóz.
- Infrainguinální výkony – chirurgické: po trombendarterectomii v infrainguinální oblasti je indikována trvalá léčba kyselinou acetylsalicylovou. Žilní infrainguinální bypass je spojen s podáváním perorální antikoagulační terapie (pokud není z jiného důvodu zásadní kontraindikace). Studiemi je prokázáno, že antikoagulační terapie má lepší výsledky z hlediska uzávěru bypassu než terapie antiagregační. Také ostatní vaskulární komplikace se vyskytují v menším rozsahu. Cílová hladina INR je 3,0–4,5. Léčba se považuje za výhodnou i při zřejmém vysokém riziku krvácení. Není jasný ev. přínos kombinované léčby antiagregační a antikoagulační z hlediska průchodnosti bypassu a progrese základního onemocnění. U alloplastických bypassů je indikována terapie antiagregační. U bypassů pomocí umělých cévních náhrad, které mají lumen menší než 6 mm, má kombinovaná terapie perorálními antikoagulanciemi s antiagreganciemi pozitivní vliv na průchodnost bypassu. Je však vysoké riziko krvácení a zvyšuje se mortalita. Indikace k této kombinované terapii se řeší individuálně – je třeba srovnat riziko uzávěru bypassu a riziko krvácení.
CÉVNÍ NÁHRADY
AUTOLOGNÍ ŽÍLA
Její použití je metodou volby při rekonstrukcích v infrainguinální oblasti. Úseky žíly se po jejich rozstřižení používají k uzávěru arteriotomií (záplata – patch). K náhradě se používá v. saphena magna, v. saphena parva a v. cephalica. V rekonstrukční cévní chirurgii infikovaných cévních protéz se používá femorální žíla (v. femoralis superficialis).Použitá žíla musí mít adekvátní kvalitu a kalibr. K vyloučení postflebitických změn a varixů se předoperačně vyšetřuje žilní řečiště pomocí barevné duplexní sonografie.Při odběru žíly se klade důraz na notouch techniku, která má zabránit poranění žilního endotelu, a tím vyvolat kaskádu reparačních procesů (trombocyty, růstové faktory, mediátory zánětu, proliferace hladkých buněk a matrixu), které vedou ke stenózám. Odebraná žíla se proplachuje a dilatuje. K proplachu se většinou používá fyziologický roztok nebo ringerlaktát. Šetrná dilatace žíly je zásadní – prokáže ev. defekt ve stěně (únik), stenózy způsobené adventiálními pruhy a umožní zhodnocení potenciálního kalibru žíly. Nešetrná dilatace může způsobit poškození endotelu žíly nebo i rupturu medie. Důsledkem je zhoršení biomechanických vlastností graftu. Za optimální tlak považujeme 100 mm Hg. Kvalitu odběru lze pozitivně ovlivnit farmakologicky. Do proplachových roztoků se přidává heparin (snížení tvorby mikrotrombů a fibrinových depozit) a papaverin (prevence vasospasmů).
Odběr žilního štěpu může být komplikován infekcí a/nebo dehiscencí rány. Dle zvyku pracoviště se kožní řez může vést v celé délce odebírané žíly (nejrizikovější z hlediska komplikací) nebo lze provést několik kratších řezů s ponecháním kožních můstků. Žílu lze také odebírat za endoskopické vizualizace. Tato metoda je spíše určena pro odběry pro kardiochirurgii, v cévní chirurgii, kdy jsou prováděny odběry dlouhých žilních úseků, se příliš neprosadila.Při plánování infrainguinálního rekonstrukčního výkonu se většinou plánuje použití ipsilaterálního žilního interponátu (v. saphena magna). Autologní venózní interponát může být uložen reverzně, nonreverzně a in situ.
Reverzní žilní graft znamená, že žíla byla v celku vyjmuta, ošetřena a otočena (reverzně konfigurována). Arteriální krevní proud je potom ve směru chlopní, které nebyly ošetřeny. Nevýhodou může být po otočení kalibr žíly, kdy její původně distální úsek, který je užší, je při rekonstrukci našit proximálně na arterii. Na distální anastomóze jsou poměry opačné – žíla je široká a arterie úzká, tato disproporce je více zřejmá u krurálních bypassů. Žíla je uložena při bypassu uložena anatomicky nebo extraanatomicky. Chlopně mohou být komplikací při trombektomii při uzávěru bypassu.
Nonreverzní žilní graft má valvulotomem poškozeny chlopně – tím má být zlepšen tok zvláště u graftu malého kalibru. Současně je zachován kalibr žíly ve vztahu k artérii. Nonreverzní graft je spojen s bohatou manipulací s žilou a tím je zvýšeno riziko jejího poranění – tuto nevýhodu vyrovnává jeho o 20% lepší průtok než u reverzního graftu.In situ žilní graft – k bypassu použitá velká safena je ponechána in situ. Je mobilizován její proximální a distální úsek k anastomózám, valvulotomem jsou porušeny chlopně k zajištění z hlediska žíly k opačnému směru toku krve a jsou přerušeny větve safeny, aby se zabránilo vzniku arteriovenózních píštělí. Proximální anastomóza je umístěna nejčastěji na společnou femorální arterii, distální anastomóza na popliteální arterii (nad nebo pod kolenem), na bércové řečiště nebo na pedální artérii. Po našití proximální arteriální anastomózy se naplní žilní bypass, funkční chlopeň brání toku a je porušena valvulotomem, který se do žíly zavede některou z postranních větví safeny. K vyhledání a ošetření postranních větví safeny existuje několik technik – od invazivního obnažení safeny v celé délce (často s komplikovaným hojením kožního řezu) po semiinvazivní identifikaci postranních větví ultrazvukem nebo angioskopicky.Žíly paže: ipsilaterální velká safena je nevhodnější žilní náhrada, ale je prokázáno, že až u 45% nemocných chybí nebo není adekvátní kvality. Lze použít žíly paže a předloktí, nejvhodnější je cefalická žíla paže, následuje bazilická žíla. Podkožní žíly předloktí jsou nejméně používané.Funkci (selhání) venózního graftu ovlivňuje řada faktorů. Obecně se uvádí, že uzávěr graftu do 30 dnů od implantace je způsoben technickou chybou při operaci. Příčinou může být nedostatečný přítok (inflow), např. při nepoznané překážce na proximální artérii, nebo tlakový pokles při kardiovaskulárním selhávání. Jinou příčinou je nedostatečný výtokový trakt (outflow) při pokročilých sklerotických změnách na bércovém řečišti. Tzv. zevní faktory časného selhání jsou rotace bypassu při zavádění do tunelu nebo zevní útlak hematomem. Do této skupiny selhání řadíme také systémové příčiny, jako jsou hyperkoagulační stavy. Tzv. vnitřní faktory selhání jsou nedostatečně ošetřené chlopně nebo technicky nekvalitní arteriální anastomóza. Pozdní selhání graftu je způsobeno intimální hyperplazií, která je indukována poškozením žíly při chirurgické manipulaci v kombinaci se střižnými a tažnými silami, které jsou vyvolány krevním tokem. Dochází k progresivnímu zesílení intimy, zúžení lumina žíly, snížení průtoku a k intraluminální trombóze. Popsané stenotické změny se vyskytují především na anastomózách.Je zřejmé, že funkční žilní graft vyžaduje pooperační sledování, protože pokud dojde k jeho uzávěru a ošetření trombektomií, je jeho další jednoletá funkce zachována jen u 30% nemocných. Pooperační sledování se skládá z anamnestického vyšetření (obnovení klaudikací, klidové bolesti), fyzikálního vyšetření (periferní pulzace, ABI) a z radiologických metod, jako je barevná duplexní sonografie. Barevná duplexní sonografie zhodnotí průtok v jednotlivých etážích, umožní včas rozpoznat vznik stenóz a lze jí sledovat dynamiku vývoje patologického nálezu. Sledování pomocí barevné duplexní sonografie a navazující ošetření bypassu zlepšilo dlouhodobé funkce o 15%. Při nejasném nálezu je nutné vyšetřit celé řečiště (přítok, bypass, výtok) angiograficky (NMR ag).
UMĚLÉ CÉVNÍ NÁHRADY
Autologní náhrady jsou limitovány ve svém množství, kvalitě a kalibru. V cévní chirurgii se proto používají umělé cévní náhrady. Původní materiály byly objeveny v období druhé světové války a jedná se o polytetrafluoroetylen (PTFE, teflon) a polyetylenterflát (PET, dacron).
Dacronové (PET protézy) se v cévní chirurgii používají ve formě pletených protéz. Jsou to porézní trubice různého kalibru. První generace těchto protéz vyžadovala „předsrážení“. Protéza musela být před implantací namočena do neheparinizované krve nemocného, krev se v protéze vysrážela a protéza se stala neprodyšnou. Většina dnešních pletených protéz tento krok nevyžaduje, protože jsou impregnovány želatinou, kolagenem nebo albuminem. Jednou z modifikací jsou protézy s impregancemi solemi stříbra, které snižují riziko infekce graftu.
Protézy z PTFE jsou dále zpracovány (protlačovány) v expandovaný PTFE (ePTFE) a protéza není pletená, ale „litá“. Struktura její stěny má vyšší porozitu než dacron, ale póry jsou menší než u pletených protéz. Stěna je hydrofobní, brání průniku krve a není potřebné předsrážení. Ke snížení trombogenity stěny protéz se u některých modelů impregnuje vnitřní plocha heparinem.
Indikace k použití umělých cévních náhrad.
Oba typy protéz jsou vhodné k rekonstrukčním výkonům v oblasti aorty a pánevního řečiště. V infrainguinální oblasti se používají (pokud není vhodná safena) pro proximální femoropopliteální bypass (nad koleno) ePTFE protézy s heparinem. Pro oblast pod kolenním kloubem (III. úsek popliteální arterie a bércové řečiště) se doporučuje ePTFE s distální anastomózou pomocí žilní manžety. Žilní manžeta (cuff ) má několik modifikací a vlastně se jedná o krátký žilní úsek vložený mezi cévní protézu a arterii. Žilní úsek zlepšuje průtok anastomózou, protože žíla má lepší compliance s arterií než protéza a současně je menší výskyt stenóz anastomózy.Umělé cévní náhrady se používají u extranatomických bypassů (axilofemorální, axiloaxilární). Typ použité protézy je dán zvykem pracoviště, výsledky jsou velmi podobné. Cévní protézy se používají i v žilní chirurgii, mají často velký průsvit, např. pro náhradu dolní nebo horní duté žíly.Nežádoucí komplikací je uzávěr graftu. Časné uzávěry jsou nejčastěji způsobeny technickou chybou nebo z celkových příčin trombofilním stavem. Příčinou pozdních uzávěrů je hyperplazie intimy na anastomózách nebo progrese aterosklerotického procesu, kdy se zhoršuje kvalita přítokového nebo výtokového traktu.Je dlouhodobou snahou zlepšit kvalitu protéz ošetřením jejich vnitřní plochy, aby vznikla jejich „tromborezistence“. Tyto protézy se označují jako biofunkční cévní protézy a k ošetření se používá např. uhlík (carbon coating), heparin, kysličník dusný na nosiči nebo antigregancia (prostaglandiny, dipyridamol).Dlouhodobou průchodnost graftů na periferním arteriálním řečišti signifikantně zlepšuje farmakoterapie. Doporučuje se antiagregační terapie aspirinem v dávce 100mg/den nebo clopidogrelem v dávce 75mg/den. U nemocných s vysokým rizikem uzávěru je metodou volby kombinace antiagregační a antikoagulační terapie. Warfarin zvyšuje účinnost léčby, ale současně zvyšuje riziko masivního krvácení na dvojnásobek.
Biologické cévní náhrady: ideální cévní náhrada se pořád hledá – měla by být snadno dostupná, se snadnou manipulací (handling), rezistentní k trombóze a infekci. Zásadní roli hraje také cena. V zásadě tedy neexistuje materiál, který by se svými vlastnostmi podobal vlastní arterii. Používá se čerstvý arteriální nebo venózní alograft. Dárce musí být ABO-kompatibilní, přesto je třeba počítat s imunitní reakcí a příjemce musí být imunosuprimován. Dostupnost čerstvého alograftu je limitována počtem dárců. Alografty podléhají degenerativním změnám, které se projevují vznikem uzávěrů a výdutí. Omezená dostupnost čerstvých graftů vedla k vývoji různých prezervačních metod. Nejběžnější metodou je kryoprezervace. Indikací k použití biologických graftů je končetinový bypass (především na bércové řečiště), kdy není k dispozici autologní žíla a jsou výhrady k použití umělé cévní náhrady (infekce). Další indikací je náhrada infikované cévní protézy nebo se na některých pracovištích používá jako interponát pro arteriovenózní spojku k hemodialýze.
CÉVNÍ INFEKCE
Infekce v cévní chirurgii ohrožuje nemocného zvýšenou mortalitou a rizikem amputace končetiny. Pooperační raná infekce je třetí nejčastější nosokomiální infekční komplikací vůbec (po pneumonii a infekci močových cest). V cévní chirurgii postihuje 0,5–5% nemocných v závislosti na typu a lokalizaci výkonu a dále na stupni ischemické choroby dolních končetin. Výkony na periferii končetin a v třísle jsou zatíženy vyšším počtem infekčních komplikací než výkony na abdominální aortě. Etiologickým agens jsou nejčastěji S. aureus, enterokoky, E. coli a koagulázanegativní stafylokoky.
- Prevence – antibiotika
Zásadní význam má peroperační antibiotická profylaxe. Její význam narůstá při použití umělých cévních náhrad (protéz). Peroperační parenterální antibiotická profylaxe snižuje výskyt jak raných infekcí,tak výskyt časných infekcí cévních protéz. Obecně platí, že stačí jedna intravenózní dávka antibiotikapodaná na začátku výkonu (úvod do anestezie). Při delších operačních výkonech, zvláště pokud byl doplňován objem, má smysl podání druhé dávky po 3–5hodinách. Protektivní efekt antibiotické profylaxe je opakovaně potvrzen, ale její prodloužení nad 24 hodin nemá žádný pozitivní efekt. K profylaxi v cévní chirurgii jsou nejčastěji doporučovány cefalosporiny 2. generace. Typ antibiotika k profylaxi by mělo určit antibiotické centrum na základě aktuálního stavu nosokomiálních infekcí v zařízení.
Při průkazu infekce je antibiotická léčba vedena na základě mikrobiologického nálezu (kultivace a citlivost na antibiotika). Cílená antibiotická léčba má především význam u infikované cévní protézy.
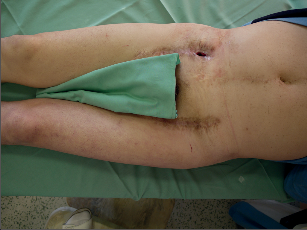
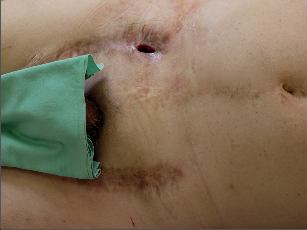
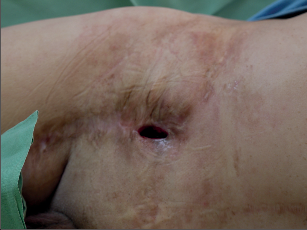
Fotogalerie 9a:
|
|
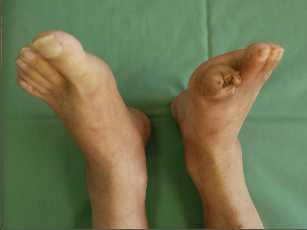
| Cévní protéza – infekce – klinika | |
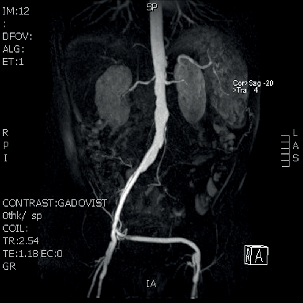
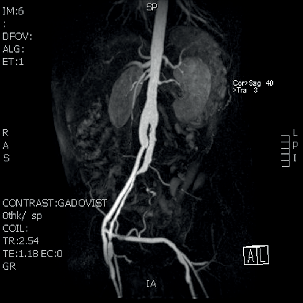
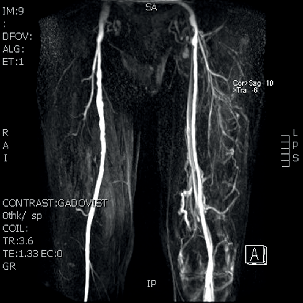
| MR ag, infekce | |
-
Diagnóza
Diagnóza infikované cévní protézy je většinou dána klinickým nálezem. Klasické projevy infekce jsou zarudnutí rány, obnažení protézy, píštěle, krvácení z anastomózy a sepse. Lokální nález může být u některých nemocných velmi diskrétní – otok bez zarudnutí, periprotetická tekutina, uzávěr graftu, pseudovýdutě a dilatace. Mikrobiologický nález při punkcí bývá negativní. Vyšetření obecných markerů infekce (leukocyty a CRP) může být negativní, ale jejich absence infekci nevylučuje. Obyklý obraz infekční komplikace lze spíše očekávat u časných infekci, pozdní infekce graftu mají často jen malé klinické příznaky (fotogalerie 9a). Předmětem diskuzí je význam stěru z rány na mikrobiologické vyšetření. Rána bývá kolonizována z okolí, větší význam může mít punkce s odběrem materiálu – i v těchto případech je až 25% odběrů nehodnotitelných nebo falešně negativních.Zásadní význam má sonografie, která může prokázat pseudovýdutě, abscesy nebo tekutinové formace. Tato metoda je lokalizuje, zhodnotí a umožní cílenou punkci. Duplexní vyšetření prokáže turbulentní tok při stenózách řečiště, které mohou být důsledkem trombotických komplikací při infekci.Další radiologická vyšetření (NMR ag, CT, fistulografie) mohou pomoci při stanovení diagnózy. Angiografický nález umožní v rozvaze stanovit možnosti rekonstrukčního výkonu. V průkazu infekční komplikace, především u chronických infekcí cévní protézy, má význam PET/CT. Metoda je limitována výkony na sledovaném řečišti – operační výkon představuje trauma s odpovídající zánětlivou reakcí a typ zánětu (traumatický × infekční) PET/CT nerozliší. Předpokládané hojení operační rány, a tím falešná pozitivita PET/CT je 3 měsíce.Infekce endovaskulárního stentgraftu se projeví obrazem bakteriémie, sepse nebo periferními embolizacemi. Vyšetření PET/CT má za výše uvedených podmínek svůj význam. - Terapeutické možnosti při infekci cévní protézy Infikovaná cévní protéza představuje i v dnešní době zásadní problém v cévní chirurgii. Pokus zachránit infikovanou protézu lokálním výkonem je opodstatněný jen u časných a ohraničených infekcí nebo u nemocných s vysokým operačním rizikem. Samotná antibiotická terapie je bez efektu, podtlaková terapie je spíše pomocným postupem, který může mít efekt u protéz, které mají dlouhodobou ochranu před infekcí (antimikrobiální povrch).Za standardní postup při infekci cévní protézy se považuje její odstranění a extraanatomická rekonstrukce pomocí autologního, homologního, heterologního nebo aloplastického materiálu (nový bypass je uložen ve zdravé tkáni). Reinfekce se vyskytuje ve 2–4,5%, ale mortalita je 12–25%. Extranatomická rekonstrukce má svá rizika, která vyplývají z její lokalizace: trombózy v důsledku nízkého průtoku, nízká dlouhodobá průchodnost, ruptura pahýlu aorty nebo infekce podkožně uloženého implantátu.Příkladem může být infikovaná bifurkační aortobifemorální protéza. Ta se vyjme, pahýl aorty se zašije a revaskularizace dolních končetin se provede extranatomickým axilobifemorálním bypassem, který je uložen v podkoží hrudníku.Alternativou extranatomické rekonstrukce je in situ rekonstrukce, kdy se infikovaná protéza vyjme a do stejné lokalizace se uloží nový bypass. Není však zřejmé, že by odstranila nevýhody rozsáhlé extranatomické rekonstrukce. Výsledky různých pracovišť prokazují, že je nižší počet reinfekcí a nižší mortalita (8–10%). Jako biologický materiál se používá hluboká stehenní žíla a homografty. Použití hluboké stehenní žíly je spojeno s jejím pracným odběrem a větším operačním traumatem. Použití homograftu je limitováno jeho dostupností (kryoprezervované žíly) a především degenerativními změnami. K rekonstrukcím in situ se také používají dacronové protézy. Rovněž na jejich použití není jednotný názor, ale výsledky těchto rekonstrukcí opravňují k jejich použití.V podstatě se používají 3 typy dacronových protéz: protéza má kolagenovou vrstvu, která obsahuje acetát stříbra, protéza obsahuje čisté stříbro, které bylo naneseno do její stěny, nebo se jedná o dacronové protézy s kolagenem a s rifampicinem (před implantací jsou namočeny do roztoku s rifampicinem).
- Dacronové protézy s acetátem stříbra – metoda využívá antibakteriální vlastnosti stříbra, které ničí bakterie jak v klidové, tak mitotické fázi. Tento duální účinek se vysvětluje absencí resistence proti účinku stříbra.
Protektivní účinek acetátu stříbra přetrvává 4 týdny. Po uplynutí této doby se chová již jako běžná dacronová protéza. Z toho vyplývá, že při přetrvání potenciálního zdroje infekce (např. defekt DKK) je nutná dlouhodobá antibiotická terapie. Po vyjmutí infikované cévní protézy a jejím nahrazení in situ pomocí protézy s acetátem stříbra je výskyt reinfekce v 10%. Parciální explantace infikované protézy je spojena s vysokým rizikem reinfekce a tato metoda je určena je pro výjimečné situace. - Stříbrem vaporizované dacronové protézy mají dlouhodobý antimikrobiální efekt. Bylo zjištěno, že po roce od implantace bylo na ploše protézy prokázáno ještě 98% stříbra. Jejich používání je zatím ve stadiu prvních nadějných výsledků. Při prokázané lokální reinfekci se prokázal příznivý efekt podtlakové terapie (VAC = vacuum assisted closure) na vhojení tohoto typu protézy.
- Dalším modelem jsou dacronové protézy jen nasáklé rifampicinem, které mají dobré výsledky u in situ rekonstrukcí. Ošetření protézy rifampicinem se provádí těsně před její implantací na operačním sále. Nevýhodou jsou reinfekce MRSA, relativně krátká doba účinku fampicinu a limitované použití u gramnegativních bakterií. Rifampicin úspěšně potlačuje infekce S. aureus a epidermidis.
Problematiku infikovaných cévních protéz lze shrnout: nezávisle na druhu použité cévní náhrady je po odstranění infikované cévní protézy třeba respektovat pravidla septické chirurgie. Jedná se o lokální ošetření (debridement) rány a celkové podávání antibiotik. Lokální terapie antibiotiky a antiseptiky doplňuje celkovou léčbu. Od celkové antibiotické léčby se očekává snížení rizika uchycení bakterií na nově implantovanou protézu. Po ošetření protézy v retroperitoneu má příznivý vliv pro její vhojení překrytí protézy vitální tkání, např. omentem nebo svalovým lalokem. Při použití protézy se solemi stříbra se doporučuje (a také se používá) tuto protézu ještě nasytit roztokem rifampicinu k vyvolání synergního efektu.Infikovaná cévní protéza by měla být chirurgicky ošetřena – v celém rozsahu vyjmuta. K její náhradě je nejvhodnější in situ bypass pomocí autologního materiálu, který je nejodolnější k reinfekci. Metodou volby jsou extranatomické bypassy neinfikovaným prostředím nebo lze použít homografty. Dobré výsledky prokazuje použití dacronových protéz, které byla antimikrobiálně ošetřeny solemi stříbra, rifampicinem nebo obojím. Použití dacronových protéz má své opodstatnění, především u nemocných, kdy není k dispozici autologní materiál nebo kdy je jeho použití spojeno s vyšším operačním rizikem.Konzervativní terapie infikované protézy pomocí drenáže, proplachů a antibiotik je určena jen pro nemocné s vysokým operačním rizikem. Možnosti lokální chirurgické léčby nyní rozšiřuje podtlaková terapie (VAC).
ZAJIŠTĚNÍ DLOUHODOBÉHO CÉVNÍHO PŘÍSTUPU – ZAVEDENÍ PORTU
Terapie onkologických onemocnění vyžaduje zajištění dlouhodobého a bezpečného žilního přístupu. Pomineme-li žilní přístup periferním řečištěm, který velmi rychle podkožní žilní řečiště ničí, přichází v úvahu kanylace centrálního žilního systému nebo použití implantabilního systému – portu. Jeho zásadní výhodou je, že celý systém je uložen do podkoží. Technika portu je použitelná i mimo žilní řečiště a jeho cestou lze zajistit permanentní vstup také do arteriálního řečiště, do peritoneální dutiny a epidurálního prostoru. Využití portu převládá v žilním přístupu (90%), asi 5% implantovaných portů je určeno pro arteriální přístup a 5% portů u nemocných k přístupu do peritoneální dutiny, subarachnoideálního nebo epidurálního prostoru.Základní indikací k zavedení portu je nutnost dlouhodobé chemoterapie. Cytostatika jsou silné kyseliny nebo zásady a jejich aplikace do periferního žilního řečiště nejenom v důsledku traumatu žíly kanylací, ale především aplikací cytostatika vede k trombóze a následnému zániku přístupu.
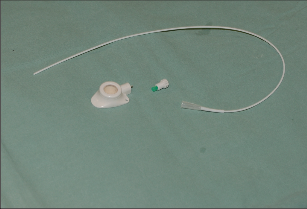
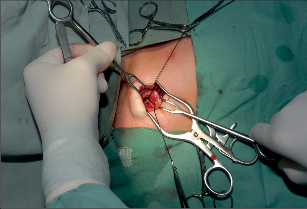
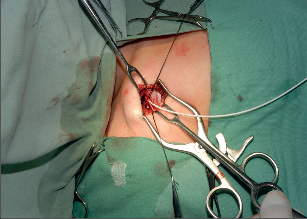
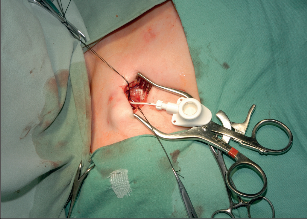
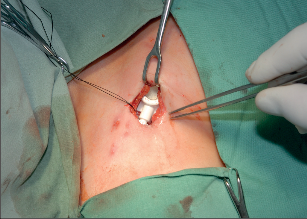
Přístup do žilního řečiště má svou historii a vývoj. Stručně lze shrnout, že začátkem 60. let minulého století byla vyvinuta technika kanylace velkých žil a zevní arteriovenózní spojka, v polovině 60. let následovala interní arteriovenózní spojka. Arteriovenózní spojka v této indikace ztratila na významu, ale vylepšila se technika kanylací centrálního žilního systému antimikrobiální úpravou kanyl a použitím metody tunelizace k jejich uložení do podkoží. V 80. letech minulého století potom začala historie podkožního žilního portu.Podkožní port je katétr s komůrkou implantovanou do podkoží. Typ portu je třeba zvážit dle indikace jeho použití. Nejběžnější jsou jednokomorové porty s malým průtokem určené pro běžnou chemoterapii solidních nádorů. Pro speciální použití (parenterální výživa, převody krevních derivátů apod.) jsou výhodnější porty dvoukomorové nebo porty s vysokým průtokem. Port je tvořen titanovou komůrkou, která je kryta silikonovou membránou a zevním pouzdrem. Pomocí spojovacího kroužku je komůrka spojena s katétrem zavedeným do centrálního žilního systému. Mezi komůrkou a katétrem je tzv. výstupní kanyla. Transkutánně se do komůrky portu podává speciální Huberovou jehlou roztok určený k intravenózní terapii. Pro správnou funkci portu je kvalita použité jehly zcela zásadní, nesmí se použít běžná podkožní jehla, která u portu poškozuje jeho membránu a může způsobit obstrukci portu. Speciální Huberova jehla umožňuje až 3000 vpichů do komůrky portu. Jehly se liší svým kalibrem a tvarem dle aplikované látky. Základní indikací v použití žilního portu je systémová chemoterapie, dalšími indikacemi jsou léčba astmatu, antibiotická léčba, krevní převody, parenterální výživa. Tepenný port je používán v regionální chemoterapii nádorů jater a slinivky břišní. Peritoneální port je indikován k regionální chemoterapii a k vypouštění ascitu. Epidurální nebo spinální port je vhodný použít k tišení bolesti u terminálních stavů.K zavedení podkožního portu se používá Seldingerovy nebo chirurgické techniky. Punkční technikou je zajištěn přístup do horní duté žíly cestou kanylace poklíčkové nebo jugulární žíly. Většinou se používá firemní implantační set. Za aseptických podmínek se v lokální anestezii provede punkce centrální žíly (nejčastěji podklíčková žíla vpravo), zavede se vodič a skiaskopicky se provede kontrola polohy zavaděče v horní duté žíle. Následuje dilatace kanálu, zavedení katétru a odstranění vodiče. Po kontrole žilního návratu se proplachuje katétr fyziologickým roztokem a v pektorální krajině se vytvoří prostor pro komůrku. Port se kompletuje a následuje jeho fixace v podkoží. Po zavedení Hubertovy jehly do komůrky aspirací kontrolujeme správnou funkci systému. Po uzávěru rány následuje kontrolní nástřik portu rtg kontrastní látkou (kontrola event. úniku látky), provede se proplach portu fyziologickým roztokem a podání heparinové zátky. Alternativní je chirurgická preparační technika. Ta je vhodná při znalosti techniky k zavedení katétru cestou cefalické žíly po její preparaci v sulcus deltoideopectoralis. Po podvazu periferie žíly se po její tomii zavede katétr za skiaskopické kontroly do horní duté žíly. Kožní řez se využije k vytvořenípodkožní kapsy pro komůrku portu (fotogalerie 9b). Při uzávěru hlavních žilních kmenů horní poloviny těla lze preparační technikou zavést kanylu portu řečištěm v. saphena magna nebo pánevních žil do dolní duté žíly.
Za kontraindikaci k zavedení portu se považuje neutropenie a trombopenie, bakteriémie a septické stavy, těžké poruchy koagulace a trombofilní stavy.Zavedení a používání podkožního žilní portu může mít komplikace. Po kanylaci podklíčkové žíly může vzniknout pneumotorax (nutná rtg kontrola po 24 hodinách po zavedení portu nebo dle klinického stavu), může dojít k poruše funkce portu pro technickou chybu (např. zalomení nebo špatná poloha katétru). Hematom v místě zavedení portu je většinou způsoben poruchami hemokoagulace. Během používání portu se mohou vyvinout komplikace, které jsou indikací k vyjmutí systému. Jedná se o netěsnost systému, dekubitus nad portem a nezvládnutelné infekční komplikace. Další komplikace jsou místní infekce, katétrové sepse a trombózy, které jsou při neúspěchu konzervativní terapie indikací k vyjmutí portu.Pokud nedojde k poruše funkce portu, a tím k potřebě jeho vyjmutí, je indikována jeho extrakce půl roku po dokončení terapie, kdy již není předpoklad potřeby přístupu do centrální žíly.
Fotogalerie 9b:
|
|