8 Diagnostická rektoskopie a výkony operačním rektoskopem
Mezi diagnostické metody, které využívá většina chirurgů, patří rektoskopie, která umožňuje vyšetření anorektální oblasti. Tato metoda byla zdokonalena konstrukcí operačního rektoskopu, který umožňuje provádět v této krajině i poměrně složité endoskopické operace. Práce s operačním rektoskopem je náplní některých chirurgů.
8.1 Diagnostická rektoskopie
8.1.1 Indikace a kontraindikace diagnostické rektoskopie
Není kontraindikací endoskopického vyšetření konečníku a esovité kličky, vyjma případů zúžení konečníku, ať již vrozeného nebo získaného, znemožňující zavedení přístroje. Často se upouští od rektoskopického vyšetření u případů infekčních chorob postihujících i část tlustého střeva přístupnou endoskopickému vyšetření. Diagnóza těchto chorob je především bakteriologická, a proto při pozitivním bakteriologickém nálezu již nemá rektoskopické vyšetření diagnostickou důležitost. Není však u těchto chorob kontraindikováno. Ani větší oslabení organismu není kontraindikací rektoskopického vyšetření, je-li toto vyšetření indikováno. V takovýchto případech, při nichž by pozice genupektorální vysíleného nemocného příliš zatěžovala, je nutno vyšetřit ho vleže v poloze na boku. Vyšetření v této poloze však neskýtá dostatečný přehled a často nedovoluje bezpečný závěr. Také je nutno vyčistit u takových nemocných dolní část tlustého střeva šetrně, jak se o tom zmíníme ještě dále. Endoskopické vyšetření je u chorob konečníku a esovité kličky nebo při podezření na onemocnění těchto úseků vyšetřením hlavním, i když je pochopitelně ještě doplňujeme dalšími způsoby pomocného vyšetření. Proto vždy, kdykoli si nemocný stěžuje na časté nucení na stolici, na pálení nebo tlak v konečníku, ať již v souvislosti s defekací nebo nezávisle na ní, je nutné vyšetření rektoskopické, a to často i opakovaně po určité údobí. Někdy nemají tyto potíže organický podklad a jejich příčinou jsou změny vzniklé poruchami trávení. Přesto pokládáme za chybu, nevyšetří-li se také nemocní s těmito potížemi rektoskopicky, neboť jsme se opětovně přesvědčili, že některé případy nádorového onemocnění distální části tlustého střeva vyvolávají zpočátku poměrně nepatrné potíže. Tím spíše je indikováno rektoskopické vyšetření při stížnosti na bolesti v konečníku, na stužkovitou stolici, na tenezmy a příměs krve nebo hlenu ve stolici. Také každý případ hemoroidů je nutno vyšetřit endoskopicky. V tomto bodě se podle našich zkušeností mnoho chybuje. Prostá existence hemoroidů je indikací digitálního a endoskopického vyšetření, a to tím spíše, přičítá-li se hemoroidům vznik zácpy, původ bolestí nebo krvácení. Je samozřejmé, že mohou být příčinou takových potíží. Vždy je pouze nutné bezpečně se přesvědčit, je-li tomu skutečně tak, nerozrůstá-li se při hemoroidech, ať již jsou v klidu či nikoli, v konečníku nebo v esovité kličce nádor, není-li zdrojem krvácení ulcerózní kolitida, rektální forma Crohnovy choroby, benigní cévní dysplazie nebo exulcerovaný polyp. Ani takových případů jsme, bohužel, neviděli málo. Také u případů análního pruritu je nutné rektoskopické vyšetření. Pruritus může být idiopatického původu a v takových případech ani rektoskopickým vyšetřením nezískáme jasno. Daleko častěji je však původ pruritu druhotný. A proto, ať jsou příčiny jeho vzniku lokální – fisury, píštěle, hemoroidy, cryptitis a papilitis, chemické – kyselá reakce stolice při kvasné dyspepsii, při tuberkulóze střev, fluoru, odkapávání moči, nebo mechanické, ať je jeho původ alergický, parazitární nebo součástí poruchy ledvinné, jaterní nebo endokrinní, vždy je nutné endoskopické vyšetření konečníku a esovité kličky. Změní-li potíže u choroby konečníku a esovité kličky svůj dosavadní charakter, je vždy nutné orientovat se v příčinách této změny vyšetřením endoskopickým, a to při určitých nejasnostech a nesrovnalostech třeba opakovaně. Nereaguje-li nemocný s určitou chorobou tlustého střeva na obvyklý způsob léčení nebo reaguje-li neobvykle, je také nutné přešetření. A endoskopické vyšetření je jedním z hlavních způsobů pomocného vyšetření.
A konečně je endoskopické vyšetření konečníku a esovité kličky důležitou součástí tzv. kompletního vyšetření osob s více nebo méně vyjádřenými příznaky dosud nezjištěné choroby. Znovu zdůrazňujeme, že některé druhy nádorů konečníku a esovité kličky nepůsobí, hlavně v počátečním údobí, dlouhou dobu výraznější místní potíže, takže nemocné jimi postižené přivádí k lékaři dříve stesk na hubnutí a únavu než potíže defekační, bolesti a příměs krve ve stolici. Je nutno zdůraznit, že rektoskopické vyšetření prováděné lege artis není bolestivé, vyjma případů zánětlivých změn v řitním kanále a fisur. Ale i u těchto stavů dovoluje zručnost, šetrný způsob zavádění a anestezie řitního kanálu, aby vyšetření bylo nebolestivé. Souhrnem lze říci: kontraindikací rektoskopického vyšetření je jen vrozené nebo získané zúžení nejdistálnějších částí tlustého střeva, znemožňující zavedení rektoskopu. Zde je nutno použít tenkou fibrózní optiku. Infekční onemocnění tlustého střeva nejsou kontraindikací, ač pozitivní bakteriologický nález ubírá rektoskopickému vyšetření na důležitosti. Každý údaj, ať subjektivního nebo objektivního rázu, svědčící pro možnost zánětlivého, vředového nebo nádorového onemocnění konečníku nebo esovité kličky, je indikací k rektoskopickému vyšetření. Totéž platí o hemoroidech, tím spíše, přičítají-li se jim četné závažné příznaky (krvácení, bolesti atd.). Rektoskopické vyšetření je nutným doplňkem tzv. kompletního vyšetření nemocných s více nebo méně vyznačenými příznaky dosud nezjištěné choroby. Změna rázu potíží nebo nezdar dosavadního léčení je indikací k opakování endoskopie.
8.1.2 Příprava vyšetření
Úspěch endoskopického vyšetření konečníku a esovité kličky je do značné míry závislý na stupni jejich vyprázdnění, neboť i malé nálety stolice na sliznici, stejně jako stékání stolice z vyšších částí tlustého střeva do částí vyšetřovaných endoskopicky, ruší značně výkon a znemožňují bezpečný závěr. Osobám určeným k endoskopickému vyšetření nikdy nepředepisujeme určité dietní předpisy za účelem snazšího vyprázdnění. Rovněž jim nedoporučujeme použít k vyprázdnění tlustého střeva projímadel. Tímto způsobem se totiž velmi často vyvolá průjmovitý stav, což je neúčelné a ztěžuje to endoskopické vyšetření. U nemocných se sklonem k průjmům nebo s průjmy pak takto vyvolaný nebo vystupňovaný status diarrhoicus potrvá často několik dní, což není pochopitelně bez odezvy na jejich celkový stav. Osoby určené k endoskopickému vyšetření konečníku a esovité kličky, s pravidelnou stolicí nebo trpící zácpou, aby ráno před vyšetřením vykonali prostou defekaci. U pacientů s poruchou vyprazdňování vyprazdňujeme střevo podáním klyzmatu Yal cca 1 hodinu před vyšetřením. Přesný návod k přípravě je popsán v příbalovém letáku přípravku. Nemocné podezřelé ze zánětlivého onemocnění dolní části tlustého střeva vyšetřujeme rektoskopicky bez přípravy. U těchto chorob bývá totiž často dolní část tlustého střeva prázdná, takže pak stolice neruší při endoskopickém vyšetřování. Předejde se tím i jistému stupni podráždění sliznice klyzmatem a je větší možnost nálezu výmětů na sliznici, ať hlenových, fibrinových nebo hnisavých, jejichž nález je velmi cenný diagnosticky, jak bude ještě zdůrazněno při popisu těchto nálezů. Není-li viditelnost dostatečná, je nutno takto získaný nález doplnit ještě rektoskopickým vyšetřením po vyprázdnění.
8.1.3 Instrumentárium
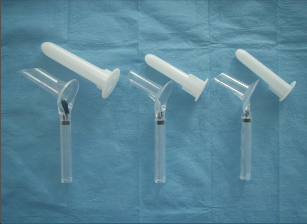
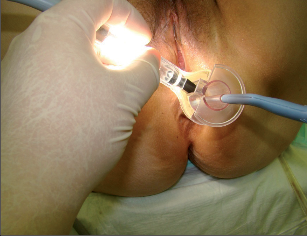
K vyšetření konečníku a přilehlé části rekta se užívají anoskopy, případně speciální retraktory, kterými lze vyšetřit anální kanál a část rektální ampuly (obr. 1, 2, 3).
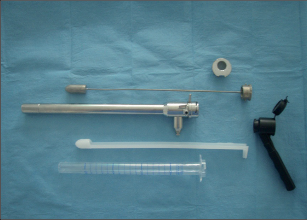
Rektoskopy umožňují vyšetření rekta v celém rozsahu a většinou i přilehlou část esovité kličky. Užívá se několik typů rektoskopů, které se liší jen malými obměnami, hlavně v umístění světelného zdroje (obr. 4, 5).
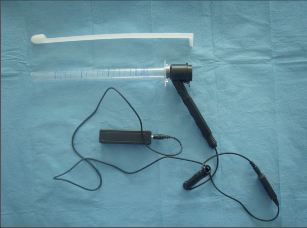
Některé typy rektoskopů mají totiž svíticí zdroj umístěn v horní části tubusu, kdežto jiné ho mají jen několik centimetrů od dolního konce tubusu. Je pochopitelné, že horní osvětlení je výhodnější, neboť svítící zdroj nemůže být tak snadno znečištěn, což ruší vyšetření. Při vyšetření je možno použít i přídatný zdroj osvětlení (obr. 6).
Pravidelně týž typ rektoskopů má více tubusů, lišících se jen délkou a tloušťkou. Každý přístroj sloužící k endoskopickému vyšetření konečníku a esovité kličky se skládá z:
- tubusu,
- obturátoru – zaváděče – mandrénu,
- okénka – ne u anoskopů,
- světelného zdroje,
- insuflátoru,
- kvalitní čelní světlo s vysokou svítivostí je dnes již samozřejmostí zejména při instrumentaci.
Tubus má rourovitý tvar a je vyroben buď z kovu nebo z plastu. Obecně vzato, plastové rektoskopy mají lepší světelnost. Jsou určeny k jednorázovému použití. Světelný zdroj je pravidelně umístěn v horní části rektoskopu. U všech rektoskopů bývá tubus na jedné nebo i na dvou stranách směrem k hornímu konci centimetrově graduován, a to u rektoskopů střední délky v rozsahu 25 cm, u nejdelších přístrojů – rigidních sigmoideoskopů pak v rozsahu 30 cm, výjimečně 35 cm. Tím se umožňuje přesné udání výšky změn od análního okraje – margo analis. Dolní konec tubusu končí tupě, aby po odstranění obturátoru nedošlo při jeho pronikání do vyšších částí k poranění sliznice. Horní část tubusu bývá v rozsahu několika centimetrů manžetovitě rozšířena. Obturátor zavírá na obou koncích dutý tubus. Jeho dolní část končí kónicky, což usnadňuje zavádění rektoskopu svěračovou částí. Některé typy rektoskopů mají po straně jednu nebo dvě hlubší podélné rýhy, které umožňují spojení vzduchu, vniklého při zavádění rektoskopu do konečníku, se zevním vzdušným prostorem. Tím se zabraňuje případnému přisátí sliznice k dolní části obturátoru při jeho vytahování z tubusu po zavedení přístroje. Horní část obturátoru bývá zpravidla upravena tak, aby svým dolním koncem zapadala do kruhovitého výstupku na vnitřní straně tubusu, čímž se při zavádění zabraňuje volnému pohybu obturátoru v tubusu při zvýšeném tlaku v jeho horní části. Délka obturátoru závisí na délce tubusu. Po vynětí obturátoru se nasadí na horní konec tubusu okénko umožňující přímý pohled a bránící, aby střevní obsah a plyny neznečistily vyšetřujícího. Po straně distální části tubusu je kohoutek sloužící k insuflaci vzduchu po nasazení mechanického insuflátoru, skládajícího se ze dvou gumových balonků. Dále se jím umožňuje odchod plynů z vyšetřované části tlustého střeva, vyvolalo-li jejich nahromadění v průběhu vyšetření bolesti. Je pochopitelné, že u různých druhů rektoskopů mají některé jeho části obměny, a to buď v konstrukci nebo v sestavení přístroje.
8.1.4 Technika zavádění
Anatomické poměry a snadnost přístupu jsou do značné míry příčinou, že se obecně pokládá endoskopické vyšetření konečníku a esovité kličky za snadné. Do určité míry je tomu tak, ovšem jen tehdy, vyšetřuje-li se správně technicky.
Hladký průběh výkonu umožňuje:
- řádná příprava vyšetřovaného,
- řádné poučení vyšetřovaného před a po dobu vyšetření (neustálý kontakt vyšetřujícího s vyšetřovaným),
- jeho vhodná poloha při vyšetřování,
- dobrý přístroj,
- správná a šetrná instrumentace.
Vedle řádného vyprázdnění oněch částí tlustého střeva, jež budou endoskopicky vyšetřovány, přináleží k přípravě vyšetření i krátká instruktáž vyšetřovaného o poloze, již pak zaujme za pomoci vyšetřujícího nebo asistujícího. Před vyšetřením umožníme pacientovi obléci si tzv. endoskopické šortky z netkané textilie. Nejčastěji se vyšetřuje nemocný v poloze genupektorální, označované dříve polohou ,,á la vache“ nebo polohou „na všech čtyřech“ či polohou kolena-lokty. Vyšetřovaný si klekne na vyšetřovací stůl. Je třebadbát toho, aby si neklekl příliš na okraj stolu, neboť pak vratkost jeho polohy ruší výkon. I když genupektorátní poloha je pro rektoskopické vyšetření nejvýhodnější, užívají některé školy jiných poloh. Někteří proktologové vyšetřují v poloze na zádech, při níž si vyšetřovaný ulehne zády na vyšetřovací stůl, lehce skloněný předním koncem. Nohy ohnuté v kloubech kolenních jsou zavěšeny v držadlech, upevněných podobně jako u vyšetřovacích stolů gynekologických. Jiní vyšetřují v poloze na boku. Nemocný se položí na pravý bok a ohne nohy v kolenních kloubech do pravého úhlu. Pánev je podložena polštářem. Někteří vyšetřují nemocného na vyšetřovacím stole sestrojeném tak, že umožňuje polohu, při níž nohy a pánev jsou v poloze vodorovné, kdežto zbylá část těla je skloněna hlavou dolů. Ohnutá část trupu svírá s částí vodorovně uloženou úhel asi 120 stupňů. Konečně někteří uloží vyšetřovaného tak, že přední část stehen leží na lůžku a trup je skloněn z postele dolů, takže se nemocný opírá lokty o polštář ležící před lůžkem. My sami vyšetřujeme rektoskopicky nemocné v pozici genupektorální, pouze je-li nemocný velmi zesláblý, dušný nebo nemůže-li pro kloubní onemocnění ohnout končetiny tak, jak vyžaduje genupektorální pozice, vyšetřujeme nemocné v poloze na straně na lehátku s lehce podloženou pánevní částí.
Vlastnímu endoskopickému vyšetření předchází vždy vyšetření řitní krajiny aspekcí a digitální vyšetření části sfinkterové i ampuly do výše, kam až dosáhne vyšetřující prstem. Na škodu není ani provést vyšetření tzv. emulzní manometrií. Po roztažení hýždí do stran posoudíme aspekcí, není-li kůže v krajině cirkumanální pozměněna, nevyskytují-li se řitní přívěsky (výčnělky, marisky), hemoroidy, fisury nebo výhřezy konečníku. Za tím účelem vyzveme vyšetřovaného, aby lehce zatlačil jako na stolici. Digitální vyšetření nás orientuje o stupni sevření svěrače. Z něho lze i usuzovat, jaký odpor bude nutno překonat při zavádění rektoskopu touto částí. Proktospazmus je velmi často nejen ukazatelem, že při zavádění přístroje bude nutno postupovat velmi opatrně, ale i projevem existence patologických změn, jako fisur, erozí atd. Za normálních poměrů je totiž digitální vyšetření nebolestivé. V ampule se vyšetřujícím prstem orientujeme o její prostornosti a o velikosti a povrchu předstojné žlázy nebo o velikosti a uložení dělohy. Po skončení digitálního vyšetření je vždy nutno zjistit, není-li rukavice vyšetřujícího znečištěna krví. Pak přistoupíme k vlastnímu endoskopickému vyšetření. Předtím je však nutno se přesvědčit, je-li přístroj v pořádku, hlavně jeho osvětlovací zařízení. Dolní vyčnívající část obturátoru, sloužící ke snazšímu překonání odporu svěrače, a stejně i otvor řitní potřeme lehce malým množstvím gelu k usnadnění prostupu. Pak uchopíme rektoskop pevně do pravé ruky. Je však nutné vtisknout horní konec obturátoru pevně do dlaně vyšetřující ruky, aby se při odporu kladeném řitním svěračem obturátor nevysunoval z konečníku a tubus tím nepohmoždil svým tupým koncem při prostupu sfinkterovou částí sliznici. Je-li vyšetřovaný velmi citlivý nebo bázlivý anebo lze-li z jeho reakce na digitální vyšetření usuzovat, že zavedení tubusu bude bolestivé, je možno umrtvit řitní kanál aplikací lokálního anestetika v masti, gelu či submukózní injekci, vyšetření je možno provést též v analgosedaci. Je nutno upozornit vyšetřovaného, že zavádění rektoskopu vyvolá nutkání na stolici. Pak se vyšetřující postaví k levé straně vyšetřovaného, nikoli přímo proti anální části. Po těchto přípravách se zavádí rektoskop lehkými otáčivými pohyby při tubusu postaveném souběžně s podélnou osou těla v genupektorální poloze. Pronikne-li tubus s obturátorem do konečníku do hloubky asi 5 cm, vyjme se obturátor, nasadí objímka s osvětlovacím okénkem a s držadlem a rektoskop se pak za kontroly zraku zavádí hlouběji do tlustého střeva. Je dobře, aby byl přitom otevřen kohoutek, sloužící nyní hlavně k desuflaci vzduchu. Otevřením je umožněno spojení plynů v konečníku se zevním vzduchovým prostorem, což často značně zmírňuje tlak, vyvolávaný zaváděním rektoskopu. Pak zasouváme přístroj výše, měníme lehce polohu tubusu z polohy vodorovné do polohy lehce šikmé, s vyvýšením části intrarektální. Při zjištění nálezu v dolní části konečníku není třeba vždy pronikat rektoskopem do vyšších částí, hlavně u případů ulcerózních kolitid, je-li zavádění provázeno značným krvácením křehké sliznice. Tuto pozici tubusu zachováváme až do přechodu konečníku v ohbí esovité kličky. V této hloubce malými exkurzemi rektoskopu doprava, doleva, nahoru nebo dolů vyhledáme přechod konečníku v esovitou kličku. Anatomické poměry vyžadují, aby se v této výšce zdvihl zevní konec rektoskopu lehce do výše. Tím se skloní dolní zavedený konec rektoskopu a pronikáme pak za stálé kontroly zraku do nitra esovité kličky. Nepodaří-li se vniknout do nitra esovité kličky, lze použít insuflace vzduchu, která pronikání usnadní. Osobně používáme insuflaci co nejméně. Je účelnější, je-li toho třeba, použít insuflace k pokusu o rozšíření spasticky zúžených částí. Průběh esovité kličky vyžaduje při dalším pronikání do jejího nitra další snižování zavedeného konce rektoskopu, samozřejmě za stálé kontroly zrakem. Tímto způsobem můžeme zavést tubus až do výše 25–30 cm od řiti. Výše není možno přístrojem proniknout z důvodů anatomických, neboť pak se esovitá klička v dalším svém průběhu kolenovitě ohýbá. Vysouvání rektoskopu z nejvýše dosaženého místa se děje rovněž pozvolna za stálé kontroly zrakem. Je nutno vždy v celém rozsahu obkroužit střevní lumen každého úseku. Stejně je nutné velmi pečlivě obkroužit přechod ampuly v řitní kanál. Vzhledem k tomu, že jsme při zavádění rektoskopu pronikli do výše asi5 cm bez kontroly zraku, vyšetříme tuto část zrakem při vytahování rektoskopu. Má-li být vyšetřena pouze anální část konečníku, vyšetří se jen anoskopem, jak již bylo řečeno. Po skončení vyšetření je nutno upozornit pacienta, že při změně polohy z koleno-loketní do kleče a při sestupu s vyšetřovacího stolu mají někteří vyšetřovaní závrať.
8.1.5 Endoskopické výkony
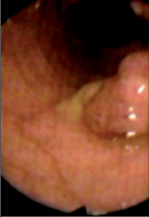
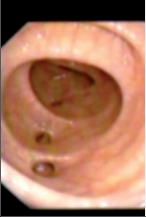
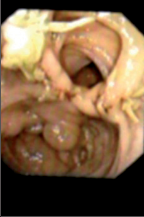
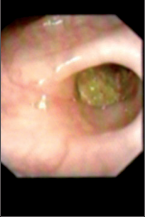
U většiny vyšetřovaných případů postačuje k diagnóze endoskopický nález v konečníku a v esovité kličce. Čím má vyšetřující v endoskopii větší zkušenosti, tím více platí, co jsme řekli. V ojedinělých případech však budí nález jisté pochybnosti. A tu je správné provést probatorní excizi. Této cenné diagnostické pomůcky není dosud u chorob konečníku a esovité kličky dostatečně využíváno. Je zásadou excidovat jen část útvaru, vyčnívajícího do lumen střeva, abychom se vyhnuli nebezpečí perforace. Nejlépe je excidovat tkáň z okraje chorobného procesu, aby nebyla excidovaná tkáň nekrotická, a vyjmout ji z několika různých míst. Excizi provádíme speciálními klíšťkami. Kompletní snesení léze v úrovni stěny rekta je vhodné provést termokoagulační kličkou či v případě menších lézí trhací kličkou. Dochází-li po excizi k většímu krvácení, stavíme je přiložením mulového tamponu smočeného v roztoku adrenalinu, sklerotizací, elektrokoagulací, argon koagulací, laserem či infrarotem. Excidované části se ihned vloží do připravené nádobky s formalínem, řádně popíšou a odešlou k vyšetření. Při tubusu zavedeném v konečníku nebo v esovité kličce lze však získat nejen materiál k vyšetření mikroskopickému nebo bakteriologickému. Odběr materiálu k vyšetření bakteriologickému se získá výtěrem. Mikroskopicky, mimo materiál získaný probatorní excizí, lze vyšetřit hlen, fibrinové nálepy, hnis nebo krev. Materiál se získá nejlépe výtěrem chorobných nebo znečištěných částí sliznice vatovým nebo mulovým tamponkem zachyceným do kleští, sloužících k čištění tubusu rigidního gastroskopu. Získaný materiál se rozetře na podložní sklíčko, fixuje acetonem nebo směsí stejného dílu 95% alkoholu a dietyleteru a vyšetřuje se buď nebarvený nebo barvený speciálními barvivy. Je však třeba velmi rutinovaného pracovníka, hlavně ke spolehlivému zhodnocení nálezu nádorových buněk. Je také možno speciálními rozprašovači při zavedeném tubusu aplikovat místně za kontroly zrakem různé léky, a to buď ve formě prášku nebo v roztoku. Je nutno dobře očistit před aplikací léku postiženou část střeva očistným malým klyzmatem. Příklady některých endoskopických nálezů při rektoskopickém vyšetření ukazují obr. 7, 8, 9 a 10.
8.1.6 Další možné aplikace endoskopů a retraktorů
Endoskopy a speciální retraktory mají ještě různé jiné možnosti využití, jak ukazují obrázky 11 až 14.
8.2 Výkony operačním rektoskopem – transanální mikroskopická chirurgie
8.2.1 Výkony operačním rektoskopem – úvod
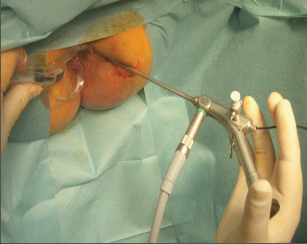
Rigidní rektoskopie je jednou z nejstarších technik v endoskopii intestinálního traktu. Počátkem dvacátého století byly vyvinuty nové techniky s pokročilejší optikou (obr. 15).
Intervenční výkony s pomocí rigidních rektoskopů s insuflací plynu byly omezeny na jednoduché operační postupy, jako například resekce kličkou. Postupně byly vyvinuty operační rektoskopy s průměrem až 4 cm, ale tyto byly používány jako mechanické retraktory a pro menší chirurgické výkony uvnitř rekta se používaly konvenční nástroje.Chirurgické výkony v rektu, jako například resekce sesilních polypů, se prováděly převážně s použitím retraktorů. Retraktory pro transanální a transvaginální aplikaci byly poprvé použity již ve starém Římě. Pokročilé technické systémy byly nalezeny také v Pompejích. Chirurgická manipulace retraktory uvnitř rekta má ovšem nevýhody:
- výhled je omezen na oblast mezi rameny retraktoru,
- lžíce retraktoru obturují části rekta,
- oblast, která je nad retraktorem, má tendenci kolabovat, což výrazně zhoršuje přehlednost v operačním poli,
- chirurgovy nástroje i ruce omezují přímý výhled na operační pole.
Z těchto důvodů se transanální chirurgická manipulace nejčastěji používá na léze v dolní třetině rekta. V závislosti na situaci mohou být části rekta, kde se nachází nádor, prolabovány nástroji směrem k okraji anu; takto se dá použít standardní chirurgická resekční technika u proximálnějších lézí v aborální části rekta.Resekce rekta je možná s použitím různých modifikací dorzálního přístupu, jako je například protětí sfinkteru dle York Massona nebo modifikovaná Kraskeho metoda.
V roce 1885 zahájil Kraske novou epochu rektální chirurgie zavedením převratné operační techniky. Princip jeho metody spočívá ve vysoké ligatuře horní hemoroidální arterie společně s mobilizací proximální části rekta a rektosigmatu, která umožňuje resekci v dostatečné vzdálenosti od tumoru ve zdravé části střeva. Kraskeho operace však vyžaduje resekci kostrče a dolních sakrálních obratlů. Vzhledem k optimálním výsledkům té doby se tato operace stala uznávanou a užívanou operační technikou téměř do konce 1. desetiletí 20. století, kdy byla modifikována Goetzem a Mandlem. Jelikož jsou obě procedury spojeny s vysokým výskytem pooperačních komplikací, provádějí se dnes zřídka.I když moderní typy přímých a cirkulárních střevních šiček umožnily provedení bezpečné koloanální anastomózy u distálních lézí, je tato technika spojená s komplikacemi charakteru dehiscencí a zvýšenou morbiditou. Může být obtížné ospravedlnit tyto potenciální komplikace u pacientů s benigními lézemi. S cílem vypracovat přesnější a méně invazivní rektální operaci vyvinuli autoři metody (Buess, Theis, Hutterer, Said) v roce 1980 transanální endoskopickou mikrochirurgii (T.E.M.).
8.2.2 Vývoj transanální endoskopické mikrochirurgie 1980–1983
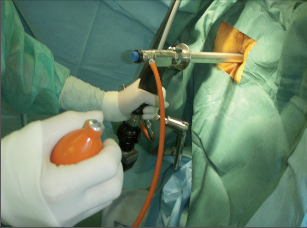
Nápad vyvinout úplně nový operační postup s použitím endoskopické techniky přišel poté, co první z autorů prof. G. F. Buess získal na Univerzitní klinice v Kolíně nad Rýnem praxi ve flexibilní kolonoskopii a konvenční endorektální a endoanální chirurgii. Vedoucí myšlenka byla spojit kvality endoskopie (dobrý přehled v dutině rozšířené plynem) s technikou chirurgického výkonu (obr. 16).
Tehdy se na klinice vytvořila malá výzkumná skupina (R. Theis, F. Hutterer, S. Said), která úzce spolupracovala s R & D skupinou (G. Wolf, H. Knittlingen, S. Hildebrandt a M. Böbel). Podle základního plánu výzkumu bylo provedeno počáteční testování s řešeními následujících problémů, které byly formulovány během rozšířeného pracovního programu:
- Rychlost proudění existujících insuflátorů neumožňovala dostatečnou dilataci rekta. Musel být vyvinut nový insuflátor s vyšší rychlostí insuflace.
- Použití existujících insuflátorů pro rozšíření lumen rekta u zvířat ukázalo, že standardní technika měření tlaku insuflace nemohla být použita kvůli malému lumen. Pokud byla insuflace přerušena, aby mohl být změřen tlak v rektu, viditelnost se zhoršila následkem kolapsu stěn. Bylo tedy potřeba, aby nový insuflátor umožnil stálé měření a stálé nafukování bez přerušování.
- Vakuové sání vyústilo v rapidní kolaps celého lumen rekta. Bylo nutné vyvinout novou techniku, která by umožnila stálou dilataci rekta i při sání.
- Monokulární vidění bylo nevhodné kvůli paralelní manipulaci s nástroji v blízkosti optiky a světelného zdroje. Bylo třeba testovat použitelnost stereoskopické techniky.
- Dostupné laparoskopické nástroje nebyly vhodné pro rektoskopickou chirurgii. Bylo třeba je přizpůsobit malému lumen rektoskopu a omezenému operačnímu poli.
- Experimentální studie ukázaly, že kapénky krve a tekutiny zakrývají optický zdroj, a to vede k časové ztrátě během zvláště kritických momentů operace. Musel být instalován čistící mechanismus.
- Bylo zjištěno, že kvůli paralelnímu umístění nástrojů je obtížné zauzlovat suturu uzavřeného defektu stěny rekta.
Bylo třeba vyvinout jinou metodu uzlování.Během dvouletého rozšířeného pracovního programu bylo třeba tyto překážky překonat, aby mohl být vyvinut nový pracovní postup:
- Potřeba stovek experimentálních testů během vývojového procesu bránila testům na zvířatech pro testování každé fáze.
- Proto byly vytvořeny zvláštní testovací modely z kravských střev těsně připevněných k rektoskopu. Tento model se postupně vyvinul v současně používaný tréninkový model (obr. 17). Jednoduché modifikace prototypů byly provedeny v laboratoři výzkumného oddělení v Kolíně (profesor W. Isselhard).
8.2.3 Indikace T.E.M.
T.E.M. je zaměřena hlavně na resekci těch rektálních polypů, které nemohou být bezpečně odstraněny resekcí polypektomickou kličkou. Je indikována pro:
- velké pendulující polypy se širokou bází,
- benigní sesilní polypy,
- rekurentní polypy,
- T1 nádory low grade v extraperitoneální části rekta,
- T2 nádory s nízkým rizikem u pacientů, kde by bylo vysoké riziko výkonu při konvenční chirurgii, nebo u pacientů, kteří odmítají klasickou či laparoskopickou resekční techniku,
- T2 a více nádory k paliativnímu ošetření u pacientů, u kterých nelze provést radikální výkon nebo u pacientů, kteří odmítají odstranění konečníku s vytvořením kolostomie,
- ošetření tumorů s vysokým rizikem nebo v pokročilejších stadiích v kombinaci s radiochemoterapiía lokální excizí,
- resekci karcinoidů,
- chirurgické excize rektálních fistulí,
- resekce či disekce stenóz v anastomóze po provedených resekčních výkonech na rektu,
- ošetření rektální endometriózy,
- ošetření masivního krvácení z rekta,
- vynětí cizích těles z rekta,
- ošetření rektální cévní dysplazie,
- ošetření rektálního abscesu,
- jako součást ultranízké resekce rekta technikou rendezvous.
Léze by neměla svou velikostí přesáhnout ⅔ obvodu rekta a měla by být umístěna ve vzdálenosti nejvíce 18cm. Z vlastní zkušenosti se přikláníme k názoru, že hraniční velikostí je ½ obvodu rekta a léze by neměla být od anu vzdálena více než 15cm ověřených rigidní rektoskopií. Berme v úvahu fakt, že 40mm tubus operačního rektoskopu lézi „tlačí“ před sebou a vzdálenější léze jsou prakticky nedosažitelné. Stejně tak musíme vzít v potaz individuální členitost a zakřivení rekta.
8.2.4 Předoperační vyšetření
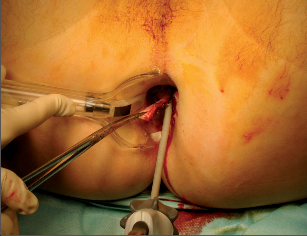
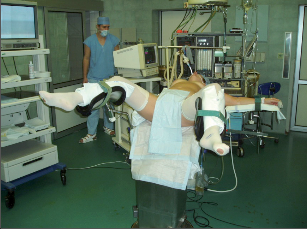
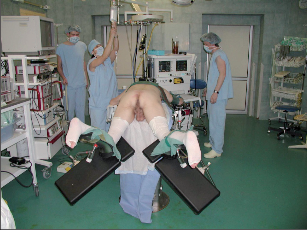
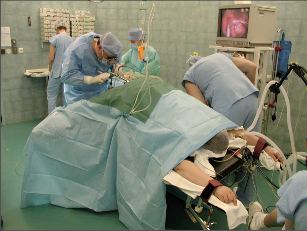
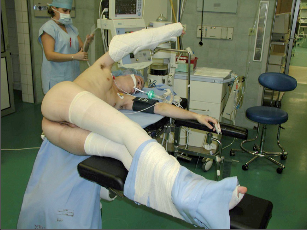
Nejčastější indikací je snesení sesilního polypu, který makroskopicky vypadá jako benigní. Je nutná kompletní předoperační koloskopie k vyloučení duplicitních lézí ve vyšších etážích tračníku. Pokud jde o výšku a umístění tumoru v rektu, je informace z flexibilního endoskopu ne zcela spolehlivá, proto by plánování operace mělo zahrnovat i rigidní rektoskopii. Digitální vyšetření pro klinický staging je možné v případě, kdy je tumor v dosahu prstu. Během rektoskopie se určí spodní a horní okraj tumoru a přesné umístění v cirkumferenci rekta. Tato informace je také důležitá pro správné polohování pacienta na operačním stole. Operovaná léze musí být vždy umístěna tak, aby „ležela na desce operačního stolu“. Proto je metoda T.E.M. prováděna ve čtyřech základních operačních polohách:
- poloze gynekologické (obr. 18),
- poloze kolenohrudní Heidelbergské nebo modifikované poloze Jack Knife (obr. 19, 20),
- poloze na levém boku – Simmsově (obr. 21),
- poloze na pravém boku – Simmsově.
8.2.5 Endoluminální ultrazvuk
Rektální rotační ultrasonografie je u všech pacientů nezbytná ke zjištění hloubky penetrace léze do stěny rekta, případně do perirektálního prostoru, a tím k určení stadia onemocnění (obr. 22). Umístění peritoneálního ohybu (řasy pánevní) se u nádorů v přední stěně horní nebo střední třetiny rekta také nejlépe určí pomocí ultrazvuku. Tumory, které už infiltrovaly do submukózy nebo rektální stěny kraniálně od peritoneálního ohybu, by neměly být léčeny pomocí T.E.M., protože plně hloubková resekce by mohla vést k perforaci stěny střeva do peritoneální dutiny.
Endosonografie rekta je dnes neodmyslitelnou součástí stagingu karcinomu rekta. Při stanovení stadia tumoru vyniká svou senzitivitou (95 %) a specifitou (89 %). Je schopna zobrazit uzliny v perirektální oblasti velikosti od 3 mm, specifita při posuzování jejich malignity je však nízká. Udává se kolem 70 %, spolehlivější je však údaj 50 %. Nejvyužívanější instrumentárium k provedení rektální sonografie představujírotační mechanické měniče se střední až vyšší frekvencí (7,5–10 MHz) s možností zobrazení jak v rovině transaxiální, tak v rovinách k ní kolmých (tzv. endfiring zobrazení). Užití elektronických měničů má také své výhody (dopplerometrie), jejich obraz je však méně názorný. Předpokladem dobrých výsledků je kromě adekvátního vybavení a vysokého počtu vyšetření i zkušenost a specializace vyšetřujícího. Ten musí být dobře informován o endoskopickém obraze a anatomických poměrech v oblasti anorekta a především o vzdálenosti předpokládané léze od anu. Vlastní vyšetření pak spočívá v zavedení sondy do maximálně možné vzdálenosti od anu. Zde vyšetřujeme vzdálenější okolí rekta endfiring řezy. Pak následuje stahování měniče (pull-back) s axiálními řezy, které dobře demonstrují postižení stěny tumorem. V místě léze pak doplňujeme řezy v dalších rovinách. Nikdy neopomíjíme posoudit stav svěračů a vzdálenějších periproktálních oddílů.
Nepostižené střevo má zachovány všechny typické vrstvy stěny a lze je vizuálně odlišit od okolních orgánů. Kvalitními měniči rozlišíme dvě hypoechogenní (mukóza a muskularis propria) a tři hyperechogenní vrstvy stěny. Nejčastějšími artefakty pak jsou zbytky stolice či střevní plyn při nedokonalém kontaktu měniče se stěnou rekta.
U endosonografického vyšetření maligních lézí je zjevná tendence nadhodnotit stadium tumoru, což je dáno technickou limitací metodiky. Významným přínosem vyšetření je možnost vyloučení invaze do okolních orgánů. Tato je dána průkazem tenké vrstvičky tuku mezi tumorem a okolními anatomickými strukturami. Pokud tuk chybí, pomýšlíme vždy na invazi, tedy stadium T4. U hraničních nálezů T1–T2 nebo T2–T3 vede endosonografie spíše k nadhodnocení.
Pokud nenalezneme v okolí rekta žádné uzliny, je pravděpodobnost jejich maligního postižení nízká. Hyperechogenní zvětšené uzliny nebývají maligně změněné, hypoechogenní zvětšené uzliny zase nemusí být vždy maligní. Může se jednat o změny zánětlivé. Detekce recidiv tumoru v anastomóze je ztížena možností záměny s pooperačními změnami, a vyžaduje proto biopsii, eventuálně prováděnou pod endosonografickou kontrolou. Při sonografické lokalizaci anastomózy pomáhá nález mírného zúžení střeva s mírnou nepravidelností struktury stěny a případně nález echogenních svorek stapleru. Ostatní tumory rekta (sarkomy, karcinoid, lymfomy) nemají z hlediska endosonografie výrazně odlišné charakteristiky od karcinomů. Možná je vhodné zmínit na tomto místě porovnání rektální endosonografie s vyšetřením endoskopickou rektální cívkou NMR. Na základě nečetných pramenů je prozatím konstatována zřejmá podobná výtěžnost obou metodik. Dostupnost a cena ERNMR však zatím zjevně převyšují dostupnost a cenu ERS, a mluví tedy ve prospěch ERS.
8.2.6 Předoperační příprava
Pacientovi je předložen informovaný souhlas popisující rizika výkonu, včetně rizika přechodu k laparotomii u pacientů s orálně uloženými lézemi. V ojedinělých případech dehiscence sutur se může objevit pooperační krvácení nebo sepse. Je zdůrazněna přibližně 1% pravděpodobnost, že bude potřeba dočasná kolostomie z důvodu komplikovaného hojení. V předoperační přípravě hraje důležitou roli ortográdní mechanická předoperační příprava střeva laxativy (fosfátový roztok, Fortrans). Klademe důraz na kompletní vyprázdnění střeva pro časové oddálení kontaktu stolice s operační ranou v pooperačním období. Příprava gelovými klyzmaty typu Yal tudíž není příliš vhodná. Nedílnou součástí předoperační přípravy je profylaktické podání antibiotika za účelem vzniku „chráněného koagula“, nejlépe v dvojkombinaci širokospektrého antibiotika a antibiotika spolehlivě kryjícího anaerobní kmeny (Bacteroides).
8.2.7 Pooperační léčba
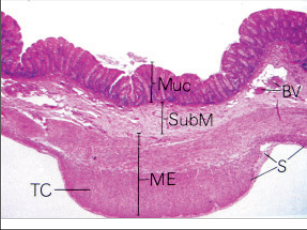
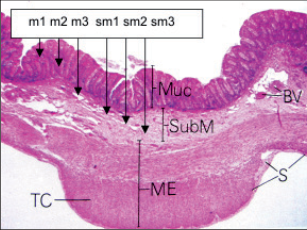
Obr. 23 – Histologický řez stěnou tlustého střeva
(Muc – mukóza, SubM – submukóza, ME – muscularis externa, S – seróza, TC – tenia coli, BV – cévy) ke změkčení stolice a Aesci
Po provedeném operačním výkonu jsou pacienti podrobeni běžnému pooperačním monitoringu odpovídajícímu interní zátěži. Pooperační období nevyžaduje podání analgetik anodyn, pacienti velice dobře reagují na analgetika antipyretika. Je jim aplikován nízkomolekulární heparin jako prevence TEN (trombembolické nemoci). Již první den jsou zatěžováni stravou v pořadí diet 0, 1, 2, v případné modifikaci diet 4 nebo 9. Je podána per os Lactulosa n k minimalizaci pooperačního otoku rekta. ATB terapie je odvislá od rozsahu výkonu a je na zvážení operatéra. Rehabilitace je časná – na lůžku i mimo lůžko.
8.2.8 Endoskopická resekce (ER)
8.2.8.1 Princip endoskopické resekce
Stěna trávicí trubice, jak bylo již dříve zdůrazněno, je složena z následujících vrstev: sliznice, včetně muscularis mucosae, svalové vrstvy – muscularis propria, a zevní vrstvy, většinou serózy. Díky tomu, že svalová vrstva a sliznice pocházejí z různých zárodečných listů (svalová vrstva z mezodermu a sliznice z entodermu), lze je bez větších problémů oddělit aplikací tekutiny podané injektorem mezi obě vrstvy. Díky tomu lze provést resekci sliznice a submukózy a lze ponechat svalovou a zevní vrstvu intaktní. Je nutno si uvědomit, že tloušťka stěny tlustého střeva se pohybuje od pouhých 1,7 do 2,2 mm, přičemž třetinu tloušťky zaujímá sliznice, třetinu submukóza a třetinu muscularis propria (obr. 23, 24).
8.2.8.2 Historie endoskopické resekce
První údaje o této technice pocházejí z padesátých let minulého století. Ještě za éry rigidní endoskopie publikoval v roce 1955 Rosenberg údaje o vyšší bezpečnosti polypektomie ze sigmatu a rekta při submukózní aplikaci fyziologického roztoku. Nejstarší technikou endoskopické resekce je tzv. „strip-off biopsy“, tj. submukózní injekce roztoku a následná resekce vytvořeného pseudopolypu kličkou. Tato metoda byla poprvé popsána Dehlem v roce 1973. V roce 1983 prvně tuto metodu použil Japonec Tada k odstranění časného karcinomu žaludku. Jeho práci lze považovat za klíčovou, neboť stála na počátku celosvětového rozšíření techniky endoskopické resekce.Obdobná, ale přece jen jiná technika, tzv. „grasping and snaring“ (nebo „lift and cut“), tj. povytažení sliznice například bioptickými kleštěmi nebo druhou kličkou při použití dvoukanálového koloskopu, byla poprvé popsána v roce 1976 Martinem a později Japoncem Takekoshim, kterého lze rovněž považovat za jednoho se zakladatelů techniky ER. Obě popsané techniky vytvořily základ pro dnes rutinní „strip biopsy“, tj. podpich, povytažení, čili retrakci a resekci. Modifikaci s využitím jehlového nože popsal jako první Japonec Hirao v roce 1988. Po submukózní injekci fyziologického roztoku s adrenalinem je okraj léze s bezpečným lemem sliznice odříznut jehlovým nožem a takto oddělená tkáň je pak snesena kličkou. Jedním ze současných nejvýznamnějších endoskopistů na poli ER je Japonec Haruhiro Inoue. Vyvinul dnes velmi populární techniku ER za použití transparentního cylindru, do kterého je tkáň před resekcí nasáta a pak snesena speciálně umístěnou polypektomickou kličkou.
8.2.8.3 „Lifting sign“ a „non lifting sign“
Ačkoliv submukózní injekce je klíčovým momentem ER, technika jejího provedení není sjednocena. Submukózní injekce vede k tvorbě prominence – pseudopolypu u jinak plochých či vpáčených lézí, a tím umožňuje jejich resekci kličkou. Zároveň se tak zvyšuje bezpečnost výkonu stran rizika perforace stěny střeva. Nadzvednutí sliznice po vpichu (tzv. „lifting sign“) je jedním z nejdůležitějších znamení, že léze je omezena na sliznici střevní, eventuálně na submukózu, a že neprorůstá do muscularis propria. Absence „lifting sign“, čili „non lifting sign“, je považována za kontraindikaci k ER. Diagnostická hodnota „non lifting sign“ byla hodnocena v celé řadě studií, většinou u pacientů s časným karcinomem tračníku. Uno a Munakata publikovali senzitivitu 100 %, specifitu 99 % a pozitivní prediktní hodnotu 83 % pro invazivní karcinom.Kato a kolektiv rozlišili 4 typy možného nadzvednutí tkáně a tomu odpovídající procenta invaze do submukózy (sm) a muscularis propria (mp):
- úplně elevovaná měkká léze (4 % sm 1, 0 % sm 3 a více),
- úplně elevovaná, ale rigidní léze (5 % do sm 1, 13% sm 2, 0% sm 3 a více)
- neúplná elevace (100 % invaze do submukózy, 20 %mp),
- „non lifting sign“ (100 % sm 3 a více).
8.2.8.4 Endoskopická mukózní resekce v tlustém střevě
Rozvojem ER je možno endoskopicky odstraňovat i jednoznačně ploché nebo dokonce vkleslé léze kdekoliv v tračníku. V céku, ascendens a transverzu však hrozí vyšší riziko perforací vzhledem k tenké stěně. Z makroskopického hlediska jsou k ER vhodné léze„lifting sign“ bez rigidity, bez vředů na povrchu stadiaI–VI „pit patern“ klasifikace:
- I – oválná jamka,
- II – jamka hvězdicového nebo papilárního charakteru,
- III – velká oválná jamka,
- IV – větvená nebo gyrifikovaná jamka,
- VI – nepravidelná struktura,
- VN – zcela bez struktury.
S přibývajícím časem lze předpokládat snahu o možnost zdokonalení techniky vnitřní resekce i rozsáhlejších nádorových lézí bez nutnosti laparotomie či laparoskopicky asistované resekce. Prototyp nástroje k celostěnné vnitřní resekci byl vyvinut Bostonskou univerzitou v USA, avšak jeho další vývoj byl prozatím zastaven. Lze dále předpokládat zdokonalení a miniaturizaci endoskopického instrumentaria a zavedení robotizace. S tímto pokrokem se naskýtá řada otázek, např. jaké jsou přesné indikace, kdo má ER provádět a kde jsou její hranice. Dosti podrobně je tato problematika prozatím zpracována jen pro T.E.M.
8.2.9 Výsledky autorského kolektivu metody T.E.M. Buess, Theis, Hutterer, Said z let 1986–1995
Technika T.E.M. byla do klinické praxe uvedena na chirurgické klinice Univerzitní nemocnice v Kolíně (Německo) v roce 1983. Poté začali autoři provádět T.E.M. roku 1985 v Mohuči a v roce 1989 v Tübingenu. Mezi lety 1986 a 1995 bylo v Mohuči operováno 226 pacientů a v letech 1989 až 1994 355 pacientů v Tübingenu. V Tübingenu byl indikací u 236 pacientů rektální adenom, u 98 rektální karcinom, u 7 karcinoid a u 14 pacientů jiné. 11% ze skupiny s adenomem bylo léčeno mukosektomií a 73 % full-thickness excizí, včetně 4 % segmentální resekcí. Průměrná doba operace byla 62 minut u mukosek tomie, 97 minut u full-thickness resekce a 163 minut u segmentální resekce. Velikost tumorů se pohybovala od 1mm2 do 95mm2. Velikost (plochy) resekovaného vzorku, včetně bezpečnostního lemu, se pohybovala od 20mm2 do 140mm2.Komplikace se objevily u 5,5 % ve skupině s adenomem (13 z 236). U tří pacientů bylo třeba provést kolostomii kvůli dehiscenci sutury, u tří vznikla rektovaginální fistula a u sedmi bylo třeba provést transanální hemostázu kvůli pooperačnímu krvácení. Ve skupině s karcinomem bylo třeba chirurgického zásahu pro komplikaci u 8 % (8 z 98). Tři pacienti podstoupili Hartmannovu operaci nebo kolostomii kvůli dehiscenci sutur. Tři pacienti podstoupili exstirpaci rekta – jeden pro perineální flegmónu, druhý pro rektovaginální fistuli a další pro pooperačně diagnostikovanou rakovinu T2. U dalších dvou pacientů bylo třeba transanální sutury pro ošetření pooperačního krvácení. Jeden pacient s adenomem zemřel následkem kardiopulmonální nedostatečnosti; mortalita tedy byla 0,3 % (1 z 355).V Univerzitní nemocnici v Mohuči byla míra komplikací 2,9 %. V jednom případě se jednalo o rektovaginální fistuli, v jednom o prosakování anastomózy a v pěti o pooperační krvácení s následným hemoragickým šokem. Mortalita byla 1,2 %, způsobená u jednoho pacienta infarktem myokardu, plicní embolií u druhého a sepsí z dehiscence sutury u dalšího. Ze 238 pacientů, kteří podstoupili T.E.M. nebo konvenční transanální excizi kvůli benigním rektálním polypům, byla u 193 pacientů shromážděna data z následného sledování praktickým lékařem. Sledování probíhalo pomocí dotazníku od 1 do 10 let po T.E.M. Dvacet dva pacientů zemřelo, dva na metastázující karcinom rekta a jeden po operaci metastazujícího karcinomu. Jeden měl reziduální tumor a dva metastázy lymfatických uzlin.Všichni pacienti, kteří podstoupili T.E.M., byli bedlivě sledováni, včetně rektoskopie, tři a šest měsíců po operaci a pak vždy jednou ročně. U dvou pacientů se rozvinula rakovina rekta dva a osm let po T.E.M. Rekurentní rektální polypy byly zjištěny u sedmi (3,6 %) pacientů. Průměrná doba latence k diagnóze byla 12 (3–24) měsíců.Z 362 pacientů s adenomem operovaných T.E.M. v Tübingenu v letech 1989 až 1996 bylo 96 % sledováno průměrně 34 měsíců. Rektální adenomy dál od jizvy, klasifikované jako nová adenomová formace, byly zjištěny u 26 pacientů. V šesti případech (1,7 %) se adenom opět objevil proximálně od resekční jizvy.54 z 98 pacientů s konečnou histologickou diagnózou karcinomu bylo pT1 málo rizikových, dva byli pT1 vysoce rizikoví, 25 pT2 málo rizikoví, dva pT2 vysoce rizikoví, 13 pT3 málo rizikových a dva pT3 vysoce rizikoví. U malé skupiny pacientů byla po T.E.M. provedena nízká přední resekce nebo abdominoperineální excize (amputace). Indikacemi pro tyto další procedury byla absence okrajů bez nádoru při histologickém vyšetření, vysoce rizikový karcinom nebo T2 či T3 málo rizikový karcinom, kde byla indikována radikální chirurgie. Osm z 56 pacientů s T1 karcinomem bylo znovu operováno a dva měli reziduální tumor, žádný neměl metastázy lymfatických uzlin. Osmnáct z 27 pacientů s T2 karcinomem bylo znovu operováno, dva měli reziduální tumor a pět metastázy lymfatických uzlin. Osm z 15 pacientů s T3 karcinomem bylo znovu operováno. Sledování bylo dokončeno u 96 % pacientů s karcinomem a u 94 % s adenomem v průměru za 24 měsíců. Ve skupině s karcinomem se vyskytly dvě lokální recidivy ze 48 pacientů s T1 karcinomem, žádná u pacientů s T2 karcinomem a jedna z šesti pacientů s T3 lézemi. Všichni pacienti s recidivou podstoupili radikální rektální resekci a v následujícím sledovacím období byli bez rekurence.V mohučské skupině s karcinomem T1 (n = 60) během pětiletého sledování po T.E.M. se u čtyř pacientů ze třinácti s vysokým rizikem T1 karcinomu léčených lokální excizí objevila recidiva, zatímco žádný z pacientů s nízkým rizikem recidivu neměl. Sledování pacientů s T1 karcinomem léčených pouze T.E.M. bylo porovnáno se skupinou 47 pacientů léčených radikální rektální resekcí. Dva (4,2 %) pacienti po radikální resekci zemřeli, zatímco po lokální excizi nenastala žádná úmrtí. Nebyly zjištěny žádné rozdíly v pětileté míře přežití ve skupině s málo rizikovým T1 karcinomem mezi pacienty léčenými lokální excizí (79 %) ve srovnání s těmi, kteří byli léčeni radikální resekcí (81 %; P = 0,72).
V roce 1996 porovnala prospektivní randomizovaná studie T.E.M. a přední resekci u pacientů s T1 karcinomem. Do dvou terapeutických skupin bylo zahrnuto 24 pacientů, kteří podstoupili T.E.M., a 26 pacientů léčených přední resekcí. Křivky přežití založené na sledování po průměrnou dobu 45 měsíců v obou skupinách nevykázaly žádné významné rozdíly. Jeden pacient v radikální skupině zemřel na časnou metastázi tumoru, zatímco jiný zemřel ve skupině s lokální resekcí z neurčených příčin. V následné publikaci bylo zaznamenáno, že jedna rekurence ve skupině s T.E.M. byla údajně vyléčena abdominoperineální resekcí.
Ačkoli věk pacientů a umístění rektálního tumoru nevykazoval při srovnání T.E.M. a přední resekce žádné významné rozdíly, ostatní parametry, jako délka hospitalizace, ztráta krve, operační čas a použití opiátových analgetik, se lišily významně ve prospěch T.E.M. Časná a pozdní úmrtnost také vykazovala významné rozdíly: míra časných komplikací byla 21 % u skupiny s T.E.M. a 35 % u skupiny s přední resekcí, zatímco míra pozdních komplikací byla 8% u skupiny s T.E.M. a 23% u skupiny s přední resekcí. Winde také ukázal, že kvalita života a délka hospitalizace byly významně lepší po T.E.M. než po přední resekci.
8.3 Literatura
- Arribas del Amo D, Ramirez R, Palacios Fanlo MJ, Martínez Diez M. Transanal endoscopic surgery for rectal tumors. Rev Esp Enferm. 2000;92: 526–535.
- Azzimuddin K, Reiter RD, Stasik JJ, Rosen L, Khubchandani IT, Reed JF. Transanal endoscopic microsurgery for excision of rectal lesions: technique and initial results. Surg Laparosc Endosc Percutan Tech. 2000;10:372–378.
- Baatrup D, Elbrond H, Hesselfeld P, Wille-Jorgensen P. Rectal adenocarcinoma and T.E.M. Int J Colorectal Dis. 2007;22:1347–1352.
- Betambeau N, Simson JN. Staged anterior resection and TEM to preserve rectal fiction in synchronous malignant and benign rectal lesions. Colorectal Dis. 2007;9:469–471.
- Borschitz T, Wachtlin D, Möhler M, Schmidberger H, Junginger T. Neoadjuvant chemoradiation and local excision for T2–3 rectal cancer. Surf Oncol. 2008;15:712–720.
- Buess G, Hutterer F, Theiss J, Böbel M, Isselhard W, Pichlmaier H. Das system für die transanale endoskopische Rectumoperation. Chirurg. 1984;55:677.
- Buess GF. Local surgical treatment of rectal cancer. Br J Surg. 1998;65:695.
- Doornebosch PG, Tollenaar RA, Gosseling MP, Stassen L, Dijkhuis CM. Quality of after T.E.M. and total mesorectal excision in early rectal cancer. Colerctal Dis. 2007;9:553–558.
- Graaf EJ, Doorenbosch PG, Stassen LP, Debets JM, Teteroo GW, Hop WC. Transanal endoskopic mikrosurgery for rectal cancer. Eur J Cancer. 2002;38:904–910.
- Helgstrand FM, Iversen E, Beck K. T.E.M. The latest 5 years experience in Roskilde County.
- Ugeskr Laeger. 2007;169:1784–1788.
- Ikeda Y, Koyanagi N, Mori M, Akahoshi K, Ueyama T, Sucimachi K. Transanal endoskopic microsurgery for T1 rectal cancer in pathiens with synchronous colorectal cancer. Surg Endosc. 1999;13:710–712.
- Lezoche E, Guerrieri M, Eliciotti F, Zenobi P, Grillo Rugerri FG. Local excision of rectal cancer by transanal endoscopic microsurgery combined with radiotherapy: new concept of radiotherapeutic approach. Lek. 2000;5:72–74.
- Lezoche G, Baldarelli M, Uerelli M, Pannini AM. A prospective randomized study with a 5-year minimum follow-up evalution of T.E.M. versus laparoscopic total excision after neoadjuvant therapy. Department of Summary pride Stefanit,
- II chir. Klin. Chirurgica University of Roma la Sapienz, emanuele.lezochevuniroma.i.