9 Nejčastější onemocnění v proktologii
Úvod
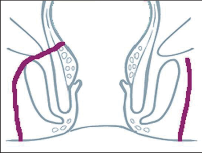
Terminologicky rozumíme konečníkem (rektem) konečnou část tlustého střeva od sigmatu až k řitnímu (análnímu) otvoru. Tato část zažívacího traktu, označovaná také jako anorektální oblast, se skládá z části pánevní a anální. Toto rozlišování často nebývá užíváno zcela přesně. V klinické praxi by pojem konečník měl být užíván jen pro pánevní část. Vývojově je anální oblast původu ektodermálního s citlivou somatickou inervací a oblast konečníku má původ entodermální s viscerální inervací necitlivou na bolestivé podněty. Hranicí obou částí je linea dentata. Diagnostika a léčba onemocnění anorektální oblasti je na pomezí chirurgie a gastroenterologie a vyžaduje speciální znalosti a školení. Proto se vytvořil zvláštní podobor nazývaný proktologie, kterým se ze svého pohledu zabývají obě odbornosti. V následujících kapitolách se pojednává o nejčastějších onemocněních a výkonech v proktologii.
Problematika nejčastějších proktologických onemocnění je častou náplní práce všeobecného chirurga a rozdělili jsme ji do následujících kapitol:
- anální absces a anální píštěl,
- sinus pilonidalis,
- řitní trhliny,
- hemoroidy.
9.1 Anální absces a anální píštěl
Obecně
Klinické obrazy análního abscesu a anální píštěle jsou spolu úzce spjaty a vycházejí ze stejného základu. Téměř vždy je absces předcházejícím akutním jevem a píštěl přímým důsledkem. Anorektální abscesy a píštěle jsou třikrát častější u mužů než u žen.
Abscesy jsou nejčastější mezi 20. a 40. rokem života a píštěle mezi 20. a 50. rokem života.
Etiopatogeneza
Periproktální abscesy jsou způsobeny nespecifickou infekcí rudimentárně uložených proktodeálních žlázek – nejčastěji v oblasti zadní komisury. Tento primární absces se klinicky nemusí projevit a může se spontánně zase zhojit. Absces se také může vyprázdnit přes kryptu do řitního kanálu. Pokud se však šíří infekce podél existujících štěrbin submukózně, subanodermálně, intersfinktericky, transsfinktericky nebo vůbec suprasfinktericky, je výsledkem klinicky výrazný sekundární absces, vlastní periproktální absces. Zde už spontánní reverze není možná. Bez léčby dochází podle polohy abscesu k jeho perforaci do rekta, do řitního kanálu nebo vně do oblasti perianální.
Klinický obraz abscesu
Symptomatika periproktálních abscesů závisí na jejich umístění. Zpravidla se však vyskytují po několik dní intenzivní, pulzující bolesti, které jsou mnohdy k nevydržení, částečně s horečkou a zřejmým pocitem nemoci. Při spontánní perforaci bolesti značně poleví, avšak nevymizí úplně. Důvodem je nedostatečná drenáž. Opětovné zadržování sekretu s novým nárůstem obtíží není výjimkou. Po spontánní perforaci (nebo chirurgické incizi) abscesu pak zůstává – podle průběhu – jedna z níže popsaných píštělí. Klinická symptomatika abscesu je mnohdy méně dramatická, když se absces rozvíjí nejprve kraniálně: ischiorektálně, pelvirektálně, supralevatorně. Zpočátku se objevuje pouze nepříjemný tlak nebo pocit přítomnosti cizího tělesa, s rostoucí expanzí brzy následují silnější bolesti, horečka nebo zimnice se silným pocitem nemoci.
Obzvláště u stavu snížené imunity by se z ischioa pelvirektálních abscesů mohly vyvinout flegmóny pánevního dna nebo až život ohrožující gangréna.
Nález u abscesu
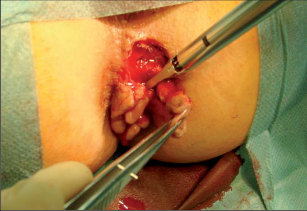
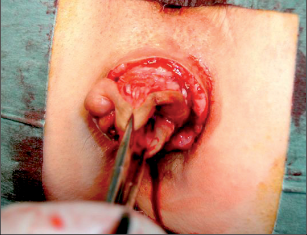
Pro praxi se doporučuje následující rozdělení abscesů;je orientováno podle anatomických struktur.
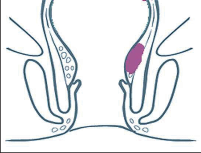
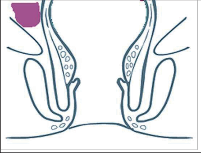
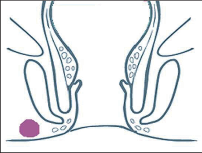
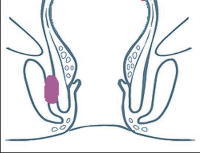
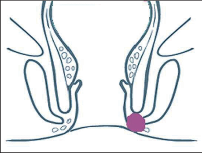
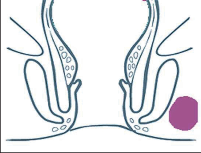
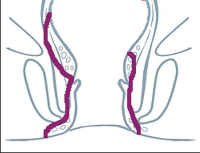
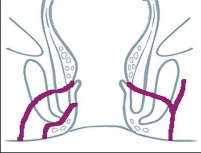
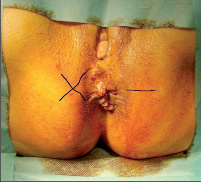
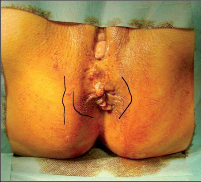
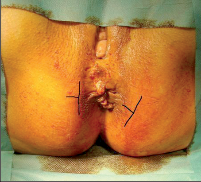
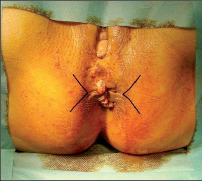
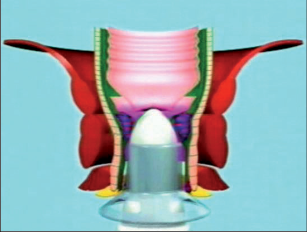
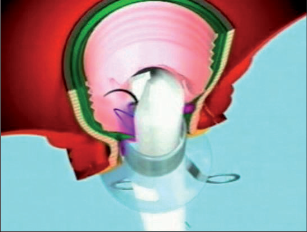
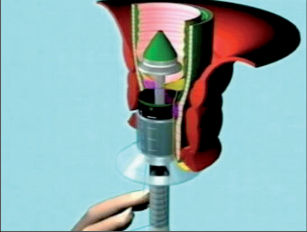
- Ischiorektální absces
Abscesy uložené v ischiorektální jámě jsou ohraničeny dovnitř svalstvem svěrače, kraniálně zdvihačem konečníku a vně kostí sedací. Mohou se vyskytovat jedno-, ale i oboustranně. - Intersfinkterický absces
Abscesy nacházející se mezi svěrači se vyprazdňují převážně prostřednictvím vývodů infikovanýchproktodeálních žlázek a poté často vystupují jakoneúplné vnitřní píštěle, z nichž se např. při vyšetření nárazově uvolňuje hnis; jiné perforují distálně. Tyto abscesy se však mohou vyskytovat takév supralevátorové oblasti, z níž vedou k suprasfinkterickým píštělím. - Subanodermální – submukózní absces
Jejich výskyt je poměrně řídký, leží na povrchu mezi svalstvem svěrače a análním, příp. rektálním epitelem. Podle toho se zde rozlišují submukóznía subanodermální abscesy. U subkutánního rozšíření je z pohledu diferenciální diagnostiky potřeba pomýšlet na anální acne inversa. - Pelvirektální absces
Tyto abscesy mezi stěnou rekta a svalstvem zdvihače se označují také jako supralevatorní abscesy.
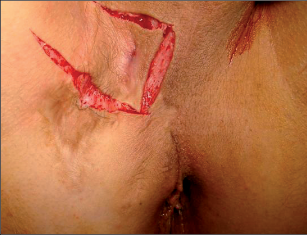
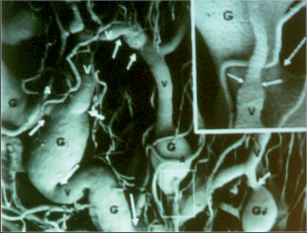
Klasifikace abscesů dle Nováka (Novák 1985) je znázorněna na obrázcích 1 až 6.
Klinický obraz „píštěle“
Na rozdíl od abscesu je klinická symptomatika perianálních píštělí méně dramatická. V popředí je různě silné vyměšování hnisavě-serózního sekretu, nezřídka s výrazným análním ekzémem. Epitelizace a následný uzávěr vnějšího ústí píštěle může způsobit přechodné zadržování sekretu, aniž by se však píštěl zhojila. Poté je otázkou času, kdy se píštěl nebo nový absces opět rozvinou.
Klinický nález u píštěle
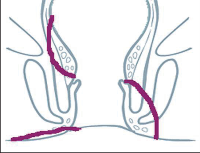
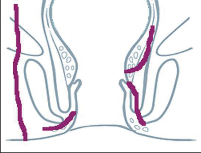
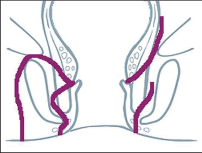
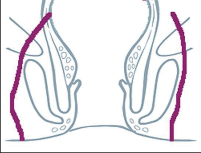
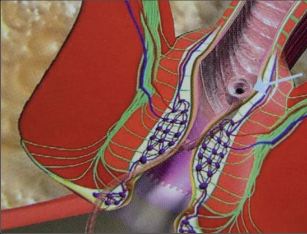
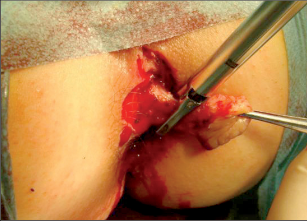
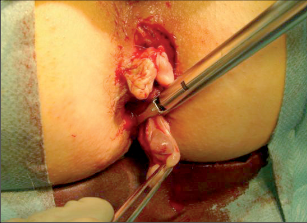
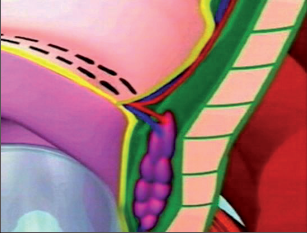
U perianálních píštělí se rozlišuje pět typů – podle jejich průběhu. Vnitřní, také primární, otvor je vývodem proktodeální žlázky, tedy krypty. Vnější otvor je většinou umístěn perianálně. Po spontánní perforaci abscesu do rekta leží sekundární otvor píštěle v horní části řitního kanálu, příp. ve spodní části rekta. Dva otvory píštěle – vždy po obou stranách řitního otvoru – poukazují na tzv. podkovovitou píštěl. U silně rozvětvených píštělí s více otvory hovoříme o píštělích ve tvaru „liščí nory“.
- Submukózní (subanodermální) subkutánní píštěl
Probíhají pod sliznicí rekta nebo anodermu, příp. vnější kůží a jsou často důsledkem kryptitidy nebo trhliny. - Intersfinkterická píštěl
Povětšinou se jedná o distální průběh mezi vnitřním a vnějším svěračem, často u chronických trhlin. Mohou mít proximálně neúplné postranní větve až hluboko retrorektálním směrem. - Transsfinkterická píštěl
Tyto píštěle pronikají vnitřním a vnějším svěračem,ústí v oblasti perianální kůže a nezřídka mají proximálně slepá vedlejší ramena v prostoru uvnitřsvěrače. - Suprasfinkterická píštěl
Tento velmi ojedinělý typ píštěle sestupuje v prostoru uvnitř svěrače, zahrnuje celý vnější svěrač řitní, obloukovitě dosahuje přes puborektální kličkuk fosse ischiorectalis a odtud k vnější kůži. Také zdese často vyskytují slepé vedlejší chodbičky větvícíse z hlavní chodby píštěle. - Extrasfinkterická píštěl
Píštěle tohoto druhu se vymykají výše uvedenému schématu, protože nevycházejí z proktodeální žlázky, čímž chybí jinak běžné spojení s řitním kanálem na úrovni zubaté linie. Tyto píštěle jsou většinou důsledkem jiného onemocnění (např. anální formy Crohnovy nemoci) nebo iatrogenních zásahů.Probíhají od vnitřního otvoru nad zubatou linií v rozšířené části konečníku přes zdvihač ke kůži.
Obdobná je situace u píštělí rektovaginálních. Ani tyto nelze přiřadit k výše popsanému schématu; jsou nejčastěji následkem porodních traumatických lézí, následkem resekčních výkonů v oblasti rekta, následkem aktinoterapie nebo Crohnovy choroby. 85–95 % všech píštělí probíhá intera transsfinktericky.
Průběh
Reverze periproktálního abscesu není možná. Není-li vyprázdněn chirurgicky, dochází zpravidla k jeho spontánní perforaci. Ta proběhne – bez ohledu na umístění – vně, do řitního kanálu nebo také do rekta. S tím se pojí rychlá změna klinické symptomatologie (bolesti, horečka, zimnice, obecný pocit nemoci). Většinou se ovšem musí počítat s důsledkem v podobě perianální píštěle. Ta nezávisí na umístění nebo rozsahu abscesu. Pouze tehdy, je-li absces chirurgicky evakuován a zároveň exstirpována k němu patřící píštěl, lze očekávat nekomplikované zhojení.
Ani u perianálních píštělí nelze očekávat spontánní reverzi. Setrvalé vylučování hnisavého, serózního sekretu, které má mnohdy různou intenzitu, je projevem perzistujícího zánětlivého infiltrátu. Bez léčby se musí počítat s progresí onemocnění s novými abscesy a dalšími píštělemi. Nutným následkem je narušení a omezení funkčnosti orgánu kontinence. U imunologických poruch se mohou i zde vyskytnout gangrenózní flegmóny se stavy sepse, představující ohrožení života. U průběhu v řádu let jsou popsány i píštělové karcinomy.
Klasifikace perianálních píštělí podle Nováka (Novák 1985) je zobrazena na obrázcích 7 až 13. Klasifikujeme je dle toho, zda mají jedno či dvě ústí (úplnost) a dle vztahu ke sfikterům a levátorům.
Diagnostika
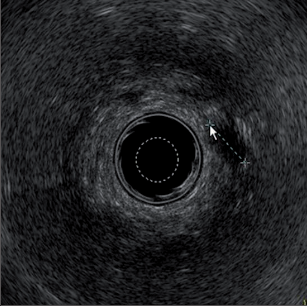
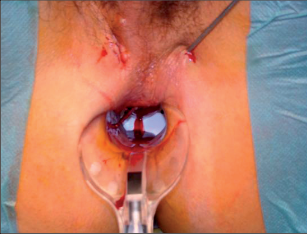
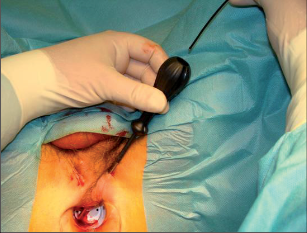
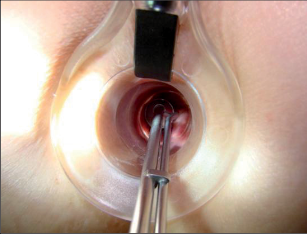
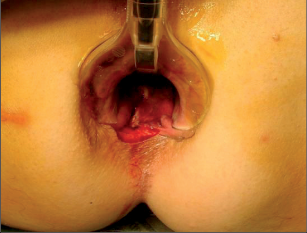
Tzv. zralý absces není obtížné diagnostikovat na základě anamnézy, klinické symptomatologie, aspekce a palpace. Ischiorektální abscesy mají při umístění na povrchu většinou načervenale lividní zbarvení s jasně viditelnou prominencí. Rozšířené abscesy mohou způsobit deformaci štěrbiny anální a případně je potom možné rozpoznat fluktuaci. V počátečním stadiu může být nesnadné s jistotou objektivizovat pelvirektální i ischiorektální abscesy. V těchto případech často pomůže digitální vyšetření rekta s otoky a bolestivostí při palpaci v řitním kanálu nebo spodní části rekta. Přesná diagnostika perianálních píštělí je spojena s většími problémy pouze u komplikovaných průběhů. U nejčastějších intersfinkterických a transsfinkterických píštělí lze většinou rozpoznat dobře viditelný vnější otvor píštěle v různých vzdálenostech od řitního otvoru a ve stejné oblasti řitního kanálu i vnitřní otvor. Podle Goodsallova pravidla je průběh těchto píštělí s vnějším otvorem pod linií mezi třetí a devátou hodinou v litotomické poloze převážně obloukovitý a nahoře přímočarý. Jejich průběh lze dobře vysledovat pomocí paličkové sondy. Ovšem u výrazných zánětlivých infiltrátů není sondování vždy snadné a může dojít ke stanovení falešné cesty. Toto nebezpečí je nutné mít na paměti především u komplikovaných průběhů píštělí s vedlejšími chodbičkami. Sondování by proto nemělo být násilné, ale mělo by proběhnout v anestezii při přípravě k operaci. Rentgenové zobrazování píštělí (fistulografie) se dříve využívalo pouze ve výjimečných případech, dnes se spíše uplatní endosonografie, počítačová tomografie nebo magnetická rezonance (obr. 14).
Diferenciální diagnóza
U análních abscesů a píštělí je vždy nutné pomyslet na Crohnovu nemoc: 10–30% pacientů s Crohnovou chorobou má své prvotní projevy v anální oblasti. Ty mohou vykazovat výše popsané formy a průběhy, ale také nemusí mít žádné spojení s předchozími orgánovými strukturami. Typické píštěle při Crohnově nemoci se mohou vyskytovat náhodně ve všech oblastech řitního kanálu nebo rekta. U acne inversa se objevují nahodilá, ve velké rozloze po obou stranách řitního otvoru vícečetná a navzájem splývající abscedující místa, většinou s mnoha hnisajícími otvory píštělí. Není zde spojení těchto píštělí s řitním kanálem nebo rektem. Také sinus pilonidalis se může vyskytnout ve formě s akutním abscesem nebo chronickou píštělí. Umístění v bezprostřední blízkosti řitní štěrbiny však z pohledu diferenciální diagnostiky zřídka zanechá pochyby. Ve výrazně menším počtu (1–3 %) lze perianální píštěle očekávat u tuberkulózy. Vychází se z kontaminace proktodeálních žlázek ze spolknutých tuberkulózních bakterií. Tyto píštěle přitom není vždy lehké odlišit od klasických píštělí. Relevantní je to v zemích třetího světa.
Léčba
U periproktálních abscesů i perianálních píštělí je nutné chápat chirurgická opatření při léčbě jako prioritní.
Léčba abscesů
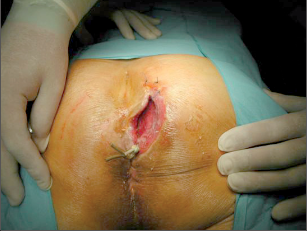
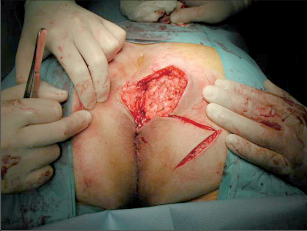
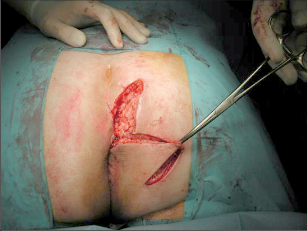
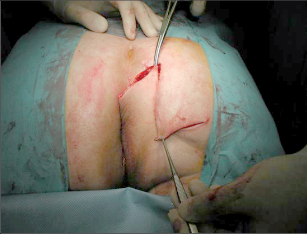
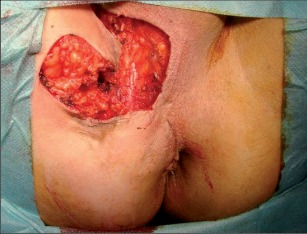
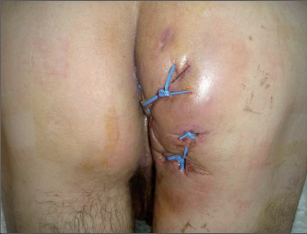
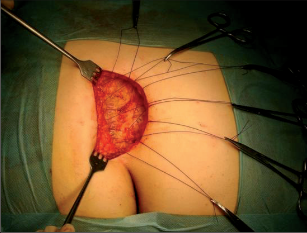
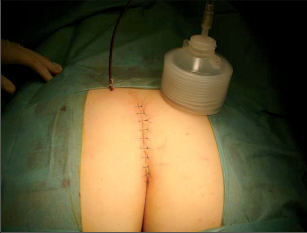
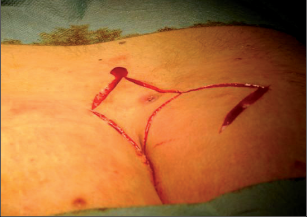
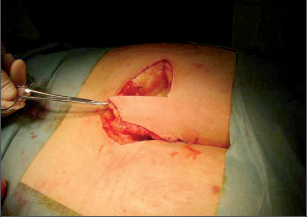
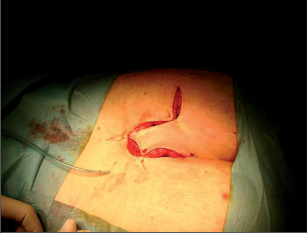
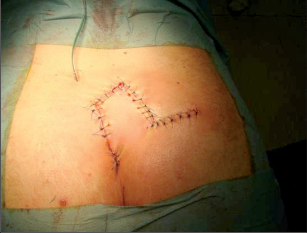
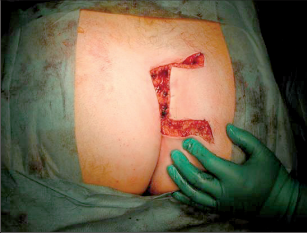
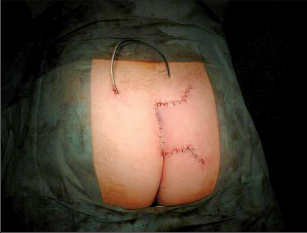
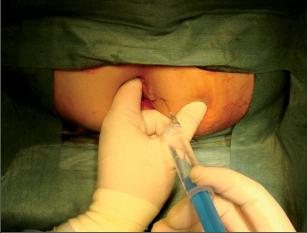
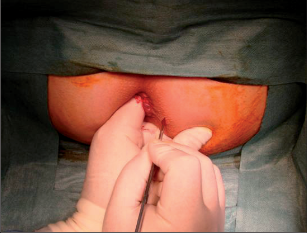
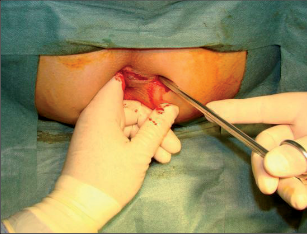
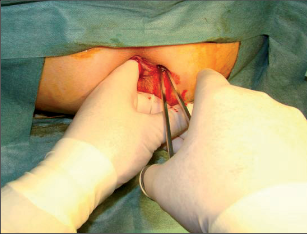
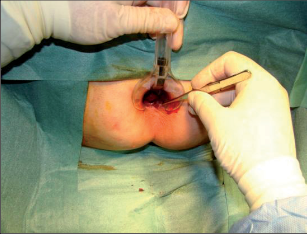
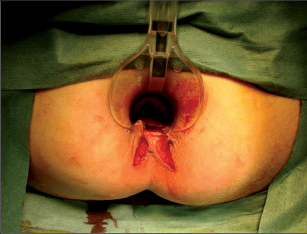
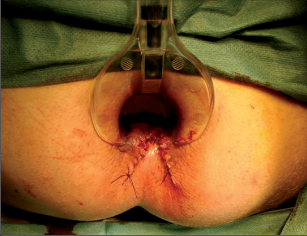
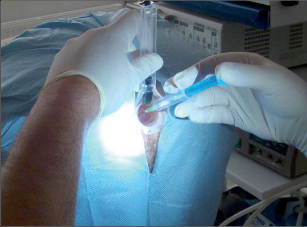
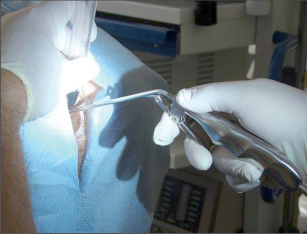
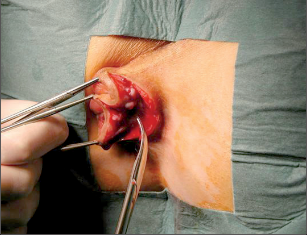
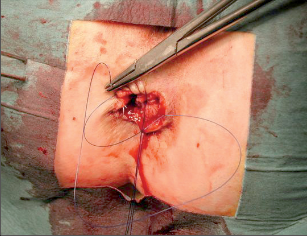
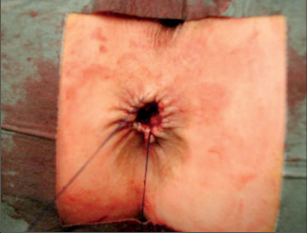
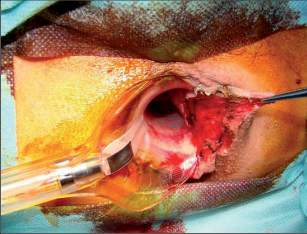
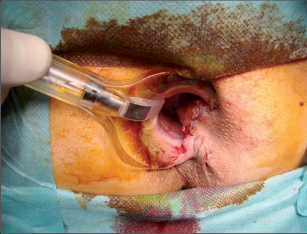
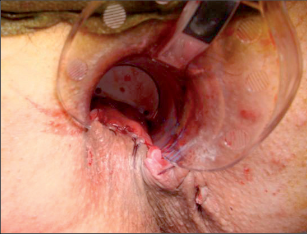
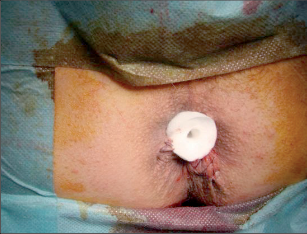
Anorektální absces by měl být v zásadě ihned po stanovení diagnózy incidován a dostatečně drenován. Protože vždy hrozí nebezpečí progrese do okolních struktur, je časový odklad kontraindikován; časové oddálení až do výskytu fluktuace nebo zkušební léčba pomocí „hojivé masti“ jsou vždy špatné. Výlučné podání antibiotik se považuje za chybu lékaře. Léčebný postup by měl zahrnovat širokou trychtýřovitou kožní incizi a následnou sekundární léčbu. Menší perianální abscesy lze zpravidla otevřít ambulantně. Doplňková léčba antibiotiky má smysl pouze v ojedinělých případech, např. při imunosupresi, doprovodné flegmóně měkkých tkání nebo doprovodné septické reakci. Intersfinkterický absces bývá kvůli chybějícímu typickému začervenání na povrchu a zduření mnohdy špatně diagnostikovatelný a obvykle jej lze rozpoznat pouze podle akutní, silné a lokalizované bolesti. Při pochybách u diagnózy se doporučuje nejprve vyšetření v narkóze a navazující úplné odkrytí dutiny abscesu – většinou se zahrnutím distálních částí vnitřního svěrače řitního. U každé operace anorektálního abscesu by se mělo pátrat po příčině. Ve většině případů je kryptoglandulární. Lze-li nalézt spojení píštěle s řitním kanálem, je píštěl primárně operována nebo nejprve pomocí vlákna napojena k několikatýdenní drenáži a poté chirurgicky ošetřena. Nelze-li píštěl primárně nalézt, mělo by se postupovat velice šetrně z důvodu nebezpečí vytvoření falešné cesty (obr. 15 až 21).
Typy incizí perianálních
|
|
|
Léčba anorektálních píštělí
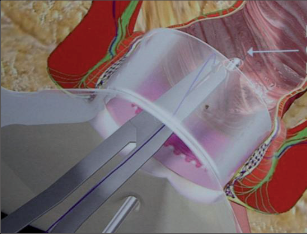
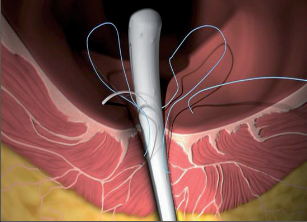
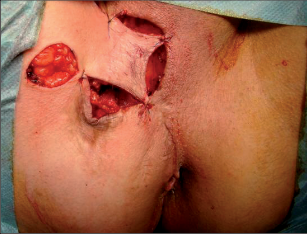
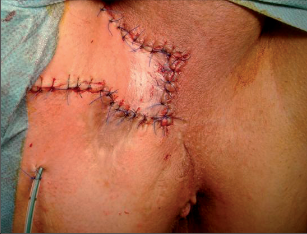
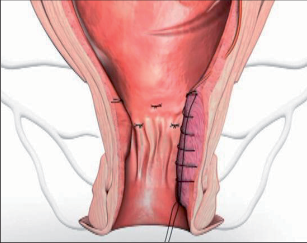
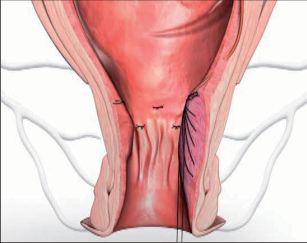
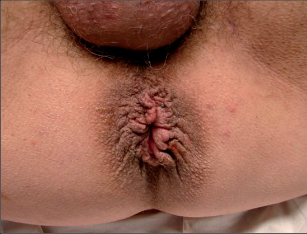
Anální píštěl představuje indikaci pro operaci, protože spontánní zhojení je popisované pouze ve výjimečných případech a je nutné počítat s recidivujícími abscesy. U dlouhotrvajících chronických průběhů jsou popsány i případy vzniku malignomů. Cílem každého chirurgického výkonu u píštělí je vyhojení bez poškození kontinence a bez recidivy. Operativní řešení se orientuje podle průběhu píštěle, tedy podle jejího vztahu k aparátu svěrače. Subanodermální, submukózní, subkutánní, intersfinkterické a distální transsfinketrické píštěle, které zahrnují jen malou část svalstva svěrače, lze úplně discidovat bez omezení kontinence. Míra recidivy se pohybuje okolo 10 %, přičemž narušení kontinence přímo závisí na míře zasažení svěrače. Zatímco v dřívějších dobách se oddělovaly až dvě třetiny svalové hmoty, dnes se postupuje šetrněji. V literatuře se tedy objevují údaje o pooperační poruše kontinence se širokým rozptylem 5–40 %. U již předem poškozeného svěrače jsou proto zapotřebí alternativní opatření. V těchto případech se zavádí volné drenážní vlákno a po několika týdnech se při úplné nepřítomnosti infekce provede roztětí nebo vytvoří plastický uzávěr píštěle. Proximální (vysoké) transsfinkterické, suprasfinkterické a extrasfinkterické průběhy píštělí procházející hlavními částmi svalů se primárně drénují vláknem a po zklidnění se v druhé době řeší plastikou. K tomu se po úplné exstirpaci píštěle především v kryptoglandulární oblasti provede přímá sutura svěrače s plastikou pomocí posuvného lalůčku ve tvaru U z mukózy a submukózy, čímž se uzavře vnitřní ústí píštěle. Kožní rána se široce otevře, aby mohl odtékat sekret. Toto kulisovité uspořádání stehů nabízí nejlepší šance na zhojení. Bezprostřední insuficience sutury plastiky se vyskytne až u 20% případů, míra recidivy se pohybuje mezi 5 až 30 %. Nenápadné poruchy kontinence se zde uvádějí až u 40%, inkontinence pevné stolice se však vyskytuje pouze v ojedinělých případech. V posledních letech se na specializovaných pracovištích stále častěji provádí u proximálních píštělí jejich roztětí s primární okamžitou rekonstrukcí svalu. Nemnohé dosavadní zkušenosti udávají míru vyhojení v 80–90%, avšak také 5–10% míru dehiscence. V následujících letech bude nutné další vyhodnocení. V roce 2009 se do České republiky rozšířila z USA také „Anal-Fistula-Plug“ (zátka). Pomocí úzkého cylindru vyrobeného z vepřového kolagenu se kanálek píštěle uzavře zevnitř. Rozsáhlejší odstranění tkáně píštěle se zde na rozdíl od jiných technik neprovádí, což tuto operaci usnadňuje. Po počátečních vysoce euforických údajích o úspěšnosti s mírami vyhojení přesahujícími 85 % uvádějí novější publikace míry zhojení mezi30 až 70%. Konečné posouzení nyní ještě není možné. Jsou naplánovány multicentrické randomizované studie. Vedle výše popsaných metod se v některých případech uplatňují také jiné techniky: přímé úplné roztětí a jednodobá nebo dvoudobá rekonstrukce a svalový interpozit. Zvláštní formu anorektální píštěle představuje rekto-, příp. anovaginální píštěl. Její diagnostika a léčba probíhá analogicky dle výše uvedených postupů. Kvůli její poloze je však nejčastěji nutný plastický zásah. V důsledku toho, že v této oblasti chybí u rektovaginálního septa okolní vazivová a svalová tkáň, jsou míry úspěšnosti nižší než u ostatních anorektálních píštělí. U análních Crohnových píštělí je 75% stejně jako u jiných píštělí kryptoglandulárního původu a má stejné průběhy. Oproti tomu 25% nesleduje anatomické struktury a proniká tkáněmi destruktivním způsobem. Jejich léčba probíhá rovněž podle výše popsaných strategií. Protože jsou kvůli vysoké míře recidivy základního onemocnění v mnoha případech nutné opakované chirurgické zásahy, mělo by se obzvláště dbát na šetrné zacházení se svalstvem svěrače. Před každým rekonstruktivním zásahem u píštěle musí být systémové abdominální onemocnění pod kontrolou a lokální nález musí být bez přítomnosti infekce. U složitých píštělí se sériemi recidiv je volná dlouhodobá drenáž vláknem opatřením, které pacient zpravidla velmi dobře snáší a které může zamezit zavedení stomie nebo jej přinejmenším oddálit.
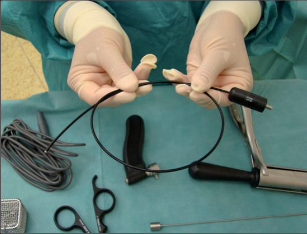
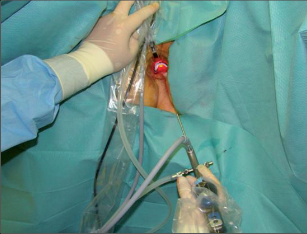
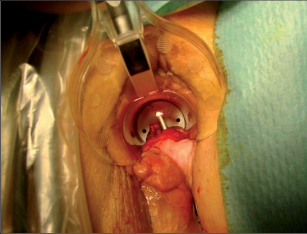
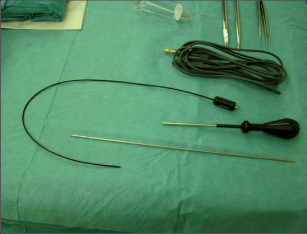
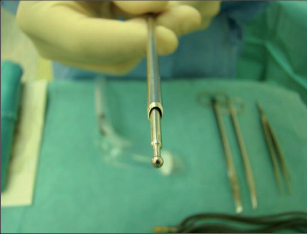
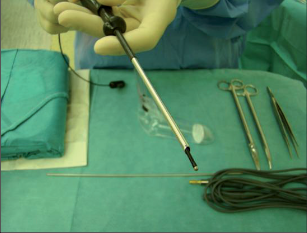
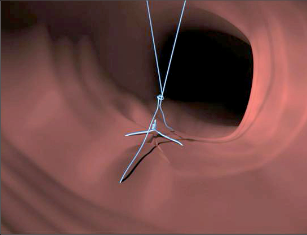
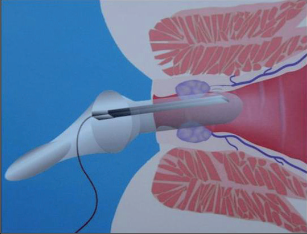
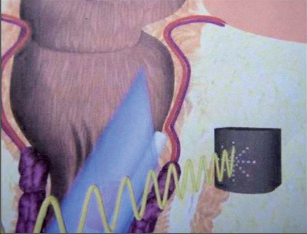
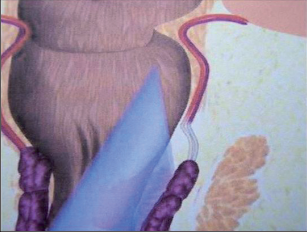
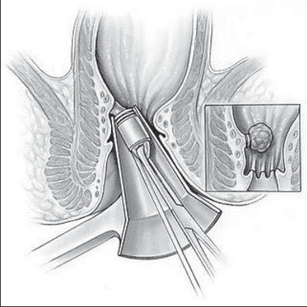
VAAFT – video assisted anal fistula treatment
Jedná se o mininvazivní techniku, která využívá k nasondování píštěle speciálně upraveného ureteroskopu – fistuloskopu, kterým, po průvleku fistulou, je zavedeno vlákno bipolární koagulace nebo vlákno diodového laseru a v průběhu fistulace je provedena fotokoagulační či elektrokoagulační syringotomie. Předpokladem úspěšného vyhojení fistulace je samozřejmě pečlivý uzávěr vnitřního ústí píštěle, který lze provést klasicky suturou, posuvným slizničním lalokem či suturou staplerem. Výkon může být doplněn aplikací tkáňového lepidla nebo aplikací kónické zátky, tzv. plugu. Léčebné postupy u píštělí jsou znázorněny na obr. 22–37.
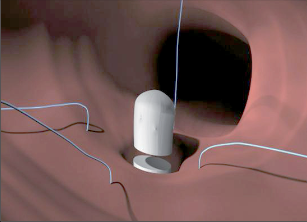
Anal-fistula-plug, anální zátka
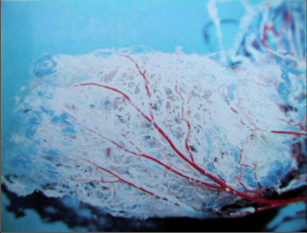
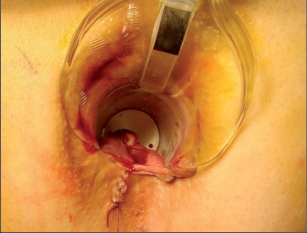
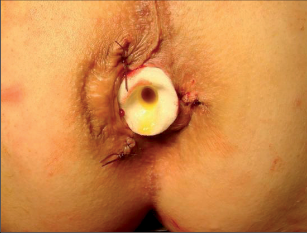
Je moderní metoda léčby periproktálních píštělí implantací biologické zátky, která je vyrobena tak zvanou SIS biotechnologií (small intestinal submucosis). Jedná se o zátku vytvořenou srolováním biologického materiálu, získaného ze submukózy tenkého střeva prasete. Z této tkáně jsou speciálními postupy odstraněny buněčné struktury mukózy se zachováním intaktní struktury submukózní matrix. Konečným produktem je prostorová extracelulární matrix. Zátka je tedy snadno manipulovatelná, sterilní, plně biologicky degradabilní. Nedochází u ní k rejekci nebo zapouzdření. Po implantaci SIS dochází k intenzivní angiogenezi, následnému osídlení stromatu buněčnými elementy a ke tkáňové přestavbě (obr. 38 až 41).
Postup operace
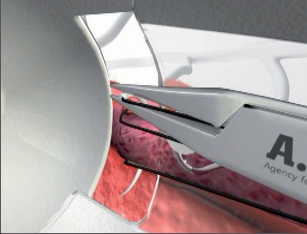
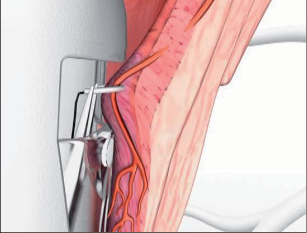
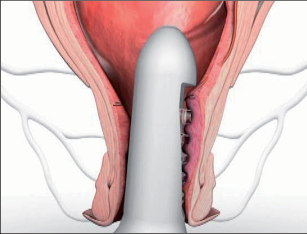
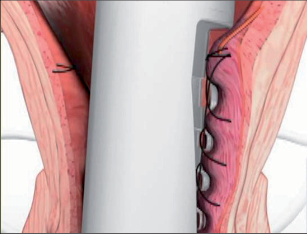
Anální fisurou se provleče zaváděč, pomocí kterého je následně protažen speciální kartáček, jímž provedeme rozrušení stěny fistuly se snahou obnažit okolní zdravou tkáň. Provádíme vyčistění kanálu od tkáňového detritu proplachem a poté pomocí protažené ligatury provlékáme takto vzniklým kanálem kónickou zátku z materiálu SIS. Zátku fixujeme ke svalovým strukturám stěny rekta a kryjeme plastikou sliznice. Zevní konec zátky odstřihneme v úrovni okolní kůže(obr. 42 až 48).
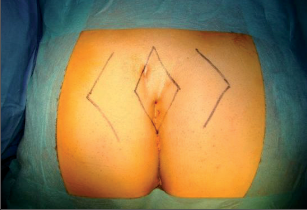
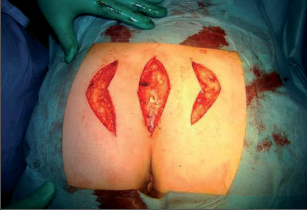
U obtížně se hojících fistulací perianálních či u nedobře technicky sanovaných fistul lze využít metody T.E.M. Double flap. Metoda spočívá v kompletní excizi fistuly v celé délce ve zdravé perirektální tkáni a uzávěru obou ústí posunutým lalokem. Metodu lze úspěšně použít u kompletních vysoce komunikujících píštělí, kde vnitřní advancement flap vytváříme technikou T.E.M., zevní ústí pak ošetřujeme některou z technik posunu či přetočení kožního laloku. Plastiku je nutno pojistit ileostomií (obr. 50 až 56).Po totální excizi píštěle, plastiky zevního defektu dle Limberga nebo Schimanowského uzavíráme vnitřní ústí posunutým lalokem technikou T.E.M. advancement flap nebo pomocí stapleru Trans STARR.
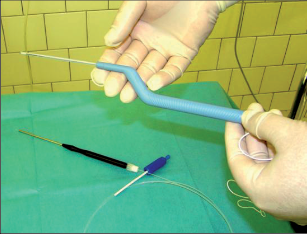
Dlouhodobá drenáž vláknem
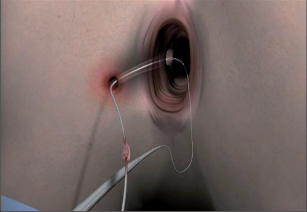
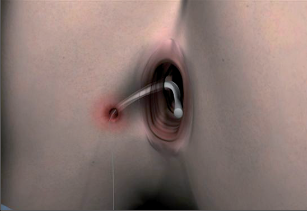
Na rozdíl od výše zmíněné drenáže vláknem při chirurgickém ošetření abscesů představuje dlouhodobá drenáž vláknem možnost léčby u vybraných případů perianálních píštělí. Cílem dlouhodobé drenáže vláknem je dosáhnout v řádech několika týdnů až měsíců epitelizace celého průběhu píštěle. Za tímto účelem jsou průběhy píštěle – případně také více píštělí – drénovány pomocí latexového nebo silikonového vlákna a konce jsou zavázány do volné smyčky. Tímto způsobem se píštěl udržuje neustále otevřená a zabraňuje se hromadění sekretu (obr. 57). V minulosti prováděná drenáž vláknem podle Hippokrata s cílem postupného protětí a jizvení aparátu svěrače se dnes kvůli vysoké míře inkontinence, silných bolestí v průběhu týdnů trvající léčby a dalším komplikacím nepoužívá.
Fibrinové lepidlo
Další možnost konzervativní léčby představuje v poslední době stále více propagované ošetření perianálních píštělí pomocí nového typu fibrinového lepidla, u něhož již máme k dispozici spolehlivé posouzení. Tato autologní fibrinová lepidla (autologous fibrin tissue adhesive = AFTA) se ve srovnání s dříve používanými jinými lepidly vyznačují obzvláště dobrou přilnavostí tkání. Základním předpokladem hojení je ale eliminace infektu. K tomu je ideální přípravou dlouhodobá drenáž vláknem.
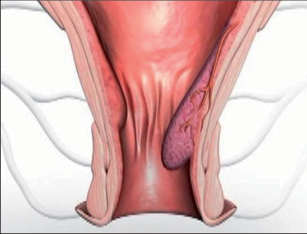
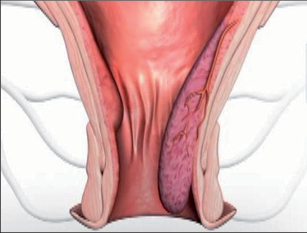
9.2 Sinus pilonidalis
Všeobecně
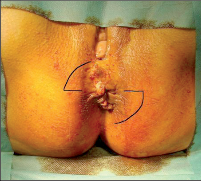
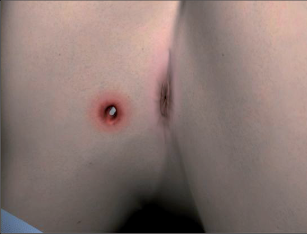
Sinus pilonidalis (pilus = vlasy, chloupky, nidus = hnízdo) je akutní nebo chronicky probíhající zánět v subkutánní tukové tkáni, převážně v oblasti kostrče. Nesprávně bývá označován dermou kostrče – sakrální dermou, jako dermoidní cysta, kostrčová píštěl, raphefistule, pilonidální cysta a sakrokokcygeální cysta. Dermoidní cysta je totiž onemocnění vrozené, bývá nejčastěji diagnostikováno v dětském věku, může obsahovat zbytky embryonální tkáně (vlasy, zuby) a často komunikuje s páteřním kanálem. Jsou rozlišovány tři obrazy pilonidálního sinu: asymptomatická, akutně abscedující a chronická forma.
Incidence
Obraz nemoci se vyskytuje často mezi 20. až 30. rokem života, převážně u mužů. Menzel a spolupracovníci referovali o 103 pacientech; z toho bylo 84 mužů a 19 žen. Během 2. světové války se muselo podrobit operaci pilonidálního sinu 77 637 amerických vojáků, u dalších 9000 mužů byla diagnóza zjištěna jako vedlejší nález – džípová nemoc. Sondenaa et al. vypočítali ze skupiny nemocných v počtu 322 pacientů nahodilost 26 na 100 000 obyvatel; mužů bylo postiženo 2,2krát více než žen.
Etiopatogeneze
Sinus pilonidalis je charakterizován jako získaná i dědičně predisponující choroba. Zdá se, že základem jeho vzniku je multifaktoriální dění, vyvolané následujícími mechanismy: třecí pohyby hýždí tlačí polámané chloupky s jejich kořenovými konci do kůže.
Protože rohovité šupiny chloupků fungují jako zpětné háčky, proniká chloupek stále hlouběji do subkutánní tukové tkáně. Tam dojde k rozvoji granulomů, které perzistují (asymptomatická forma), mohou se ale infikovat (abscesující a chronická forma). Silné ochlupení, adipozita, nadměrná sekrece potu a nedostatečná hygiena těla napomáhají vzniku pilonidálního sinu. Je popsána také rodinná predispozice.
Klinický obraz
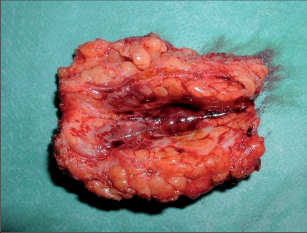
Sinus pilonidalis se vyskytuje z převážné části v rima ani, ale také bývá v oblasti pupku, za ušima, na penisu a interdigitálně u holičů. Potíže jsou závislé na klinickém vzhledu: symptomatická forma je charakteristická nálezem většího množství dilatovaných pórů v rima ani a takto je také diagnostikována. Akutně abscesující forma imponuje otoky a bolestmi často paramediálně rima ani. Po spontánní perforaci odteče hnis. V chronickém stadiu trpí pacienti permanentní nebo občasnou serózně-hnisovou sepurací z dilatovaného póru (primárního otvoru), případně z laterálních sekundárních otvorů. Neexistuje spontánní vyléčení. Asymptomatický sinus dlouhodobě perzistuje, může také přejít do akutní (abscedující) formy nebo do chronického stadia. Po delším neléčení může dojít k maligní degeneraci. Davis et al., Kulaylat et al. našli do roku 1966 více než 40 takových případů; v 80 % se jednalo o dlaždico-buněčný karcinom (obr. 58 a 59).
Diagnostika
Diagnostika se provádí prostřednictvím inspekce, palpace a sondáží. Při tlaku na chronický sinus vyteče často krvavě-serózní tekutina z primárního otvoru ležícího v rima ani. Další diagnostické prostředky nejsou potřebné. Dahl a Henrich viděli v sinu vystlaném epitelem fragmenty chloupků a granulačnítkáně s příměsí obrovských buněk. Elektronově-mikroskopicky se daly prokázat trny nebo do proti háků formované vlasové elementy. Sendenaa et al. vyšetřili 53 pacientů se sinem pilonidálním; prokázali chronickou zánětlivou reakci kůže na základě shlukování keratinu a buněčného detritu. Diferenciálně diagnosticky vzácně přicházejí v úvahu anální Crohnovy píštěle a acne inversa.
Terapie
- Konzervativní terapie chronického sinus pilonidalis
Lokální nebo systémové podávání antibiotik se nedoporučuje, neboť nepůsobí definitivně na vyléčení sinu. Injekce fenolu v roztoku se kvůli vysoké toxicitě a možné resorpci fenolu již nepoužívá. - Chirurgická terapie chronického sinus pilonidalis
Při kyretáži píštělového systému dle Lorda a Millara, která se dnes používá jen zřídka, jsou nejdřív vyříznutím zvětšeny primární a sekundární otvory a subkutánní chodby jsou pomocí kartáčku či exkochleační lžičky vyškrabány a vyčištěny. Tento zásah vyžaduje profylaktickou dávku širokospekého antibiotika. U tohoto postupu byla popsána recidiva v 6%. Metodou volby při akutně abscedující formě je operace. Absces je nejdříve otevřen a tímto je vytvořena účinná drenáž. Definitivní ošetření sinu pilonidalis následuje sekundárně následujícími způsoby:- Excize a sekundární hojení
Je provedena kompletní excize ložiska se všemi fistulacemi až k fascii sakrální. Okraje rány plochá jizva. Pečlivým vyholením musíme před výkonem připravit zónu bez ochlupení. Bascom prokázal, že v pokožce bez folikulů se onemocnění nevyskytne. Pečlivá péče o vytvořenou jizvu je podstatnou součástí konceptu terapie. - Excize s primárním uzavřením rány
Po excizi je rána primárně ošetřena suturou, případně je plasticky rekonstruována. Pro poslední jmenovaný operativní postup jsou doporučeny různé metody. Plastika by měla být provedena při ATB profylaxi.
- Excize a sekundární hojení
Operace pilonidálního sinu posuvným lalokem dle Karydakise
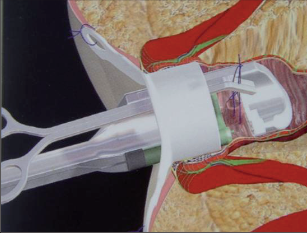
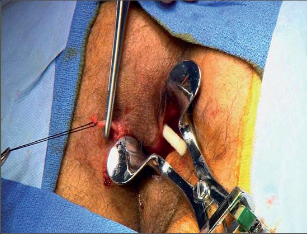
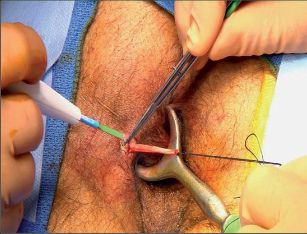
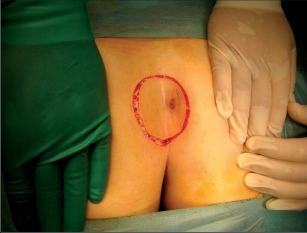
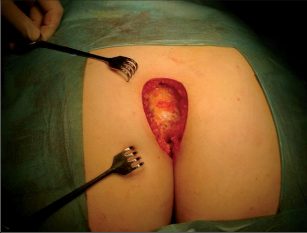
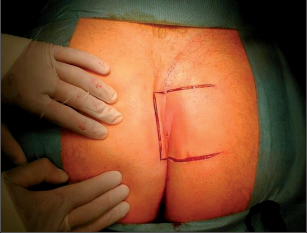
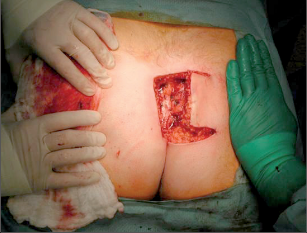
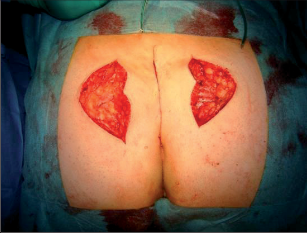
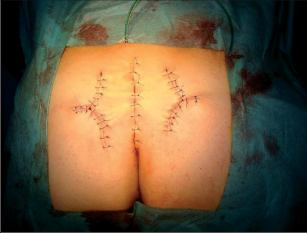
Dr. George Karydakis publikoval svou metodu chirurgické excize pilonidálního sinu v roce 1973. Podstata jeho originálního řešení spočívá v jednoduchém odstranění ložiska sinu bikonvexním eliptickým excentrickým vyříznutím měkkých tkání až k sakrální fascii. Technikou laterálního podminování je pak vytvořen kožně-podkožní lalok, který je přetažen excentricky mediálně. Dojde tak k plastice defektu se změlčením rima ani bez napětí.Po dezinfekci a zarouškování operačního pole v poloze Jack Knife s roztaženými půlkami, které jsou v této poloze fixovány pásy náplasti, jsou hlavní kanál a případná vedlejší ústí sinu nastříknuty patentní modří. Někteří operatéři provádějí výkon bez nástřiku. Eliptická excize je pak situována excentricky k rima ani tak, aby osa elipsy byla vedena cca 1,5 až 2 cm paralelně s rima ani na zdravou stranu, tedy stranu bez vyústění hlavního vývodu a vývodů sekundárních. Jsou-li hlavní vývod a případné vývody sekundární umístěny v rima ani, přesvědčíme se pátradlem o umístění vlastního ložiska sinu. Elipsu pak excentricky umísťujeme na „stranu zdravou“. Excizi kůže a podkoží se sinem provádíme kolmo ke spodině až k fascii sakrální. Pamatujeme na uložení análního kanálu s levátory a svěračovým systémem. Během excize sledujeme případný výskyt modrého zbarvení, které prokazuje caro luxurians a pyogenní membránu případných chobotů sinu. Exaktně stavíme krvácení elektrokoagulací. V polovině tloušťky podkoží pak rovnoměrně se spodinou natínáme podkoží na straně blíže k rima ani, a vytváříme tak lalok pro budoucí posuvnou plastiku. Takto provedenou discizi rozevřeme a v jejím vrcholu nakládáme jednotlivé stehy, které fixujeme ke spodině vzniklého defektu, tedy k fascii sakrální, a dále do podkoží strany protější. Stehy nedotahujeme, ale věšíme. V závěrečné fázi operace povolujeme náplasťové fixace. Vkládáme tenký Redonův drén na spodinu defektu a po přetažení kožně-podkožního laloku ke straně protější jednotlivé stehy uzlíme. Dokončujeme suturu kůže, Redonův drén napojujeme na aktivní sání. Po toaletě rány tuto kryjeme buď lepícím krytím, či do rima ani vkládáme nevelké mulové hypomochlion ve tvaru válečku o průměru asi tak 2 cm (obr. 60–63). V pooperačnmím období by měl pacient ležet na zádech.
Operace pilonidálního sinu přetočeným lalokem dle Limberga
Podstata výkonu spočívá opětovně v kompletní excizi ložiska sinu, tentokrát však ve tvaru kosočtverce či lépe rhomboidu a krytím defektu přetočením rotovaného laloku dle Limberga (obr. 64–67).Po dezinfekci a zarouškování operačního pole v poloze Jack Knife, po nástřiku hlavního vývodu a případných vývodů sekundárních patentní modří provádíme excizi ložiska sinu ve tvaru rhomboidu až k fascii sakrální. Exaktně stavíme krvácení koagulací. Na námi zvolené straně vyměřujeme budoucí Limbergův lalok kožně-podkožní, incize vedeme kolmo ke spodině, k povázce m. gluteus maximus. Podkoží ostře odpreparováváme od povázky, a získáváme tak volný kožně-podkožní lalok. Na spodinu defektu umístíme Redonův drén, nakládáme jednotlivé stehy, které uzlíme postupně po naložení všech. Výkon dokončujeme suturou kůže a napojením Redonova drénu na aktivní sání. Po toaletě kryjeme suturu, po výkonu pacient zůstává v poloze na zádech.
Operace pilonidálního sinu posuvným lalokem dle Schimanowského
Podstata výkonu opět spočívá v excizi sinu, tentokrát ve tvaru obdélníka a ve vytvoření kožně-podkožního obdélníkového laloku, který je doplněn na laterální straně dvěma uvolňovacími trigonálními excizemi, které umožní jeho mediální přesun a krytí vzniklého defektu (obr. 68–71).
Další možnou modifikací je řešení sinu plastikou V-Y (obr. 72–75)
9.3 Řitní trhliny
Obecně
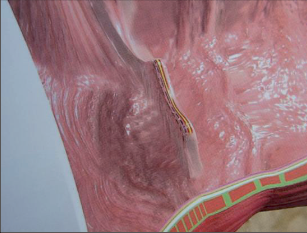
Řitní trhlina patří svou klinickou symptomatologií výrazných a intenzivních bolestí k nejpozoruhodnějším proktologickým onemocněním. Jedná se přitom o podélný, vředovitý defekt v oblasti vysoce citlivého anodermu. Bez cíleně prováděné léčby lze časem očekávat chronický průběh nemoci. Přesná čísla ohledně četnosti výskytu řitních trhlin nejsou k dispozici. V proktologických ordinacích lze počítat, že budou tvořit 10–15 % všech případů.
Etiopatogeneze
Na vzniku řitních trhlin se podílí více faktorů. Velký význam mají poruchy vyprazdňování stolice. Ke vzniku řitních trhlin nevede pouze tuhá stolice, ale také kašovitá a průjmová stolice, která může být konstipačního původu, je důsledkem nadměrného užívání laxativ nebo se vyskytuje při chronických zánětlivých střevních onemocněních. Dochází k zánětlivým procesům v oblasti análních krypt. Kromě toho není řitní kanál dostatečně rozpínán, čímž trpí jeho elasticita. Svůj významný podíl mají také hemoroidy. Za těchto okolností dochází již při fyziologickém namáhání řitního kanálu při defekaci k natržení anodermu se špatnou tendencí k hojení.
- K endogenním faktorům, které přispívají ke vzniku trhliny, řadíme rodinnou predispoziční zátěž, nadváhu a také sklon k trombóze.
- K exogenním faktorům patří nevhodná skladba stravy, nedostatek pohybu, nadměrné užívání laxativ.
- Endogenní faktory společně s exogenními vedou ke ztíženému průběhu defekace, nedostatečnému vyprázdnění krve z hemoroidálních polštářů během defekace, k ektázii hemoroidů s rigiditou análního kanálu. Výsledným stavem je circulus vitiosus: mikrotrauma, zánět, bolestivý spasmus svěrače… Tak vzniká bludný kruh, který vysvětluje vysokou náchylnost k chronickému průběhu onemocnění.
Klinický obraz
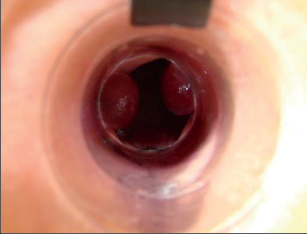
Na rozdíl od mnoha jiných proktologických onemocnění se u řitní trhliny vyskytuje typická symptomatologie. V popředí stojí bolesti související s vyprazdňováním stolice, které nastupují při defekaci (okamžitá bolest) a mohou přetrvávat několik hodin. Při častém vyprazdňování stolice trpí postižený jedinec bolestmi v průběhu celého dne. Jinak bolesti většinou odezní večer a v průběhu noci a následující den se opět dostaví při vyprazdňování stolice. Mnoho pacientů se z důvodu silných bolestí uchyluje k používání projímadel, aby měli stolici co nejměkčí a při defekaci měli menší bolesti. Právě tento krok je ale chybný, protože kašovitá nebo tekutá stolice snáze ulpívá v trhlině a porušuje okraje rány, čímž aktivuje setrvalý zánětlivý proces. Při přechodu do chronického stadia intenzita bolestí ustupuje. Dále je typické křečovité stažení vnitřního svěrače řitního způsobené bolestmi. Digitální vyšetření je mnohdy stěží možné; stolice je široká pouze jako tužka. Krev se obvykle vyskytuje v podélných proužcích na sloupku stolice nebo při čištění na toaletním papíru. Trhlina může nakonec neustále vyměšovat sekret, a tím způsobovat anální ekzém.Řitní trhliny se vyskytují v 80 % na zadní komisuře, v 10–15 % na přední komisuře a zřídka v postranních oblastech. U morfologického nálezu můžeme rozlišit akutní a chronické řitní trhliny, přičemž přechod mezi nimi je často plynulý.
Akutní řitní trhliny
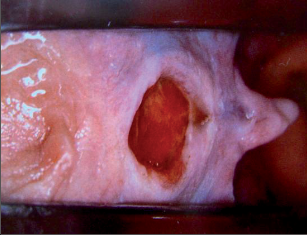
Akutní řitní trhliny se při klinickém vyšetření jeví jako ploché, podélné defekty s délkou 0,5–1,0 cm v oblasti anodermu. Spodina rány je zpočátku prokrvácená a později pokrytá fibrózním náletem. Nápadné jsou v tomto stadiu výrazně ohraničené okraje. Mnohdy lze zjistit apikálně v trhlině prohloubené krypty (obr. 76).
Chronické řitní trhliny
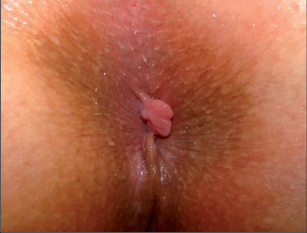
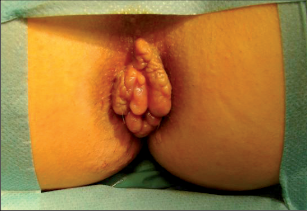
Chronické řitní trhliny se od akutních zřetelně liší. Morfologický nález připomíná kalózní vřed, na jehož spodní části lze pozorovat příčně probíhající bělavá vlákna vnitřního řitního svěrače. Okraje chronických trhlin jsou hrubé a vystouplé. Většinou jsou porušené. Typické pro chronické řitní trhliny jsou hypertrofické anální papily dosahující až velikosti třešně a anální kožní řasy, které při prohlídce jako tzv. předsunuté vrásy či strážní hrboly poukazují na umístění trhliny (viz obr. 80). I tyto mohou nezřídka dosahovat až velikosti lískového ořechu. Chronické řitní trhliny mohou vést ke vzniku neúplné vnitřní píštěle vycházející ze spodní části trhliny, směřující vzad. To vede k zesílenému vyměšování hnisavého sekretu. Mnohdy lze hovořit o chronických řitních trhlinách také tehdy, nezhojí-li se po šesti týdnech (obr. 77).
Histologie
Pro řitní trhliny je na rozdíl od jiných defektů řitního kanálu charakteristický zánětlivý infiltrát pod spodinou trhliny. Rozsah těchto zánětlivých změn se projevuje obzvláště podél nejjemnějších nervových vláken. Tím se vysvětluje také silná intenzita bolestí a hypertonus svěrače.
Průběh a prognóza
Nepodaří-li se co nejdříve prolomit bludný kruh vyskytující se u řitních trhlin, je nutné počítat s přechodem do chronicity. Při ní se stávají obtíže sice méně dramatickými a příležitostně také zcela vymizí, ale onemocnění není vyléčeno. Vždy je za těchto okolností nutné počítat s akutní exacerbací a vznikem abscedujících píštělových onemocnění. Tyto průběhy onemocnění představují riziko pro kontinenci.
Diagnostika
Akutní řitní trhliny lze většinou velice snadno diagnostikovat na základě typických bolestí souvisejících s vyprazdňováním stolice, křečovitě staženého svalstva svěrače, se stolicí často o šířce pouhé tužky a krví na stolici nebo toaletním papíru. Vyšetření – nejlépe pomocí análního spekula – lze usnadnit aplikací lokálního anestetika na trhlinu. Pomocí různě zakřivených sond lze snadno zjistit kapsovité a píštělové útvary a posoudit nejvíce prohloubené krypty. U chronických trhlin je vyšetření obecně méně problematické. Trhlinu lze rozpoznat často již při rozevření hýždí. Digitální sondování řitního kanálu a vyšetření pomocí úzkého análního spekula lze obecně provést bez znecitlivění. Měření tlaku svěrače nemá u řitních trhlin žádný obzvlášť velký význam – ani před operativními zásahy z pohledu forenzní medicíny, neboť neposkytují výpověď o patofyziologických poměrech svěračového systému. Povšechně trvá algicitou indukovaný hypertonus.
Diferenciální diagnóza
Defekty trhlinového charakteru se objevují i u jiných análních onemocnění. Morfologicky často nabízejí podobný obraz, ale většinou jinou klinickou symptomatologii. „Řitní trhliny“ u Crohnovy choroby lze nalézt ve všech oblastech řitního kanálu, zřídka však vedou k bolestem a křečím svěrače. Hovoříme také o atypických trhlinách. Obdobně se jeví léze trhlinového charakteru u anální syfilis. Trhlinové defekty karcinomu řitního kanálu mohou začínat jako u typické trhliny s bolestmi souvisejícími s vyprazdňováním stolice. U dráždivého toxického análního ekzému jsou časté bolestivé paprskovitě rozložené ragády a oděrky.
Léčba
Konzervativní léčba
Klinická symptomatika na straně jedné a nebezpečí přechodu do chronicity na straně druhé u akutní trhliny přímo vyžadují důsledný postup. 70–90 % všech akutních forem lze vyléčit konzervativně, přerušením bludného kruhu farmakologickými přípravky. Základem je vždy úprava stolice prostřednictvím stravy bohaté na balastní látky a příjmu dostatečného množství tekutin (více než 3 litry denně).
Anální dilatace, masáž sfinkterů, anální tampony
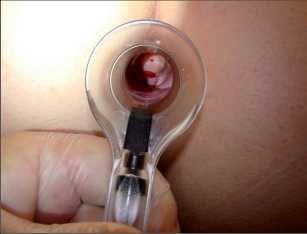
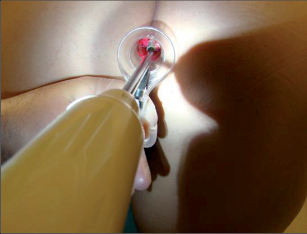
Lokální anestezie s infiltrací spodiny trhliny umožní nejen přesné vyšetření, ale je také rozhodujícím terapeutickým úvodem k samotnému ošetření trhliny: každodenní vlastní dilatace svěrače pomocí nástroje k roztažení análního otvoru a anestetizujícího krému, doplněné o závěrečnou aplikaci obdobně působícího análního tamponu. U méně bolestivých řitních trhlin lze každodenní aplikaci análního tamponu, případně dilataci svěrače provádět bez infiltrace lokální anestezií (obr. 78–79).
Glyceroltrinitrát (GTN)
GTN je při lokální aplikaci na vnitřní a vnější svěrač řitní v koncentraci 0,1–0,4 % metabolizován na oxid dusnatý (NO), což je látka s vlastním terapeutickým účinkem. Odstraní křeče svěrače, navodí jeho relaxaci, zlepší podkožní prokrvení anodermu a zajistí předpoklad pro zhojení trhliny. Přípravek by se měl vmasírovat 2–3× denně nejen do oblasti trhliny, ale do oblasti celého řitního otvoru. Od 1. 1. 2007 je k dispozici Rectogesic jako hotový přípravek. Tento přípravek však není registrován českým lékopisem, dalším nepříznivým ukazatelem je jeho vysoká cena, v neposlední řadě se aplikace přípravku setkává s poměrně častými vedlejšími účinky (bolesti hlavy, nitrátová vazodilatace).
Kalcioví antagonisté
Léčba kalciovými antagonisty je další možností „chemické sfinkterotomie“ u chronických řitních trhlin. Hypertonus hladkého svalstva svěrače u řitních trhlin je založen na mechanismu, který je ovlivněn kalciem. Kalcioví antagonisté jako Diltiazem snižují tonus svěrače, čímž zlepšují prokrvení. Tímto způsobem se, stejně jako u GTN, zajistí podmínky pro zhojení trhliny. Látka zpracovaná ve formě masti se nanáší 2–3× denně do oblasti análního otvoru. Protože tato indikace není v České republice schválena, není hrazena zdravotní pojišťovnou.
Botulotoxin typu A (BTX)
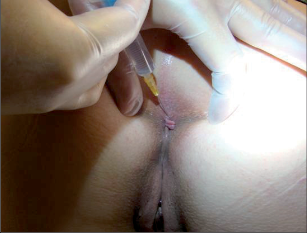
Tato látka je toxinem, který vytváří bakterie Clostridium botulinum. Při intramuskulárním podání je BTX vázán motorickými nervovými zakončeními a způsobuje zhruba tříměsíční ochrnutí svalstva v důsledku potlačení vylučování acetylcholinu. V tomto časovém úseku jsou vytvořeny podmínky pro zhojení trhliny. Již dlouhou dobu je znám jeho efekt v kosmetice a plastické chirurgii, jeho užití v neurologických indikacích a v proktologii je kratší. Aplikací přesně dané dávky botulotoxinu typu A do oblasti trhlinky vede k dočasné relaxaci vnitřního svěrače, a tím k uvolnění velkého svalového napětí a ke zmenšení trhliny. K léčbě se používá velmi tenká jehla a aplikace je prováděna bez celkové či lokální anestezie. Nástup účinku preparátu je uváděn v období 2–3 dnů po aplikaci, naše zkušenosti ukazují, že nástup může být i 4. den po aplikaci. Délka působení BTX je 4–6 týdnů a během této doby máme možnost (pomocí mastí, používáním čípků a lokálních medikamentů) nastartovat hojení fisury, nebo ji dokonce zcela zahojit. Jako téměř veškeré dění v medicíně je i rychlost hojení fisury zcela individuální, dá se však konstatovat, že čím déle a dramatičtěji trhlina v konečníku „obtěžovala“, tím je i léčení zdlouhavější. V těžších případech je indikace i k opakované aplikaci uvedeného preparátu BTX. Tento způsob léčby je možný opakovat. Rizika stojící za zmínku při této léčbě neexistují. Nanejvýše je potřeba počítat ve 2–3 % případů s přechodným omezením kontinence. Nevýhodou jsou vysoké náklady. Léčba kalciovými antagonisty, GTN a BTX představuje způsob chemické sfinkterotomie.
Terapie infračervenou koagulací
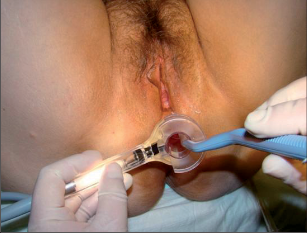
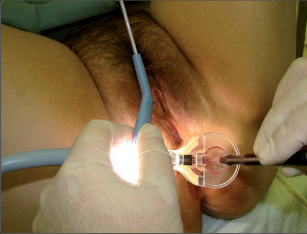
Princip této terapie spočívá v termickém poškození fisurace (akutní nebo chronické) s vytvořením nekrózy (je nebolestivá, neboť došlo k destrukci senzitivních nervových zakončení vytvořením popáleniny III. stupně) a jejím následným odhojením s epitelizací z okrajů defektu. Výkon je prováděn v lokální anestezii, která nám ihned po začátku svého působení umožní provedení šetrné divulze se zavedením anoskopu o dostatečném průměru (obr. 80–84).
Chirurgická léčba
Operaci trhliny indikujeme tehdy, když metody konzervativní léčby nevedly ke zhojení nebo když na základě sekundárních změn, jakými jsou hypertrofické anální papily s prohloubenými kryptami, narušené předsunuté vrásy nebo píštěl na spodině trhliny, nelze zhojení očekávat. Při chirurgickém řešení řitních trhlin jsou k dispozici tři postupy: laterální sfinkterotomie podle Notarase nebo Parkse, mediánní nebo posteriorní sfinkterotomie podle Eisenhammera a fisurektomie podle Gabriela s opatrným manuálním rozpínáním. Všechny tři postupy lze provádět ambulantně, v lokální anestezii.
Při laterální sfinkterotomii je kaudální okraj vnitřního svěrače řitního incidován a prostřednictvím snížení tonusu se tak vytváří podmínka ke zhojení trhliny. Zákrok lze provádět jako otevřený (podle Parkse) nebo zavřený (podle Notarase). Samotná trhlina i se sekundárními změnami a případnými prohloubenými kryptami by měla být současně vyříznuta, přitom by měl být zanechán dostatečný drenážní trojúhelník. Původní technika jej nezahrnovala.
Při operaci trhliny podle Eisenhammera se při vyříznutí trhliny a jejích sekundárních změn provádí hluboká sfinkterotomie v oblasti trhliny. Nevýhodou je zde možnost vzniku tzv. defektu klíčové dírky, který poté může negativně ovlivňovat jemnou kontinenci. Gabriel z tohoto hlediska upustil od hluboké sfinkterotomie a odstraňuje pouze trhlinu a chronické změny jako předsunuté vrásy, hypertrofické anální papily, prohloubené krypty a okraje jizvy. To vedlo ke stejně dobrým výsledkům s menšími vedlejšími účinky. Ve spojení s několikaminutovou manuální divulzí svěrače za vhodného znecitlivění je proto tato operace uplatňována u většiny případů. Při překotném rozpínání řitního kanálu může dojít k ruptuře částí svalstva svěrače. S analgetiky by se po operaci nemělo šetřit. Vlažné sedací koupele mají příznivý vliv na bolesti a slouží k důkladnému očištění rány po vyprázdnění stolice. Nakonec se doporučuje hýždě a ránu opatrně osušit lehkými doteky a nosit mezi půlkami hýždí malé vložky z gázy. Takto se předchází análnímu ekzému zapříčiněnému sekretem z rány. Stolice by neměla být příliš měkká, jinak se zhojení rány prodlouží. Navíc by se mělo asi od osmého dne po operaci začít s vlastním ošetřením (1–2× denně) pomocí nástroje k dilataci análního otvoru, které bude působit příznivě na zhojení rány.
Výsledky konzervativní léčby
Prodloužené rozpínání svěrače pomocí nástroje k roztažení análního otvoru a lubrikačního gelu vede u akutních řitních trhlin ke zhojení v 90 % , přičemž však v 50 % lze počítat se spontánním vyléčením. Při léčbě glyceroltrinitrátem jde o podobný průběh. Lze takto úspěšně léčit nejen akutní, ale také chronické řitní trhliny. Takto dosáhli Palazzo u chronických řitních trhlin při použití 0,5% GTN masti zhojení v 73 % a Hasegawa dosáhl s 0,2% GTN masti zhojení v 50 % chronických řitních trhlin. Lund zjistil u 80 pacientů, kteří byli ošetřováni buď 0,2% GTN nebo placebem, že u GTN se trhlina zhojila v 80 % a u placeba pouze v 8 %. Obdobné výsledky jsou při srovnání GTN a Lidocaingelu. U GTN došlo u akutních a chronických řitních trhlin ke zhojení v 64 %, zatímco u Lidocaingelu toho nebylo možno dosáhnout. Tyto pozitivní léčebné účinky GTN odpovídají prokazatelnému snížení tonu svěrače a zlepšenému prokrvení. Jeví se, že koncentrace GTN má u výsledků léčby dílčí význam. V každém případě zjistil Monokian u koncentrací mezi 0,2–1,0% GTN významný neměnný podíl zhojení, který činil u akutních řitních trhlin 69 % a u chronických řitních trhlin 59 %. Rozdílné koncentrace jsou dle jeho údajů odpovědné za vedlejší účinky (> 0,2 % významný nárůst bolestí hlavy, synkopální stavy). Většina studií se vztahuje k chronickým řitním trhlinám, aniž by však pro ně existovala přesná definice. Mnohdy se hovoří o nekomplikovaných trhlinách. Přesný popis morfologického nálezu nebo trvání onemocnění není k dispozici. Při této nepřesné definici chronických řitních trhlin nepřekvapují studie s opačnými výsledky. Tak nebyly zjištěny, jak uvádějí Altomare et al., v multicentrické randomizované dvojité slepé studii s kontrolní skupinou s placebem u 120 pacientů s chronickými řitními trhlinami žádné rozdíly u výsledků léčby mezi 0,2% GTN a placebem. Pravděpodobně to lze vztáhnout k nejednoznačně popsaným sekundárním změnám u chronických řitních trhlin, jakými jsou hypertrofické anální papily nebo předsunuté vrásy. Tyto domněnky potvrzují i výsledky Brühla et al. V této studii byly rozděleny řitní trhliny na trhliny s hypertrofickými análními papilami nebo předsunutými vrásami a trhliny bez těchto změn. Při léčbě 0,3% GTN nedošlo v první skupině ke zhojení, zatímco u druhé skupiny jej bylo dosaženo v 80 %. Zdá se, že léčba kalciovými antagonisty je pacienty lépe snášena, neboť se u ní nevyskytují nitrátové bolesti hlavy jako u GTN. Studie, které provedli Griffin aj., Billecki, Bader aj., prokázaly na skupině 32 pacientů, z nichž 50 % bylo předtím neúspěšně léčeno pomocí GTN, že u 30 pacientů se trhliny zhojily. Dvě z těchto nezhojených trhlin musely být ošetřeny chirurgicky. Vedlejší účinky se u této léčby nevyskytly; recidivy nebyly v průběhu 6 měsíců následného sledování zaznamenány. Použití botulotoxinu k léčbě řitních trhlin vykazuje dobré výsledky. U nekomplikovaných trhlin lze u 70–80 % po zhruba čtvrtroce počítat s úplným zhojením. To potvrzuje studie Josta, který pomocí BTX u 100 pacientů s řitními trhlinami dosáhl vymizení bolesti po 8 dnech v 70 % a úplného vyléčení po 6 měsících v 79 %. 21% muselo být ošetřeno operativně. Ve dvojité slepé studii s kontrolní skupinou s placebem uvádí Maria u chronických řitních trhlin zhojení ve zhruba 73 %. Vzhledem k množství je u vyšších dávek (25 jednotek namísto 15 jednotek) možno očekávat celkově účinnější dlouhodobé působení. Důležité je také místo vpichu injekce. Aplikace nalevo a napravo vedle přední komisury vede u posteriorních řitních trhlin k lepšímu zhojení a delšímu ochrnutí svalů než u injekce v oblasti zadní komisury. U řitních trhlin rezistentních vůči léčbě, které nebyly zhojeny pomocí aplikace BTX, prokázali Lysy et al., že doplňková léčba pomocí GTN výrazně zvýšila podíl zhojení. Srovnávací šetření u chronických řitních trhlin s GTN a BTX vedla u skupin 25 pacientů ke zhojení trhlin u BTX v 96 % a u GTN v 60 %. Při cross-over studii vykázaly všechny dosud nevyléčené trhliny zhojení (9 u GTN a 1 u BT). Ovšem Nelson na základě metaanalýzy dokázal, že u GTN a BTX i jiných látek, jakými jsou kalcioví antagonisté, hydrokortizon, Lidocain a strava bohatá na balastní látky, lze oproti placebu očekávat pouze nepatrné výhody. Je nutné vycházet z toho, že trhliny s výraznými sekundárními změnami (hypertrofické anální papily, předsunuté vrásy, poškozené zjizvené okraje, volně ležící a sklerotizovaná vnitřní část) většinou nebylo možno vyhojit pomocí konzervativní terapie.
Chirurgická nebo konzervativní léčba
Chirurgické ošetření chronických řitních trhlin vede k lepším výsledkům, než kterých lze dosáhnout konzervativním způsobem pomocí GTN nebo BTX. Agor et al. prokázali ve sledovaném období mezi čtyřmi až dvaceti lety u 2108 pacientů, že laterální sfinkterotomie vedla k lepším dlouhodobým výsledkům než GTN nebo BTX.V Německu se k léčbě chronických řitních trhlin doporučuje manuální rozpínání svěrače s fisurektomií– v neposlední řadě na základě šetření Hasse. V angloamerických zemích se provádí otevřená i uzavřená laterální sfinkterotomie s posteriorním postupem. Na našem pracovišti preferujeme provedení modifikované laterální sfinkteromyotomie dle Parkse.
Laterální sfinkteromyotomie dle Parkse
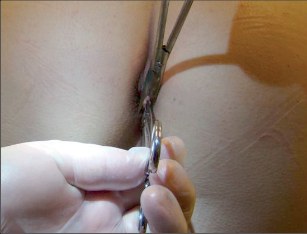
Operaci provádíme v krátkodobé celkové anestezii, v gynekologické poloze. Výkon začínáme provedením šetrné divulze anu dle Récamiera ve směru latero-laterálním a ventro-dorzálním v celém obvodu anu. Na č. 3 provádíme drobnou kožní incizi v délce 3 mm. Zde provádíme infiltraci perirektální tkáně, vnitřního sfinkteru a submukózy 20 ml roztoku 1 % Mesocainu s adrenalinem 1/200 000. Pak zavádíme tangenciálně zavřené branže preparačních Metzenbaumových nůžek, kterými obkružujeme zevně musculus sfinkter ani externus směrem do intersfinkterického sulku. Tento ozřejmujeme ukazovákem levé ruky zavedeným do análního kanálu. Pak provádíme obrat nůžek o 90 stupňů. Rozevřenou branži zavádíme pod kontrolou pohmatem submukózně a provádíme prostřižení masy musculus sphincter ani internus v délce cca25 mm. Pohmatem zjišťujeme miskovitý defekt na č. 3. Dáváme bedlivý pozor, abychom neperforovali stěnu rekta. Po vytažení nůžek nesuturujeme vstupní incizi. Ošetřujeme ji toaletou a krytím. Dle velikosti a charakteru fisurace lze provést následně její trigonální excizi, kterou můžeme krýt eventuálně Y-V plastikou (obr. 85–92).
Léčebná doporučení
EBM důkazní algoritmus (evropský konsenzus) k léčbě řitních trhlin doporučuje bez ohledu na morfologické a časové faktory následující postup: primární léčba by měla být prováděna pomocí nitrátů nebo kalciových antagonistů, přičemž se doporučuje podávání balastních nebo bobtnavých látek (zbytková strava). Navíc lze pacientům předepsat analgetika. Kontrolní vyšetření by mělo proběhnout po 6–8 týdnech. U zhojených trhlin se doporučuje i nadále dodržovat dietu bohatou na balastní látky. Nezhojené trhliny se zřetelným ústupem obtíží lze v průběhu dalších 6–8 týdnů léčit nitropřípravky nebo kalciovými antagonisty. Nedojde-li ani poté ke zhojení, doporučuje se jako další léčba operace (fisurektomie příp. sfinkterotomie). V případě nezhojení trhlin po fisurektomii (1–5 %) by měla být provedena sfinkterotomie.
9.4 Hemoroidy
Všeobecně
Nad linea dentata, pod sliznicí rekta, se rozvětvují terminální větve arteria rectalis superior – hemoroidální arterie – k cévnímu konglomerátu corpus cavernosum recti (hemoroidálnímu polštáři). Při hyperplazii této fyziologické cévní struktury se hovoří o hemoroidech I. až IV. stupně a z toho vyplývajících obtížích – o hemoroidální nemoci. Více než 100 let byly na základě Virchow-Schenovy interpretace hemoroidy vnímány jako anální varixy, ačkoli byly již tehdy o této představě pochybnosti. Až Stelzner et al. prokázali, že se u corpus cavernosum recti nejedná o žíly, nýbrž o arterio-venózní houbovité těleso s lokalizací na predilekčních místech na 3, 7 a 11 hodinového ciferníku v litotomické poloze. Corpus cavernosum má důležitou funkci pro zachování jemné kontinence.
Fyziologie
Corpus cavernosum recti má během kontineční fáze pružnou elastickou konzistenci, neboť žilní, transfinkterický odtok krve je v návaznosti na kontrakci musculus sphincter ani internus obleněn. Tímto jsou cévní polštářky k sobě intimně přiloženy a brání nechtěnému odchodu větrů a řidší stolice. Při defekaci umožňuje relaxace vnitřního svěrače nerušený odtok krve z hemoroidálních polštářů; tyto se vyprázdní a stolice může bezproblémově odejít bez traumatizace análního kanálu. Předpoklad pro tento fyziologický postup je dobře tvarovaná stolice s dostatečným dilatačním efektem na vnitřní svěrač.
Etiopatogeneze
Výskyt hemoroidálních potíží a s nimi spojené morfologické změny jsou způsobeny jak geneticky, tak v důsledku narušené defekace při potravě chudé na balastní látky. V mnoha rodinách jsou časté hemoroidální potíže a vyšetření jednotlivých rodinných příslušníků ukazuje často identické morfologické nálezy. Méně jsou postiženy osoby s tužší stolicí, při které musí tlačit, než osoby s kašovitou až průjmovou konzistencí stolice. V každém případě je procentuální výskyt hemoroidálních onemocnění při chronické zácpě menší (10–16 %) než při průjmech (> 20 %). Stolice takové konzistence je nefyziologická zátěž pro hemoroidální polštáře: nedojde k dostačujícímu roztažení a relaxaci análního kanálu, takže ještě pružné plné hemoroidální polštáře jsou při průchodu stolice vystaveny zesílenému traumatu. Zda má kvalita stolice v důsledku příjmu ostře kořeněných jídel nebo alkoholu vliv na symptomatiku hemoroidálních obtíží, je otázkou. V každém případě se v ohledu na hemoroidální symptomatologii neprokázal rozdíl mezi týdenním podáváním ostře kořeněného jídla s kayenským pepřem a podáváním placeba.
Dle Stelznerovy teorie je na anorektální vaskulární plexus – AVP (corpus cavernosum recti) nahlíženo jako na plexus, tvořený funkčními kavernami – arte riemi a žílami, jejichž stěna je bohatě vystavěna svalovinou a mezi kterými je bohatá síť arterio-venózních zkratů (shuntů). V místě AV shuntů svalový mechanismus podobný sfinkteru reguluje náplň a výtok krve z kaveren AVP. Při hemoroidální chorobě je tento mechanismus výrazně změněn. Dochází k redukci svalových vláken ve stěnách kaveren a k redukci elastických vláken v submukóze (obr. 93–95).
Hodnocení příčin onemocnění dle Aignera
| Nízký podíl vlákniny ve stravě | Sporné |
| Obstipace nebo průjmy | Sporné |
| ODS | Diskutováno |
| Zvýšený tonus sfinkterů | Sporné |
| Genetická dispozice | Diskutováno |
| Vaskulární poruchy | Diskutováno |
| Poruchy provazců míšních | Diskutováno |
| Věk | Diskutováno |
| Těhotenství | Potvrzeno dle EBM (Evidence Based Medicine) |
Klinický obraz
Potíže vztahující se k hemoroidům jsou netypické a také existují u mnoha jiných proktologických onemocnění. Nejsou závislé na morfologickém rozsahu hemoroidů. Nejčastější je krvácení. Nepochází přímo z hemoroidů, ale z trombozovaných cév ve sliznici. Krvácení bývá nejen při stolici, případně při prolabovaných hemoroidech, ale také i po stolici. Světle červená krev může často kapat nebo stříkat a potřísnit toaletní mísu. Krvácení má téměř vždy světle červenou barvu. Může se vyskytovat denně u každé stolice a pak se bez jakékoliv terapie může na týdny i měsíce zastavit. Hemoroidální krvácení může vést k výrazným anémiím. U hemoroidů je často narušena jemná kontinence. Spodní prádlo bývá vlhké a znečištěné od stolice. Z toho iritativně vzniklé typické anální ekzémy se svěděním jsou po krvácivosti nejrozšířenější hemoroidálním příznakem. Bolesti nejsou pro hemoroidy typické. Nezávisle na stolici si však pacienti stěžují na tupý tlak nebo na pocit cizího tělesa v konečníku. Často jsou udávány pálivé bolesti při synchronně existujících ragádách nebo fisurách anodermu (hemoroidy II.° až v 70 %). Silné bolesti jsou ale v případě hemoroidální trombózy a při výrazném otoku uzlů. Takový klinický obraz je pak charakterizován velmi namáhavou stolicí s dlouhodobě přetrvávajícími potížemi.
Nález
Dle morfologických a klinických změn se rozlišují 4 stupně hemoroidů (obr. 96–99):
4 stupně hemoroidů (obr. 96–99):
| I ° | jen proktoskopicky viditelné polštářky |
| II ° | prolaps u defekace – retrahuje se spontánně |
| III ° | prolaps u defekace – manuálně reponibilní |
| IV ° | prolaps perianálně fixovaný a fibrózní –nereponibilní |
- Hemoroidy I.° v proktoskopu se jeví jako pružná elastická, sliznicí pokrytá klenutí, která se při tlaku na stolici či zakašlání ještě více zvýrazní.
- Hemoroidy II.° prolabují u defekace a pak se zase spontánně zatáhnou zpět. Mohou se vyskytnout jednotlivě nebo jako kruhový prolaps. Prolabované hemoroidy se nedají zaměnit s charakteristickým perianálním, případně subanodermálním žilním polštářem. Tyto mohou imponovat při tlaku na stolici jako prolaps, jsou však – na rozdíl od hemoroidů – pokryty dlaždicovitým rohovějícím epitelem.
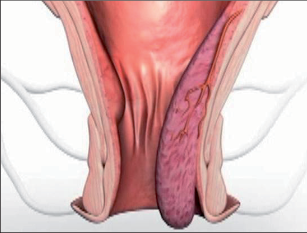
- Hemoroidy III.° prolabují po defekaci nebo tělesné námaze. Nezatáhnou se spontánně zpět, ale musí být manuálně reponovány. To může být spojeno s následným tlakem nebo pocitem cizího tělíska v konečníku. Stejně jako hemoroidy II.° nemusí působit při další defekaci žádné potíže. Často prolabují nejen masivně zvětšené hemoroidální polštáře, ale také zároveň linea dentata s rozvolněným anodermem – známka narušené struktury análního kanálu.
- Hemoroidy IV.° jsou zvětšené, prolabované hemoroidální komplexy, spolu s vyhřezávajícím anodermem distálního análního kanálu. Tyto struktury jsou částečně fibrotizované, zvenku fixované. Nedají se již reponovat.
Hemoroidy IV.° nemusí způsobovat žádné potíže typu bolestí nebo krvácení. Způsobují ale poruchu jemné kontinence.
Dnes se pomalu začínáme přiklánět k podstatně jednoduššímu dělení.
- Uzly I a II označujeme jako low grade LGH.
- Uzly III a IV označujeme jako high grade HGH.
Průběh a prognóza
Hemoroidy jsou progredující onemocnění; bez efektivní terapie narůstá jejich velikost i obtíže jimi způsobované. Záleží na dispozicích a jiných faktorech (např. zácpě, tlačení u defekace, nadváze), jak rychle povedou hemoroidy I.° k hemoroidům II., III. a IV. stupně. Stadia mohou následovat po sobě, ale mohou se také vyskytnout nezávisle na sobě. Léčbou hemoroidů se dá takovému průběhu spolehlivě předejít (regulací stolice, sklerotizací, bandáží elastickým ligačním kroužkem, hemoroidální arteriální ligací či hemoroidální laserovou okluzí).
Diagnostika
Neprolabované hemoroidy (hemoroidy I.°)se dají nejlépe rozeznat anoskopicky. Nejvhodnějšími se jeví proktoskopy firmy Sapimed. Prolabované hemoroidy se dají nejzřetelněji zjistit po defekaci (je-li třeba, po provokaci klyzmatem), přičemž hemoroidy II.° se při následné prohlídce již často reponují. Pak by měl být pacient vyšetřen v podřepu a při tlaku na stolici. Zvenku fixované a dále nereponovatelné hemoroidy (hemoroidy IV.°) se dají dobře posoudit inspekcí.
Histologie
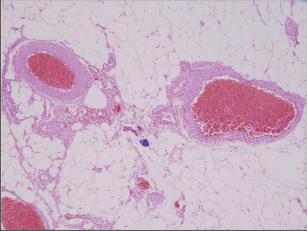
Histologicky se jedná u hemoroidů o submukózní, často tenkostěnné a síťovitě navzájem propojené krevní prostory, které ve své celistvosti tvoří tzv. plexus submucosus anorectalis. Část těchto cév je pojivovými tkáněmi ohraničena na způsob kavernózního tělesa v malé a větší cévní konvoluty. Mezi nimi leží silně dilatované žíly. Také arterie vedou do cévních konglomerátů a jeví se po úsecích jako arteriovenózní anastomózy. Tento komplex vybudovaných cévních sítí připomíná svým charakterem a funkcí houbovité těleso (corpus cavernosum recti) (obr. 100).
Terapie
Cílem terapie je pokud možno trvalé odstranění potíží a symptomů s co nejlepším obnovením původních fyziologických a anatomických poměrů. K tomuto výsledku vedou 4 cesty:
- základní terapie,
- léčení příznaků,
- redukce hyperplastických cévních konvolutů,
- profylaxe recidivy.
Základní terapie
Základní perorální medikací jsou v dnešní době flavonoidy v kombinaci s aescinem. Samotná venotonika v terapii postrádají věrohodnost, neboť hyperplastické hemoroidální polštáře nejsou křečové žíly (varixy). Dále je důležitá eliminace exogenních škodlivin, neboť genetické komponenty se prozatím nedají odstranit. Pro postiženého platí konzumovat vlákninnou bohatou stravu, dostatečné množství tekutin a dodržovat zásady správné defekace. Stolice by měla být formovaná. Toaletu by měl pacient vyhledat při typických nutkáních. Především by se měl vyvarovat tlačení. Strava bohatá na balastní látky může příznivě ovlivnit hemoroidální nemoc především u pacientů trpících zácpou.
Léčení příznaků
Nezávisle na stupni hemoroidálních obtíží platí – příznaky pokud možno co nejrychleji a účinně lokálně terapeuticky odstranit, případně zmírnit.
Prvním a základním krokem konzervativní terapie perianálních hemoroidálních potíží je vhodná anální hygiena teplou vodou bez mýdla nebo sprchovacího gelu. Neměly by se používat ani navlhčené toaletní ubrousky (alergenní a ekzém tvořící potenciál díky chemický přísadám).Při lokální, tzn. čistě symptomatické hemoroidální léčbě musí být pamatováno, že
- symptomatologie může spontánně výrazně kolísat, hemoroidy nejsou ošetřovány přímo,
- často je dosaženo jen krátkodobého zlepšení a
- pokračování nemoci není ovlivněno.
K dispozici jsou jen dva komplexy příznaků určených k lokální terapii:
- dráždění perianální kůže: svědění, pálení, bolest (iritativně-toxický anální ekzém),
- potíže v distálním, tedy v senzitivním análním kanálu (bolesti a dráždění anodermu), často se zvýšeným tonem sfinkterů.
Drážděná perianální kůže na základě nedostatečného svírání konečníku se dá jednoduše ochránit zinkovou pastou. Při silnějších ekzematózních změnách jsou indikována speciální dermatika. Principem terapie hemoroidální nemoci je odstranění nebo zmírnění symptomů hemoroidální nemoci, jako jsou bolest, krvácení, svědění, pálení. Žádná terapie nemůže být zahájena bez klinického vyšetření. Postupuje se od konzervativní terapie, která je indikovaná pro všechna stadia hemoroidální nemoci, přes miniinvazivní ambulantní postupy až k operaci. Důležitou součástí terapie je úprava životosprávy a péče o pravidelnou defekaci. Při obstipačních problémech je důležité vyšetřit příčinu obstipace a vyloučit popřípadě obstrukční defekační syndrom, který může být způsoben zevním útlakem při sigmoideokéle, enterokéle, prolapsem gynekologických orgánů nebo může být způsoben rektokélou či intususcepcí rekta. Tyto nálezy jsou zpravidla doprovázeny nutností usilovné defekace, která může být jednou z příčin vzniku hemoroidálních uzlů. Největšího efektu konzervativní terapie lze dosáhnout v počátečních stadiích hemoroidální nemoci. V pokročilejších stadiích je konzervativní terapie doplňková a zmírňuje symptomy hemoroidální nemoci.
- Prostředky pro úpravu konzistence stolice – důležitou součástí konzervativní terapie je péče o pravidlenou stolici, proto je důležitý dostatečný přísun stravy bohaté na vlákninu. Vhodným změkčovadlem stolice je laktulóza. Vhodná jsou i probiotika při průjmových onemocněních. Samotné užití laxativ je v léčbě hemoroidů nanejvýše sporné. Řídká stolice nevytváří svým tlakem na senzitivní zónu v aborální části rekta dostatečný impulz k relaxaci anu, a tím také povel k vyprázdnění arteriovenózního anorektálního plexu.
- Lokální masti a čípky – preparáty zmírňují symptomy hemoroidální nemoci, jako jsou pálení, svědění, krvácení a bolesti. Přípravky se většinou příliš neliší ve složení a obsahují protizánětlivou složku, lokální anestetikum, adstringent, vazokonstriktor a epitelizans v různých kombinacích. V zahraničí jsou častou složkou antihemoroidálních čípků a mastí i kortikosteroidy. V ČR není v současnosti na trhu žádný přípravek obsahující kortikosteroid. Při konzervativné léčbě dáváme vždy přednost mastem před čípky.
- Protektanty – jedná se většinou o kakaové máslo obsažené ve vehikulu, glycerin, kaolin, lanolin, minerální oleje, oxidy zinku, vitaminy A a D, extrakty ze žraločích chrupavek atd. Patří sem preparáty Preparation H a přírodní přípravky jako Hemodin, Hemostop. Protektanty brání iritaci perianální oblasti tvorbou fyzikální bariéry na kůži, a brání tak kontaktu kůže se stolicí nebo secernující hemoroidální sliznicí. Tato bariéra tak brání nebo zmírňuje svědění, pálení a bolesti v okolí konečníku.
- Vazokonstrikční látky – fenylefrine, efedrine sulfát, epinefrin (Preparation H). Zmírňují bolest a svědění mírným anestetickým účinkem.
- Adstringenty – zlepšují koagulaci a zklidňují podrážděnou pokožku perianální oblasti, Spofax, Doxiproct, dubová kůra, Hemostop.
- Lokální anestestika – cinchocain, lidokain.Jak bylo výše uvedeno, všechny preparáty jsoukombinací různých skupin. Kombinují všechny,nebo jen některé složky. Snad více protizánětlivě působí svým složením preparáty Faktu, Mastu, Proctoglyvenol. Mírně vazokonstrikčně a více hemostypticky pak Spofax, Doxiproct, Proctoglyvenol. Víc antiedematózně Preparation H, Dobexil H,Hemostop, Hemodin, Hemoval, Cyclo3Fort.
- Venotonika – hlavním představitelem je flavonoid diosmin, většinou v mikronizované formě.V ČR mají identický obsah diosminu preparátyHemostop, Mobiven, Detralex, Vitavenon. Ve složení přídavných složek jsou jen minimální rozdíly. Nejlepšího léčebného efektu venotonik je dosaženo při terapii akutní hemoroidální ataky přiakutní trombóze. Efekt delšího nebo chronickéhoužívání diosminu v indikaci hemoroidální nemocije sporný.
Redukce hyperplastických uzlů
Redukce patologicky zvětšených (hyperplastických) cévních konvolutů, tedy obnova původního stavu corpus cavernosum recti, je v návaznosti na příznaky viděna jako „kauzální terapie“. Na rozdíl od léčení příznaků by měla být patologicky hyperplastická hemoroidální tkáň redukována na fyziologickou velikost, a tím obnovena normální anatomie análního kanálu. Terapeutické výkony se řídí stupněm změn. Invazivní, např. operativní zákroky (hemoroidopexa pomocí infrarot či argonové koagulace, podvázání gumovým kroužkem dle Barrona, hemoroidální arteriální ligace HAL, hemoroidální laserová arteriální okluze HALOHelp, hemoroidektomie), event. plastické rekonstrukce análního kanálu, jsou indikovány u změn vyšších stupňů.
Profylaxe recidivy
Při všech možnostech terapie musí být také počítáno s recidivami. V profylaxi recidivy nám zůstává jen vyloučení exogenních škodlivin, neboť genetickou predispozici momentálně nelze ovlivnit. Nejúčinnější prevencí je již výše popsaná základní terapie: strava bohatá na vlákninu, dostatečné množství tekutin a správný průběh defekace. Kontroly konečníku a tlustého střeva specialistou – pokud možno v pravidelných intervalech – umožní recidivu rozpoznat včas a také efektivně a bezproblémově léčit.
Terapie
Léčba sklerotizací
Sklerotizace hemoroidů může být provedena dle Blonda nebo Blancharda, příp. Bensaudeho. Metody jsou v anglosaské literatuře považovány za terapi první volby u hemoroidů I.°. V našich podmínkách doporučujeme léčbu flavonoidy a slizniční fixaci technikou Infrarot. Není ale od věci se o technice zmínit.U Blondovy metody je sklerotizační roztok (např. Polidocanol, Thesit, Chinin, Calcium-zinek-chlorid) anoskopem cirkulárně injektován nad linea dentata submukózně do hemoroidální tkáně. K tomu stačí 1,0–3,0 ml sklerotizačního roztoku, který je aplikován opakovaně, s odstupem 8–14 dní. Blondovou sklerotizací by se mělo zabránit vytvoření vnitřního prolapsu hemoroidů do análního kanálu při defekaci a mělo by se předejít traumatizaci při průchodu stolice.U sklerotizační techniky dle Blancharda se aplikuje vždy 1–3 ml roztoku fenolu a mandlového oleje nebo roztok fenolu a oleje z burských ořechů v oblasti přívodní hemoroidální arterie při 3, 7 a 11 hod. v litotomické poloze. Bensaude používá 0,5–1,0 ml Natetradecylsulfátu při stejné technice. Také zde jsou nutná zpravidla 2–3 ošetření s odstupem 1–2 týdnů. Původní představa, že se sklerotizací dosáhne omezení přítoku krve k hemoroidálním polštářům, byla histologickými vyšetřeními vyvrácena. Terapeutický efekt souvisí s fixací hemoroidálních polštářů nad linea dentata. Oba postupy nejsou bez komplikací. Týká se to krvácení, které může velmi zřídka nabýt nebezpečných rozměrů. Příležitostně se mohou také vyskytovat bolestivé tlaky nebo pocit cizího tělesa. Při používání sklerotizačního roztoku obsahujícího chinin se musí počítat ve 3–4 % s alergickými reakcemi. V ojedinělých případech mohou nastat nekrózy rekta a septické kompĺikace s následkem smrti. Při srovnávacím vyšetření obou metod vykazuje lepší efekt Blondův postup. Hemoroidální potíže (krvácení) odezní při Blondově postupu po dvou ošetřeních již v 70–80 %. S recidivou se počítá u 70 % po třech letech. Relativními kontraindikacemi jsou ulcerózní kolitida, anální forma Crohnovy choroby a imunosuprese (obr. 101–102).
Podvázání gumovým kroužkem dle Barrona – rubber band ligation
Hemoroidy druhého stupně se dají elegantně a úspěšně odstranit malým gumovým kroužkem. K tomu vytvořil Blaisdell v roce 1954 postup, který byl Barronem modifikován a dodnes platí jako terapie první volby k léčení hemoroidů II.°. Jestliže jsou hemoroidy III.° segmentární, dobře reponibilní a bez doprovázejících análních prolapsů, může být tato metoda stejně tak použita s dobrým efektem. Za pomoci speciálního aplikátoru se hemoroidální uzly podvážou. Během krátké doby to vede k nekróze a v následujících dnech k odpadnutí mrtvé tkáně. Gumové kroužky nesmí být za žádných okolností umístěny pod linea dentata, nýbrž jen v necitlivých oblastech nad touto linií. Jinak musíme počítat po několik dní se silnými bolestmi. Ostatně bolesti se mnohdy objeví i po správné aplikaci nad linea dentata, jsou velice individuální. Někteří autoři doporučují gumové kroužky neumístit přímo na hemoroidální polštáře, ale těsně nad ně, a tímto sliznici „nabrat“. Toto působí proti prolabování hemoroidálních uzlů, aniž by se musely zároveň porušit. Aby se zabránilo sklouznutí gumového kroužku z malého uzlu, může se sklerotizační prostředek injektovat přímo do uzlu. Z ekonomických důvodů má smysl ošetřit všechny prolabované uzly současně, tzn. při jednom sezení. Na základě možných rizik by se však přitom mělo dbát opatrnosti. S počtem podvázaných uzlů stoupá zjevně riziko komplikací. Po prvním ošetření by se mělo s další kontrolou počkat 4–6 týdnů. Teprve potom je možné dostatečně posoudit terapeutický efekt a morfologické změny, a tím zvážit a provést eventuální cílené umístění dalšího gumového kroužku. Vedle bolestí (14 %) se musí v ojedinělých případech počítat se silným krvácením, které může být dokonce hemodynamicky významné. To se může vyskytnout cca 1 týden po ošetření. Referováno bylo také o poruchách mikce, teplotě, abscesech, trombóze a tvorbě fistul. Jako závažná komplikace s následkem smrti je popsána pozdní alergická reakce na gumová aditiva. U gumových kroužků z přírodního kaučuku bez chemických přísad nebo u termoplastických izomerů tato komplikace popsána nebyla. Doposud byla u určité skupiny pacientů (transplantovaní, imunosuprimovaní, po implantacích cévních stentů a náhrad, stejně tak po kardiálních implantátech) u ligatury dle Barrona, stejně jako u sklerotizace doporučována antibiotická endokarditická profylaxe. Po aktuálních doporučeních kardiologické společnosti z roku 2007 není lékařský benefit doložen a od aplikace ATB profylaxe bylo upuštěno. Léčebné úspěchy ligatury gumovým kroužkem jsou u hemoroidů II.° po dlouhodobém sledování 3–5 let mezi 70–80%. V porovnání s ošetřením sklerotizací a koagulací infračerveným zářením jsou uváděny převážně lepší výsledky. Stupeň recidivy je v porovnání se sklerotizací signifikantně nižší – 25 % po 4 letech.
Terapeutické výsledky
Metaanalýza, která se vztahuje k 18 randomizovaným studiím, došla při porovnávání jednotlivých terapeutických postupů k následujícím výsledkům: operativní ošetření hemoroidů je zjevně efektivnější než manuální divulze konečníku, potřebuje méně často další léčení, neukazuje žádný rozdíl v návaznosti na komplikace, ale způsobuje více bolesti. Také ve srovnání s ligaturou gumovým kroužkem se při operačním postupu očekávají lepší výsledky, i když jsou komplikace větší, speciálně s ohledem na bolesti. Ligatura gumovým kroužkem je oproti tomu úspěšnější než sklerotizace u hemoroidálních onemocnění I.–III. stupně. Komplikace při sklerotizaci nebo ligatuře gumovým kroužkem bývají stejně časté. Nutnostdále pokračující terapie při ošetření sklerotizací a při koagulaci infračervenými paprsky je udávána častěji než u ligatury gumovým kroužkem. Bolesti bývají u sklerotizace a koagulace infračervenými paprsky jen zřídka proti ligatuře gumovým kroužkem. Na základě této analýzy je v USA ligatura gumovým kroužkem doporučována jako počáteční terapie u hemoroidů I. až III. stupně, i když operace vede k lepším výsledkům. Vzhledem k tomu, že operativní ošetření je zatíženo většími komplikacemi, mělo by se k němu přistoupit, když ligatura gumovým kroužkem není úspěšná. U nás bývají hemoroidy III. stupně ošetřovány ponejvíce chirurgicky (obr. 105–109).
Koagulace infračervenými paprsky – infrarot
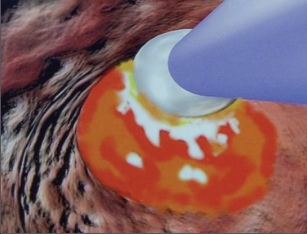
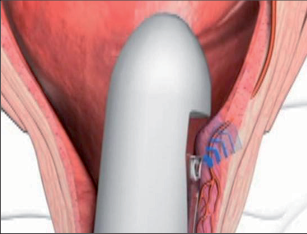
Koagulace infračervenými paprsky představuje velice jednoduchý a efektivní terapeutický postup, který se velmi dobře osvědčil u léčení krvácejících hemoroidů I. stupně. Používá se přitom infračervený koagulátor podobný pistoli, kterým jsou ošetřovány hemoroidy otevřeným proktoskopem. Terapeutický efekt má na infračervené záření, které vede svou teplotou 100 °C k nekróze tkáně. Koagulační body musí být umístěny nad linea dentata. Tato metoda ošetření je bezbolestná a vede zhruba po 2 sezeních asi k 75% úspěšnosti. U výlučně krvácejících hemoroidů I. stupně jsou popsány stejně dobré výsledky léčby jako u ligatury gumovým kroužkem. Na jedno sezení nesmí být aplikovány více než 4 koagulace. Vedlejší účinky by být neměly, přičemž krvácení v prvních dnech po ošetření není nic neobvyklého a pacient musí být o něm po výkonu vždy řádně poučen (obr. 110–112).
Hemoroidální arteriální ligace (HAL)
Možnost úspěšně zmenšit hemoroidy II. a III. stupně dopplerometricky navigovanou ligaturou je původně popsána Morinaganou a modifikována Meintjesem. Princip spočívá v tom, že pomocí speciálního proktoskopu, ve kterém je zabudovaná dopplerovská sonda, se přívodné hemoroidální arterie lokalizují a podvážou. To vede ke zmenšení arteriálního plnění a následnému smrštění hemoroidálních uzlů. Tímto by neměl zmizet pouze hemoroidální prolaps, nýbrž také s ním spojené obtíže. Autoři metody u 1415 ošetřených pacientů popisují úspěšnost 93 %. Předpokladem je podvázat nejen hlavní arterie v lokalizaci 3, 7 a 11 ciferníku hodin, ale také v této studii dodatečně popsané cévy při 1, 5 a 9 ciferníku hodin. Vážné komplikace, jako krvácení, lokální infekce, anální fisury a perianální trombózy, se objevují jen velice zřídka. Mezitím jsou k dispozici také jiné studie o této léčebné metodě. Úspěšnost je popisována mezi 50 a 70 %. Terapeutický efekt se zdá být ale v důsledku podvázání hemoroidálních arterií menší než u ošetření hemoroidů ligaturou gumovým kroužkem. Indikace a účinnost nejsou po více než desetiletém používání jednoznačně definované (obr. 113–115).
Rekto-anal-repair (RAR)
Tento postup představuje další rozvoj metody HAL, při které nejsou podvázány jen hemoroidální arterie, ale hemoroidální uzly jsou pokračujícím stehem spirálově řaseny a následně je provedena jejich taxe do análního kanálu. Originální metoda užívá speciální Doppler-proktoskop, podobný HAL-proktoskopu, se kterým se tento zásah může provádět ve více sektorech. Pokračující steh musí být ukončen striktně v denervovavé zóně nad linea dentata. Přesto je tato metoda spojena s vyšší bolestivostí, krvácením a poruchami močení v pooperačním průběhu. Doposud nejsou k dispozici žádné konkrétní výsledky studií, které zdůvodňují upřednostnění tohoto ošetření před jinými etablovanými postupy (obr. 116–119).
Elektrofrekvenční termoterapie
Principem této metody je lokální termické poškození patologické tkáně, k níž dochází mezi dvěma bipolárními elektrodami. Výsledkem je narušení endotelové výstelky žilní stěny s následným narušením žilního toku. Využívá se teplot kolem 60–80 °C, což je výrazně nižší hodnota než 600–700 °C při využití laseru (obr. 120–121).
Hemoroidální arteriální laserová okluze HALO
Moriganovu techniku HAL modifikoval v roce 2005 Salfi využitím diodového pulzního laseru jako náhrady vstřebatelných ligatur. Tato zcela bezbolestná ambulantní technika je určena k léčbě hemoroidů I. a II.stupně. Pro terapii uzlů III. stupně je navržen postup s užitím speciálně upraveného kónického laserového vlákna, které je zaváděno axiálně-perianálně do oblasti hemoroidálního plexu z drobné kožní incize. Technika sleduje nejen uzávěr terminální větvě přívodné hemoroidální arterie, ale též vytvoření aseptické tepelné nekrózy, která po svém zhojení má za následek fixaci parciálního análního prolapsu a jeho retrakci. Technika však musí být provedena v lokální anestezii či krátkodobé celkové anestezii, neboť se již nejedná o výkon v senzitivně neinervované části rekta. Technika HALO Help je jako zcela bezbolestná vypracována pouze pro I. a II. stupeň onemocnění. Pro III. stupeň je modifikována jako výkon při užití anestezie. Užitím HALO pro III. stupeň můžeme však docílit downstagingu onemocnění na I. až II. stupeň a aplikací Barronovy ligatury pak využijeme všech jejích výhod k redukci zbylého mukózního análního prolapsu (obr. 122–128).
Operace
Hemoroidy III. stupně, které při defekaci prolabují, se neretrahují spontánně, a proto musí být reponovány manuálně, jen ve výjimečných případech jsou ještě ošetřovány konzervativně či semiinvazivně s uspokojivým výsledkem. Indikace k operaci musí být stanovena individuálně a velmi pečlivě.Jsou k dispozici následující metody:
- otevřená hemoroidektomie podle Milligan-Morgana,
- zavřená hemoroidektomie podle Fergusona,
- submukózní hemoroidektomie dle Parkse,
- rekonstrukční hemoroidektomie dle Fanslera-Arnolda:
- anodermální hemoroidektomie dle Whiteheada nebo Toupeta.
- supraanodermální hemoroidopexe PPH staplerem dle Longa.
Obzvláště při segmentovaných hemoroidálních uzlech se doporučují postupy dle Milligan-Morganaa Fergusona, pokud už není indikována ligatura gumovým kroužkem. Zvětšené hemoroidální uzly jsou segmentárně resekovány s ponecháním dostatečně širokých můstků anodermu, aby se zabránilo striktuře,eventuálně poruše kontinence. Metoda dle Milligan
Morgana je založena na široké excizi uzlů, ponechává vzniklé defekty v anodermu otevřené k sekundárnímu hojení. Princip operace staví již na návrzích Milese z roku 1919. Kavernózní uzly jsou resekovány v typických lokalizacích, včetně sliznice, a je proveden vysoký podvaz hemoroidální arterie. Suturu sliznice a anodermu autoři neprováděli (obr. 129–132).
U techniky dle Fergusona je uchováno více anodermu, aby se rána mohla pohodlně uzavřít stehem. Resekce uzlů je shodná s technikou Milligana a Morgana s tím rozdílem, že Fergusson pokračovacím stehem uzavírá defekt ve sliznici i anodermu. Nevýhodou této metody je vyšší riziko perianální infekce a následné dehiscence sutury. Většina autorů dnes volí jakýsi kompromis a uzavírá jen slizniční porci s ponecháním „drenážních otvorů“ v anodermu (obr. 133–135).
Operace dle Parkse
Operace dle Parkse spočívá v submukózní resekci uzlů s nízkým podvazem hemoroidální arterie s následnou suturou sliznice. V dnešní době je tento výkon opuštěn, plně jej nahrazuje provedení tzv. rubber band ligation – Barronovy ligatury (obr. 136).
Operace dle Whiteheada je indikována při objemném nálezu uzlů IV. stupně s fixovaným análním prolapsem. Spočívá v cirkumcizi anodermálního přechodu, vypreparování terminálních větví arteria haemorrhoidalis v predilekčních místech a následné resekci. Výkon je ukončen cirkulární suturou mukokutánními stehy či za užití stapleru. Výkon byl zatížen vysokým výskytem závažných komplikací (striktura anu, protruze anální mukózy s následným syndromem vlhké „komor y“ (řiti), snížením senzitivity anální s inkontinencí I.–II. stupně). Whiteheadova operace je u nás dnes indikována jen výjiměčně. Renesanci Whiteheadova operace prožívá v Americe (obr. 137–140).
Modifikací Whiteheadovy operace je operace dle Toupeta. V kvadrantech 3 a 9 je postupováno jako při Whiteheadobvě cirkumcizi, v kvadrantech 12 a 6 jako při operaci dle Milligana-Morgana. U čísla 6 navíc prováděl autor vnitřní sfinkterotomii.V českých zemích jen výjimečně prováděnou operační technikou je operace dle FansleraArnolda. Je indikována u objemných uzlů s prolapsem a spočívá v subanodermální a submukózní preparaci zevního plexu s následným odstraněním vnitřní porce společně s mukózou rekta. Vzniklý defekt v mukóze je pak vykryt plastikou z „přebytečného“ anodermu. Operace je náročná technicky i časově a oproti ostatním výkonům nepřináší signifikantně lepší výsledky (obr. 141–145).Povšechně můžeme klasické operační postupy hodnotit jako techniky s operačním časem okolo 10–60 minut, doba pobytu v nemocnici je 1–3 dny, pracovní neschopnost asi 1–2 týdny, míra komplikací je méně než 10 %. Frekvence recidivy je udávána v literatuře posledních 20 let mezi 3 a 26 %, dle definice pojmu„recidiva“ a délky následného sledování. Když jsou zvětšeny jen jeden nebo dva segmenty hemoroidálních polštářů, je resekce těchto částí dostačující. Profylaktická operace nehypertrofovaných hemoroidů není smysluplná. Operační výkony laserem – místo skalpelem – se orientují na výše zmíněné techniky, ale neukazují žádné efektivní přednosti, proto jsou používány jen velmi málo.
Longova metoda
Od roku 2001 má v České republice značně vzrůstající tendenci operace cirkulárním staplerem PPH Longo. Využívá již přes 20 let v kolonoa proktochirurgii užívaných staplerů, které jsou modifikovány. Prolabované hemoroidy jsou reponované, přebytek mukózní tkáně, eventuálně proximálními podíly hemoroidálního plexu jsou cirkulárně resekované. Tímto je dosažena taxe a fixace především prolabovaného anodermu a hemoroidálních plexů ve fyziologické intraanální pozici. V dalším průběhu tak dochází sekundárně k redukci tkáně na normální velikost plexu. Předností je především malá pooperační bolestivost. Dlestávajících zkušeností je tato metoda často indikována u cirkulárních uzlů III. stupně. Je popisován menší počet komplikací než u konvenční hemoroidektomie, doba pobytu v nemocnici a pracovní neschopnost jsou kratší. V Anglii a Itálii je metoda – v závislosti na jiné struktuře zdravotního systému – prováděna převážně ambulantně. V současnosti je publikováno více než 30 studií, které předkládají pozitivní výsledky. Skoro ve všech je referováno o signifikantně menších pooperačních bolestech a ve většině případů je popsán větší komfort, stejně tak je rychleji dosaženo pracovní schopnosti pacienta. V jedné studii je také informováno o pozitivních výsledcích při akutním hemoroidálním prolapsu (obr. 146–151).Při dlouhodobém hodnocení recidivy prolapsu, obtíží a reoperací se jeví lepší výsledky u konvenčních operačních technik. Při interpretaci těchto dat prováděných v letech 2000–2004 je třeba zohlednit, že zde byli zahrnuti pravděpodobně pacienti s hemoroidy IV. stupně, případně s fixovaným análním prolapsem. Teprve ve studiích po roce 2005 byly pro hemoroidy IV. stupně uváděny signifikantně horší výsledky a indikační hranice se v posledních letech ve srovnání s dřívějšími studiemi změnila. Pokud se nedá hemoroidální prolaps již reponovat, hovoříme o hemoroidech IV. stupně. V případě akutní trombózy je dávána přednost konzervativní léčbě antiflogistiky, analgetiky a lokálními prostředky. Zkušeným lékařem může být provedena okamžitá operace, ale musí být brán zřetel především na nebezpečí postoperační striktury způsobené nadměrným rozsahem resekce v edematózním stadiu. U chronických, fibrózních, fixovaných nálezů, často doprovázených cirkulárním prolapsem anodermu, mají také smysl plastické rekonstrukční postupy (Fansler-Arnold). Tento postup je operačně technický delikátní a také časově náročný (doba operace 30–60 minut). Docílí vedle resekce hemoroidálních uzlů díky plastickému posuvnému laloku vytvořenému z prolabovaného anodermu cirkulární, případně semicirkularní rekonstrukci análního kanálu. Metoda je však zatížena vyšším výskytem pooperačních komplikací hojení. I po klasických operacích jsou popsány recidivy, ale při pravidelných kontrolách bývají zachyceny včas a dají se řešit semiinvazivními technikami. Počet reoperací je nižší než 5 %. Trvalé poruchy kontinence se vyskytují jen u asi 5 % pacientů, přičemž permanentní inkontinence bývá u tuhé stolice v naprosto ojedinělých případech. Metaanalytická srovnání operačních metod s konzervativními postupy mluví ve prospěch operací s mírou úspěšnosti 96 % versus 77 %. V neprospěch operací svědčí zvýšená míra komplikací 18 % versus6 % a větší bolest 83 % versus 10 %. Dříve běžná divulze a sfinkterotomie se dnes v terapii hemoroidů užívají jen ojediněle. Operace prováděné laserovou technikou (jako náhrada skalpelu) nepřinesly žádné výhody v porovnání s konvenční technikou nůžkami, skalpelem nebo elektrokoagulací. Terapie hemoroidálního onemocnění s adekvátně indikovanou konzervativní terapií a s užitím semiinvazivních chirurgických technik dává vysoké šance na vyléčení s nízkým rizikem komplikací a recidiv.
9.5 Použitá a doporučení studijní literatura
- Abu Galala KH, Salam IMA, Abu Samaan KR et al. Treatment of pilonidal sinus by primary closure with a transported rhomboid flap compared with deep suturing: a prospective randomised clinic trial. Eur Surg. 1999;165:468–472.
- Akca T, Colak T, Ustunsoy B, et al. Randomized clinical trial comparing primary closure with the Limberg flap in the treatment of primary sacrococcygeal pilonidal disease. Br J Surg. 2005; 92:1081–1084.
- Altomare D, Rinaldi M, Milito G, et al. Glyceryl trinitrate for chronic anal fissure – healing or headache? Results of a multicenter, randomized, Plazebo-controled, doubleblind trial. Dis Colon Rectum. 2000;43:174–179.
- Antebi E, Schwartz P, Gilon E. Sclerotherapy for the treatment of fissure in ano. Surg Gynecol Obstet. 1985;160:204–206.
- Argor S, Levandovsky O. Open lateral sphincterotomy is still the best treatment for chronic anal fissure. Am J Surg. 2000;179:201–202.
- Athanasiadis S, Köhler A, Nafe M. Treatment of high anal fistulas by primary occlusion of the internal ostium, drainage of the intersphincteric space and mucosal advancement flap. Int J Colorect Dis. 1994;9:323–330.
- Bacher H, Mischinger H, Werkgarten G, et al. Local nitroglycerin for treatment of anal fissure: an alternative to lateral sphincterotomy? Dis Colon Rectum. 1997;40:840–845.
- Bader F, Bruch HP. Topisches Diltiazem zur Behandung der chronischen Analfissur. Coloproctology. 2006;28:309–313.
- Ballas K, Psarras K, Rafailidis S, et al. Interdigital pilonidal sinus in a hair dresser. J Hand Surg. 2006;31:290–291.
- Barwell L, Watkins R, Lloyd-Davies E, et al. Lifethreatening retroperitoneal sepsis after hemorrhoid injection sclerotherapy: report of a case. Dis Colon Rectum. 1999;42:421–423.
- Bascom F. Pilonidal disease: long-term results of follicle removal. Dis Colon Rectum. 1983;12: 800–807.
- Bat L, Melzer E, Koler M, et al. Complications of rubberband ligation of symptomatic internal hemorrhoids. Dis Colon Rectum. 1993;36:287–290.
- Bensaude A, Neiger A, Nicholls R, et al. Vier Antworten auf neun Fragen ůber die Sklerotherapie von Hámorrhoiden mit Chininderivaten und Phenolmandelol. Coloproctology. 1981;3:182–183.
- Blanchard C. Text-book of ambulant proctology. Youngstown, Ohio: Medical Success Press; 1928.
- Blond K, Hoff H. Das Hamorrhoidalleiden. Leipzig, Wien: Deutike; 1936.
- Broader JH, Gunn IF, Alexander-Williams F. Evalution of a bulk-forming evacuant in the managment of hemorrhoids. Br J Surg. 1974;61:142–144.
- Brook L. Anaerobic meningitis in an infant associated with pilonidal cryst abscess. Clin Neurol Neurosurg. 1985;87:131–132.
- Brown SR, Balan K, Ho E, et al. Stapled mucosectomy for acute thrombosed circumferentially prolapsed piles: a prospective randomised comparison with conventional haemorrhoidectomy. Colorectal Disease. 2001;3:175–178.
- Brühl W, Schmauz R. Zur Verödungstechnik der Hemorrhoiden nach Blond. Coloproctology. 1998;13:344–347.
- Buchmann P, Alexander-Williams F. Classification of perianal Crohn’s disease. Clin Gastroenterol. 1980;9:323–330.
- Casberg MA. Infected pilonidal cysts and sinuses Bull. US-Army M. Dept.1949;9:493–496.
- Cintron J, Park I, Orsay C, et al. Repair of fistulas in ano using autologus fibrin tissue adhesive. Dis Colon Rectum. 1999;42:607–613.
- Chaikhouni Á, Regueyra F, Stevens J. Adenocarcinoma in perineal fistulas of Crohn’s disease. Dis Colon Rectum. 1985;24:639–643.
- Christensen A, Nilas L, Christiansen I. Treatment of transsphincteric anal fistulas by the Seton technique. Dis Colon Rectum. 1986;28:454–455.
- Christiansen J, Ronholt C. Treatment of recurrent high anal fistula by total excision and primary sphincter reconstruction. Int J Colorect Dis. 1995;10:207–209.
- Novák J. Základy proktologie. 1st ed. Praha: Avicenum; 1985, s. 96–154.