14 Poranění jícnu
Do této kapitoly jsou zařazeny patologické stavy spojené s různě závažným poškozením stěny jícnu, které mohou gradovat až v perforaci stěny. Lehčí stupně poleptání stěny jícnu a uvázlá cizí tělesa jsou zpravidla léčeny gastroenterology, při těžším poškození stěny a při perforaci je nezbytná konzultace chirurga, mnohdy je nutné chirurgické řešení:
- poleptání jícnu,
- cizí tělesa v jícnu,
- perforace jícnu.
14.1 Poleptání jícnu
Korozivní ezofagitida
Etiologie a výskyt. K poškození jícnu může dojít po požití kyseliny, louhu a dalších chemikálií, např. ve formě čisticích prostředků, miniaturních baterií, uváznou-li v jícnu apod. Frekvence těchto poranění není velká. Ubývá sebevražedných pokusů tímto způsobem a častěji jde o nešťastnou náhodu při záměně tekutin.
Patologické nálezy a průběh. Kyselina působí koagulační a louh kolikvační nekrózu. Stupeň poškození záleží na koncentraci roztoku a délce působení (tab. 1) [1, 2, 3]. Z časového hlediska rozlišujeme akutní stadium, asi do 4. dne po poleptání, kdy dochází k tvorbě nekróz s možnými celkovými toxickými projevy (teplota). Následuje stadium reparační, trvající asi do 4. týdne, které je charakterizováno odlučováním nekróz, tvorbou ulcerací, granulací a krvácením. Pozdní stadium trvá do 4 měsíců a dochází k jizevnatému hojení a tvorbě striktur, které se klinicky manifestují většinou v rozmezí 8 týdnů až 1 roku. Většina těžkých poškození jícnu je způsobena silnými louhy. Po požití silné kyseliny dochází často k poleptání žaludku a jícen zůstává nepoškozen.
| Tab. 1 Stupně poškození jícnu při poleptání |
|
| 1. stupeň | Překrvení a edém sliznice |
| 2. stupeň | Zvředovatění, fibrinové nálety a krvácení sliznice |
| 3. stupeň | Hluboké ulcerace a nekróza stěny, jizevnaté hojení |
.
Klinický obraz. Na první pohled může být patrný edém rtu, jazyka a orofaryngu. Chybí-li toto viditelné poškození, je vážnější poleptání jícnu méně pravděpodobné. Známkami těžšího poleptání jsou bolest na hrudníku, dysfagie, říhání a salivace.
Může se rozvinout i těžká tracheobronchitida. K závažným komplikacím patří perforace (viz další část kapitoly) a krvácení, které se projeví hematemezí. Celkové příznaky v akutním stadiu odpovídají závažnosti poleptání. U nemocného se mohou vyvinout toxické příznaky s teplotou a šokem.
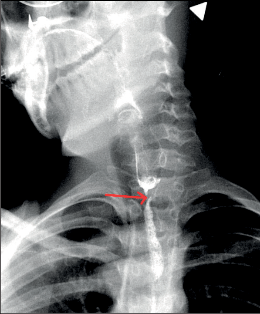
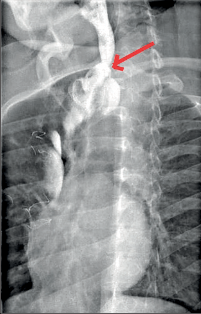
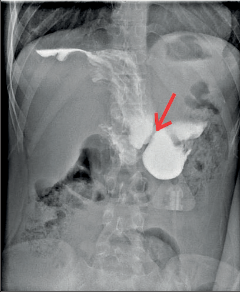
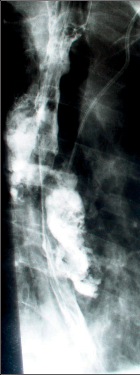
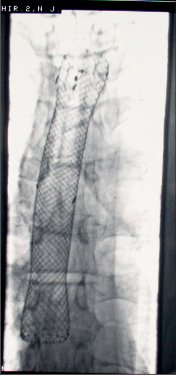
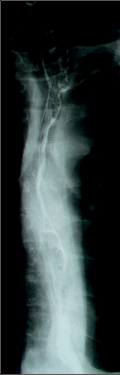
Diagnostika. Je zjevná z anamnézy, nemocní pociťují pálivou bolest v krku, za sternem a dysfagii. Přesné, objektivní posouzení rozsahu poleptání umožní endoskopie v raném (akutním) stadiu. Musí být provedena zkušeným endoskopistou pro nebezpečí perforace. Rentgenové kontrastní vyšetření vodným roztokem má význam především k vyloučení perforace. O přínosu endoskopie, která se dříve považovala za nebezpečnou a kontraindikovanou, nejsou pochyby. Důležité je stanovení stupně poleptání jako správné vodítko k další léčbě (viz tab. 1). Rentgenové vyšetření má význam k určení rozsahu striktur v pozdním stadiu poleptání (obr. 1a,b,c, videozáznamy rtg pasáž jícnu u striktury po poleptání louhem v horní části hrudního jícnu, rtg pasáž po by-passu tlustým střevem, horní část koloplastiky s ezofagokolickou anastomózou, rtg pasáž po by-passu tlustým střevem, dolní část koloplastiky s kologastrickou anastomózouu jsou dostupné v elektronické verzi – viz tiráž knihy).
Léčba. V akutním stadiu spočívá v podávání analgetik, u šoku v jeho léčbě. Bezprostředně po poleptání je možné se pokusit o chemickou neutralizaci, u kyselin vodou, mlékem či „sodou“ (hydrogenuhličitanem sodným), u louhů kyselinou citronovou či zředěným octem. Jinak platí zákaz perorálního příjmu, je nutná parenterální výživa a podání antibiotik. Po 3–4 týdnech je vhodné podávání kortikosteroidů po dobu 4–8 týdnů jako prevence vzniku striktur. Prevencí vzniku zúžení je i časná dilatace bužiemi od druhého týdne po poleptání. Riziko perforace je zde však značné. Při rozvoji striktur v pozdním stadiu je nutno provádět dilatace dlouhodobě a opakovaně i řadu let, než dojde ke stabilizaci zúžení. Při těžkém poleptání je někdy nutné zajistit výživu gastrostomií a výjimečně akutně odstranit poleptaný orgán. Při rozsáhlých strikturách a nutnosti dlouhodobé dilatace je nutno s individuálním přihlédnutím k operačnímu riziku zvážit možnost chirurgické náhrady jícnu (obr. 1a,b,c). Riziko vzniku karcinomu jícnu ve striktuře z poleptání je v odstupu 15–20 let několikanásobně vyšší než u normální populace. Proto je nutné trvalé endoskopické sledování jícnu, v případě založení by-passu je vhodné postižený jícen odstranit [4, 5, 6].
Literatura
- Bartels H. Öesophagus und Magenverätzung. In: Siewert JR, et al. (Hrsg). Chirurgische gastroenterologie, Bd 2, 2. Aufl. Berlin Heidelberg New York Tokyo; Springer; 1990. p. 567–573.
- Kikendall JW. Caustic ingestion injuries. Gastroent Clin North Am. 1991;20:847–857.
- Poley JW, Steyerberg EW, Kuipers EJ, Dees J, Hartmans R, Titanus HW, Siersema PD. Ingestion of acid and alkaline agents: outcome and prognostic value of early upper endoskopy. Gastrointest Endosc. 2004;60:372–37
- Andreoni B, Farina ML, Biffi R, Crosta C. Esophageal perforation and caustic injury: emergency management of caustic ingestion. Dis Esophagus. 1997;102:95–100.
- Han Y, Cheng QS, Li XF, Wang XP. Surgical management of osophageal stricture after caustic burns: a 30 years of experience. World J Gastroenterol. 2004;10:2846–2849.
- Zargar SA, Kochhar R, Nagi B, Mehta S, Mehta SK. Ingestion of corrosive acids. Spectrum of injury to upper gastrointestinal tract and natural history. Gastroenterology. 1989;97:702–707.
14.2 Cizí tělesa v jícnu
Výskyt a etiologie. Polknutí cizích těles do zažívacího traktu se nejčastěji vyskytuje u dětí mladších 10 let [1, 2, 3]. V dospělosti se polknutí cizího tělesa vyskytuje hlavně u starších osob a rizikovými faktory jsou mentální retardace, psychiatrické onemocnění, požívání alkoholu a drog. Obvykle se jedná o polknutí cizího tělesa v souvislosti s přijímáním potravy, nejčasněji to bývají kosti z ryb a kuřat, dentální náhrady, instrumenty užívané při stomatologickém ošetření a zubní párátka [4]. Děti polykají mince, knoflíky, špendlíky, píšťalky a jiné drobné předměty. U starších osob jsou to kousky tvrdého masa, kůrky, ořechy, kosti, pecky, obaly bonbonů, tablety léků, zuby, plomby, zubní protézy. V kterémkoli věku mohou být nevědomky polknuty předměty ponechané ze zlozvyku mezi rty, např. spínací špendlíky, jehly, knoflíčky, hřebíčky apod. Bizarní je výběr polknutých předmětů u psychopatů a vězňů.
Klinický obraz. Predilekčními místy pro uváznutí cizích těles či perforaci jsou fyziologická zúžení, zejména v horním a dolním jícnu. Ve středním jícnu je to méně často, pokud se zde cizí těleso nezabodne. Subjektivní příznaky mohou být minimální, může být pocit cizího tělesa v krku, zvýšená salivace, bolesti či dysfagie. Nejzávažnější komplikací je perforace, o níž se zmíníme později, a aspirace. Obecně lze říci, že polknutí cizího tělesa do zažívacího traktu se častěji vyskytuje u malých dětí a jde většinou o polknutí během jídla nebo u dětí během hry. U dospělých je tato příhoda vzácná. Riziko polknutí cizího tělesa v dospělosti je velmi malé a zejména polknutí neostrých oblých cizích těles zpravidla proběhne bez komplikací a dojde k odchodu přirozenou cestou se stolicí. Občas se vyskytnou u ostrých a špičatých cizích těles (hrotnatá kost, párátko, špendlík) i závažné komplikace v podobě perforace zažívacího traktu, což si vyžádá operační řešení a výjimečně, zvláště po pozdním rozpoznání této komplikace, může dojít i k úmrtí pacienta.
Diagnostika. Důležitým vodítkem k určení diagnózy je obvykle anamnéza. Základním vyšetřením je prostý rentgenový snímek, na němž se zobrazí většina cizích těles. Není-li diagnóza jasná nebo při podezření na perforaci je indikováno kontrastní vyšetření pouze vodným roztokem. Vyšetření baryem je kontraindikováno, protože by ztížilo pozdější vyšetření endoskopické.
Léčba. Až 90 % polknutých cizích těles projde do žaludku, zbytek se obvykle podaří extrahovat endoskopicky a jen asi 1 % si vyžádá operaci [5, 6, 7]. Místo rigidních ezofagoskopů se dnes již takřka výhradně užívají fibroskopy. U dětí a neklidných nemocných je někdy nutná celková anestezie. Odstranění se provádí úchopovými klíšťkami. Hladká a příliš velká tělesa, která nelze uchopit klíšťkami, mohou být odstraněna zavedením dilatačního balonku pod cizí těleso a poté vytažením balonku i endoskopu společně. Je zde větší nebezpečí vniknutí cizího tělesa do dýchacích cest. Malá cizí tělesa, pod 20 mm, mohou být zatlačena do žaludku. Větší cizí tělesa, která projdou jícnem, obvykle uváznou v žaludku. Jinou možností extrakce je užití polypektomické kličky či extrakčního košíku. Při neúspěchu extrakce je nutné chirurgické odstranění z ezofagotomie.
Literatura
- Gerling S, Behrens R. Fremdkörperringerstionen im Kindesalter. Pädiat Prax. 1994;47:53–63.
- Haraguchi M, Matsuo S, Tokail H, Azuma T, Ymaguchi S, Dateki S, et al. Surgical intervention for the ingestion of multiple magnets by children. J Clin Gastroenterol. 2004;38:915–916.
- Berggreen PJ, Harrison E, Sanowski RA, Ingebo K, Nolad B, Zierer S. Techniques and complications of esophageal foreign body extraction in children and adults. Gastrointest endosc. 1993;39:626–630.
- von Rahden BHA, Feith M, Dittler HJ, Stein HJ. Cervical esophageal perforation with severe mediastinitis due to an impacted dental prosthesis. Dis Esophagus. 2002;15:340–344.
- Barros JL, Caballero A Jr, Rueda JC, Monturiol JM. Foreign body ingestion: management of 167 cases. World J Surg. 1991;15:783–788.
- Manegold BC. Fremdkörper im Bereich von Ösophagus und Magen. In: Siewert JR, et al. (Hrsg.). Chirurgische Gastroenterologie. Bd 2, 2. Aufl. Berlin Heidelberg New York Tokyo: Springer Verlag; s. 574–581.
- Lai ATY, Chow TL, Lee DTY, Kwok SPY. Risk factors predicting the development of complication after foreign body ingestion. Br J Surg. 2003;90:1531–1535.
14.3 Perforace jícnu
Etiopatogeneze. Otevřená poranění (střelná, bodná) jícnu jsou vzácná a zpravidla jsou spojena s poraněním okolních struktur. Více než 75 % poranění jícnu vzniká iatrogenně při endoskopii, dilataci striktur či pokusu o odstranění cizího tělesa [1]. Do této problematiky náleží i závažná komplikace v ezofageální chirurgii, dehiscence jícnové anastomózy [2, 3].
Hlavním nebezpečím při poranění jícnu je šíření vysoce virulentní infekce do preformovaných prostor na krku v mezihrudí a vznik mediastinitidy [4]. Infekce se často šíří i do dutiny pohrudniční. Daleko vzácnější je přenos infekce do mediastina lymfatickou a krevní cestou nebo přímým přestupem z okolních orgánů (plíce, dentální infekce). Rozvinutá akutní mediastinitida vede k těžkému septickému stavu se špatnou prognózou a vysokou úmrtností 30–40 %.
Klinický obraz a diagnostika. Na možnost perforace je nutné myslet po každém instrumentálním vyšetření a je nutné nemocného přiměřenou dobu sledovat. Alarmujícími příznaky jsou bolest, dysfagie, otok a podkožní emfyzém, lokalizovaný zejména na krku, a z objektivních příznaků tachykardie a teplota. Na prostém rentgenovém snímku mohou být známky emfyzému v některých tkáních, rozšíření mediastina a známky pleurálního výpotku a pneumotoraxu. Při podezření na perforaci je třeba neodkladně provést kontrastní vyšetření jícnu vodným roztokem. Takto většinou spolehlivě ozřejmíme místo a rozsah perforace, popř. prokážeme uvázlé těleso.
Predilekčními místy perforace jsou fyziologická zúžení jícnu. K instrumentální perforaci dochází nejčastěji v krčním jícnu. Ezofagoskop zde může tlačit v krikofaryngeální oblasti na zadní stěnu jícnu proti krční páteři. Dochází tak ke zhmoždění a laceraci jícnu, zvláště u nemocných s osteofyty.
Léčba. Nejdůležitějším faktorem při léčení perforace jícnu je včasné stanovení diagnózy a bezodkladné zahájení léčby. Při čerstvém poranění je možné provést, nejpozději do 24 hodin od poranění, suturu trhliny. Při pozdní diagnóze a zejména při rozvoji mediastinitidy, která vzniká často již po několika hodinách, sutura již není spolehlivá, protože stehy v rozbředlém terénu nedrží. Za této situace je možná jen drenáž, výživu nemocného lze zajistit zavedením sondy a individuálně je nutno zvážit založení výživné gastrostomie. Vždy je indikována léčba antibiotiky, parenterální výživa a komplexní resuscitační péče, včetně umělé plicní ventilace u těžkých stavů. Slibným se jeví zavádění tzv. obdukovaných stentů, které uzavřou místo perforace. Větší zkušenosti s touto metodou již byly získány i při řešení komplikací v jícnové chirurgii, jak je uvedeno dále. Při rozsáhlé perforaci a pokročilé mediastinitidě může být jediným možným řešením exstirpace jícnu s krční ezofagostomií a gastrostomií. Po zvládnutí akutního stavu pak následuje náhrada jícnu.
Z hlediska léčebné taktiky a techniky je nutno rozlišit poranění v oblasti krčního a hrudního jícnu. U krčního jícnu lze výjimečně, při nepatrné trhlině, postupovat konzervativně za bedlivého sledování nemocného. Je to možné tam, kde ezofagogram prokazuje pouze krátkou výchlipku zasahující mimo lumen bez šíření do větší vzdálenosti od jícnu. Nesmí být přítomny celkové septické příznaky, zejména vysoká teplota, tachypnoe a hypotenze. Jen zcela výjimečně by tato situace mohla nastat u poranění hrudního jícnu. Vždy je nutno postupovat v součinnosti se zkušeným jícnovým chirurgem a nejlépe je předat nemocného na specializované pracoviště. Je největší chybou lékaře a tragédií pro nemocného oddálit chirurgické léčení perforace, je-li indikováno [5, 6, 7, 8, 9].
Komplikace ezofagogastrické anastomózy
K dehiscenci ezofagogastrické anastomózy po náhradě jícnu může dojít podle typu rekonstrukce buď na krku, nebo v hrudníku. Podrobnou definici a analýzu této komplikace podal Lerut se spolupracovníky i další odborníci a navrhují klasifikaci stupně dehiscence a z ní se odvíjejí i možnosti léčby [10] (tab. 2).
| Tab. 2 Definice a klasifikace dehiscence anastomózy doporučená Lerutem [10] |
|
| Stupeň dehiscence | Definice |
| I. Bez klinických příznaků | Radiologický průkaz |
| II. Mírné klinické příznaky | Lokální zánět (rána na krku); minimální únik kontrastu na rtg (hrudní anastomóza) |
| III. Výrazné klinické příznaky | Příznaky sepse |
| IV. Nekróza transponovaného žaludku | Endoskopické ověření |
.
Etiologie vzniku dehiscence je multifaktoriální. Mezi významné rizikové faktory patří předoperační malnutrice, diabetes mellitus, dlouhodobá hospitalizace, dilatace transponovaného žaludku, hypotenze a hypoxie v perioperačním období, předoperační radiochemoterapie, kardiovaskulární a respirační choroby, vyšší věk, neplánovaná splenektomie, zkušenost chirurga a další. Stále diskutovanou otázkou je i technika anastomózy ručním či staplerovým šitím, využití omentoplastiky, kdy se zdá, že více převažuje názor o výhodnosti použití staplerů [13, 14, 15]. V diagnostice má vedle klinických projevů (horečka, tachykardie, leukocytóza, septické příznaky) význam průkaz podané metylenové modři ve drénech a zejména kontrastní ezofagogram, případně v kombinaci s CT.
Spektrum klinických obtíží se odvíjí od stupně dehiscence, jak byla charakterizována v tab. 2, a rozhodujícím faktorem je stupeň kontaminace mediastinálního a pleurálního prostoru, zvláště došlo-li k nekróze žaludečního tubusu. Pro posouzení je důležitý obraz rozsahu úniku kontrastní látky při ezofagografii. Nevelký ohraničený únik zpravidla nevyvolává výraznou symptomatologii na rozdíl od většího úniku do mediastina a pleurální dutiny, který je obvykle spojen se septickými projevy. Je samozřejmé, že krční dehiscence má zpravidla mnohem méně dramatické příznaky než hrudní, a většinou zde vystačíme s konzervativní léčbou.
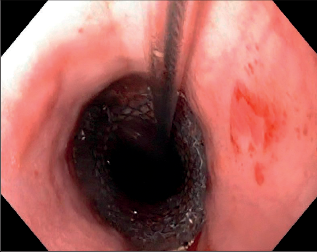
Obr. 5
Endoskopický pohled na zavedený obdukovaný stent do jícnu při dehiscenci gastroezofageální anastomózy
S ohledem na možný různorodý klinický obraz dehiscence anastomózy v hrudníku přichází v úvahu i různý, tíži postižení odpovídající způsob léčby. Z našich zkušeností, které se shodují s údaji publikovanými v odborné literatuře, vyplývá, že klasické chirurgické zásady platné pro léčení dehiscence intratorakální anastomózy založené na horní části zažívacího traktu, jsou obdobné jako při perforaci jícnu cizím tělesem či při endoskopii [16,17,18]: drenáž místa perforace, zabránění dalšímu úniku sekretu mimo zažívací trakt a zajištění pasáže a dostatečná enterální výživa po dobu hojení perforace. Podobně jako u perforace jícnu je sutura dehiscence možná jen při včasné diagnoze. Při rozvinutém zánětu již stehy ve zmíněné oblasti nedrží a lepším řešením je kombinace stentu a drenáže. Otevřenou drenáž z torakotomie je dnes často možno nahradit zavedením drénu pod CT či sonografickou kontrolou se současným zavedením obdukovaného stentu. Exkluze jícnu založením krční ezofagostomie a současná gastroči jejunostomie k zajištění odsátí obsahu jícnu a k enterální výživě je dnes takřka vždy nahrazena užitím speciálních enterálních sond. Implantace obdukovaného jícnového stentu patří k poslední miniinvazivní novince, stále častěji úspěšně uplatňované v posledním desetiletí [3, 19–31] (obr. 2–5). Při rozsáhlé dehiscenci a těžké mediastinitidě, zejména je-li přítomná nekróza transponovaného žaludku, je nutné tubus odstranit a založit krční ezofagostomii a jejunostomii. V druhé době je pak možno jícen nahradit koloplastikou.

Obr. 6
Setkání s prof. R . Belseym na kon gresu v Lucembursku v roce 1995 (zprava: M. Duda, R . Belsey, S. Czudek)
Závěrem této kapitoly si dovolím vzpomenout slavného jícnového chirurga prof. Ronalda Belseyho z Bristolu, se kterým jsme po dlouhá léta udržovali přátelské i odborné kontakty (obr. 6). V 80. letech minulého století na otázku „Jak by postupoval, kdyby měl u svého pacienta intratorakální dehiscenci anastomózy?“ odpověděl: „Zavolal bych kněze.“ Naštěstí se naše možnosti od těch let značně změnily.
Spontánní ruptura jícnu (Boerhaaveův syndrom)
Jde o onemocnění vzácné, avšak historicky a patogenicky zajímavé. Popsal je Boerhaave roku 1724 u velitele nizozemské flotily admirála Wassenaera, který podlehl ruptuře po excesu in Baccho [32].
Etiologie. Příčinou je náhlé zvýšení tlaku v jícnu vyvolané zvracením, zvláště v alkoholickém opojení, epileptickým záchvatem, porodem, namáhavou defekací, zdvižením břemene apod. K roztržení stěny jícnu dojde nejčastěji v posterolaterální části levé poloviny terminálního jícnu. Dispozičním faktorem je chorobně změněný jícen při ezofagitidě apod.
Klinický obraz a diferenciální diagnóza. V klinickém obraze dominuje náhlá bolest, která navazuje na zvracení. Podle místa perforace se stav jeví jako náhlá příhoda hrudní či břišní, kde je třeba vyloučit (spontánní) pneumotorax, infarkt myokardu, disekující aneuryzma aorty, perforaci žaludku atd. Další průběh onemocnění se neliší od perforace jícnu jiného původu.
Diagnostika a léčba. Diagnózu ověříme kontrastní pasáží jícnu vodným roztokem, zásady léčení jsou stejné jako u jiných druhů perforace jícnu. I zde je prognóza závislá na včasné diagnóze a zahájení léčby [33, 34].
Literatura
- Hep A. Perforace jícnu. In: Dítě P, editor. Akutní stavy v gastroenterologii. Praha: Galén; 2005: s. 41–47.
- Vyhnálek P, Sákra L, Daněk T, Šiller J, Havlíček K, Hájek J, Sillinger P. Endoskopické řešení iatrogenního poškození jícnu. Rozhl Chir. 2006;85(1):6–8
- Klečka J, Šimánek V, Vodička J, Špidlen V, Pradl R, Ferda J. Akutní mediastinitis – optimální diagnostická a léčebná opatření. Rozhl Chir. 2009;88(5):253–258.
- Ferguson MK. Esophageal perforation and caustic injury: management of perforated esophageal cancer. Dis Esophagus. 1997;10:90–94.
- Fernandez FF, Richter A, Freudenberg S, Wendl K, Manegold BC. Treatment of endoscopic esophageal perforation. Surg Endosc. 1999;13:962–966.
- Jones WG II, Ginsberg RJ. Esophageal perforation: a continuing challenge. Ann Thorac Surg. 1992;53:534–543.
- Kim-Deobald J, Kozarek RA. Esophageal perforation: an 8-year review of a multispecialty clinic’s experience. Am J Gastroenterol. 1992;87:1112–1119.
- White RK, Morris DM. Diagnosis and management of esophageal perforation. Am Surg. 1992;58:112–119.
- Duda M, Adamčík L, Czudek S, Škrovina M, Velkoborský M, Čech B, Bezděk R, Merenda M, Kamler A. Miniinvazivní řešení komplikací v jícnové chirurgii. Slovenská chirurgia. 2010; 7(1–2):21–24.
- Lerut T, Coosemans W, Decker G, et al. Anastomotic complication after esophagostomy. Dig Surg. 2002;19:92–98.
- Cassivi SD. Leaks strictures end necrosis: a review of anastomotic complication following esophagectomy. Semin Thorac Cardiovasc Surg. 2004;16:124–132.
- Peel AL, Taylor EW. Propoused definations of the audit of postoperative infection: a discussion paper Surgical infection study group. Ann R Coll Surg Engl. 1991;73:385–388.
- Turkyilmaz A, Eroglu A, Aydin Y, Tekinbas C, Muharren Erol M, Karaoglanoglu N. The management of esophagogastric anastomotic leak after esophagectomy for esophageal carcinoma. Dis Esophagus. 2009; 22:119–126.
- Paterson IM, Wong J. Anastomotic leakage: an avoidable complication of Lewis – Tanner esophagectomy. Br J Surg. 1989;76:127–129.
- Mathisen DJ, Grillo HC, Wilkins EW Jr, et al. Transthoracic esophagectomy: a safe approach to carcinoma of the esofagus. Ann Thorax Surg. 1988;45:137–143.
- Duda M, Gryga A, Dlouhý M, Scheinarová A, Marek O, Mocňáková M. Léčba perforační mediastinitidy. Rozhl Chir. 1996;75(1):31–33.
- Vomela J. Mediastinitis acuta diagnostika a terapie. 1. vydání. Brno: 2000; Acta facultatis Medicae Universitatis Brunensis Masarykianae (Sborník prací lékařské fakulty č. 116 Masarykovy Univerzity Brno); 2000
- Janík M, Krajč T, Benej R, Haruštiak S. Aktuálne trendy v limbe akútnej mediastinitídy. Slovenská chirurgia. 2008;5(4):4–8.
- Kauer WKH, Stein HJ, Dittler HJ, Siewert JR. Stent implantation as a treatment option in patiens with thoracic anastomotic leaks after esophagectomy. Surg Endosc. 2008;22:50–53.
- Yano F, Mittal SK. Post-operative esophageal leak treated with removable silicone-covered polyester stent. Dis Esophagus. 2007;20:535–537.
- Al-Haddad M, Craig CA, Odell J, Pajaro O, Wallace MB. The use of self-expandable plastic stents for non-malignant esophago-pleural fistulas. Diseases of the Esophagus. 2007;20: 538–541.
- Nowakowski P, Ziaja K, Ludyga T. Kuczmik W, Biolik G, Ćwik P, Ziaja D. Elf-expandable metallic stents in the treatment of post-esophagogastrostomy/post-esophagoenterostomy fistula. Dis Esophagus. 2007;20:358–360.
- Johnsson E, Lundell L, Liedman B. Sealing of esophagel perforation or rupture with expandable metallic stent: a prospective controlled study on treatment efficacy and limitations. Diseases of the Esofagus. 2005;18(4):262–266.
- Langer FB, Wenzl E, Prager G, Salat A, Miholic J, Mang T, Zacherl J. Management of postoperatice esophageal leaks with the Polyflex self-expanding covered plastic stent. Ann Thorac Surg. 2005;79(2):392–403.
- Radecke K, Gerken G, Treichel U. Impact of self-expanding plastic esophageal stent on various esophageal stenoses, fistulas, and leakages: a single-enter experience in 39 patients. Gastrointest Endosc. 2005;61(7):812–818.
- Schubert D, Scheidbach H, Kuhn R, Wex C, Weiss G, Eder F, Lippert H, Pross M. Endoscopic treatment ot thoracic esophageal anastomosis leaks by using silicone-covered, self-expanding polyester stents. Gastrointest Endosc. 2005;61(7):891–896.
- Scileppi T, Li JJ, Iswara K, Tenner S. The use of a Polyflex coated esophageal stent to assist in the closure of a colonic anastomosis leak. Gastrointest Endosc. 2005;62(4):643–645.
- Gelbmann CM, Ratiu NL, Rath HC, Rogler G, Lock G, Schölmerich J, Kullmann F. Use of self-expandable plastic stents for the treatment of esophageal perforations and symptomatic anastomosis leaks. Endoscopy. 2004;36(8):695–699.
- Hünerbein M. Stroszczynski C, Moesta KT, Schlag PM. Treatment ot thoracic anastomosis leaks after esophagectomy with self-expanding plastic stents. Ann Surg. 2004;240(5):801–807.
- Doniec JM, Schniewind B, Kahlke V, Kremer B, Grimm H. Therapy of anastomotic leaks by means of covered self-expanding metallic stents after esophagogastrectomy. Endoscopy. 2003;35(8):652–658.
- Roy-Choudhury SH, Nicholson AA, Wedgwood KR, et al. Symptomatic malignant gastroesophageal anastomotic leak: management with covered methalic esophageal stents. Am J Roentgenol. 2001;176:161–165.
- Brauer RB, Liebermann-Meffert D, Stein HJ, Bartels H, Siewert JR. Boerhaave’s syndrome: analysis of the literature and report od 18 new cases. Dis Esophagus. 1997;10:64–68.
- Váňa J, Celec J, Kačo L’, Bízik L. Primárne nepoznaný Boerhaave syndrom. Rozhl Chir. 2002;81(2):51–53.
- Vysloužil K, Král V, Klementa I, Blahut L, Konečný M, Neoral Č. Chirurgické léčení spontánní perforace jícnu – Boerhaave syndrom. Rozhl Chir. 2000;79(11):521–523.