3 Miniinvazivní a endovaskulární léčba cévních onemocnění
3.1 Miniinvazivní výkony v cévní chirurgii
Miniinvazivita v chirurgii spočívá v minimalizaci operačních vstupů (ran). Jednoznačné výhody miniinvazivního přístupu spočívají ve snížení pooperačních obtíží (snížení bolestivosti, zkrácení pooperační závislosti na ventilátoru), lepším hojení, umožnění včasnější rehabilitace a návratu do běžného života, nezanedbatelný je efekt kosmetický. U cévních rekonstrukcí v oblasti aorto-iliako-femorální, a to jak při postižení uzávěrovém – obliteračním, tak i dilatačním– aneuryzmatickém, se využívají techniky minilaparotomie, ruční asistence a laparo/torakoskopie, a to samostatně, nebo se spolu kombinují a nebo využívají počítačem řízeného robotického systému.
3.1.1 Minilaparotomie
Jako přístupové cesty do dutiny břišní se využívá malého řezu (6–12 cm, střední nebo příčná). Základní podmínkou úspěšného provedení cévního výkonu z malého řezu je dobrá svalová relaxace a rozvěračová technika.
3.1.2 Laparoskopie
Laparoskopické techniky se uplatnily v cévní chirurgii s určitým zpožděním (1993 – Dion, laparoskopicky asistovaný aortobifemorální bypass, 2001 – Dion, laparoskopická resekce výdutě břišní aorty), které bylo dáno technickou obtížností čistě laparoskopicky založené cévní anastomózy (dva endojehelce). Laparoskopické cévní rekonstrukce se provádějí v pneumoperitoneu, přístupem transperitoneálním, retroperitoneálním nebo kombinovaným (problematika dostatečného operačního prostoru „nekontaminovaného“ střevními kličkami) a vyžadují speciální cévní laparoskopické instrumentarium. Poloha nemocného, umístění a počty trokarů (pracovních vstupů) závisí na typu rekonstrukce.
3.1.2.1 Laparoskopická sympatektomie
Lumbální sympatektomie se provádí většinou v kombinaci s cévní rekonstrukcí, a využívá tak stejného operačního přístupu. V případě samostatného výkonu je dnes již metodou volby v oblasti bederního sympatiku perkutánní radiofrekvenční ablace.
3.1.2.2 Laparoskopie v kombinaci s endovaskulární léčbou AA
Laparoskopicky se provádějí, a to primárně jako součást hybridního výkonu, nebo sekundárně při řešení komplikací, tyto doplňující chirurgické výkony endovaskulární léčby AA (additional-associated surgery)– uzávěry lumbálních tepen, dolní mesenterické tepny a vnitřní iliakální tepny, fixace stentgraftu v místě aortálního nebo iliakálního krčku.
3.1.3 Laparoskopicky asistovaná cévní rekonstrukce
K provedení cévní rekonstrukce se kombinuje laparoskopie s minilaparotomií. Laparoskopicky je vypreparována tepna/aorta a následné klasické našití cévní anastomózy z minilaparotomie zjednodušuje a zrychluje výkon.
3.1.4 Rukou asistovaná laparoskopie
K provedení cévní rekonstrukce se kombinuje nedominantní ruka operatéra zavedená do dutiny břišní pomocí speciálního „handportu“ a cévní laparoskopické instrumentárium. Výkon se provádí v pneumoperitoneu, ruka zjednodušuje laparoskopické našití anastomózy.
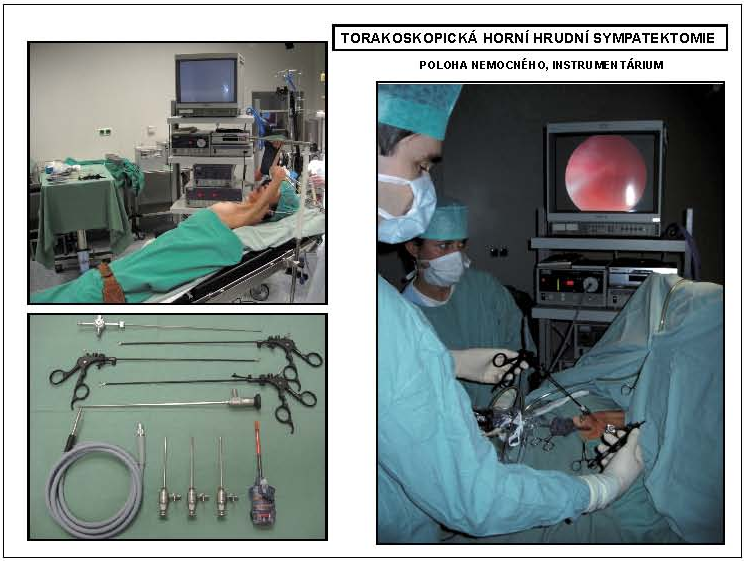
TORAKOSKOPICKÁ HORNÍ HRUDNÍ SYMPATEKTOMIE
3.1.5 Torakoskopie
Praktické využití torakoskopických výkonů na hrudní aortě není ani ve světě běžné. Na aortální oblouk se přistupuje zprava, na sestupnou aortu zleva, u torakoabdominálních výdutí se torakoskopie kombinuje s transperitoneo-retroperitoneálním otevřeným přístupem.
3.1.5.1 Torakoskopická sympatektomie
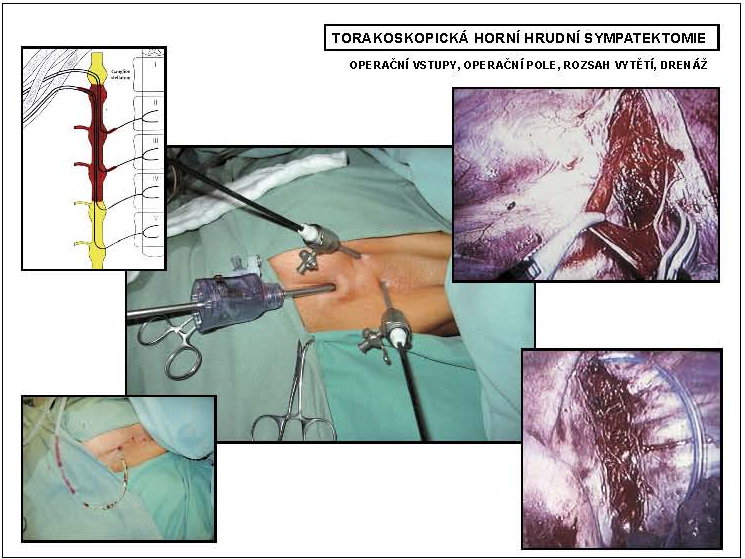
Torakoskopický výkon je i dnes metodou volby na hrudním sympatiku. Výkon se provádí ze tří vstupů (pro optiku a dva nástroje) v odpovídajících mezižebřích. Splňuje všechny předpoklady miniinvazivního výkonu a v této oblasti je navíc zcela přehledný a rychlý (obr. 1, 2).
3.1.6 Robotická chirurgie
Robotická chirurgie využívá k provádění operací počítačem řízeného robotického systému. Robotická ramena se specializovanými nástroji jsou připojena k mechanismu řízenému počítačem, který je ovládán operatérem od řídící konzoly. Výhodou robotického systému je zvýšení přesnosti, kontroly a zručnosti provedení a zkrácení doby výkonu (rychlejší šití cévní anastomózy). První cévní rekonstrukce asistovaná robotem byla provedena v roce 2001, v ČR v roce 2005– Štádler (obr. 3).
3.1.7 Indikace k miniinvazivním výkonům
Indikace k miniinvazivnímu výkonu by měla vždy vycházet z toho, zda zisk z minimalizace operačního přístupu u daného nemocného a plánovaného cévního výkonu převýší jeho nevýhody a rizika.
3.1.8 Chyby a komplikace miniinvazivních výkonů
Nejčastější chybou v miniinvazivní chirurgii je na prvním místě nevhodný výběr nemocného a dále špatná volba typu a umístění pracovních vstupů, které mají za následek znepřehlednění operačního pole. Při komplikovaném průběhu (obtížná preparace,přetrvávající krvácení…) je zásadní chybou pozdní rozhodnutí ke konverzi na rozšířený přístup, a tím i prodlužování výkonu a anestezie. V průběhu laparo/torakoskopických výkonů je třeba hlídat insufaci CO2. Respirační systém je přetěžován, vysoký intrakavitální tlak může způsobit kolaps kapacitních cév, snížit cévní resistenci a krevní tlak, způsobit těžkou hyperkapnii s kardiodepresivním účinkem. Možnou komplikací je poranění vnitřních orgánů při zavádění prvního trokaru (ostatní jsou již zaváděny pod optickou kontrolou). Další komplikace jsou specifické pro typ výkonu a neliší se od komplikací při klasické cévní chirurgii.
3.1.9 Závěr
Miniinvazivní přístupy jsou možnou alternativou u klasických cévních výkonů. Laparo/torakoskopické cévně rekonstrukční výkony nejsou zatím prováděny běžně, ale vysoce výběrově, a jsou soustředěny do specializovaných center (v ČR Nemocnice Na Homolce, Praha). Nevýhodou všech miniinvazivních přístupů je dlouhá doba trvání výkonu (přípravy a vlastní operace) a v některých případech snížený pracovní komfort (malé operační pole). Zlepšující se technické možnosti (dokonalejší instrumentarium) a zkušenosti však vedou ke zkrácení operačního času, a tím i délky anestezie, ke snížení počtu technických chyb a komplikací. Z ekonomického pohledu jsou pořizovací náklady vysoké (endoskopické věže, specializované operační nástroje). Na druhé straně zkrácení hospitalizace a rychlejší návrat k běžnému životu tyto výkony pro společnost zlevňují. Snížení pooperačních obtíží (snížení bolestivosti, zkrácení pooperační závislosti na ventilátoru), lepší hojení, umožnění včasnější rehabilitace a návratu do běžného života, nezanedbatelný kosmetický efekt, to vše přináší zásadní zlepšení komfortu pro nemocného.
3.2 Endovaskulární léčba
Endovaskulární léčba je prováděna metodami a technikami angiointervenční radiologie. Její základy položily perkutánní punkce tepny se zavedením katétru po vodiči (1953 – Seldinger), dilatace tepny koaxiálním katétrem (1964 – Dotter), vývoj balónkového katétru (1974 – Grüntzig) a myšlenka kovové výztuže vložené do cévy (1983 – Dotter). Opravdový „boom“ endovaskulární chirurgie přišel s rozvojem nových technologií koncem 80. let minulého století.
3.2.1 Endovaskulární léčba uzávěrového postižení cév
Endovaskulární léčba uzávěrového postižení cév využívá techniky PTA, event. doplněné stentem nebo stentgraftem, trombolýzu a SIR. Během výkonů je podávána antikoagulační léčba a nemocní jsou následně trvale na anti-agregační léčbě.
3.2.1.1 Perkutánní transluminální angioplastika – PTA
Principem této metody je roztažení cévy pomocí balonkového katétru. Katétr je zaveden do místa zásahu (zúžení, uzávěr) s balonkem ve složeném stavu perkutánně po vodiči. Naplněním balonku dojde ke „kontrolovanému“ roztržení patologicky změněné cévní stěny v rozsahu endarteria (intimy a vnitřní části medie). Délka balonku odpovídá délce léze, šířka balonku je maximálně o 10% větší než předpokládaná šířka „zdravé“ cévy. Po výkonu je balonek vypuštěn a katétr vytažen. Punkční otvor v cévě je uzavřen prostou kompresí místa vpichu (manuální, kompresní zařízení) nebo pomocí perkutánní sutury (speciální šicí zařízení) (obr. 4).
3.2.1.2 Stenty, stentgrafty
Stenty jsou endovaskulární výztuže, které mají pomocí své radiální síly přemoci kompresivní sílu stenotické léze a pomocí kruhové pevnosti odolat zevní kompresi. Podpoří tak výsledek PTA. Podle způsobu užití je dělíme na balon-expandibilní (plastické) a samo-expandibilní (elastické). Balon-expandibilní stenty (z chirurgické oceli) mají větší sílu a pevnost, ale menší elasticitu, a tak se používají do krátkých stenóz v rovných úsecích cév. Samo-expandibilní stenty (z nitinolu) mají dobrou elasticitu, a proto se používají do delších stenóz ve vinutých cévách. Povrchy stentů mohou být upraveny (potažení zlatem, chromem, titanem, silikonem, heparinem, imunosupresivy) s cílem zmenšit dráždění cévní stěny, snížit riziko restenózy a udržet průchodnost (obr. 5). Stentgrafty jsou stenty potažené materiálem charakteru cévní protézy. Hlavními indikacemi je stavění krvácení při ruptuře tepny nebo vyřazení výdutě. Do periferních stenotických lézí se používají stentgrafty potažené ePTFE (Hemobahn-Gore).
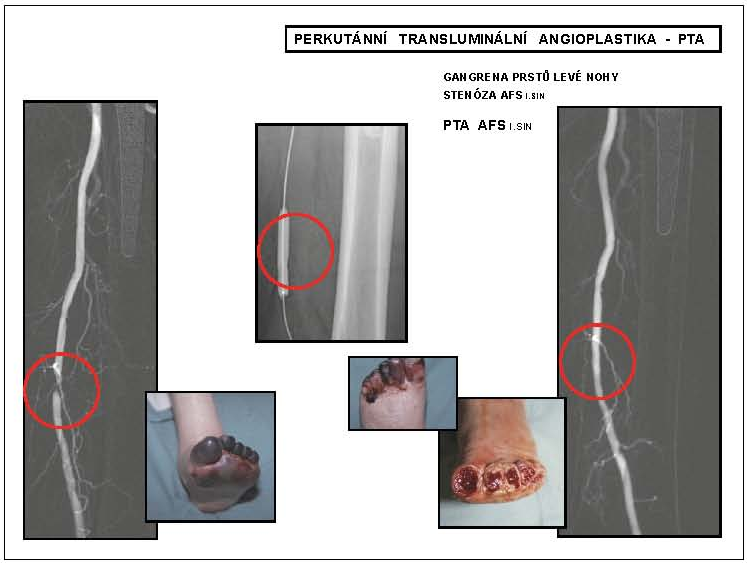
Obr. 4
Perkutánní transluminální angioplastika – PTA
* AFS l.sin – arteria femoralis superfi cialis na levé dolní končetině
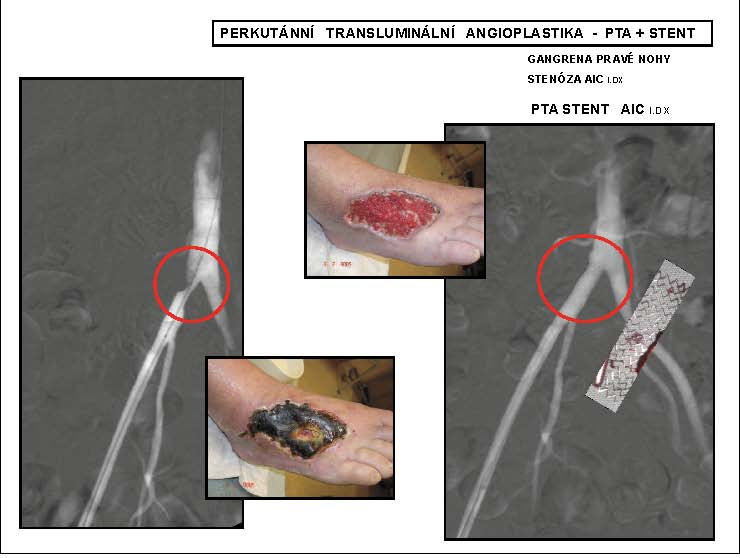
Obr. 5
Perkutánní transluminální angioplastika – PTA + STENT
* AIC l.dx – arteria ilica communis na pravé dolní končetině
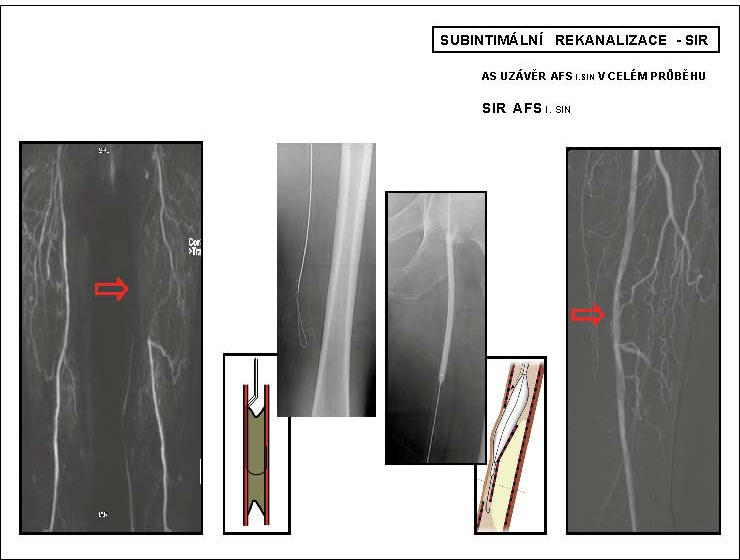
Obr. 6
Subintimální rekanalizace – SIR
* AFS l.sin – arteria femoralis superfi cialis na levé dolní končetině
3.2.1.3 Subintimální rekanalizace – SIR
Principem metody je vytvoření „neolumina“ ve stěně tepny v subintimálním prostoru (1980 – Amman Bolia). Po průniku vodiče do subintimálního prostoru nad překážkou technikou vytvoření kličky na jeho konci, kterou posouváme směrem do periferie, otevíráme subintimální prostor až do místa reentry pod překážkou. Vzniklé neolumen předilatujeme balonkem, event. vyztužíme stentem. Metodu využíváme u dlouhých uzávěrů nebo difuzních stenotických změn tepen (povrchní stehenní tepna, podkolenní tepna). Technická úspěšnost výkonu se pohybuje kolem 80% (obr. 6).
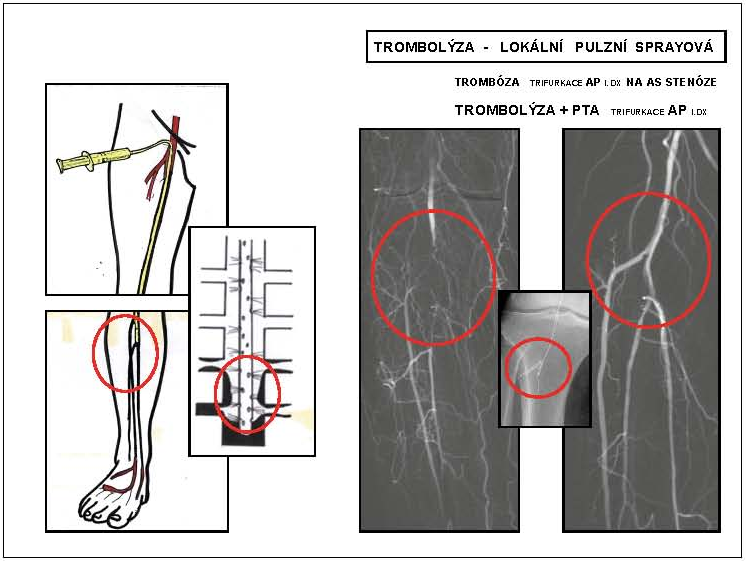
3.2.1.4 Trombolýza
Cílem trombolytické léčby je obnovení antegrádního toku v tepenném nebo žilním řečišti a prevence možných trombembolických komplikací. Metodou volby je dnes lokální trombolýza katétrem (1974 – Dotter) zavedeným do uzávěru/sraženiny, nejčastěji ve formě tzv. pulzní sprejové farmako-mechanické trombolýzy (katétrem s bočními otvory jsou dávány krátkodobé vysokotlaké pulzy). K lokálnímu podání je dnes v ČR na trhu jediné vhodné trombolytikum, a to rt-PA (Actilyse, Boehringer Pharma), která se vazbou na fibrin ve sraženině aktivuje a indukuje přeměnu plasminogenu na plasmin, a tak rozpouštění sraženiny. Výhodou lokálního podání je zvýšení účinnosti, snížení dávky, a tím i krvácivých komplikací. Kontraindikací trombolýzy jsou všechny stavy, které mohou vést k závažnému krvácení/prokrvácení. Na trombolýzu musí bezprostředně navazovat definitivní vyřešení příčiny uzávěru, a to intervenční nebo chirurgickou cestou (obr. 7).
3.2.1.5 Perkutánní aspirační trombembolektomie
Při perkutánní aspirační trombembolektomii se pomocí katétru s koncovým otvorem přímo odsává sraženina. Doplňuje trombolýzu, v případech čerstvého trombu nebo embolu může uspět samostatně.
3.2.2 Endovaskulární léčba u aneuryzmatického postižení tepen
Cílem léčby aneuryzmat/výdutí je vyřazení vaku výdutě z aktivního krevního toku, a tak prevence jeho komplikací (ruptury se život ohrožujícím krvácením; trombózy s končetinu ohrožující trombembolizací). Principem endovaskulární léčby je vyřazení vaku výdutě pomocí stentgraftu zavedeného endoluminálně s využitím speciálního zaváděcího zařízení ze vzdáleného přístupového místa a ukotveného ve zdravé tepně nad a pod vakem výdutě (v proximálním a distálním krčku). Metoda byla zavedena do klinické praxe u AA na přelomu 80. a 90. let 20. století (1986 – Volodos, 1991 – Parodi). V České republice byly provedeny první endovaskulární výkony tohoto druhu v Hradci Králové (1996 – Ferko). Možnosti endovaskulární léčby jsou omezeny vlastnostmi/konstrukcí stentgraftu a zaváděcího zařízení. Standardní endovaskulární léčba je tak možná jen při odpovídající morfologii výdutě. Speciální endovaskulární léčbu výdutí představuje využití fenestrovaných nebo větvených stentgraftů (pro odstupy aortálních větví) a hybridní výkony.
3.2.2.1 Endovaskulární léčba výdutí hrudní aorty – EVL ATA
Endovaskulární léčba výdutí hrudní aorty (1992 – Dake) se provádí standardně pomocí tubárního aortálního stentgraftu zavedeného cestou společné femorální arterie. Indikací jsou aterosklerotické nebo infekční výdutě descendentní aorty, disekce aorty typu B, traumatické pseudovýdutě. U výdutí v oblasti aortálního oblouku, které zaujímají odstupy aortálních větví oblouku, je endovaskulární řešení možné s využitím tubárního fenestrovaného nebo větveného stentgraftu a nebo pomocí hybridního výkonu (cévněchirurgická revaskularizace větví oblouku).
3.2.2.2 Endovaskulární léčba torakoabdominálních výdutí – EVL TAA
Torakoabdominální výdutě zaujímají odstupy viscerálních cév, které odstupují z krčku nebo z vaku výdutě. Jejich endovaskulární řešení je tak možné jen s využitím speciálního fenestrovaného nebo větveného tubárního aortálního stentgraftu a nebo pomocí hybridního výkonu (cévněchirurgická revaskularizace viscerálních větví).
3.2.2.3 Endovaskulární léčba výdutí břišní aorty – EVL AAA
3.2.2.3.1 Aneuryzma infrarenální aorty – AAA
Infrarenální úsek břišní aorty je místem nejčastějšího výskytu výdutě vůbec. Infrarenální výduť břišní aorty (AAA) postihuje 2–6% populace starší 60 let s trvale stoupající incidencí (0,15% ročně). Aktivní až agresivní přístup k AAA a jejich indikaci k elektivní preventivní léčbě je dán jejich záludností, fatální prognózou („každá AAA se zvětšuje a jednou praskne, a to v nejméně vhodnou dobu“) a tristními výsledky urgentní léčby s vysokou morbiditou a mortalitou (70%) ve srovnání s přijatelnými výsledky elektivní léčby i ve vysokém věku. Cílem elektivní léčby AAA je vyřazení vaku výduti z přímého krevního oběhu jako prevence jeho zvětšování a ruptury. Základním předpokladem úspěšné elektivní léčby AAA je výkon s operačním rizikem pro nemocného výrazně menším, než je riziko ruptury výdutě. Standardem léčby AAA je léčba chirurgická. Technika a taktika resekce AAA s náhradou aorty pomocí umělé cévní protézy byla vyvinuta a do klinické praxe zavedena v 50. letech 20. století. Ne všichni nemocní s AAA jsou však schopni se vyrovnat s invazivitou a hemodynamickou náročností chirurgického výkonu. Většina nemocných s AAA patří mezi tzv. cévněchirurgické nemocné s vyšším výskytem přidružených onemocnění. Mortalita elektivní chirurgické léčby AAA je dnes udávána kolem 2–8%. Závažná kardiální morbidita je udávána mezi 10–12%, pulmonální mezi 5–10% a renální kolem 5–7%. Tyto všeobecně akceptabilní výsledky elektivní chirurgické léčby AAA však platí jen pro nemocné s nízkým operačním rizikem. U nemocných s vysokým operačním rizikem jsou mortalita (19%) i kardio-pulmonální morbidita (40%) výrazně vyšší. Jejich indikace k elektivnímu výkonu je proto problematická. Někteří nemocní jsou pro klasickou chirurgickou léčbu přímo kontraindikováni.
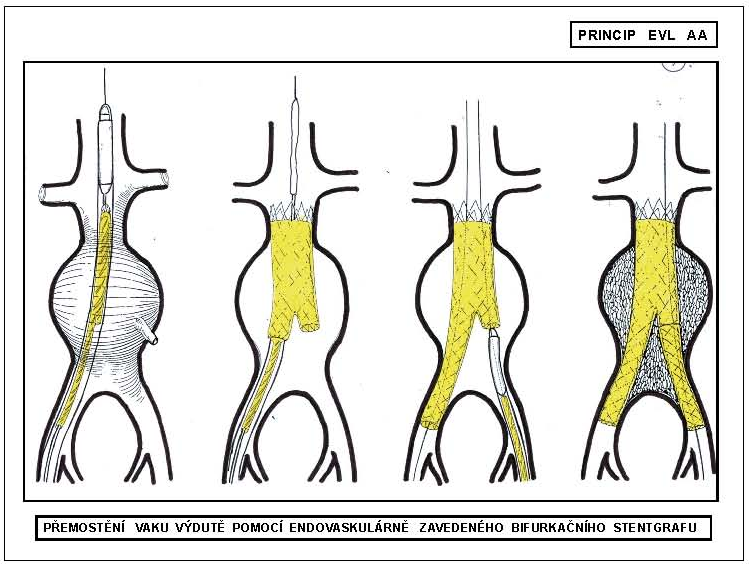
3.2.2.3.2 Endovaskulární léčba
Obrovský rozvoj intervenční radiologie v 80. a 90. letech 20. století vyústil v oblasti angiointervence k zavedení metody endovaskulárního stentgraftu k léčbě aortálních výdutí. Princip endovaskulární léčby (EVL) nabídl možnost miniinvazivní a hemodynamicky nenáročné léčby AAA s únosným operačním rizikem a nízkou morbiditou a mortalitou i pro vysoce rizikové nemocné. EVL AAA se tak dostala do popředí zájmu. Během deseti let od svého zavedení do klinické praxe si získala EVL pevné místo a zásadně ovlivnila přístup a indikační kritéria k elektivní léčbě AAA. Principem endovaskulární léčby AAA je vyřazení výdutě z oběhu jejím přemostěním endovaskulární protézou (stentgraftem) zavedenou endoluminální cestou. Stentgraft je zaveden ze vzdáleného místa (femorální arterie) pánevním řečištěm do aorty v zavaděči v komprimovaném stavu. V aortě je stentgraft uvolněn a ukotven v místě nad a pod vakem výduti v již nedilatované zdravé tepně, tzv. krčku výdutě. Ve srovnání s chirurgickou léčbou je endovaskulární léčba AAA méně invazivní – neprovádí se při ní laparotomie. Výkon je rovněž méně hemodynamicky zatěžující – odpadá přechodný uzávěr (klamping) subrenální aorty (obr. 8).
3.2.2.3.3 Stentgraft
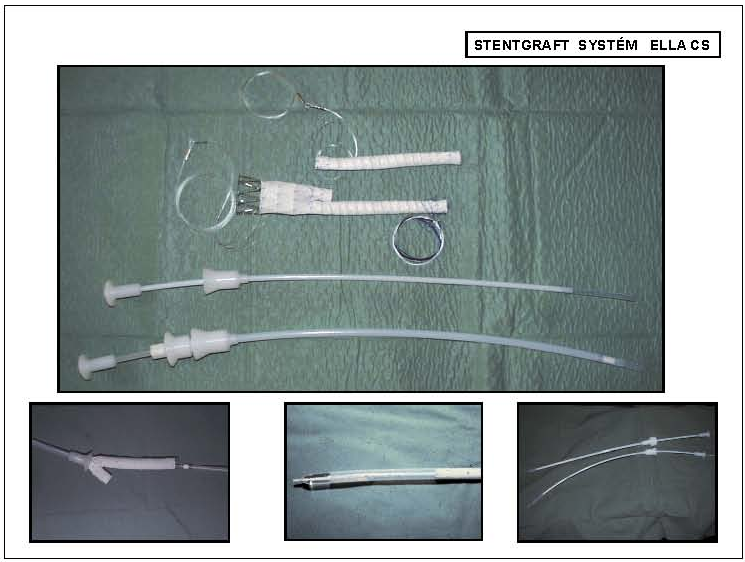
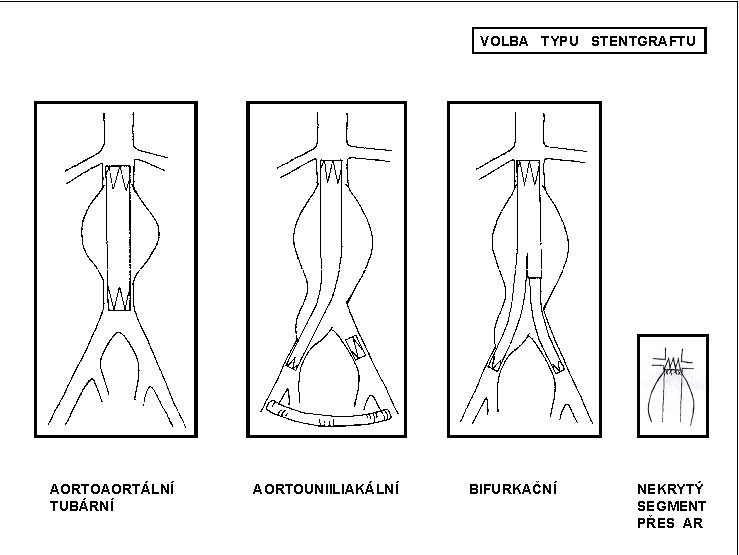
Stentgraft (endovaskulární protéza) je kombinace stentu a syntetické cévní protézy. Nejčastěji je stentgraft tvořen umělou cévní protézou (polyester, ePTFE) v celém rozsahu vyztuženou kovovým samoexpandibilním skeletem (chirurgická ocel, nitinol). Jeho výhody jsou v jednoduché manipulaci při zavádění a schopnosti kopírovat změny morfologie krčku v průběhu doby. Hlavní roli ve fixaci stentgraftu hraje stent a jeho mechanické vlastnosti – radiální síla. Tato stentovaná anastomóza je však považována za hlavní slabinu endovaskulární léčby. Zaváděcí systém umožní zavedení stentgraftu na místo určení, jeho umístění a vysunutí. Základem je široký katétr (zaváděcí pouzdro) z polyuretanu s hemostatickou chlopní na zevním konci. Podle tvaru rozlišujeme tři základní typy stentgraftu: tubární – aortoaortální, uniiliakální– aortouniiliakální a bifurkační – aortobiiliakální. Typ použitého stentgraftu závisí na morfologii aneuryzmatu a pánevního řečiště (obr. 9).
3.2.2.3.4 Morfologie AAA
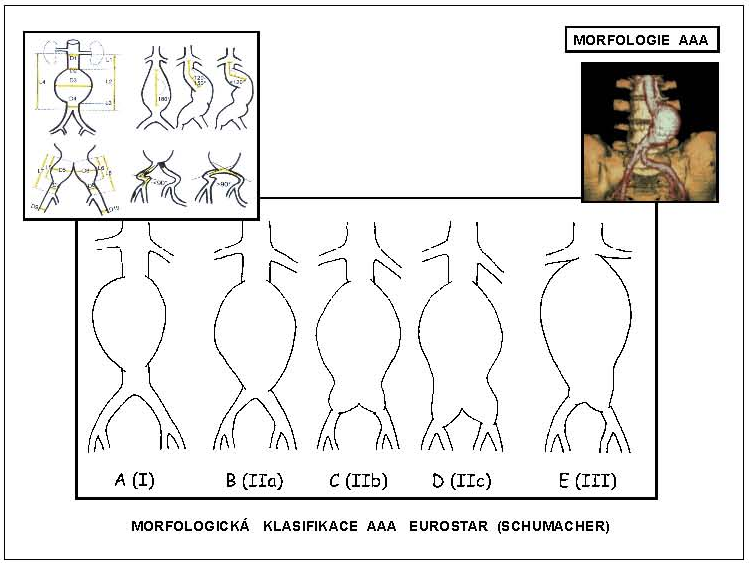
Základní podmínkou EVL je vhodná morfologie AAA a iliakálního řečiště, tj. takové anatomicko-patologické poměry v oblasti infrarenální aorty s výdutí a v iliakálním řečišti, které umožní bezpečné zavedení, spolehlivé rozvinutí a ukotvení stentgraftu. Morfologii výdutě hodnotíme z pohledu morfologických kritérií pro EVL AAA. Tyto doporučené parametry bezpečné EVL vycházejí ze současných možností EVL AAA a určují morfologické poměry, za kterých je možné bezpečně a s dlouhodobým efektem provést EVL AAA se stentgraft systémy současné konstrukce. Morfologická kritéria EVL AAA se během doby mění, a to tak, jak se vyvíjejí endovaskulární techniky a technologie. Na aortě se sleduje především oblast mezi odstupem renálních tepen a vakem výdutě – tzv. proximální krček výdutě. Hodnotí se jeho průměr, délka, tvar a event. přítomnost kalcifikací a trombů. Všechny tyto údaje mají zásadní vliv na rozhodnutí o vhodnosti aneuryzmatu k EVL. Tyto faktory jsou rovněž rozhodující z hlediska dlouhodobé stability implantovaného stentgraftu. Dále se hodnotí vak výdutě a oblast bifurkace – a to průměr a délka vaku výdutě, přítomnost event. trombu ve vaku výdutě. Rovněž velmi důležitým parametrem je úhel, který svírá podélná osa výdutě s podélnou osou krčku aneuryzmatu. Přítomnost distálního krčku, tj. zdravého úseku aorty pod aneuryzmatem, rozhoduje o typu stentgraftu. Pokud se aneuryzma šíří distálně od bifurkace, sleduje se rozsah postižení iliakálních tepen. Nejvýznamnějšími parametry ovlivňujícími zásadněmožnost EVL z technického hlediska jsou délka proximálního krčku a angulace subrenální aorty. Z čistě endovaskulárního hlediska, pokud se neberou v úvahu nové, prozatím spíše experimentální možnosti (fenestrovaný stentgraft, větvené stentgrafty) či kombinované endovaskulárně chirurgické metody (hybridní výkony), platí, že minimální délka proximálního krčku by měla být 15 mm a angulace subrenální aorty do 60 stupňů. K přesnému zobrazení a měření pro stanovení morfologie výdutě je v současnosti obecně využívána angiografie výpočetní tomografií (CTA). S ohledem na endovaskulární léčebné postupy byly vytvořeny morfologické klasifikace AAA. Jsou založeny na hodnocení rozsahu výdutě v souvislosti s přítomností a délkou horního a dolního aortálního krčku. Jejich využití je jednak praktické při výběru nemocných k EVL a volbě typu stentgraftu k exkluzi AAA a jednak slouží k přesnému porovnání výsledků léčby. Praktického rozšíření dosáhly klasifikace Schumacherova a klasifikace EUROSTAR (obr. 10).
3.2.2.3.5 Volba typu stentgraftu
Existují tři způsoby vyřazení AAA z oběhu, a proto tři typy stentgraftu. Liší se podle oblasti distálního kotvení stentgraftu. U aneuryzmat s vhodným proximálním i distálním krčkem (delším než 15 mm) je indikována implantace tubárního typu stentgraftu. Aneuryzmat vhodných z morfologického hlediska k implantaci tubárního stentgraftu je poměrně málo. U aneuryzmat bez vhodného distálního krčku závisí typ stentgraftu na morfologii pánevního řečiště. Ideálním řešením je bifurkační typ stentgraftu, zachovávající fyziologické hemodynamické poměry. Z endovaskulárního hlediska technicky jednodušší léčbou výdutí bez vhodného distálního krčku je použití uniiliakálního typu stentgraftu doplněného uzávěrem kontralaterálního pánevního řečiště a s revaskularizací druhostranné končetiny extraanatomicky pomocí femoro-femorálního crossover bypassu. Tento typ léčby však nerespektuje fyziologické anatomické a hemodynamické poměry, je proto indikován pouze u složitých morfologických poměrů na pánevním řečišti, kdy pro výrazné vinutí pánevního řečiště, jeho nedostatečnou šíři nebo uzávěr lumen jedné strany není možná implantace bifurkačního typu stentgraftu. Pro úspěšné, bezpečné a stabilní ukotvení je zásadní správné stanovení rozměrů stentgraftu, vycházející z pečlivé analýzy a zhodnocení morfologie aneuryzmatu s dostatečným nadhodnocením průměru rozvinutého stentgraftu. Na správném průměru stentgraftu je přímo úměrně závislá těsnost anastomóz. Pro horní i dolní anastomózu se volí průměr stentgraftu o 20% větší, než je skutečný průměr tepny v místě kotvení. K podpoře stability stentgraftu slouží a riziko migrace snižují kovové háčky nebo kaudálně orientované ostny v proximální části těla stentgraftu. U aneuryzmat s krátkým proximálním krčkem (méně než 15 mm) je indikován stentgraft s nekrytým proximálním segmentem. Implantace nekrytého proximálního segmentu přes odstupy renálních tepen zlepšuje i u aneuryzmat s dostatečně dlouhým proximálním krčkem kotvení stentgraftua snižuje riziko jeho migrace i možnost výskytu proximálního perigraft endoleaku (obr. 11).
3.2.2.3.6 Indikace k léčbě EVL AAA
Indikace k EVL je dána obecnou indikací nemocného s AAA k léčbě a vhodnou morfologií AAA k zavedení stentgraftu. Operačního riziko nemocného stojí vzhledem k miniinvazivitě a hemodynamické nenáročnosti EVL v pozadí. Z klinického pohledu je EVL AAA určena především pro nemocné s vysokým operačním rizikem ASA III–IV, kteří jinou šanci léčby AAA s přijatelnou morbiditou a mortalitou nemají.Z pohledu morfologie výdutě jsou limitujícími faktory šíření aneuryzmatu suprarenálně, nepřítomnost vhodného proximálního krčku aneuryzmatu nebo jeho nevhodný tvar, rozsáhlý trombus v oblasti proximálního krčku aneuryzmatu, angulace abdominální aorty, výrazně vinuté nebo stenotické pánevní řečiště. Podle striktních morfologických kritérií se v současné době udává, že 30–50% AAA je vhodných k EVL. Větší počet AAA vhodných k EVL (40–80%) uvádějí pracoviště, která využívají širokou nabídku různých typů stentgraftů a jejich zhotovení na míru. Z morfologického hlediska se indikace k EVL stále vyvíjí. Relativních kontraindikací ubývá. Nerespektování současných morfologických kritérií indikace k EVL AAA zvyšuje možnost primárního technického neúspěchu léčby a významně zvyšuje riziko pozdních komplikací a sekundárního selhání. Při vědomém nerespektování současných morfologických indikačních kritérií EVL AAA se musí k zabezpečení technického úspěchu primárně počítat s doplňující chirurgickou korekcí (hybridní výkon). Indikace k EVL AAA u nemocných mladých, u nemocných s nízkým operačním rizikem a u nemocných s dobrou dlouhodobou prognózou je nejasná vzhledem k prozatím neznámým dlouhodobým výsledkům EVL. U nemocných s AAA a se závažným přidruženým onemocněním v dutině břišní nebo retroperitoneu, které je plánováno k operační revizi v druhé době, umožní endovaskulární provedení výkonu na výduti zachovat přehledný operační terén pro následný výkon.K EVL jsou rovněž indikováni nemocní s akutní rupturou AAA. EVL snižuje letalitu urgentního výkonu u těchto nemocných na 12–20%. EVL umožňuje vyhnout se laparotomii, předchází výraznému snížení krevního tlaku, vedoucímu až k cirkulačnímu kolapsu při uvolnění retroperitonea, snižuje kardiorespirační zátěž a minimalizuje ztráty krve. Vzhledem k časové ztrátě vznikající nutností provedení časově náročnějších předoperačních vyšetření (CT, popřípadě alespoň kalibrační angiografie) jsou k urgentní EVL indikováni pouze relativně hemodynamicky stabilní nemocní.
3.2.2.3.7 Kontraindikace k EVL AAA
Kontraindikací k EVL je zcela nevyhovující morfologie AAA, infikovaná výduť a výduť spojená s vývojovými vadami pojiva. Absolutní kontraindikací k EVL je dnes již jen akutní volná ruptura AAA u nestabilního nemocného.
3.2.2.3.8 Vlastní provedení výkonu
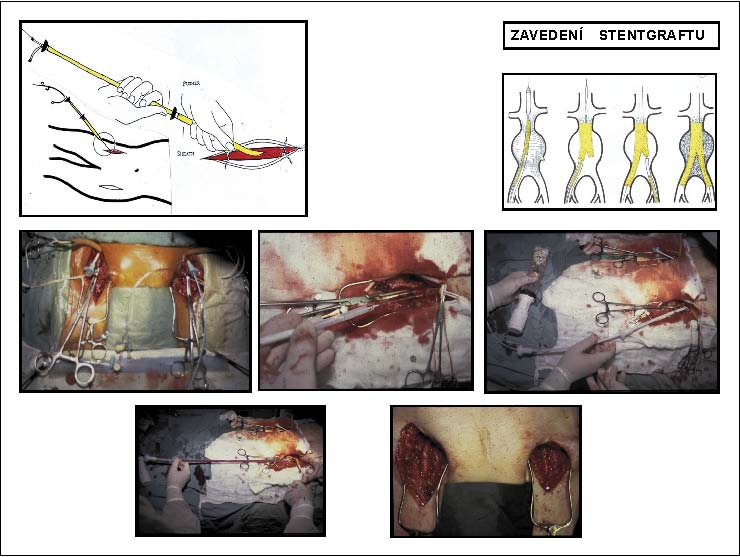
Protože jde o metodu endovaskulární, tak základem úspěšného výkonu je dokonalá pooperační zobrazovací technika. Výkon se provádí v celkové heparinizaci a pod antibiotickým krytím nejlépe v regionální anestezii (spinální, epidurální). Současná standardní technika EVL AAA je spojena s nutností chirurgické přípravy cévního přístupu. Podle typu a vzhledem k šíři zavaděčů se stentgraft implantuje z jednostranné či oboustranné arteriotomie arteria femoralis. V situaci, kdy šíře femorálních či zevních iliakálních tepen neumožňuje průchod zavaděčů, může být stentgraft implantován z extraperitoneálního přístupu cestou a. iliaca communis. Princip výkonu, zavést, uvolnit, usadit, vysunout a rozvinout stentgraft, je vždy stejný, ale vlastní provedení se liší podle typu stentgraftu a použitého stentgraft systému. Obecně po předchozí angiografii, která slouží ke stanovení místa odstupu renálních tepen z abdominální aorty, je stentgraft v zavaděči zaveden po velmi tuhém vodiči pod skiaskopickou kontrolou do místa implantace. Po přesném umístění horního konce je stentgraft uvolněn ze zavaděče. Pokud je implantován bifurkační typ stentgraftu, po uvolnění aortoiliakální komponenty je z druhostranné arteriotomie nasondováno retrográdně společné tělo přes její krátké raménko a zavedením kontralaterálního raménka se intraluminálním sestavením stentgraftu vytvoří bifurkační tvar, a tím se dokončí implantace Výkon končí uzavřením arteriotomií a suturou operační rány. U uniiliakálního typu stentgraftu uzávěru arteriotomie předchází uzávěr kontralaterální společné iliakální tepny embolizací nebo ligaturou a založení extraanatomického femoro-femorálního crossover bypassu. Snahou dále minimalizovat invazivitu výkonu, která by vedla k dalšímu snížení morbidity, jsou perkutánní sutura tepny nebo snížení průměru zaváděcích systémů stentgraftů. Snížení průměru zaváděcích systémů stentgraftů je v současné době technologicky neuskutečnitelné. Perkutánní sutura tepny je však již v současnosti možná pomocí automatických šicích zařízení. V případě technického selhání primárního výkonu můžeme zvážit primární korekci nebo konverzi výkonu, a to jak endovaskulární, tak chirurgickou (obr. 12).
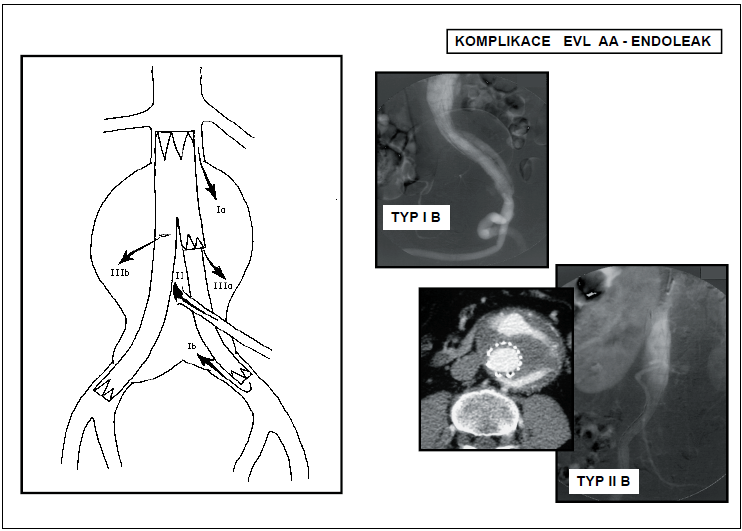
3.2.2.3.9 Komplikace EVL AAA
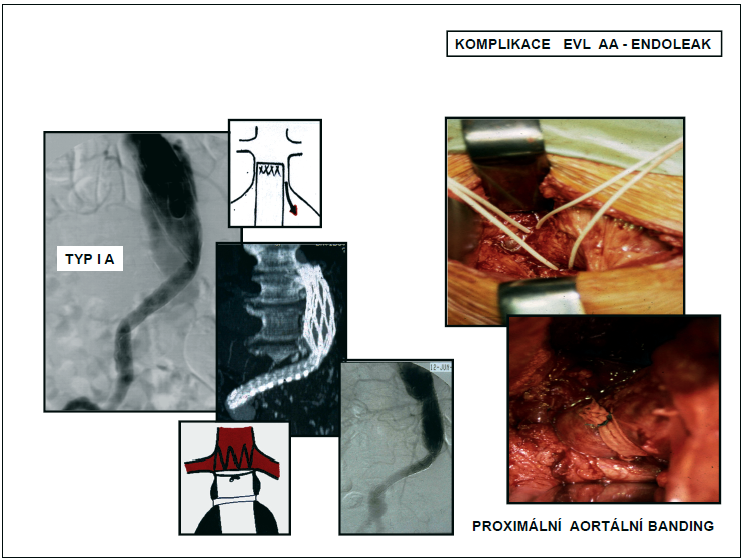
Kromě komplikací, se kterými je možné se setkat u chirurgických výkonů s použitím umělé cévní náhrady a u endovaskulárních výkonů (nespecifické komplikace místní, vzdálené a celkové), má EVL AAA své komplikace specifické.Z nespecifických komplikací jsou nejzávažnější komplikace kardiopulmonální přicházející u EVL AAA v 6,9% oproti 19,6% u chirurgické léčby. Symptomatická embolizace do periferie, způsobená manipulací ve vaku, přichází do 3%, renální selhání po EVL AAA, ať již jako komplikace podání kontrastní látky nebo jako důsledek embolizace při instrumentaci, se vyskytuje u 2–3% nemocných. Výskyt komplikací po uzávěru obou vnitřních iliakálních tepen (hýžďové klaudikace, vaskulogenní poruchy erektility a blíže nedefinovatelný pánevní diskomfort) se udává mezi 12–40%. S vyřazením obou vnitřních iliakálních tepen stoupá i riziko ischemie tračníku a míchy.Specifické komplikace mohou být vázané na stentgraft nebo na zaváděcí systém. Mezi komplikace vázané na stentgraft patří jeho nesprávné umístění, okluze, infekce, přetrvávající perfuze vaku aneuryzmatu (tzv. endoleak), zalomení stentgraftu (kinking), stenóza, migrace z místa původní fixace, porušení skeletu a protézy stentgraftu. Nejzávažnějším důsledkem specifických komplikací EVL AAA je ruptura vaku výdutě. Zvláštní komplikací je „endotension“. Jedná se o situaci, kdy je patrné zvětšování vaku výdutě po EVL bez zjistitelného endoleaku s přetrvávajícím nebo znovu nastupujícím přetlakem ve vaku. Tento přetlak může vést rovněž k ruptuře výdutě a výskyt se udává kolem1,5–5%. Příčina přetlaku není zcela jasná. Mezi komplikace vázané na zaváděcí systém pak patří disekce aorty a pánevních tepen nebo jejich perforace.Z hlediska časového vztahu k operaci lze komplikace rozdělit na časné a pozdní. Časné (primární)komplikace jsou ty, které vznikají během vlastního výkonu nebo do 30 dnů po operaci. Pozdní (sekundární) komplikace pak po 30. dnu po operaci.Nejčastější specifickou komplikací a zároveň známkou neúplného vyřazení vaku výdutě z oběhu je endoleak. Tento přetrvávající tok krve ve vaku aneuryzmatu udržuje tlak ve výduti blížící se systémovému a může vést až k ruptuře výdutě. Endoleak rozlišujeme podle doby vzniku, příčiny a místa vzniku a podle hemodynamické významnosti. Hodnocení endoleaku podle příčiny a místa vzniku vychází z toho, zda je jeho vznik vázán na stentgraft nebo na volné větve vaku výdutě. Může být důsledkem netěsnosti v místě kotvení stentgraftu (typ I) nebo spojení jeho jednotlivých částí a vysoké porozity protézy (typ III) nebo je důsledkem retrográdního toku volnými větvemi vaku z kolaterálního oběhu (typ II). Klasifikace endoleaku má praktický význam. Podle typu endoleaku indikujeme jeho řešení. Primární endoleak se objeví již při výkonu nebo do 30 dnů po výkonu. Sekundární endoleak je diagnostikován po 30 dnech od úspěšného výkonu. Přijatelný výskyt primárního endoleaku se udává kolem 10%. Většinou se jedná o endoleak I. a III. typu. Je důsledkem špatného zhodnocení morfologie AAA, špatné volby typu nebo velikosti stentgraftu a špatné techniky jeho zavedení. Průměrný výskyt sekundárního endoleaku se udává mezi 20–40%. Nejčastěji se jedná o endoleak II. typu z retrográdního toku do vaku výduti. Vyšetřování endoleaku má endoleak prokázat nebo potvrdit, určit jeho typ a hemodynamickou významnost. Typ endoleaku a jeho hemodynamická významnost indikují jeho léčbu. Žádná zobrazovací metoda není v diagnostice endoleaku suverénní (CTA, MRA, DSA), ale navzájem se doplňují. Řešení komplikací EVL AAA zahrnuje výkony doplňující – korekce nebo převedení na jiný typ výkonu – konverze. Obojí může být provedeno endovaskulárně nebo chirurgicky. Své místo má i léčba konzervativní. Znamená observaci a monitorování komplikace (endoleaku) zobrazovacími metodami a čekání na správný timing výkonu. Metodou volby v léčbě komplikací EVL AAA jsou miniinvazivní a hemodynamicky nenáročné endovaskulární angiointervenční metody, které jsou ve většině případů úspěšné.Prognosticky závažnější je obecně endoleak I. a III. typu. Znamená vysoké riziko ruptury výdutě. Je zcela jednoznačně indikován k léčbě. Může být důsledkem změn aorty a stentgraftu, ke kterým dochází v průběhu doby nebo původní takticko-technické chyby při indikaci a provedení výkonu, která se projevila až s odstupem času. Léčba endoleaku I. a III. typu je většinou endovaskulární – překrytí netěsnícího úseku prodlužovacím segmentem, endoleak I. typu lze někdy řešit tzv. chirurgickým bandingem, tj. zevně naloženou ligaturou utěsňující proximální krček aneur yzmatu kolem endoluminálně zavedeného stentgraftu. Při neřešitelné korekci komplikace endovaskulární cestou je nutná konverze na klasický chirurgický výkon. U endoleaku II. typu je riziko ruptury výdutě malé. Proto z hlediska standardizace výsledků není hemodynamicky nevýznamný endoleak II. typu považován za selhání EVL AAA. K léčbě je indikován endoleak II. typu, jen pokud je hemodynamicky významný, tj. spojený s pokračujícím zvětšováním vaku výdutě. Léčba endoleaku II. typu se provádí superselektivní embolizací příslušné volné větve vaku (nej-častěji lumbální arterie, arteria mesenterica inferior), ve které došlo na podkladě hemodynamických změn k retrográdnímu toku po tlakovém spádu do vyřazeného vaku výdutě. Superselektivní embolizace je však značně finančně i časově náročná a někdy nemožná. U retrográdního endoleaku přes arteria mesenterica inferior je možné místo embolizace tepnu v odstupu z vaku laparoskopicky zaklipovat. Jinou možností léčby retrográdního toku ve vaku aneuryzmatu je perkutánní aplikace trombinu přímo do vaku aneuryzmatu v místě patrného endoleaku (obr. 13, 14).
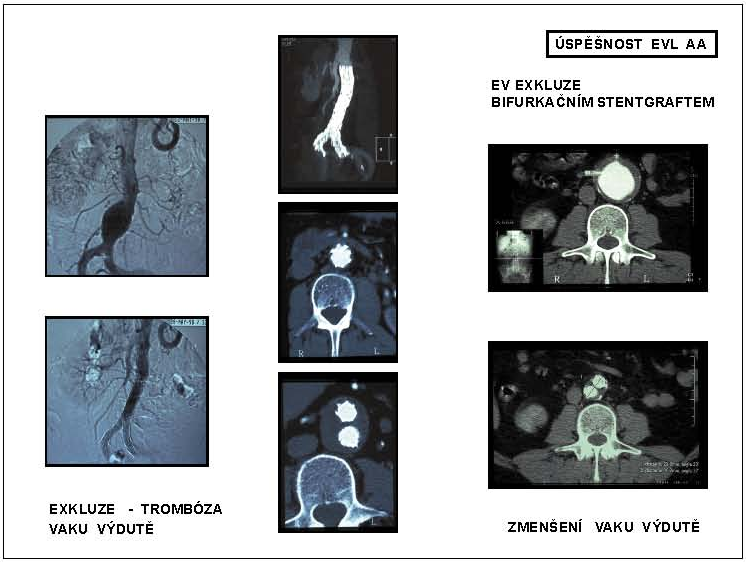
3.2.2.3.10 Výsledky EVL AAA
Primární úspěšnost endovaskulární léčby AAA je udávána mezi 48–93%. Počet konverzí ke klasické chirurgické léčbě se pohybuje mezi 0–16,5%, třicetidenní letalita mezi 1,5–7%, což jsou výsledky srovnatelné s léčbou chirurgickou. U pacientů s rizikem operačního výkonu ASA III a ASA IV je letalita endovaskulárního výkonu jednoznačně nižší než letalita výkonu chirurgického. Endovaskulární léčba přinesla rovněž výrazné snížení perioperační morbidity a krevních ztrát. Délka hospitalizace se zkrátila, pohybuje se mezi 1 až 12 dny, délka pobytu na JIP většinou nepřekračuje průměrně dva dny, významně se zrychlil návrat nemocných do normálního života. Hlavním kritériem sekundární úspěšnosti a účinnosti endovaskulární léčby je přetrvávající vyloučení aneuryzmatu z oběhu s postupným zmenšováním trombotizovaného vaku výdutě během dalšího sledování a koreluje se snížením tlaku v exkludovaném vaku aneuryzmatu. Ke zmenšení vaku výdutě dojde u 45–70% endovaskulárně léčených nemocných. Z krátkodobého a střednědobého hlediska jsou výsledky efektivity endovaskulární léčby obecně akceptované (EVAR 1 Trial 2004, Dutch Dream Trial 2004). Zhodnocení dlouhodobé efektivity léčby a zvláště stability endoprotézy však vyžaduje další pečlivé sledování (obr. 15).
3.2.2.4 Endovaskulární léčba výdutí pánevních tepen
Výdutě pánevních tepen spojené s AAA jsou řešeny společně, nejčastěji pomocí bifurkačního stentgraftu. V případě samostatného postižení je možné výduť na společné ilické tepně řešit zavedením tubárního ilakálního stentgraftu. Výduť vnitřní ilické tepny řešíme vyřazením jejího odstupu pomocí stentgraftu zavedeného do společné ilické tepny a doplňujeme event. embolizací volných větví vaku výdutě.
3.2.2.5 Endovaskulární léčba periferních tepenných výdutí
Nejčastější periferní výdutí je výduť podkolenní tepny. Problémem je požadavek na dostatečnou flexibilitu stentgraftu. Endovaskulární řešení je možné pomocí tubárního samoexpandibilního stentgraftu potaženého ePTFE (Hemobahn-Gore) nebo pomocí techniky tzv. stented-graftu, tj. dvěma balon-expandibilními stenty ukotvené ePTFE protézy nebo žilního štěpu nad a pod výdutí; přístupovou cestou je společná femorální arterie. Podobně lze endovaskulárně řešit výdutě na karotidách nebo podklíčkové tepně.
3.2.3 Embolizace
Intervenční embolizace má za cíl uzavřít cévu nebo více cév za účelem léčby patologií cévního řečiště (trauma – krvácení, malformace, nádory) nebo patologií jejich prostřednictvím zásobených orgánů a tkání (krvácení, navození ischemie – nádory). Embolizační materiál (resorbovatelný – Gelaspon, neresorbovatelný – spirály, balóny, tekutiny – alkohol, lepidla) je do cílové oblasti dopraven přímo punkčně nebo pomocí katétru pod angiografickou kontrolou.
3.2.4 Indikace k endovaskulární léčbě
Indikace k endovaskulárním výkonů obecně vychází z jejich předností – miniinvazivity, hemodynamické nenáročnosti a technických možností v periferním řečišti. Indikujeme především polymorbidní nemocné s vysokým operačním rizikem klasického cévního výkonu; izolovaná postižení, kde by klasický cévněchirurgický výkon byl zbytečně invazivní; periferní tepenná postižení nebo onemocnění žilního systému, kde jsou možnosti klasické cévní chirurgie omezeny.
3.2.5 Komplikace endovaskulární léčby
Komplikace endovaskulární léčby jsou obecně stejné jako u klasické cévní chirurgie (uzávěr rekonstrukce, periferní embolizace, krvácení, infekce…) a se stejnými důsledky pro nemocného a končetinu (ztráta končetiny, smrt…). Specifické komplikace pak jsou spojeny s použitou metodou (poškození renálních funkcí kontrastní látkou) a technikou (hematom místa vpichu, perforace tepny při PTA, SIR; uvíznutí dilatačního balonku; ztráta, deformace, zalomení stentu, stentgraftu).Specifickou komplikací při léčbě aneuryzmat hrudní aorty je paraplegie z ischemie míchy a u aortoilických výdutí ischemie střevní.
3.2.6 Závěr
Technické možnosti, miniinvazivita a hemodynamická nenáročnost jsou důvodem, proč endovaskulární metody jsou více než přijatelnou alternativou klasické cévní chirurgie. V řadě indikací jsou dnes metodou volby, a to nejen jako výkon, který je z pohledu technického nebo vzhledem k přijatelnému celkovému operačnímu riziku často jediný proveditelný, tak i jako výkon s lepšími dlouhodobými výsledky. Provádění úspěšné komplexní endovaskulární léčby předpokládá pracoviště s vysoce erudovaným personálem, vybavené veškerou škálou intervenčního instrumentária a s cévně-chirurgickým zázemím.
3.3 Hybridní výkony
Základem pro hybridní výkony v cévní chirurgii je spojení/kombinace metod angiointervenční radiologie (endovaskulární léčby) a klasické (otevřené) cévní chirurgie. Tato kombinace různých metod, postupů a technik umožní řešit cévní postižení, která by jednotlivými metodami samostatně řešit nešla vůbec a pokud ano, tak s vysokým operačním rizikem pro nemocného nebo s vysokým rizikem technického selhání a komplikací samostatného výkonu.
3.3.1 Hybridní výkony u uzávěrového postižení cév
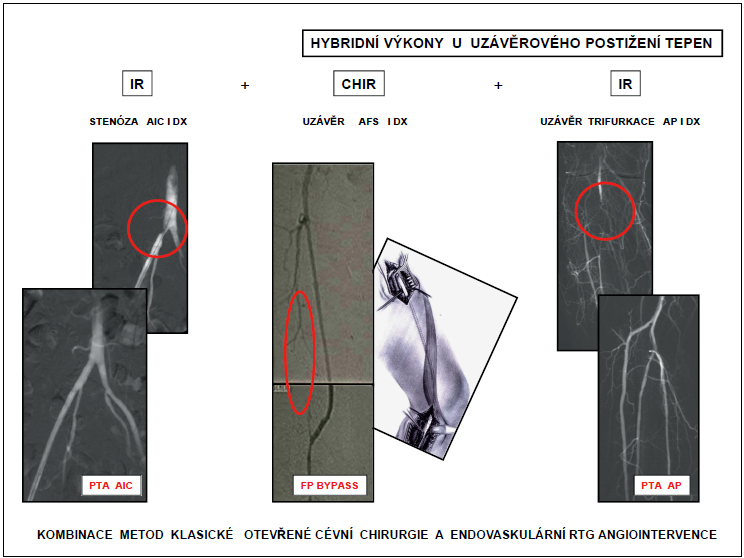
3.3.1.1 Tepenný systém
Kombinované výkony využíváme u víceetážového postižení. V jedné době provádíme radiologickou angiointervenci – peroperační PTA, event. doplněnou stentem a cévně-chirurgickou rekonstrukci – desobliteraci, plastiku, bypass, interpozici. Jedna metoda vytváří podmínky pro použití metody druhé – dostatečný tepenný přítok nebo výtokový trakt, tj. základní předpoklad úspěšné revaskularizace. Klasikou těchto výkonů je PTA v oblasti aortoilické s chirurgickou plastikou vidlice femorální nebo femoropopliteálním bypassem; chirurgická plastika vidlice femorální s PTA oblasti femoropopliteokrurální; femoropoplietální bypass s PTA oblasti popliteokrurální (obr. 16).
3.3.1.2 Revaskularizace s volným přenosem svalového laloku
Kombinovaný výkon spojuje v jedné době akrální revaskularizaci pomocí femorokrurálního bypassu (event. v kombinaci s PTA oblasti aortoilické) a krytí defektu aker volným lalokem s mikroanastomózou jeho cévní stopky. Specializovaný tým v simultánně prováděném výkonu doplňuje mikrochirurg – plastik.
3.3.1.3 Žilní systém
Při řešení hluboké žilní trombózy (subklaviální, ileofemorální, kavální) je v určitých indikacích možnou alternativou lokální trombolýzy nebo perkutánní trombektomie klasická chirurgická trombektomie Fogartyho katétrem, kterou kombinujeme s radiologickou angiointervencí – peroperační PTA, event. s implantací stentu k řešení žilní stenózy.
3.3.1.4 Hemodialyzační přístupy
Při řešení trombózy hemodialyzačního AV shuntu (autologního nebo s využitím cévní protézy) kombinujeme klasickou chirurgickou trombektomie Fogartyho katétrem s ošetřením stenóz radiologickou angiointervencí – peroperační PTA s event. implantací stentu.
3.3.2 Hybridní výkony u aneuryzmatického postižení tepen – aortálních výdutí
V 90. letech 20. století zasáhla významně do léčby aortálních výdutí (AA) endovaskulární léčba (EVL). Hemodynamicky nenáročný výkon (non aorta clamping method) výrazně snížil perioperační rizika elektivního výkonu. U výdutí subrenální aorty se EVL stala během krátké doby alternativou klasické chirurgické léčby a metodou volby pro nemocné s vysokým operačním rizikem (ASA III, IV). Zásadní postavení si získala EVL i v léčbě aneuryzmat hrudní aorty. Ne u všech AA je však standardní EVL možná. Omezení vychází ze současné konstrukce stentgraft systémů, která omezuje její použití jen na AA s vhodnou morfologií výdutě a pánevního řečiště. Některé AA tak není možné EV léčit vůbec, a pokud ano, pak s vysokým rizikem primárního technického neúspěchu nebo sekundárního selhání EVL. Do popředí zájmu se proto dostala možnost léčby AA pomocí hybridního výkonu (HV). Obecným principem HV v léčbě AA (hybrid approach, hybrid procedure, hybrid technique, kombinovaná strategie, combined strategy, combined endovascular and surgical approach) je primární spojení standardní endovaskulární exkluze vaku výdutě (stentgrafting) s pomocným chirurgickým výkonem. Pomocný chirurgický výkon („primary adjunctive – additional – associated surgery“) umožní endovaskulární výkon spolehlivě a bezpečně provést.
3.3.2.1 Pomocné cévní výkony jako standardní součást EVL AA
Obecně je EVL AA v podstatě kombinovaný výkon. Čistě perkutánní provedení není ani dnes běžně možné. Vytvoření a uzavření přístupu k cévě a do cévního řečiště (společná femorální tepna), založení femorofemorálního crossover bypassu u aortouniiliakálního typu exkluze, stejně jako ligatura k uzávěru tepny se však považují za běžně užívaný cévněchirurgický standard.
3.3.2.2 Pomocné cévní výkony jako nadstandardní součást endovaskulární léčby EVL AA
V případě primárního spojení EVL AA a klasických cévněchirurgických postupů/výkonů nad rámec dnešního standardu mluvíme o HV v léčbě AA.
3.3.2.2.1 Indikace HV
Indikace HV je ovlivněna z hlediska klinického a technického a je vysoce individuální. Z klinického pohledu se ke kombinované léčbě doporučují nemocní obecně indikovaní k léčbě AA (základem je dobrá life expectancy a vitalita nemocného), nicméně s vysokým operačním rizikem ke klasické chirurgické léčbě AA (ASA III–IV, ne však s kontraindikací laparotomie). Vzhledem k přece jen větší náročnosti kombinované léčby se k ní vyhrazují AA s naléhavou indikací k výkonu (průměr AA > 5 cm, nárůst > 5mm/6 měsíců, symptomatická intaktní výduť). Po stránce technické jsou ke kombinované léčbě indikovány AA s komplikovanou morfologií výdutě a přístupových cest, které nesplňují současná indikační kritéria pro standardní EVL. Komplikovanou morfologii AA představují problematický aortální krček (široký, krátký, angulovaný, konický, s kalcifikacemi, s trombem), angulace aorty (> 60°), důležité viscerální větve odstupující z vaku výdutě (větve aortálního oblouku, renální tepny, truncus coeliacus, horní mesenterická tepna) a výdutě zasahující oboustranně až do vidlice ilické. Problematické přístupové cesty mají oboustranně významné stenózy, uzávěr nebo vinutost v oblasti iliakofemorální. Stentgraft tak nejde buď vůbec nebo ne spolehlivě zavést, vysunout, rozvinout a ukotvit nebo jeho zavedením dojde k vyřazení/uzávěru důležitých aortálních větví s rizikem orgánové ischemie. Standardní endovaskulární léčba tak není možná vůbec, nebo s vysokým rizikem technických komplikací a primárního nebo sekundárního selhání léčby.
3.3.2.2.2 Cévněchirurgické výkony používané u HV u AA
3.3.2.2.2.1 Alternativní přístup
Je to dočasný přístup do cévního řečiště založenýnad tříselným vazem nejčastěji s využitím dakronové cévní protézy (temporary conduit) našité na společnou iliakální tepnu nebo aortu extraperitoneálním přístupem z pararektálního řezu. Indikací je gracilní, stenotické nebo obliterované iliakální řečiště. V případě stenóz v iliakofemorálním přechodu je možné vytvořit přístup jejich zprůchodněním chirurgicky přímou desobliterací nebo při postižení proximálněji nepřímou desobliterací Fogartyho kličkou.
3.3.2.2.2.2 Primární banding
Je to zevní ligatura naložená kolem tepny v oblastistentovaných anastomóz krčků výdutě (iliakální, aortální). Řeší problematickou fixaci stentgraftu. Zakládá se pomocí dakronového proužku na tepně se zavedeným stentgraftem a naplněným dilatačním balonkem, z extraperitoenálního přístupu (iliakální) nebo z minilaparotomie/laparoskopicky (aortální).
3.3.2.2.2.3 Revaskularizace
Zakládají se k zajištění prokrvení orgánů a tkání zásobených stentgraftem vyřazenými aortálními větvemi vaku nebo krčku výdutě. Využívají techniky extraanatomických bypassů.
Femoro-iliakointeriorní bypass se zakládá jednostranně z tříselného přístupu k revaskularizaci pánevního řečiště.
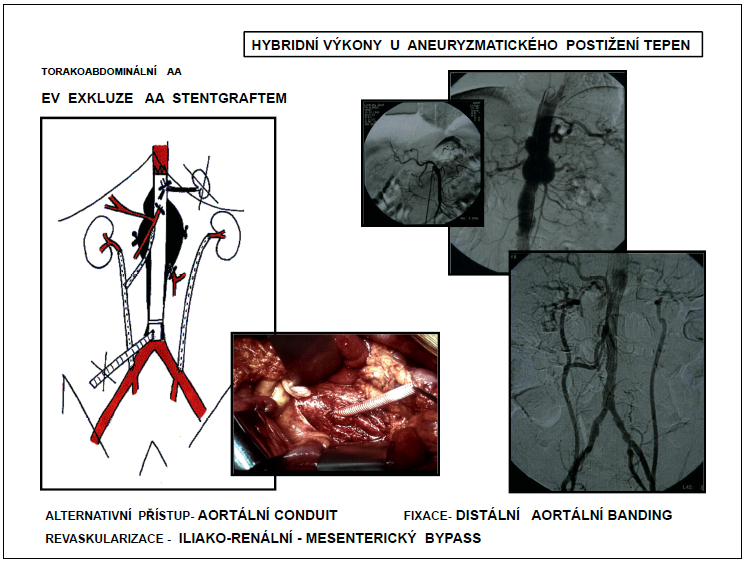
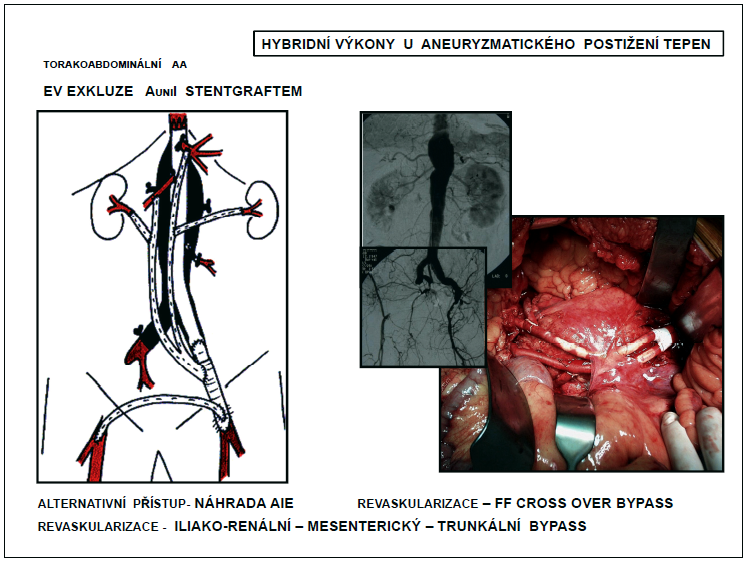
Iliakorenální, iliakomesenterikosuperiorní, iliakotrunkální bypassy se zakládají k revaskularizaci viscerálních větví abdominální aorty. Základem společné revaskularizace všech viscerálních větví je na zevní ilickou tepnu reverzně našitá ePTFE bifurkační protéza, na jejíž raménka se pak našívají další odstupy (obr. 17, 18).
Karotidokarotické, karotidosubklaviální bypassy se zakládají k revaskularizaci větví aortálního oblouku. Přímá revaskularizace všech větví aortálního oblouku již vyžaduje stereotomii. Přítoková anastomóza je založená na ascendentní aortě. Může být využita bifurkační protéza s raménky na truncus brachiocefalicus a levou karotidu, sekvenční bypass nebo dvě samostatné rekonstrukce (obr. 19).
3.3.2.2.3 Provedení výkonu
Výkony se provádějí za podmínek běžných pro klasickou cévní chirurgii na hybridním operačním sále. Přístupové cesty k pomocným chirurgickým výkonům se volí podle typu výkonu se snahou o miniinvazivitu (minilaparotomie, extraperitoneální přístup). Alternativou může být u některých výkonů laparoskopický přístup, který však, ač miniinvazivní, není hemodynamicky zcela nenáročný (tlak kapnoperitonea). Většinu výkonů je možné provést v regionální (spinální, epidurální) anestezii, v případě rozsáhlých cévních rekonstrukcí z laparotomie volíme celkovou anestezii.
3.3.2.2.4 Závěr
HV u AA spojuje výhody hemodynamické nenáročnosti endovaskulární exkluze výdutě a technických možností klasické cévní chirurgie. HV vyžadují rozsáhlejší operační přístupy, a invazivita výkonu tak narůstá, ale hlavní výhoda EVL AA, hemodynamická nenáročnost („non aorta clamping“ vyřazení vaku výdutě), zůstává zachována. Zvýšení invazivity výkonů vede zákonitě ke zvýšení pooperační morbidity, nicméně tato zůstává stále přijatelná. HV umožní EVL AA, které na současném stupni vývoje endovaskulárních technik standardně endovaskulárně léčit nelze (AA s komplikovanou morfologií), a tím bezpečnou a spolehlivou léčbu AA (sníží riziko primárního nebo sekundárního technického selhání) s přijatelným operačním rizikem (hemodynamická nenáročnost) i pro nemocné, jejichž polymorbidita je činí neschopnými podstoupit klasickou chirurgickou úpravu (nemocní kontraindikovaní k aortálnímu klampingu). Pro tyto nemocné je HV metodou volby. U AA s nutností revaskularizace může být HV pro svou hemodynamickou nenáročnost a technickou jednoduchost (jak endovaskulární exkluze vaku, tak založení revaskularizačních bypassů) alternativou klasické chirurgické léčby u všech nemocných, u kterých je jinak spolehlivé zavedení a ukotvení stentgraftu možné. Nenáročnost a jednoduchost HV platí jen z pohledu k nemocnému. HV vyžadují odpovídající personálně-technické zázemí (hybridní sál) a mají být prováděny v komplexních centrech znalých kompletní problematiky endovaskulární a chirurgické léčby AA. Při odpovědné indikaci výkonu v rukou erudovaného cévního chirurga jsou úspěšné. U AA lze předpokládat, že s rozvojem nových technologií dojde k vývoji dokonalejších stentgraft systémů (fenestrované a větvené stentgrafty), a tak některé typy HV budou vytlačeny z použití.
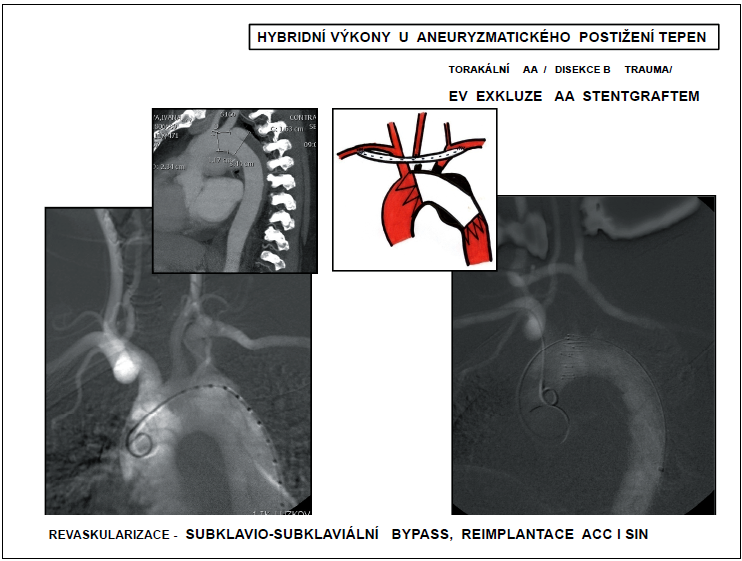
Obr. 19
Hybridní výkony u aneuryzmatického postižení tepen
* ACC l.sin – arteria carotis communis vlevo
3.3.3 Indikace k hybridním výkonům
Pro úspěšné provedení HV je předpokladem správná a uvážlivá indikace a vhodná kombinace jednotlivých metod a technik, která vychází ze skutečně úzké týmové spolupráce základních odborností cévního chirurga, angiointervenčního radiologa a anesteziologa.
3.3.4 Komplikace hybridních výkonů
Komplikace HV vycházejí z jednotlivých použitých metod a jejich rizika se sčítají; nejproblematičtější je již špatná indikace k výkonu vůbec a k typu výkonu.
3.3.5 Závěr
Technické možnosti, miniinvazivita a hemodynamická nenáročnost, které vycházejí z kombinace metod angiointervenční radiologie (endovaskulární léčby) a klasické cévní chirurgie, jsou důvodem, proč HV jsou více než přijatelnou alternativou léčby cévních onemocnění a v řadě indikací jsou dnes metodou volby, a to nejen jako výkon, který je z pohledu technického nebo vzhledem k přijatelnému celkovému operačnímu riziku často jediný proveditelný, tak i jako výkon znamenající pro nemocného maximální možný přínos s co nejmenšími riziky. HV výrazně rozšířily možnosti léčby. Je jen otázkou, zda v určitých oblastech při určitém typu postižení (např. aneuryzmatické postižení aortálního oblouku) je indikace HV, abychom vyřešili „neřešitelné“, vždy na místě.