13 Nádory jícnu
13.1 Benigní nádory
Výskyt a příznaky: nezhoubné nádory jícnu jsou vzácné. Jejich klasifikace a možné druhy jsou uvedeny v tab. 1. Asi 75 % benigních nádorů jsou leiomyomy, ostatní patří k raritám [1].
| Tab. 1 Benigní nádory jícnu a stavy napodobující nádor |
|
|
.
Tyto nádory jsou většinou jen náhodným nálezem a nedělají obtíže. Pouze při větších rozměrech mohou tlakem působit dysfagii. Intraluminální slizniční nádory mohou být příčinou krvácení.
Diagnóza: stanovíme ji na základě rentgenového a endoskopického vyšetření. Indikací k operaci jsou obtíže nemocného nebo nemožnost jednoznačně vyloučit maligní onemocnění. U intramurálních nádorů, jako je leiomyom, se nedoporučuje endoskopický odběr biopsie, protože se tím vytvoří jizevnaté změny mezi sliznicí a nádorem, což pak ztěžuje bezproblémovou enukleaci nádoru při torakoskopickém přístupu.
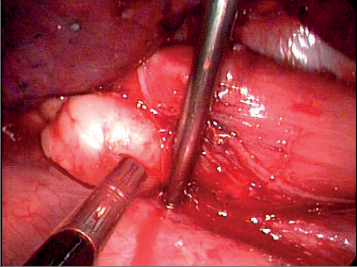
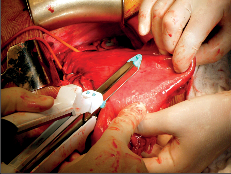
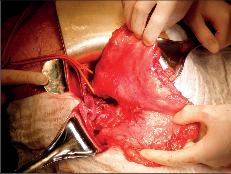
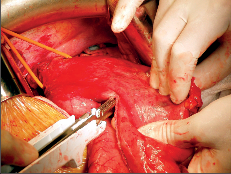
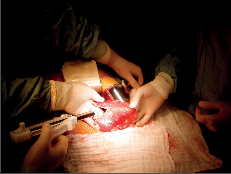
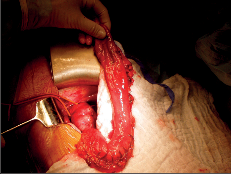
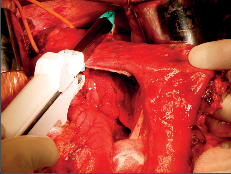
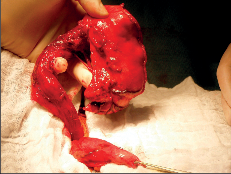
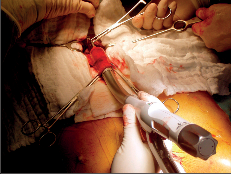
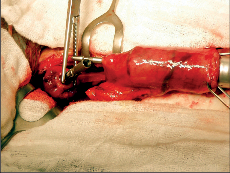
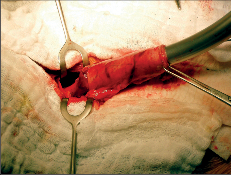
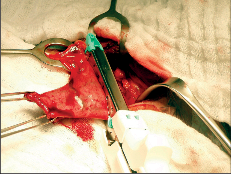
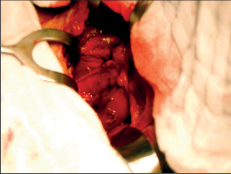
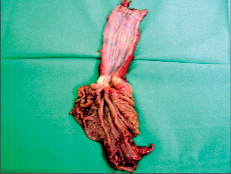
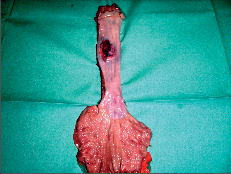
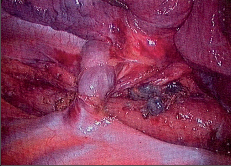
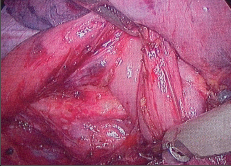
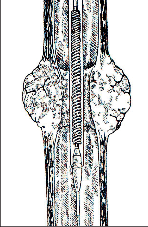
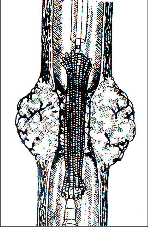
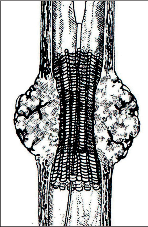
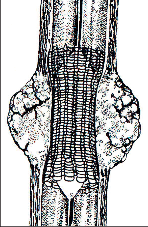
Terapie: intraluminální tumory lze zpravidla odstranit endoskopicky. U intramurálních nádorů je většinou možná enukleace bez narušení sliznice. Méně často je nutná klínovitá resekce stěny jícnu s otevřením sliznice. Tyto výkony se prováděly z torakotomie a v dnešní době převážně torakoskopicky, což je pro nemocného méně zatěžující. Obrázek 1 ukazuje torakoskoskopickou enukleaci leiomyomu jícnu a totéž je znázorněno na videu dostupném v elektronické verzi – viz tiráž knihy.
13.2 Maligní nádory
13.2.1 Klasifikace
Maligní nádory jícnu lze dělit z několika hledisek. Histologicky jsou nejčastější spinocelulární karcinom a adenokarcinom, vyskytující se především v terminálním jícnu a oblasti gastroezofageálního přechodu. Zatímco dříve ve statistikách převažoval spinocelulární karcinom v 80–95 %, v posledních desetiletích se tato situace mění, přibývá adenokarcinomu, a jejich poměr se prakticky vyrovnává. V jícnu se může vzácně vyskytovat řada dalších histologických typů nádorů, vesměs jde však o velmi vzácné nálezy (tab. 2).
| Tab. 2 Některé vzácné maligní nádory jícnu |
|
V časných stadiích roste karcinom jícnu polyploidně, později cirkulárně zužuje jícen a dalším charakteristickým znakem je častá podélná submukózní tumorózní infiltrace jícnu. Časté je i prorůstání do okolí a metastázování do regionálních paraezofageálních a infradiafragmatických uzlin. Vzdálené metastázování je nejčastější do jater, plic, kostí a mozku.
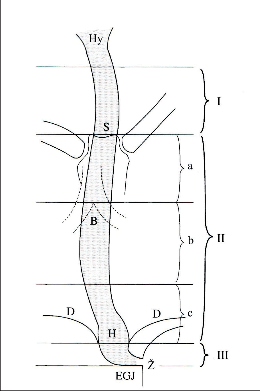
Z hlediska léčebné taktiky je důležitá topograficko-anatomická klasifikace lokalizace nádoru. Umístění nádoru na jícnu se definuje vzdáleností od řezáků k hornímu okraji nádoru při endoskopickém vyšetření. Rozlišujeme jícen krční od hypofaryngu po horní hrudní aperturu, hrudní jícen se dělí na horní třetinu do úrovně v. azygos, střední třetinu do úrovně dolní plicní vény a dolní třetinu do vstupu jícnu do dutiny břišní v úrovni hiátu a zbylou částí ezofagu do ezofagogastrické junkce je abdominální jícen (obr. 2). Různě udávané údaje ve výskytu nádorů v dolní třetině jícnu vyplývají z toho, které nádory gastroezofageálního přechodu zařadíme k nádorům jícnu a kardie.
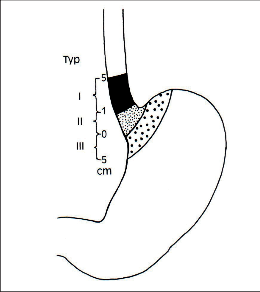
Často je v rámci diagnostické klasifikace obtížné odlišit adenokarcinom distálního jícnu od karcinomu kardie. Za adenokarcinom jícnu se obvykle považuje ten tumor, kdy se více než 80 % nádoru nachází v tubulárním jícnu. Většina adenokarcinomů jícnu se vyvíjí na podkladě Barrettova jícnu. Dalším kritériem přesné klasifikace adenokarcinomu gastroezofageálního přechodu je určení centra tumoru, a tedy předpokládaného počátku zhoubného bujení. V praxi je často přesná klasifikace nádoru gastroezofageálního spojení obtížná [2] (obr. 3).
.
13.2.2 Etiologie a výskyt
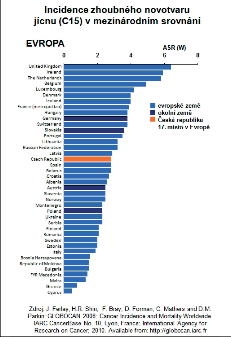
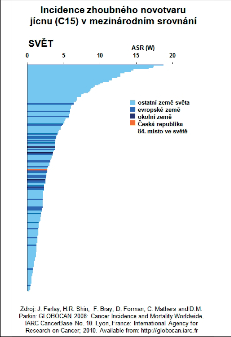
Z hlediska epidemiologie, etiopatogeneze a lokalizace nádorů ezofagu je důležité rozlišovat mezi spinocelulárním karcinomem a adenokarcinomem jícnu. Oficiální statistická data však zpravidla uvádějí celkový výskyt a mortalitu karcinomu jícnu a jen zřídka se přesně rozlišují histologické subtypy. Největší výskyt je uváděn ve Střední Asii a Jižní Americe a u Američanů afrického původu. Mimořádně vysoká incidence je v určitých oblastech Číny, v Japonsku, Indii a Brazílii. Z evropských zemí pak ve Velké Británii, Irsku a Holandsku (obr. 4a,b,c,d).
Výskyt spinocelulárního karcinomu v posledních desetiletích stagnuje, zatímco je zřetelný nárůst výskytu adenokarcinomu, zejména u bělošské populace ve vyspělých západních zemích Evropy a v Americe. Zřetelná je i souvislost s výskytem Barrettova jícnu [3, 4, 5]. V oficiálních světových i našich statistikách o karcinomu jícnu se však většinou spinocelulární karcinom a adenokarcinom nerozlišuje.
Z řady epidemiologických studií bylo prokázáno, že kouření a požívání alkoholu má i v našich podmínkách významný vliv na vznik karcinomu jícnu [6, 7].
Významným rizikovým faktorem pro vznik adenokarcinomu dolního jícnu je gastroezofageální reflux s následným Barrettovým jícnem. Za rizikový faktor adenokarcinomu je považována i obezita [5, 8].
K dalším stavům se zvýšeným rizikem vzniku karcinomu jícnu patří achalázie, striktury po poleptání jícnu, infekce Helicobacter pylori a papilomatózním virem stejně jako příslušnost k nižším socioekonomickým vrstvám [9, 10, 11].
Typickou lokalizací pro spinocelulární karcinom je hrudní jícen, zatímco adenokarcinom se až na výjimky vyskytuje v dolní třetině jícnu, zpravidla v souvislosti s Barrettovým jícnem.
Údaje o léčení nemocných se solidními nádory v České republice jsou shromažďovány v Národním onkologickém registru (NOR). Data jsou uložena v elektronické podobě a pomocí originálního softwaru, nazvaného Systém pro vizualizaci onkologických dat (SVOD), je možné přehledné grafické zpracování různých kombinací uložených parametrů – Národní onkologický registr (NOR) České republiky, Systém pro vizualizaci onkologických dat SVOD (www.cba.muni.cz/svod). Řada důležitých údajů z této rozsáhlé databáze je přehledně zpracována i v nedávno vydané monografii Czech cancer care in numbers 2008–2009 [12]. Následující statistická analýza údajů o zhoubných nádorech jícnu v České republice byla provedena z této databáze NOR [13].
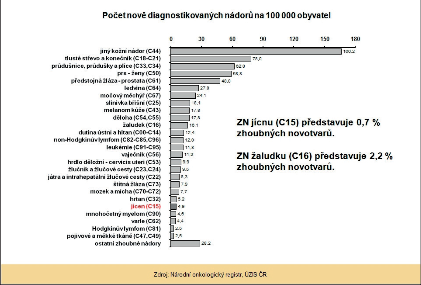
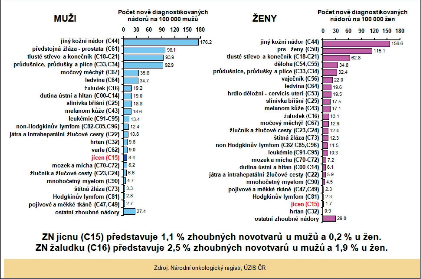
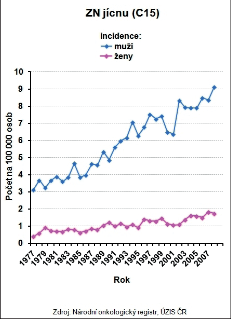
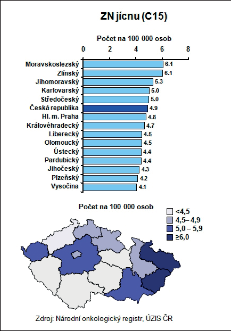
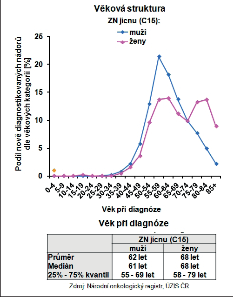
Zhoubné nádor y (ZN) jícnu představují v České republice (ČR) jen něco méně než 1 % ze všech solidních maligních nádorů a s incidencí 4,9 onemocnění na 100 000 obyvatel patříme mezi země se středním výskytem tohoto onemocnění. Zatímco u mužů je incidence 8,4 na 100 000 obyvatel, u žen je podstatně nižší, jen 1,7 (obr. 5, 6).
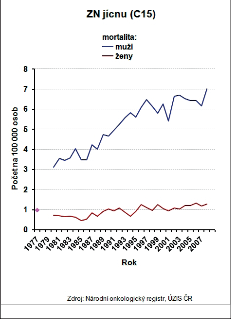
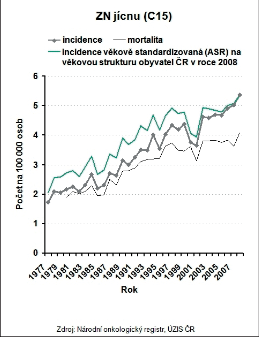
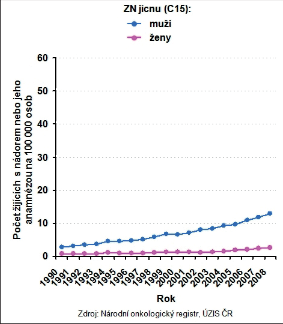
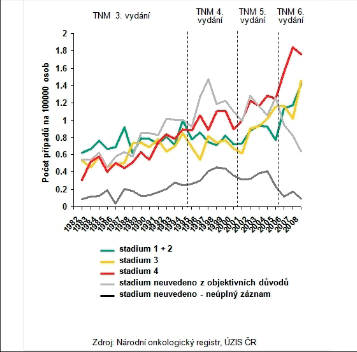
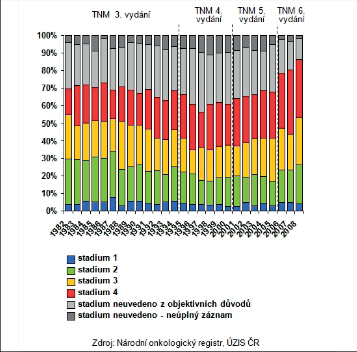
Vývoj incidence a mortalitu zhoubných nádorů jícnu v posledních třiceti letech ukazují obrázky 7 a 8. Rozdílná je i incidence v jednotlivých regionech České republiky. Nakolik se na těchto rozdílech podílejí obecně známé rizikové faktory, jako je konzumace alkoholu, kouření a socioekonomická úroveň regionu, lze jen spekulovat (obr. 9a,b). I když frekvence výskytu karcinomu jícnu je v České republice ve srovnání s ostatními solidními nádory malá, má prevalence ZN jícnu v průběhu let vzestupnou tendenci (obr. 10) a v absolutních číslech se nejedná o nijak zanedbatelný počet nemocných, kteří s touto diagnózou vyžadují naši pozornost. Celkovou epidemiologickou situaci zhoubných nádorů jícnu v roce 2008 shrnuje tab. 3.
| Tab. 3 – Celková epidemiologická situace ZN jícnu (C15) v ČR v roce 2008 ZN jícnu (C15) |
|||
| Muži | Ženy | Celkem | |
| Incidence (rok 2008) | |||
| Absolutní počet | 468 | 93 | 561 |
| Počet na 100 000 osob | 9,1 | 1,7 | 5,4 |
| Mortalita (rok 2008) | |||
| Absolutní počet | 368 | 84 | 452 |
| Počet na 100 000 osob | 7,2 | 1,6 | 4,3 |
| Prevalence (rok 2008) | |||
| Absolutní počet | 657 | 134 | 791 |
| Počet na 100 000 osob | 12,8 | 2,5 | 7,6 |
.
Rozdíly mezi spinocelulárním karcinomem a adenokarcinomem jícnu
V etiologii koreluje výskyt adenokarcinomu s kouřením méně výrazně než u spinocelulárního karcinomu, zato je u něj výrazná souvislost s výskytem refluxních obtíží a Barretovým jícnem. To se odráží i v anamnéze a klinické symptomatologii, kdy u spinocelulárního karcinomu dominuje dysfagie a úbytek hmotnosti, u adenokarcinomu se častěji jedná o mladší jedince s refluxními obtížemi a méně častější je konzumace nikotinu a alkoholu. Pokud se týká metastázování a prognózy, nebyly v retrospektivních studiích shledány žádné signifikantní rozdíly. Je samozřejmé, že se liší frekvence metastázování do uzlin jednotlivých kompartmentů podle jeho lokalizace na oblast krčního, hrudního a abdominálního jícnu. Nádory dolního jícnu metastázují převážně do mediastina a abdominálně, nádory horní části jícnu do mediastina a do krčních uzlin a nádory ve střední třetině do všech těchto oblastí.
13.2.3 Molekulárně biologická charakteristika
Výzkum v oblasti molekulární biologie popisuje četné molekulárně biologické markery v nádorové tkáni tumoru jícnu. Patří mezi ně např. růstové faktory a receptory
- EGFR (epidermal growth factor receptor), VEGF (vascular endothelial growth factor), supresorové geny – P53 gen, onkogeny – cyklin D1, proliferační markery
- PCNA (proliferating cell nuclear antigen), heat – shock proteiny – HSP 70 a 27 a celá řada dalších faktorů. Byl zkoumán zejména jejich význam jako nezávislých prognostických faktorů. Názory na jejich význam se však přes rozsáhlý výzkum zatím různí a celkově neposkytují spolehlivou prognostickou odpověď ve srovnání s klasicky ověřenými prognostickými faktory, jako je radikalita operace (R0), hloubka nádorové infiltrace či postižení lymfatických uzlin.
13.2.4 Klinický obraz, diagnostika a screening
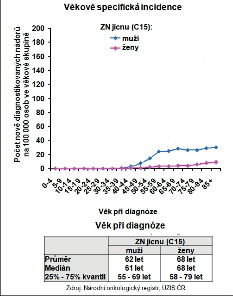
Nejčastějšími klinickými příznaky karcinomu jícnu jsou dysfagie, úbytek tělesné hmotnosti a retrosternální bolest. Dysfagie je bohužel příznakem pozdním, kdy jsou již tumorem infiltrovány nejméně dvě třetiny obvodu jícnu. Časné klinické příznaky, které by byly specifické pro maligní nádor jícnu, bohužel nejsou. Epidemiologické studie o karcinomu jícnu ukazují, že vyšší výskyt je u mužů než u žen. Průměrný věk při stanovení diagnózy je u mužů 62 a u žen 68 let (obr. 11a,b).
Diagnostika
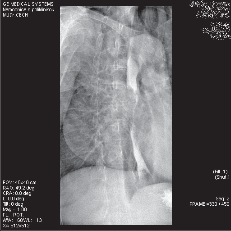
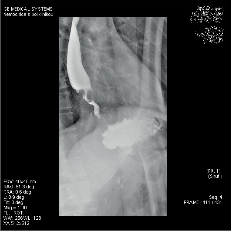
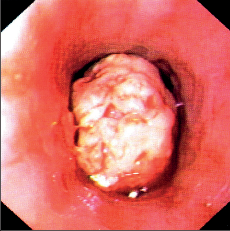
Ke klasické diagnostice nádorů jícnu dlouhodobě vedle anamnézy a klinického vyšetření patřila kontrastní pasáž jícnem a žaludkem (obr. 12a,b; videozáznam rtg pasáže u karcinomu středního jícnu, rtg pasáže u karcinomu dolního jícnu a rtg pasáže žaludečním tubusem po náhradě jícnu jsou dostupné v elektronické verzi – viz tiráž knihy), jejíž význam dnes ustupuje do pozadí. V diagnostice zhoubných nádorů jícnu má dnes rozhodující význam endoskopie s biopsií (obr. 12c). Určí lokalizaci nádoru a histologické vyšetření pak přesný typ nádoru, stupeň malignity (grading) a u časných nádorů i stupeň infiltrace stěny. Ke zpřesnění stadia onemocnění je pak k dispozici celá škála zobrazovacích metod.
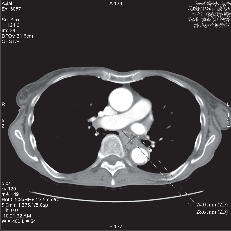
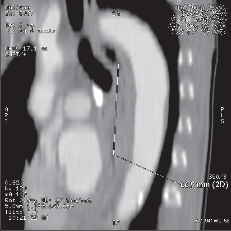
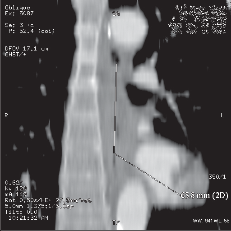
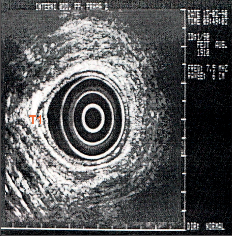
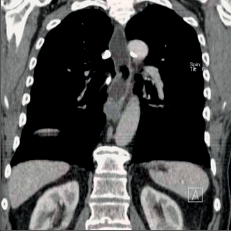
Dalším nezbytným vyšetřením je ze zobrazovacích metod výpočetní tomografie hrudníku a břicha (spirální CT) (obr. 13a,b,c) a endosonografie [14, 15] (obr. 14). V jednotlivých případech jsou tato vyšetření doplněna ORL vyšetřením, bronchoskopií, perkutání sonografií a případně diagnostickou laparoskopií. Cílem diagnostického postupu je stanovit přesné stadium onemocnění, což má význam pro stanovení prognózy a správnou strategii léčby.
Všechna užívaná klasifikační schémata – Union Internationale Contre le Cancer (UICC), American Joint Commitee on Cancer (AJCC) TMN classification a Japanese Classification of Esophageal Cancer – se zakládají na stanovení hloubky nádorové infiltrace ve stěně jícnu, postižení uzlin a přítomnosti vzdálených metastáz. U nás je užívaná TMN klasifikace a zařazení nádorů do jednotlivých klinických stadií I–IV. V současnosti je k dispozici 7. vydání klasifikace nádorů AJCC z roku 2010 [16] (tab. 4 a 5).
| Tab. 4 TNM klasifikace nádorů jícnu |
| T – Primární nádor TX – primární nádor nelze hodnotit T0 – bez známek primárního nádoru Tis – karcinom in situ T1 – nádor postihuje lamina propria mucosae (T1a) nebo submukózu (T1b) T2 – nádor postihuje muscularis propria T3 – nádor postihuje adventicii T4 – nádor postihuje pleuru, perikard a bránici (T4a) nebo aortu, obratle a tracheu (T4b) |
| Regionální lymfatické uzliny NX – regionální lymfatické uzliny nelze hodnotit N0 – v regionálních lymfatických uzlinách nejsou metastázy N1 – metastázy v 1–2 regionálních lymfatických uzlinách N2 – metastázy v 3–6 regionálních uzlinách N3 – metastázy v 7 a více regionálních uzlinách |
| Vzdálené metastázy MX – vzdálené metastázy nelze hodnotit M0 – nejsou vzdálené metastázy M1 – vzdálené metastázy Pro nádory dolního hrudního jícnu platí: M1a – metastáza(y) v celiakálních lymfatických uzlinách M1b – jiné vzdálené metastázy Pro nádory horního hrudního jícnu platí: M1a – metastáza(y) v krčních lymfatických uzlinách M1b – jiné vzdálené metastázy Pro nádory středního horního jícnu platí: M1a – nepoužitelná M1b – metastázy v mízních uzlinách jiných než regionálních nebo jiné vzdálené metastázy |
Regionální lymfatické uzliny
|
.
V diagnostickém algoritmu karcinomu jícnu je dnes tedy základem endoskopie s biopsií. Pro předoperační staging má rozhodující význam CT vyšetření a endosonografie. Umožňují posoudit velikost a lokalizaci tumoru, jeho šíření do okolí, postižení mediastinálních a břišních uzlin a přítomnost vzdálených metastáz. Lokoregionálnímu stagingu slouží jak CT, tak endoskopická sonografie. Její dostupnost u nás je zpravidla ve srovnání s CT menší, ale kombinace obou vyšetření je žádoucí zejména v případech sporného nálezu lokoregionálního šíření dle CT vyšetření. Konvenční radiologické vyšetření hraje již jen sekundární roli. Perkutánní ultrasonografie má význam jen při posouzení krčních uzlin u karcinomu v této lokalizaci.
| Tab. 5 Klasifikace karcinomu jícnu podle 7. vydání AJCC 2010 |
|||||
| Stadium | T | N | M | Grading | Lokalizace na jícnu |
| 0 | Tis | 0 | 0 | 1 | všechny |
| IA IB |
1 2 |
0 0 |
0 0 |
1 2–3 |
všechny všechny |
| IIA IIB |
3 1–2 |
0 1 |
0 0 |
1 všechny | horní, střední všechny |
| IIIA . . IIIB IIIC |
4a* 3 1,2 3 4a* 4b* všechna |
0 1 2 2 1–2 všechna N3 |
0 0 0 0 0 0 0 |
všechny všechny všechny všechny všechny všechny všechny |
všechny všechny všechny všechny všechny všechny všechny |
| IV | všechna | všechna | 1 | všechny | všechny |
.
Tis – high grade dysplasia
* Vysvětlení str. 283 (stadium T4)
Pro staging karcinomu jícnu je dnes na některých pracovištích používána i magnetická rezonance (MRI). V současnosti však nepřináší využití této metody přínos proti konvenčnímu zobrazení CT a není standardně zařazována do diagnostického schématu [17, 18].
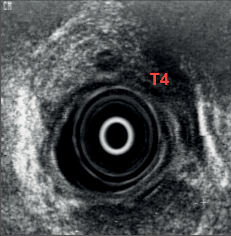
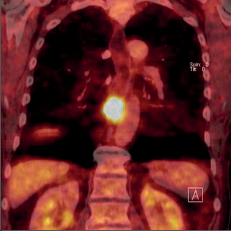
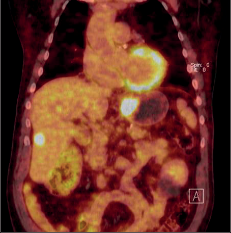
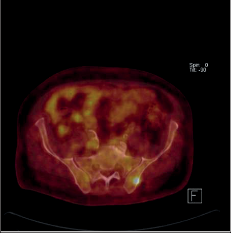
Naproti tomu roste význam využití pozitronové emisní tomografie (PET), zpravidla v kombinaci s CT (PET/CT) v předoperační diagnostice karcinomu jícnu (obr. 15). V předoperačním stagingu je předností této metody detekce generalizace, posouzení efektu neadjuvantní léčby a nezastupitelný význam má PET/CT při diagnostice recidivy a generalizace karcinomu jícnu v pooperačním sledování. Byla provedena celá řada srovnávacích studií s dalšími zobrazovacími metodami, zejména CT a endoskopickou sonografií, aniž bylo dosaženo jednoznačné shody o výhodnosti a spolehlivosti té či oné metody. Většinou je doporučována kombinace více zobrazovacích vyšetření k dosažení co nejpřesnějšího diagnostického závěru [19, 20]. Převážná část ZN jícnu je u nás odhalena až v pokročilém stadiu, když se onemocnění projeví poruchou polykání a často jde již o generalizaci (obr. 15c,d, obr. 16a,b).
Historický pohled
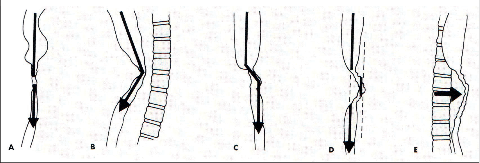
Obr. 17
Osová úchylka jícnu při klasické rtg pasáži ezofagem:
A – dosud nepokročilý nádor,
B, C, D – různé typy osové úchylky svědčící pro pokročilost nádoru,
E – oddálení lumina jícnu od páteře svědčí rovněž pro pokročilý nádor
Až do 60. let minulého století bylo konvenční rentgenové vyšetření pasáže jícnem jedinou možností, jak stanovit rozsah a délku zúžení a pokročilost nádoru (obr. 17).
Vztahy nádoru k okolí, útlak či prorůstání a postižení regionálních uzlin bylo možno posuzovat jen nepřímo, vodítkem bylo zobrazení osy jícnu při kontrastní pasáži ezofagem. V 60. letech minulého století byla rozpracována v té době moderní metoda pneumomediastina, která umožňovala daleko přesnější stanovení stadia onemocnění, než tomu bylo u pouhé kontrastní pasáže jícnem. Publikace olomouckých pracovníků na toto téma (Holub, Šimeček 1968) vyvolala značný mezinárodní ohlas. Vpichem v jugulu směrem pod sternum byl do mediastina aplikován plyn a na zhotoveném rentgenového snímku bylo možno posuzovat zevní obrysy jícnu a pak velikost nádoru jícnu a jeho vztah k okolí [21]. Toto vyšetření bylo později zcela nahrazeno daleko dokonalejší výpočetní tomografií (CT). Po zavedení CT vyšetření patřili olomoučtí chirurgové opět k průkopníkům využití této metody u karcinomu jícnu a první zkušenosti publikovali v roce 1989 [22], stejně tomu bylo u endoskopické sonografie [23]. V posledních letech pak ke zdokonalení diagnostiky přispívá zavedení PET/CT vyšetření, jehož význam u karcinomu jícnu vyhodnocuje současná generace olomouckých jícnových chirurgů, navazuje tak na tradice a reflektuje možnosti nových zobrazovacích metod [24].
Lze shrnout, že v současnosti je k dispozici velký počet zobrazovacích metod k posouzení stadia karcinomu jícnu. Obecně je doporučován multimodální přístup s využitím CT, endoskopické ultrasonografie a PET/CT vyšetření, což vede k maximálnímu zpřesnění stagingu. Naproti tomu konvenční radiologie, perkutánní ultrasonografie (s výjimkou karcinomu krčního jícnu) a MRI nejsou v současnosti rutinně zařazovány do diagnostického schématu.
Časná diagnostika a screening
Časná diagnostika je možná jen endoskopicky. Příznivých léčebných výsledků lze dosáhnout jen u nižších stadií onemocnění, a na místě je proto snaha o aktivní vyhledávání těchto nemocných v rizikových skupinách v rámci preventivních programů. Teoreticky by to znamenalo pravidelné preventivní vyšetřování rizikových skupin (např. mužů, kuřáků, alkoholiků nad 50 let), což se v praxi zatím nepodařilo uskutečnit.
Pouze v centrálních oblastech Číny s vysokou incidencí spinocelulárního karcinomu jícnu byl tamní vládou organizován screeningový program užívající cytologický odběr z jícnu balonkovým katétrem. Program byl úspěšný v odhalení časných asymptomatických stadií tumoru. Nebyl však prokázán vliv screeningového programu na snížení mortality [25].
V USA ani v západní Evropě není zatím screening pro spinocelulární karcinom jícnu doporučován. Naproti tomu u Barrettova jícnu, kde je prokázané zvýšené riziko vzniku karcinomu, je namístě pravidelné endoskopické sledování s odběrem biopsií. Počáteční stadium karcinomu jícnu nemá žádné specifické příznaky a diagnóza časného tumoru může být stanovena pouze v rámci pravidelného programu endoskopického sledování nebo jako náhodný nález. Program endoskopického sledování je u této rizikové skupiny nutný [26]. Pravidelné sledování těchto nemocných vedlo k podstatnému zvýšení podílu operovaných pro časný adenokarcinom v sestavě chirurgické kliniky v Mnichově v průběhu let 1982 až 2003 z 13,2 % na 49,2 % ze všech operovaných pro karcinom jícnu [27]. Zvýšené riziko výskytu karcinomu jícnu a vhodnost endoskopického sledování se uvádí i u nemocných po delší době (10–20 let) od poleptání jícnu a s pokročilou ezofagokardiální achalázií.
13.2.5 Stanovení léčebného plánu a prognóza
Na základě předoperačního vyšetření lze asi s 80–90% spolehlivostí stanovit rozsah nádoru a stadium onemocnění, optimální léčebný postup a prognózu onemocnění. Přihlédnout je nutno i k celkovému stavu nemocného, věku a dalším doprovodným onemocněním. Potom je nutné stanovit léčebný plán. Rozhodujeme se mezi radikální operací, paliativními výkony a radioa chemoterapií. Chirurgickou léčbu je nutno začlenit do multimodálního léčebného postupu. Z tabulky 6 je patrné, že multimodální léčba byla v ČR u karcinomu jícnu v uplynulých letech provedena u necelých 20 % léčených pacientů [28].
Nádory umístěné orálně od bifurkace trachey mají obecně horší prognózu vzhledem k jejich častému prorůstání do okolních struktur. Poměrně nejlepší prognózu má diferencovaný spinocelulární karcinom. Nejdůležitějším prognostickým faktorem je pokročilost onemocnění. Z nemocných, u kterých byl zjištěn nádor jícnu, lze operovat jen menší část. Jak vyplývá z údajů v tab. 7, z celkového počtu diagnostikovaných nádorů jícnu byla možná operace jen asi ve 40 % a radikálně bylo operováno jen necelých 20 %.
| Tab. 6 Primární operační léčba v kombinaci s dalšími léčebnými modalitami u nově diagnostikovaných zhoubných novotvarů v ČR za rok, průměr z období 2001–2005 [28] |
||||
| Počet pacientů ročně celkem | Všichni operovaní | Pouze operace | Operace v kombinaci s jinou léčbou |
|
| dutina ústní a hltan (C00–C14) | 1 177 | 75,7 % | 24,5 % | 51,2 % |
| jícen (C15) | 454 | 39,9 % | 20,3 % | 19,6 % |
| žaludek (C16) | 1 726 | 59,8 % | 42,9 % | 16,9 % |
| tlusté střevo a konečník (C18– C21) | 8 020 | 82,3 % | 44,2 % | 38,1 % |
| játra a intrahepatální žlučové cesty (C22) | 809 | 13,4 % | 9,3 % | 4,1 % |
| žlučník a žlučové cesty (C23, C24) | 1 009 | 45,1 % | 34,9 % | 10,2 % |
| slinivka břišní (C25) | 1 704 | 31,8 % | 20,1 % | 11,7 % |
| hrtan (C32) | 535 | 79,7 % | 27,0 % | 52,7 % |
| průdušnice, průdušky a plíce (C33, C34) | 6 146 | 15,6 % | 8,6 % | 7,0 % |
| melanom kůže (C43) | 1 653 | 97,6 % | 85,9 % | 11,7 % |
| jiný kožní nádor (C44) | 14 659 | 98,2 % | 96,3 % | 1,9 % |
| pojivové a měkké tkáně (C47, C49) | 261 | 86,6 % | 46,9 % | 39,7 % |
| prs – ženy (C50) | 5 600 | 84,4 % | 10,5 % | 73,9 % |
| hrdlo děložní – cervicis uteri (C53) | 1 038 | 74,6 % | 35,9 % | 38,8 % |
| děloha (C54, C55) | 1 746 | 89,9 % | 39,9 % | 50,0 % |
| vaječník (C56) | 1 235 | 81,7 % | 22,5 % | 59,2 % |
| předstojná žláza – prostata (C61) | 3 955 | 56,9 % | 28,6 % | 28,4 % |
| varle (C62) | 415 | 97,6 % | 18,0 % | 79,6 % |
| ledvina (C64) | 2 613 | 70,8 % | 62,7 % | 8,2 % |
| močový měchýř (C67) | 2 263 | 91,0 % | 75,4 % | 15,6 % |
| mozek a mícha (C70–C72) | 780 | 64,8 % | 24,8 % | 39,9 % |
| štítná žláza (C73) | 646 | 90,8 % | 37,6 % | 53,3 % |
| ostatní zhoubné nádory | 2 729 | 49,1 % | 29,7 % | 19,4 % |
| Celkem | 61 173 | 72,8 % | 48,2 % | 24,5 % |
.
| Tab. 7 Primární operační léčba u nově diagnostikovaných zhoubných novotvarů v ČR za rok, průměr z období 2001–2005 [28] |
||||
| Počet pacientů ročně celkem | Všichni primárně operovaní pacienti ročně | Radikální operace* ročně | Jiné operace ročně | |
| dutina ústní a hltan (C00–C14) | 1 177 | 891 (75,7 %) | 601 (51,1 %) | 290 (24,6 %) |
| jícen (C15) | 454 | 181 (39,9 %) | 89 (19,6 %) | 92 (20,3 %) |
| žaludek (C16) | 1 726 | 1 032 (59,8 %) | 686 (39,7 %) | 346 (20,0 %) |
| tlusté střevo a konečník (C18–C21) | 8 020 | 6 602 (82,3 %) | 5 574 (69,5 %) | 1 028 (12,8 %) |
| játra a intrahepatální žlučové cesty (C22) | 809 | 108 (13,3 %) | 29 (3,6 %) | 79 (9,8 %) |
| žlučník a žlučové cesty (C23, C24) | 1 009 | 455 (45,1 %) | 255 (25,3 %) | 200 (19,8 %) |
| slinivka břišní (C25) | 1 704 | 542 (31,8 %) | 135 (7,9 %) | 407 (23,9 %) |
| hrtan (C32) | 535 | 426 (79,6 %) | 282 (52,7 %) | 144 (26,9 %) |
| průdušnice, průdušky a plíce (C33, C34) | 6 146 | 960 (15,6 %) | 689 (11,2 %) | 271 (4,4 %) |
| melanom kůže (C43) | 1 653 | 1 613 (97,6 %) | 1 567 (94,8 %) | 46 (2,8 %) |
| jiný kožní nádor (C44) | 14 659 | 14 395 (98,2 %) | 14 176 (96,7 %) | 219 (1,5 %) |
| pojivové a měkké tkáně (C47, C49) | 261 | 226 (86,6 %) | 194 (74,3 %) | 32 (12,3 %) |
| prs – ženy (C50) | 5 600 | 4 728 (84,4 %) | 4 203 (75,1 %) | 525 (9,4 %) |
| hrdlo děložní – cervicis uteri (C53) | 1 038 | 775 (74,7 %) | 573 (55,2 %) | 202 (19,5 %) |
| děloha (C54, C55) | 1 746 | 1 570 (89,9 %) | 1 439 (82,4 %) | 131 (7,5 %) |
| vaječník (C56) | 1 235 | 1 009 (81,7 %) | 741 (60,0 %) | 268 (21,7 %) |
| předstojná žláza – prostata (C61) | 3 955 | 2 252 (56,9 %) | 1 098 (27,8 %) | 1 154 (29,2 %) |
| varle (C62) | 415 | 405 (97,6 %) | 393 (94,7 %) | 12 (2,9 %) |
| ledvina (C64) | 2 613 | 1 850 (70,8 %) | 1 770 (67,7 %) | 80 (3,1 %) |
| močový měchýř (C67) | 2 263 | 2 059 (91,0 %) | 1 602 (70,8 %) | 457 (20,2 %) |
| mozek a mícha (C70–C72) | 780 | 505 (64,7 %) | 375 (48,1 %) | 130 (16,7 %) |
| štítná žláza (C73) | 646 | 587 (90,9 %) | 571 (88,4 %) | 16 (2,5 %) |
| ostatní zhoubné nádory | 2 729 | 1 339 (49,1 %) | 839 (30,7 %) | 500 (18,3 %) |
| Celkem | 61 173 | 44 510 (72,8 %) | 37 882 (61,9 %) | 6 628 (10,8 %) |
.
13.2.6 Léčba karcinomu jícnu
Léčebná strategie karcinomu jícnu vychází ze snahy o provedení R0 resekce, což je základní předpoklad dosažení dlouhodobějšího či trvalého léčebného efektu. Základními body při posuzování indikace k léčbě je lokalizace primárního tumoru, hloubka invaze nádoru a postižení uzlin. Pro naše rozhodování má také zásadní význam celkový stav nemocného, který může limitovat jak chirurgickou tak multimodální léčbu.
Dalšími léčebnými možnostmi jsou chemoterapie a radioterapie. Spinocelulární karcinom je chemoa radiosensitivnější než adenokarcinom, ale v dlouhodobějším sledování nejsou mezi oběma histologickými typy výraznější rozdíly v léčebných výsledcích. Ke standardně podávaným cytostatikům patří 5-fluorouracil a cisplatina. Ozáření se provádí megavoltážními zdroji frakcionovaně do celkové dávky 50–60 Gy. Před samostatnou chemoa radioterapií se dnes dává přednost kombinaci lokálního a systémového přístupu a chemoterapie se podává současně se zářením. Tento moderní přístup se označuje jako konkomitantní chemoradioterapie. Rozšíření této metody umožnilo zavedení méně toxických cytostatik, které navíc zvyšují sensitivitu na ozáření. Přesto je stále nutno počítat s možností vedlejších toxických účinků, ke kterým patří zvracení, průjmy, vznik enteritidy apod. Neoadjuvantní chemoradioterapie rovněž negativně ovlivňuje operační morbiditu a mortalitu. V léčebné strategii u spinocelulárního karcinomu v horní a střední třetině jícnu je konkomitantní chemoradioterapie považována některými onkology za alternativu ezofagektomie se srovnatelnými výsledky léčby [29].
Neoperativní léčení se volí zejména u spinocelulárního karcinomu krčního jícnu. Nádor v této lokalizaci je poměrně vzácný a vyskytuje se jen asi v 5–15 % všech zhoubných nádorů jícnu. Prognóza je špatná pro obvykle vysokou lokální agresivitu nádoru, pozdní stanovení diagnózy a dosud nejednotný názor na optimální léčbu. Publikované studie zahrnují malý počet různorodých pacientů. Často se pojednává společně o hypofaryngálním karcinomu, jehož prognóza je významně lepší než u karcinomu krčního jícnu [30, 31]. Z chirurgického hlediska u operabilních stavů přichází v úvahu totální nebo krční ezofagektomie, ale i pharyngo-laryngo-ezofagektomie a rekonstrukce žaludečním tubusem či volně přenesenou jejunální kličkou. Tyto technicky náročné výkony vyžadují i speciální kombinovaný přístup sestávající obvykle s vysoké torakotomie ve třetím mezižebří, laparotomie a širokého kolárního řezu na krku. Morbidita po těchto náročných výkonech je uváděna v rozmezí 30–70 % a mortalita do 10 % [32, 33, 34].
Předoperační aktinoterapie (neoadjuvantní) má za cíl především zlepšení operability spinocelulárního karcinomu (obvykle krátkodobé ozáření během 1–2 týdnů do dávky 15 až 30 Gy). Operační výkon pak následuje po 4–6 týdnech. Pooperační aktinoterapie (adjuvantní) má za cíl likvidaci reziduálních nádorových buněk, především u resekcí R1 a u postižení uzlin. U inoperabilních nádorů vede aktinoterapie ke zmenšení tumorózní masy a zlepšení dysfagie. Plná terapeutická dávka (40–60 Gy) se obvykle aplikuje během 4–6 týdnů. Metoda intraluminálního ozáření – afterloading – je vhodná zvláště pro exofyticky, do lumen rostoucí nádory. Výhodou je přímá lokální aplikace vysoké dávky záření bez škodlivého působení na okolní zdravé tkáně (3–6 aplikací 7 Gy ze vzdálenosti 1 cm). Mnohé naděje vkládané do chemoterapie, která se dnes užívá většinou v kombinaci s dalšími léčebnými postupy, nepřinesly zatím prokazatelné výsledky. O neoadjuvantním či adjuvantním léčebném režimu v kombinaci s chirurgickou léčbou je pojednáno dále.
Časný (povrchní) karcinom jícnu (T1)
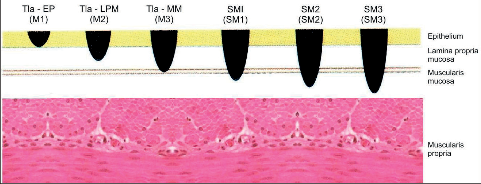
Obr. 18 – Hloubka nádorové invaze a její označení podle japonské klasifikace pro spinocelulární karcinom jícnu. Časný nádor jícnu představují stadia M1–3, kdy infiltrace nezasahuje do submukózy, ale stadium M3 má již riziko lymfatického metastázování
Je definován jako nádor neprorůstající do submukózy. Hloubku invaze časného nádoru podle japonské klasifikace nádorů jícnu [35] ukazuje obr. 18.
Frekvence časného karcinomu je v Japonsku udávána mezi 15 a 30 % [35–37]. V západních zemích je tato incidence mnohem nižší, protože na rozdíl od Japonska zde neexistuje žádný screeningový program pro tumory v horní části zažívacího traktu – foregut carcinoma [36]. Pro léčebnou strategii těchto nádorů je důležitá otázka možného lymfatického metastázování. Zatímco tumory klasifikace T1M1–M2 (viz obr. 18) nedosahují do oblasti lymfatických cév a není u nich riziko metastázování do lymfatických uzlin, tumory stadia T1M3 již mají lymfatickou drenáž a frekvence metastázování do lymfatických uzlin je udávána až v 16 % [38, 39]. Nádory s větší hloubkou prorůstání T1SM2–3 mají riziko lymfatického metastázování přesahující 70 % [36, 38–40]. Z těchto zjištění vyplývá závěr, že endoskopická resekce nádoru (endoskopická mukosektomie) je oprávněná jen u stadia T1M1–M2 japonské klasifikace, kde není riziko lymfatického metastázování. S endoskopickou mukosektomií, tj. odstranění nádoru s okolní zdravou sliznicí a submukózou, byly velmi dobré dlouhodobé výsledky získány zejména v Japonsku. U nás, kde diagnostika těchto raných stadií je zatím bohužel výjimkou, dostatečné zkušenosti chybějí. U vyšších stadií japonské klasifikace (T1M3 a hlubší prorůstání) je pak indikována chirurgická resekce jícnu s lymfadenektomií jako standardní postup. Neoadjuvantní léčba časného karcinomu jícnu je stále předmětem diskuze a v některých centrech je používána, i když její jednoznačný přínos není dosud na základě kritérií evidence based medicine prokázán.
Pokročilý karcinom
Stadium T2–T3
Léčba pokročilého karcinomu jícnu spočívá buď v samostatném chirurgickém léčení, nebo ve spojení s multimodální léčbou. Ta má dvě varianty: neoadjuvantní terapii předcházející chirurgickou resekci či léčbu adjuvantní po provedené operaci. O neadjuvantní a adjuvantní léčbě je blíže pojednáno dále.
Stadium T4
U většiny nemocných v tomto stadiu je indikována definitivní radiochemoterapie pro nemožnost provedení resekce pro lokální inoperabilitu či vzhledem k celkovému stavu nemocného. Indikace k chirurgické terapii v tomto stadiu je závislá na možnosti provedení R0 resekce. Ve stadiu T4a při prorůstání tumoru do pleury, perikardu nebo bránice je možné provést radikální resekci nebo se pokusit o zlepšení operability (downstaging) neoadjuvantní chemoradioterapií. Při invazi nádoru do vitálních struktur (T4b), jako jsou velké cévy, trachea a podobně, je obvykle indikována definitivní chemoradioterapie, po jejímž ukončení a kontrole ústupu nálezu pomocí vyšetření výpočetní tomografií (CT) je někdy možno ještě při dobrém stavu pacienta přistoupit k operaci, označované v odborné literatuře jako salvage surgery [41, 42]. Nakolik je tento postup pro nemocného přínosem, není zatím ověřeno.
Neoadjuvantní chemoradioterapie
Přínos a rizika neadjuvantní chemoradioterapie byly v posledních desetiletích předměty velké řady retrospektivních i randomizovaných klinických studií. Tak například recentní metaanalýza z roku 2009 [43] hodnotí 1308 nemocných z 11 randomizovaných klinických studií z let 1980–2008. Poslední souborná práce italských autorů z roku 2012 [44] analyzuje výsledky dalších několika desítek studií o neoadjuvanci karcinomu jícnu. Z hodnocení tohoto velkého souboru prací vyplývá, že přes veškeré vynaložené úsilí je otázka neoadjuvance a optimální strategie léčby karcinomu jícnu stále kontroverzním problémem bez jednoznačného závěru. Neoadjuvantní chemoradioterapie je akceptována především pod tlakem onkologů ve stále větším měřítku. Její aplikace zlepšuje počet možných R0 resekcí, a je tedy cestou ke zlepšení výsledku léčby. Jak však ukazuje nedávná práce [45], celkové přežívání po této neoadjuvanci po 2 letech bylo pouze 13 %. Tento poměrně malý přínos je nutno pečlivě korelovat s možnými vedlejšími a toxickými účinky této léčby a s její finanční náročností. Takřka každá z těchto studií končí výzvou, že je třeba dalších dobře plánovaných a statisticky vyhodnocených randomizovaných klinických studií, aby mohlo být lépe posouzeno, nakolik je tento postup přínosem. Tato situace je stále znovu se opakujícím problémem v průběhu posledních nejméně čtyř dekád. Není proto divu, že řada chirurgů zabývajících se dlouhodobě touto problematikou neoadjuvantní léčbu u primárně R0 resekovatelného karcinomu jícnu neindikuje a využívá ji pouze u pokročilejších nádorů k zlepšení operability (downstaging).
Adjuvantní terapie
Obdobně jako u neadjuvantní léčby není význam pooperační (adjuvantní) radioterapie a/nebo chemoterapie jednoznačný. Po R0 resekci u spinocelulárního karcinomu pravděpodobně snižuje podle některých studií lokoregionální recidivu, ale nezlepšuje dobu přežití. Po ezofagektomii lze předpokládat přínos chemoradioterapie u R1 resekcí a pozitivitě resekčních okrajů a u adenokarcinomů s pozitivními lymfatickými uzlinami. Je možné se takto snažit ovlivnit lokoregionální progresi [29].
Doporučení České onkologické společnosti
Jediné oficiální doporučení v České republice, které se týká léčby zhoubných nádorů jícnu, vydává každoročně již 15 let Česká onkologická společnost v tzv. Modré knize České onkologické společnosti [46]. Tato publikace obsahuje doporučené farmakoterapeutické postupy v klinické onkologii u solidních zhoubných nádorů. V kapitole Zhoubný novotvar jícnu, na ejimž sestavování se nepodílejí onkochirurgové, je uvedeno:
„Lokoregionální onemocnění (stadia I–III)
Primární léčebné možnosti lokálně pokročilého resekabilního onemocnění (T2 nebo vyšší, jakéhokoliv N) jsou: předoperační chemoradioterapie, definitivní chemoradioterapie (zejména v případě krční lokalizace), předoperační chemoterapie nebo ezofagektomie. Preferovanou léčebnou metodou lokálně pokročilých resekabilních adenokarcinomů distálního jícnu a gastroezofageální junkce je předoperační chemoradioterapie.
Kurativní chemoradioterapie je akceptovatelná léčba spinocelulárních karcinomů; jedinou kurativní léčbou adenokarcinomů je radikální resekce. Režimy založené na 5-FU nebo taxanech jsou vhodné do konkomitance s radioterapií neoadjuvantní, definitivní, a také v případě neresekabilního lokálně pokročilého onemocnění nebo u pacientů nevhodných pro chirurgické řešení z důvodů komorbidit.
Výběr chemoterapeutického režimu závisí na celkovém stavu pacienta (performance status), komorbiditách, toxickém profilu léčby a HER2-neu expresi (pouze u pokročilých a metastatických adenokarcinomů EGJ). Pooperační léčba závisí na histologickém typu nádoru, resekčním okraji, pozitivitě lymfatických uzlin.
T1N0M0
Radikální chirurgický výkon bez pooperační léčby. Chemoradioterapie je preferována v případě krční lokalizace karcinomu jícnu, který je technicky neoperabilní.
T2 a vyšší N jakékoli M0
- Radikální chirurgický výkon. Bez pooperační léčby u dlaždicobuněčného karcinomu. Chemoradioterapie na bázi 5-FU po ezofagektomii v případě R1 nebo R2 resekce (alternativou při makroskopickém reziduálním onemocnění je paliativní chemoterapie). V případě adenokarcinomu distálního jícnu a gastroezofageální junkce se doporučuje adjuvantní chemoradioterapie u high risk T2N0, T3N0 (G3, lymfovaskulární invaze, neurovaskulární invaze, mladý věk), jakékoli N pozitivní adenokarcinomy nebo perioperační chemoterapie ECF (3 cykly před operací, 3 cykly po operaci).
- Definitivní chemoradioterapie je preferována v případě krční lokalizace karcinomu jícnu, který je technicky neoperabilní. Je založena na bázi fluoropyrimidinu a cisplatiny. Výsledky studie f. III PRODIGE 5/ACCORD 17 prokázaly režim s oxaliplatinou jako stejně afektivní.
- Ve vybraných případech operaci předchází neoadjuvantní chemoradioterapie založená na cisplatině a 5FU.
Stadium IV
Indikována je paliativní chemoterapie založená na cisplatině a fluropyrimidinu. Léčba dalších linií, individualizované paliativní chemoterapie je založená na cisplatině a 5-FU; cytostatika s prokázanou aktivitou, převážně studiemi f.II: docetaxel, paklitaxel, irinoketan, oxyliplatina.“
Doporučení uváděná v Modré knize jsou neobyčejně důležitá a užitečná pro orientaci v této složité problematice. Je třeba si však uvědomit, že uváděná doporučení pro léčbu lokálně pokročilého resekabilního karcinomu jícnu (stadium T2 a vyšší a jakékoliv N) jsou pouze léčebné možnosti. Přínos doporučované neoadjuvantní léčby pro nemocného není podle publikací s vyšším stupněm síly doporučení dle EBM, uvedené v předchozích subkapitolách, vždy jednoznačný. Je proto nutné u každého pacienta stanovovat léčebný plan v interdisciplinárním týmu, individuálně s přihlédnutím k reálně předpokládanému profitu různých léčebných modalit pro jeho další osud.
Taktika a technika chirurgické léčby
Radikální chirurgická terapie
U raných stadií karcinomu jícnu (TisT1) může být dostatečným výkonem pouhá resekce sliznice – endoskopická ukosektomie, jak je o tom pojednáno v části o časném karcinomu jícnu.
V oblasti gastroezofageálního přechodu se klasické resekční postupy liší podle lokalizace nádoru. U adenokarcinomu gastroezofageálního přechodu typu II a III (viz obr. 2), které se klasifikačně zařazují ke karcinomu žaludku a kardie, je radikálním řešením totální gastrektomie s resekcí terminálního jícnu a rekonstrukce pasáže některou z variant Rouxovy kličky. Operačním přístupem je laparotomie (horní střední laparotomie či příčná v nadbřišku), kdysi často užívaná levostranná torakofrenolaparotomie se dnes již pro svou přílišnou extenzitu jeví jako zbytečně zatěžující. Z obdobného přístupu nebo z levostranné torakotomie a frenotomie lze provést méně radikální resekci kardie (horní polární resekci žaludku) s resekcí terminálního jícnu a založit ezofagogastroanastomózu end-to-side. U adenokarcinomu z Barrettova jícnu (adenokarcinom gastroezofageálního přechodu typ I) je pro nebezpečí submukózního šíření nádoru orálním směrem, stejně jako u ostatních nádorů na nitrohrudním jícnu, indikována subtotální ezofagektomie.
Termínem ezofagektomie rozumíme zpravidla vlastně subtotální resekci jícnu (subtotální ezofagektomie), kdy ponecháváme různě dlouhou část krčního jícnu, případně přechod krčního jícnu v hrudní ve vrcholu pleurální dutiny. Totální ezofagektomie je nutná jen v případě karcinomu krčního jícnu. Zde může být alternativou segmentální resekce krčního jícnu s rekonstrukcí pasáže vložením volně transplantované jejunální kličky.
Z hlediska chirurgické taktiky a techniky je možné ezofagektomii provádět různým způsobem, s užitím různých alternativních postupů:
Volba přístupu
Na prvním místě je zvolení přístupu k jícnu. Transtorakální přístup z pravostranné torakotomie umožňuje dokonalou ymfadenektomii, je však spojován s větším počtem plicních komplikací. Při transhiatální (transmediastinální) ezofagektomii
bez torakotomie navržené Orringerem [47, 48] je jícen uvolněn „naslepo“ bez kontroly zrakem, rukou přes rozšířený hiatus z břicha. Podle mezinárodního přehledu zpracovaného v roce 2009 dává 52 % chirurgů přednost hrudnímu přístupu a 26 %
transhiatálnímu [49]. O specifickém přístupu k tumorům krčního jícnu je pojednáno již na počátku této kapitoly. Další možnosti, jak zmenšit operační zátěž, přináší miniinvazivní chirurgie, jak je o tom pojednáno dále.
Jícnová anastomóza
Další diskutovanou otázkou je, zda je výhodnější anastomóza na krku či v hrudníku. Obecně tradovanou předností krční anastomózy je, že v případě dehiscence se obvykle zhojí bez větších problémů pouhou drenáží, zatímco dehiscence nitrohrudní anastomózy je i dnes život ohrožující komplikací. Metaanalýza publikovaná v roce 2011, hodnotící dosavadní publikace, včetně čtyř randomizovaných studií, uvádí, že krční anastomóza je spojena s častějším výskytem dehiscence a častější parézou vratného nervu, zatímco u obou typů anastomózy není rozdíl v mortalitě, plicních komplikacích a vzniku fibrózní striktury v místě spojky. Závěrem této studie je, že v současnosti žádná z obou spojek není signifikantně výhodnější proti druhé [50]. Vedle umístění spojky je důležitý způsob založení a šití anastomózy. Podle mezinárodního přehledu z roku 2009 ve specializovaných centrech zakládá krční anastomózu end-to-side 50 % a hrudní anastomózu 64 % chirurgů. Krční anastomózu šijí chirurgové častěji ručně a hrudní častěji pomocí stapleru [49]. Šití anastomóz srovnávala celá řada studií. Metaanalýza randomizovaných studií z roku 2001 shledala obdobné výsledky u ručně i mechanicky šitých anastomóz, pokud se týká výskytu dehiscence či striktur [51].
Náhrada jícnu
Možností, jak nahradit resekovaný jícen, je několik. Nejčastěji se více než v 90 % užívá tubulizovaný žaludek [49]. Resekuje se část žaludku podél malého zakřivení a subkardiálně a žaludeční tubus vytvořený podél velkého zakřivení má zachované cévní zásobení z gastroepiploických cév. Nepanuje shoda, zda provádět jako doplněk gastroplastiky rutinně pyloroplastiku – činí tak 40 % chirurgů, 38 % tímto výkonem tubulizaci žaludku nedoplňuje nikdy [49]. Autoři metaanalýzy z roku 2002 docházejí
na základě publikovaných zkušeností s drenážními operacemi žaludku při ezofagektomii k závěru, že pyloroplastika redukuje časnou poruchu průchodnosti pyloru, ale má malý vliv na jeho pozdější funkci [52]. Pokud není možno k náhradě jícnu využít
žaludek, užívá se většinou k jeho substituci tlusté střevo (koloplastika). Nejčastěji je to v případě, kdy byl žaludek dříve resekován pro vřed nebo nádor. Ke koloplastice se užívá zejména levá část kolon a transversum se zachováním cévního zásobení z a. colica sinistra. Jen výjimečně přichází v úvahu k náhradě jícnu tenká klička.
Jejunem v úpravě „Y“ Rouxovy kličky je možno bez problému nahradit dolní třetinu jícnu, transpozice až na krk se nemusí vždy zdařit. Jejunum je možné také užít jako volný jejunální transplantát s cévním napojením mikrovaskulární technikou při resekci krčního jícnu. Uložení jícnové náhrady je nejvýhodnější v zadním mediastinu v původním lůžku ezofagu. Pokud to není možné, např. pro jizevnaté změny v této oblasti, nejčastěji provádí-li se náhrada až v druhé době v odstupu od ezofagektomie, pak se volí tupě uvolněný retrosternální prostor.
Lymfadenektomie
Důležitou součástí chirurgické léčby je lymfadenektomie. Je prokázáno, že metastatické postižení uzlin (N+) významně zhoršuje prognózu onemocnění. Počet postižených uzlin nebo poměr postižených uzlin ku počtu všech odstraněných uzlin koreluje se zhoršující se délkou přežívání. Podle nejnovějšího 7. vydání TMN klasifikace je u jícnu stanovena tato N klasifikace N0, N1 (1–2 postižené uzliny), N2 (3–6), N3 (více jak 7). Ke správnému stanovení kategorie N a z toho vyplývajícího stanovení prognózy se považuje za nutné vyšetření nejméně 16 uzlin [53]. Výskyt metastatického postižení uzlin koreluje s hloubkou prorůstání tumoru (T klasifikací).
Vyskytují se také tzv. skip metastázy, jak se označuje postižení vzdálenějších uzlin bez postižení bezprostředně regionálních uzlin. Souvisí to s lymfatickým řečištěm v submukóze jícnu. Podle konsenzuální konference ISDE (International Society for Diseases of the Esophagus) z roku 1995 byl definován rozsah a typy lymfadenektomie [54]. Lymfadenektomii lze provádět ve třech oblastech (polích, kompartmentech):
- I. krční
- II. hrudní
- standardní v dolním a středním mediastinu
- rozšířená, navíc horní mediastinum na pravé straně
- totální, navíc horní mediastinum na obou stranách
- III. břišní
Provádí se buď dvou(II. + III.), nebo tříkompartmentová lymfadektenomie. Od dvoukompartmentové lymfadenektomie je třeba odlišit tzv. „en-block ezofagektomii“.
Tento způsob navržený Loganem byl znovu zaveden a zpopularizován Skinnerem [55] (viz kapitola 4 – obr. 5b). Cílem tohoto postupu je minimalizovat vznik lokální recidivy. Jícen se přitom odstraňuje en block spolu s okolními tkáněmi. Spolu s jícnem resekujeme laterálně pleuru, ventrálně perikard, tkáň mezi jícnem, aortou a páteří a v nejradikálnější variantě včetně duktus toracikus, v. azygos. Tento výkon je indikován u tumoru v dolní a střední třetině jícnu. V horní třetině nelze resekovat přilehlé životně důležité orgány. Je otázkou, zda je tento výkon v současné době ještě oprávněný, když máme možnost využívat chemoradioterapii, která v kombinaci s ezofagektomií a dvoukompartmentovou lymfadenektomií podstatně snižuje riziko lokální recidivy.
Rozšířenou koncepci tříkompartmentové lymfadenektomie navrhli a propagují japonští chirurgové již od 80. let minulého století. Tento koncept vychází ze skutečnosti, že u krčního jícnu dochází často k metastázování do krčních uzlin [56].
Lymfadenektomie v třetím kompartmentu představuje nejen totální odstranění krčních uzlin, ale i řetězců uzlin z krku do mediastina podél vratných nervů. Hlavním rizikem tohoto postupu je vysoký výskyt trvalé parézy vratných nervů dosud bez zcela jasného průkazu přínosu pro přežívání operovaných. Pro tumory v dolní a střední třetině jícnu je doporučována dvoukompartmentová lymfadenektomie, tříkompartmentová lymfadenektomie pak přichází v úvahu u tumoru v horní části hrudního a v krčním jícnu, zejména pak při pozitivním nálezu krčních uzlin při sonografickém vyšetření.
Operační postupy
Užívané operační postupy volí mezi různými přístupovými cestami k jícnu. Součástí je vždy i lymfadenektomie:
Transtorakální ezofagektomie s nitrohrudní ezofagogastrickou anastomózou (Ivor-Lewisova ezofagektomie). Tento postup je poměrně často užíván v západních zemích Evropy a v Americe. V první abdominální fázi je dutina břišní otevřena horní střední laparotomií, je mobilizován abdominální jícen a žaludek a vytvořen z něho tubus podél velkého zakřivení, výkon je obvykle doplněn pyloromyotomií. Součástí abdominální fáze je lymfadenektomie z povodí a. coeliaca a okolí břišního jícnu. Ve druhé fázi je z pravostranné posterolaterální torakotomie izolován jícen i s tumorem a do dutiny hrudní je vtažen žaludeční tubus. Po resekci jícnu spolu se subkardiální částí žaludku je založena staplerová anastomóza v apexu pravé pleurální dutiny mezi jícnem a žaludečním tubusem. Výkon je obvykle doplňován dvoukompartmentovou rozšířenou lymfadenektomií a je možné provést i en bloc resekci.
Třífázová ezofagektomie
V první fázi operace se z pravostranné torakotomie provede ezofagektomie a hrudní lymfadektomie, ve druhé, abdominální fázi se obdobně jako při předchozím typu operace připraví žaludeční transponát a provede břišní lymfadenektomie. Ve třetí, krční fázi se po protažení žaludečního tubusu založí krční anastomóza. Pokud se provádí současně krční lymfadenektomie, užívá se široký kolární řez, pro založení anastomózy je dostatečný řez podél vnitřního okraje kývače vlevo.
Transhiatální ezofagektomie (Orringerova ezofagektomie bez torakotomie)
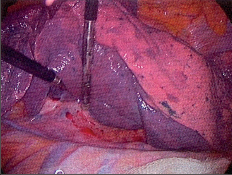
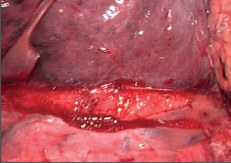
Při tomto postupu [47, 48] je z horní střední laparotomie transhiatálně jícen uvolněn „naslepo“ bez kontroly zrakem, rukou přes rozšířený hiátus z břicha a zbytek jícnu z krční incize zavedenými prsty ruky. Břišní lymfadenektomie se provede standardním způsobem. Přístup je pro pacienta šetrnější a méně narušuje plicní funkce, neumožňuje však dokonalou mediastinální lymfadenektomii. Tyto výhody převažují u tumorů v dolní třetině jícnu [48]. V břiše připravený tubus se pak protáhne do krční incize, kde se založí anastomóza s jícnem. Postup operace je znázorněn na obr. 19–22 a resekát na obr. 23.
Srovnáním dosažených výsledků při užití transtorakální a transhiatální ezofagektomie byla v minulosti věnována velká pozornost [57]. Úzce to souvisí s hodnocením významu lymfadenektomie pro dlouhodobou prognózu a tato otázka není stále jednoznačně zodpovězena. Nepochybně je pouze prokázáno, že zlepšení prognózy souvisí s menším počtem metastaticky postižených uzlin. V poslední randomizované studii z roku 2007 [58] srovnávající tyto dvě metody u adenokarcinomu jícnu nebyly shledány rozdíly v morbiditě, mortalitě a celkovém přežívání. Byl však sledovatelný trend k lepšímu 5letému přežívání u nemocných s transtorakální ezofagektomií. Statisticky signifikantní se jeví zlepšení přežívání u pacientů s menším postižením než v 8 uzlinách, kteří podstoupili transtorakální ezofagektomii. Ke stejným výsledkům dospěla i jiná studie z USA [59]. Tyto výsledky svědčí pro dosažení lepších onkologických výsledků u transtorakální ezofagektomie. Transhiatální ezofagektomie se svou menší zátěží pro pacienta je nadále vhodná pro rizikové nemocné, kterým zaručuje lepší přežívání ve srovnání s paliativní léčbou.
Miniinvazivní ezofagektomie
Koncem 80. let minulého století byla Buessem zavedena periviscerální endoskopická ezofagektomie. Při této metodě se z incize na krku zavádí speciální mediastinoskop, který umožňuje bezpečné miniinvazivní uvolnění jícnu [60]. Zřejmě i z důvodu následného rozvoje torakoskopické a laparoskopické chirurgie nedoznala tato metoda širšího uplatnění. První zprávy o možnosti provedení torakoskopické mobilizace a resekce jícnu [61, 62] a transhiatální laparoskopické mobilizace ezofagu [63] pocházejí již z první poloviny 90. let minulého století. Tyto nové metody, stejně jako v jiných oblastech chirurgie, sledují zmenšení operační zátěže u těchto náročných operací. V uplynulých dvou desetiletích byla mnoha týmy prokázána proveditelnost miniinvazivní ezofagektomie a provedeno srovnání s klasickou otevřenou operací [64–68]. Procento konverzí je závislé na zkušenosti chirurga, miniinvazivní výkon trvá obvykle déle, kratší je ale hospitalizace, procento respiračních komplikací je menší u miniinvazivních operací, v ostatních parametrech, jako je dehiscence anastomózy, onkologické aspekty výkonu či pooperační mortalita, nebyly zaznamenány výraznější rozdíly. Publikované metaanalýzy srovnávající obě metody [69–71] poukazují na mnoho kontroverzních problémů v hodnocení. Mezi nejdůležitější patří skutečnost, že zatím není, s výjimkou jedné probíhající [72], žádná randomizovaná klinická studie srovnávající miniinvazivní a otevřenou ezofagektomii. Pacienti indikovaní k miniinvazivní léčbě mají zpravidla méně pokročilé stadium onemocnění a nižší výskyt průvodních onemocnění.
Ezofagektomie má fázi preparační, při které uvolňujeme jícen s nádorem, a rekonstrukční, kdy vytváříme žaludeční tubus, který pak transportujeme do hrudníku či na krk a provádíme gastroezofageální anastomózu. Jsou propracovány a popsány různé varianty miniinvazivních postupů pro obě fáze operace [73, 74]. Výhody miniinvazivního postupu se projeví především ve fázi preparační, kdežto rekonstrukční fázi je výhodné provést asistovaně laparoskopicky nebo výhradně otevřeně. Existují tak v podstatě dva možné postupy:
Torakoskopická mobilizace jícnu
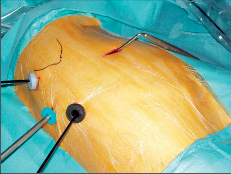
Pacient je intubován speciální intubační kanylou umožňující separátní ventilaci jedné plíce. V první fázi operace je nemocný uložen na levý bok obdobně jako při torakotomii a výhodné je jeho částečné natočení směrem na břicho (semipronační poloha). Podle zvyklosti operatéra se zavádějí obvykle čtyři porty, z toho tři přibližně v zadní axilární čáře a jeden poněkud ventrálněji. Jeden z portů může být nahrazen přes drobnou incizi zavedeným kardiálním ekarterem, kterým asistent odtahuje plíci.
Námi užívaný způsob zavedení portu ukazuje obr. 24. Zkušený miniinvazivní chirurg z tohoto přístupu může dokonale uvolnit celý jícen od bráničního hiátu až vysoko do apexu pleury. V průběhu preparace se protíná vena azygos a je možné provést dokonalou lymfadenektomii. Výkon je ukončen zavedením hrudního drénu incizí po ventrálně uloženém portu a směřuje směrem do pleurální kupoly (obr. 25 a 26, video, torakoskopická mobilizace karcinomu hrudního jícnu, je dostupné v elektronické verzi knihy – viz tiráž knihy).
V druhé fázi operace je pacient uložen v poloze na zádech a je připraveno jak břišní, tak i krční operační pole. Na krku se využívá obvykle přístupu z operačního řezu na vnitřní straně levého kývače při mírném záklonu a vytočení hlavy doprava. Břišní fáze operace sestává z mobilizace žaludku a břišního jícnu a vytvoření žaludečního tubusu, jak to bylo popsáno při otevřené operaci. Operaci je možno provádět buď kompletně, nebo asistovaně laparoskopicky z pětiportového přístupu. Většinou však chirurgové připojují alespoň malou laparotomii, ze které pak vytvářejí vlastní tubus před přední stěnou břišní a tudy také extrahují celý operační preparát. Dle velikosti preparátu a tumoru je možno jej někdy extrahovat i přes krční incizi. Řada chirurgů provádí břišní fázi klasicky otevřeně z laparotomie. Třetí fáze operace se provádí z krčního řezu otevřeně a protažený tubus se anastomozuje se zbytkem krčního jícnu.
Laparoskopická mobilizace jícnu
Při této operaci je pacient po celou dobu operace v jedné poloze vleže na zádech. Nejprve se z pětiportového laparoskopického přístupu provede transhiatální uvolnění jícnu, což však obvykle není možné výše než do úrovně bifurkace trachey, a proto je tento způsob vhodný převážně pro nádory v dolní třetině ezofagu. Následuje vytvoření žaludečního tubusu opět buď čistě laparoskopicky, nebo častěji po vysunutí žaludku z malé laparotomie před přední stěnu břišní. Krční fáze operace se pak již neliší od předcházejícího popisu.
Zhodnocení technicko-taktických prvků v léčebné strategii
Resekce a náhrada jícnu je velmi náročnou operací a je třeba vždy zvážit její únosnost dle celkového stavu pacienta. V chirurgické onkologii platí nepochybně zásada, že rozhodující význam pro další osud nemocného má biologie nádoru. Na druhém místě je důležitý správný staging onemocnění, jak jsme se o něm již zmínili. Teprve na třetím místě má význam volba operační techniky, kde při dokonalém technicko-taktickém zvládnutí různých alternativních metod je dosahováno srovnatelných výsledků [75, 76]. Při užití miniinvazivních technik je možno hlavní přínos spatřovat především ve zmenšení operační zátěže, např. tím, že se vyhneme torakotomii, a máme možnost dokonalé vizuální kontroly při exstirpaci jícnu a lymfadenektomii ve srovnání s exstirpací jícnu naslepo. Aby tyto výhody nebyly eliminovány neúměrnou, organizmus zatěžující délkou operace, je kompromisním řešením provádět miniinvazivně jen exstirpační fázi operace, a tuto taktiku volíme i my.
Časné výsledky chirurgické léčby a komplikace
Přes zlepšující se chirurgickou techniku a perioperační intenzivní péči je ezofagektomie stále spojena s poměrně vysokou morbiditou a mortalitou. Mortalita v uveřejněných studiích kolísá mezi 2,7–9,8 % a celková morbidita mezi 40–60 %.
Nejčastějšími a nejvýznamějšími komplikacemi jsou respirační komplikace v 18–28 % a dehiscence anastomózy v 11–25 % [77–82]. Mezi předa perioperační faktory, které jsou významně spojené s vyšší morbiditou a mortalitou, patří: vyšší věk, diabetes mellitus, dyspnoe, kouření a požívání alkoholu, nutnost pooperačního podávání transfuzí a pooperační vznik pneumonie. Naproti tomu neadjuvantní chemoradioterapie nevedla ke zvýšení morbidity. Jen v jedné studii [77] nebyla s vyšším rizikem komplikací spojována torakotomie a rovněž jedna studie [80]neshledala vliv dehiscence anastomózy na vyšší frekvenci komplikací. Nepříznivý vliv na riziko plicních komplikací má podle japonských studií i tříkompartmentová lymfadektomie, která zvyšuje i riziko poranění vratných nervů, což rovněž významně negativně ovlivňuje plicní funkci. Riziko plicních komplikací je po ezofagektomii vyšší než po jiných velkých chirurgických operacích, včetně plicních resekcí, a je příčinou více než poloviny úmrtí po této operaci. Respirační komplikace se projevují různou škálou patologických stavů, jako je pleuritida, atelektázy, pneumonie, a mohou se vystupňovat až v ARDS (akutní respirační distres syndrom). Významnou roli v prevenci těchto plicních komplikací má preventivní předoperační dechová fyzioterapie. Mezi faktory vedoucí k redukci plicních komplikací se uvádí: speciální protektivní ventilace s využitím PEEP (positive end-expiratory pressure) během separované ventilace jedné plíce [83], časná extubace a mobilizace pacienta, intenzivní respirační fyzioterapie a bronchoskopická toaleta, adekvátní tlumení bolesti (epidurální katétr) a negativní tekutinová bilance. Operační trauma po ezofagektomii vede v organizmu k vyvolání zánětlivé odpovědi, jejímž důsledkem je kumulace tekutin v organizmu [84], obdobnou reakci vyvolává pooperační porucha respirace a následkem je intersticiální plicní edém, který vede ke zvýšenému riziku vzniku plicních a srdečních komplikací. Restrikce přísunu tekutin v průběhu operace a prvních pooperačních dní tak může významně přispět ke snížení rizika pooperačních plicních a kardiálních komplikací [85].
Pacienti po ezofagektomii byli tradičně ponecháváni na řízené plicní ventilaci přes noc do následujícího rána, kdy byli extubováni. Mechanická ventilace, zvláště po separované ventilaci jedné plíce, je spojená s barotraumatem, a může tak paradoxně vést ke zvýšení plicních komplikací. Naopak po časné extubaci na operačním sále je stejná nebo mírně menší pooperační morbidita a mortalita [86–88].
Vznik insuficience jícnové anastomózy má multifaktoriální původ. Mezi obecné příčiny ovlivňující vznik této komplikace patří celkový zdravotní stav, porucha kardiorespiračních funkcí, pokročilost nádoru a malnutrice. Z lokálních příčin je to špatné cévní zásobení jícnu a transponátu, mechanické napětí založené spojky, místní infekce a v neposlední řadě technicky špatně provedená sutura anastomózy. Z uvedených důvodů může kolísat frekvence této komplikace v jednotlivých sestavách ve značném rozmezí. Dehiscence spojky může být asymptomatická, je zjištěna při rentgenovém vyšetření, nebo může mít projevy lokální infekce až těžkého septického stavu. Diagnózu ověříme kontrastní rentgenovou pasáží vodným kontrastním roztokem nebo CT vyšetřením. Na řadě pracovišť se rentgenová kontrastní pasáž provádí rutinně před zatížením pacienta stravou mezi 4.–9. pooperačním dnem. Mnoho pacientů s nevelkou, včas diagnostikovanou dehiscencí lze léčit konzervativně vyřazením perorálního příjmu, parenterální výživou či lépe enterální pomocí sondy, dekompresí transponátu sondou, podáním antibiotik a lokální perkutánní drenáží oblasti kolem anastomózy pod kontrolou sonografu či CT. V posledních letech se v léčbě insuficience anastomózy úspěšně využívají samoexpanzibilní stenty (viz kap. 14.3 Perforace jícnu) [89–91]. Chirurgická intervence je indikována při selhání konzervativní terapie nebo primárně při rozsáhlé dehiscenci, projevech těžké mediastinitity či peritonitidy spolu se sepsí či při nekróze transplantátu. Chirurgická revize umožňuje dokonalejší drenáž, odstranění nekrotického transplantátu; rekonstrukce anastomózy v těchto případech je možná jen výjimečně. Součástí chirurgického výkonu může být i využití samoexpanzibilního stentu či založení krční ezofagostomie.
Fast-track program po ezofagektomii
Cílem tohoto programu je urychlení rekonvalescence po operaci redukcí pooperačního stresu, a tím snížení pooperační morbidity, urychlení návratu do stabilizovaného stavu a zkrácení hospitalizace, a tedy i snížení nákladů. Tento program byl vypracován a je užíván již delší dobu v kolorektální chirurgii a je snaha jej aplikovat i na jiné oblasti chirurgie [92]. Dle dosud publikovaných zkušeností zahrnuje zejména následující opatření: Před operací podrobné poučení a dechová cvičení. Pooperační program rozpracovaný na jednotlivé dny zahrnuje bezprostřední extubaci, včasnou rehabilitaci a mobilizaci, udržování negativní tekutinové bilance, urychlenou realimentaci, brzké odstranění drénů, sond a katétrů a účinnou analgetizaci. Soubor těchto opatření a jejich algoritmus není dosud obecně stanovený. Z dosavadních zkušeností však vyplývá, že aplikace tohoto programu, včetně zkrácení pobytu na JIP a celkové délky hospitalizace, přináší srovnatelné či mírně lepší výsledky v rychlosti zotavení a ve výskytu pooperační morbidity.
Dlouhodobé léčebné výsledky
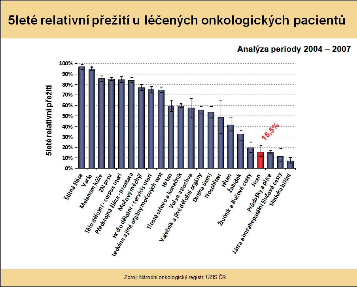
Skutečnosti, že u většiny nemocných je nádor odhalen až v pozdním stadiu onemocnění, odpovídají i špatné léčebné výsledky. Pětileté přežívání u léčených pacientů s karcinomem jícnu v České republice je 15,5 % a horší výsledky jsou jen u zhoubných nádorů plic, jater a slinivky břišní (obr. 27).
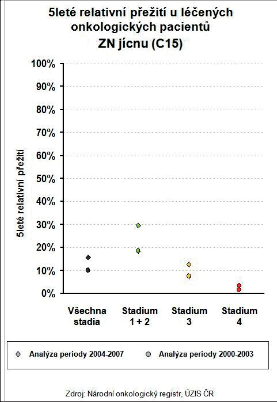
Dlouhodobá prognóza karcinomu jícnu je zásadně odvislá od pokročilosti onemocnění. Vyléčení nebo dlouhodobější přežívání lze přes veškeré pokroky multimodální léčby dosáhnout pouze v počátečních stadiích onemocnění, kde má chirurgická léčba rozhodující význam. Přežívání nemocných s karcinomem jícnu podle údajů z národního onkologického registru České republiky ukazuje obr. 28. Významně delší je pětileté přežívání méně pokročilého nádoru v 1. a 2. stadiu onemocnění, kde v analyzovaném období 2004–2007 bylo 30 % a proti analýze periody let 2000–2003 došlo ke zlepšení o 10 %.
Recidiva nádorového onemocnění může být lokoregionální, méně často v anastomóze, častěji v lůžku jícnu a v lokoregionálních uzlinách. Systémová generalizace nejčasněji postihuje játra, plíce, kostní dřeň a mozek. Podle údajů ve světové literatuře je recidiva onemocnění po samotné chirurgické léčbě a po neadjuvantní chemoterapii obdobná a pohybuje se kolem 50 % [93, 94]. Poslední americká studie publikovaná v roce 2010 uvádí snížení rekurence po neadjuvantní terapii na 31,5 % [95].
Paliativní terapie
Nelze-li nádor pro jeho velikost či celkový stav nemocného radikálně odstranit, je na místě odstranit nebo alespoň zlepšit dysfagii. Založení trvalé gastrostomie je pro nemocného výkonem mutilujícím, značně zhoršujícím kvalitu jeho života. Tato možnost se proto dnes už prakticky nevyužívá. V dřívější době byly u inoperabilních stavů zakládány paliativní by-passy ze žaludku či střeva při ponechání inoperabilního tumoru in situ. Operace byla obdobou rekonstrukční fáze u radikálních operací. Pro nemocného s inoperabilním nádorem, většinou ve špatném celkovém zdravotním stavu, byla tato operace neúměrně náročná a riziková. Řadu let byla užívána intubace stenozujících tumorů, zvláště dolního jícnu, Häringovou endoprotézou. Ta byla zaváděna z laparotomie a gastrotomie a později byla vypracována i metoda endoskopického zavedení. Výkon byl často provázen komplikacemi, nejčastěji supurací rány a dislokací tubusu. Z těchto důvodů byla hledána nová alternativní řešení dysfagie.
Pro nemocné je méně zatěžující dilatace nádorových striktur, která má však jen omezenou možnost a krátkodobý efekt. Pokrokem je laserová rekanalizace jícnu, vyžadující ale obvykle několik sezení.
Zatím nejdokonalejším způsobem paliativního řešení dysfagie je užití pletených kovových stentů. Zavádějí se pod rentgenovou či endoskopickou kontrolou, výkon nevyžaduje anestezii a lze ho často provést i ambulantně. Stent se na vodiči zavede do striktury a po odstranění obalu se postupně rozvine, roztlačí nádorovou strikturu a pevně se do ní zaklíní. Obdukované stenty (kovová síť je potažena neprostupnou blánou) lze užít i k paliativnímu uzávěru ezofagobronchiálních píštělí (obr. 29 a 30; videozáznam zavádění jícnového stentu pod rtg kontrolou u karcinomu středního jícnu je dostupný v elektronické verzi – viz tiráž knihy). Zavedení stentů je možné užít i jako provizorní řešení dysfagie během neoadjuvantní terapie před plánovanou radikální operací. Na počátku 90. let minulého století se naše pracoviště zasloužilo o zavedení a zdokonalení této metody v léčbě karcinomu jícnu [89, 96–98].
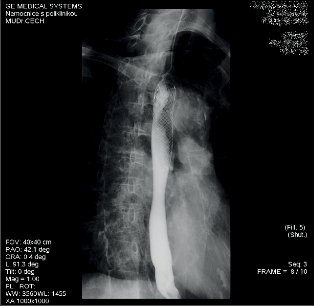
Obr. 30g
Karcinom jícnu, rtg pasáž jícnem bezprostředně po zavedení stentu
Chirurgická léčba karcinomu jícnu a princip high-volume centers
Chirurgická léčba je vysoce specializovanou činností hrudních chirurgů zaměřených na problematiku jícnu a správná je koncentrace nemocných do center ve smyslu principu high-volume centers (HVC – centra s vysokým počtem operací). Celá řada studií potvrzuje, že při vyšším počtu prováděných operací se zmenšuje pooperační mortalita a morbidita a zlepšují se výsledky léčby. Potřebné počty operací jsou v odborné literatuře uváděny ve velkém rozmezí. Americká studie uvádí jako nízkovolumová centra (LVC – low-volume centers) pracoviště s méně než 7 operacemi za rok, kde pooperační mortalita byla více než 15 %, zatím co u HVC byla mortalita 7,5 % [99]. Švédská studie uvádí u LVC méně než 5 operací za rok při mortalitě 10,4 %, u center střední velikosti s 5–15 operacemi za rok byla pooperační mortalita 6,3 % a u HVC s více než 15 operacemi za rok byla mortalita 3,5 % [100]. V holandské studii je v HVC s průměrným počtem 56 resekcí/rok uváděna mortalita 5 % oproti mortalitě 13 % v LVC s méně jak 7 resekcemi/rok [101]. Na základě srovnání výsledků center s různým počtem operací docházejí autoři metaanalýzy z roku 2004 k závěru, že ke zlepšení pooperační mortality je nutné provést nejméně 20 ezofagektomií za rok [102]. Některé z těchto studií uvádějí i příznivý vliv počtu operovaných na dlouhodobé 3a 5leté přežívání [32–35, 103–105]. Jiní autoři však vliv počtu operovaných na dlouhodobé přežívání neprokázali [36–38, 106–108]. Ukazuje se, že počet operací sám o sobě negarantuje vysokou kvalitu chirurgické péče. Úlohu zde hraje nepochybně nejen osobní zkušenost chirurga, ale ve velké míře zkušenost celého týmu (anesteziologů, intenzivistů, sester a dalšího personálu), od kterého závisí provedení operace, pooperační péče a zvládání případných komplikací. Definice vysokovolumových center není nikde ve světě jasně dána, a jak vyplývá z uvedeného, nemůže být jediným kritériem jen počet provedených operací, ale velkou roli hraje zkušenost celého týmu s ošetřováním závažných a rizikových stavů. Hlavním kritériem opravňujícím provádění ezofagektomií by proto měly být dosažené výsledky daného pracoviště ověřované pravidelným vyhodnocováním kvality chirurgické péče v dané oblasti.
13.2.7 Karcinom jícnu v České republice – shrnutí
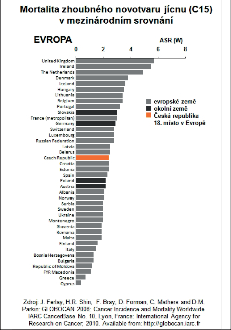
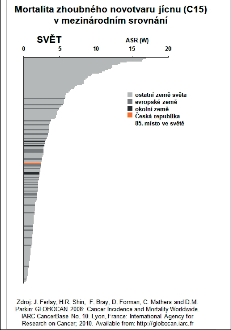
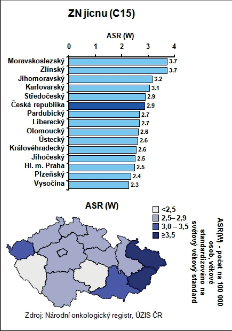
Zhoubné nádory jícnu představují 0,7 % ze všech solidních zhoubných nádorů v ČR (1,1 % u mužů a 0,2 % u žen). V rozmezí let 1977 až 2008 vzrostla incidence ze 2 případů na 5,4 na 100 000 obyvatel a mortalita z 1,9 na 4,1 případů na 100 000 obyvatel. V absolutních číslech byla v roce 2008 incidence 561 osob (5,4 na 100 000 obyvatel). Mortalita pak byla v absolutním počtu 452 zemřelých (4,3 na 100 000 obyvatel) a prevalence (počet žijících s nádorem nebo s jeho anamnézou) 791 osob (7,6 na 100 000 obyvatel). V mezinárodním srovnání je Česká republika v incidenci na 84. místě ve světě a 17. místě v Evropě (mortalita 85. místo ve světě a 18. místo v Evropě). V České republice je nejvyšší incidence v kraji Moravskoslezském a Zlínském (6,1 na 100 000), nejnižší pak v kraji Plzeňském (4,2) a Vysočina (4,1). Průměrný věk při zjištění diagnózy je u mužů 62 let a u žen 68 let, maximum výskytu mezi 55 a 69 lety u mužů a mezi 58 až 79 lety u žen. V době stanovení diagnózy převažují vyšší stadia onemocnění. V roce 2008 bylo ze zjištěných onemocnění 28 % v I. a II. stadiu, 60 % bylo ve III. a IV. stadiu a u 12% nebylo stadium určeno. Pětileté přežívání u léčených pacientů z analýzy období 2004 až 2007 bylo celkově 15,5 %. U I. a II. stadia bylo pětileté přežívání 30 %, u III. stadia 12 % a IV. stadia 2 %. Při srovnání analýzy periody 2004 až 2007 s analýzou období 2000 až 2003 došlo u I. a II. stadia ke zlepšení o 10 % a u III. stadia o 4 % (viz obr. 3 až 10, 16, 19, 20). Podle registru hrudních výkonů Sekce hrudní chirurgie z let 2007 až 2010 se hrudní výkony provádějí v České republice na 19 až 22 pracovištích, resekce jícnu pak na 13 až 14 pracovištích, ale jen u 8 až 9 pracovišť je frekvence těchto výkonů 10 a více operací za rok [109].
V letech 2001–2005 bylo každoročně v České republice diagnostikováno v průměru 457 nemocných se zhoubným novotvarem jícnu. Primární operační léčba u nově diagnostikovaných zhoubných novotvarů jícnu byla provedena jen u 181 nemocných, tedy v necelých 40 % zjištěných nádorů, a za radikální byl výkon považován jen u 89 nemocných, tj. v 19,6 % všech diagnostikovaných případů. Primární operační léčba byla v 51 % jediným léčebným postupem a u 49 % operovaných byla chirurgická terapie kombinována s dalšími léčebnými modalitami (chemo-, radioterapie) [110].
V uplynulých deseti letech bylo v českém písemnictví publikováno jen několik prací z menšího počtu pracovišť, kde se provádí jícnová chirurgie zaměřená na chirurgickou léčbu karcinomu jícnu [67, 68, 111–115]. Z těchto zveřejněných dat nelze podrobněji z celostátního pohledu analyzovat další údaje o léčbě a výsledcích léčení karcinomu jícnu, než jaké byly získány z databáze NOR. Bylo by jistě žádoucí vytvořit v budoucnu celostátní registr těchto operací, z něhož získané a analyzované údaje by mohly pomoci zlepšit výsledky na tomto poli.
13.2.8 Chirurgie karcinomu jícnu v zrcadle olomoucké jícnové chirurgie
Chirurgická léčba karcinomu jícnu má v Olomouci dlouhou tradici. První ezofagektomie pro karcinom byla provedena 2. 8. 1946 [116] (viz kap. 4, obr. 3). Problematika léčby karcinomu jícnu byla na I. a II. chirurgické klinice Fakultní nemocnice a Lékařské fakulty v Olomouci v letech 1970–2006 opakovaně předmětem zájmu [117–120]. Postupně byly hodnoceny soubory nemocných. V roce 1976 to bylo 277 operovaných z let 1945–1975, v roce 1983 pak 61 operovaných z let 1976–1980 a v roce 1993 sestava dalších 54 operovaných z let 1986–1992. Pro toto období je charakteristický vysoký podíl paliativních výkonů (by-passy, chirurgické zavádění jícnových endoprotéz) a vysoká pooperační úmrtnost kolísající mezi 20–30 % po radikálních operacích.
V posledních dvaceti letech se v tomto ohledu situace radikálně změnila díky zlepšené kolem operační intenzivní péči a pokrokům v chirurgické taktice a technice. Běžné se stalo užití moderních staplerů a stále častěji se využívá i možností miniinvazivní chirurgie. Poslední z Olomouce publikovaná práce [68] prezentuje sestavu 178 resekcí jícnu z let 2000–2009. Pooperační mortalita do 30 dnů byla 4,5 % (8 nemocných), nejčastější byly plicní komplikace v 31 %, píštěl v krční anastomóze v 7,3 %, paréza vratného nervu v 9 %. U 54,5 % operovaných byl využit videoasistovaný přístup k mobilizaci jícnu, zpravidla laparoskopický. V 55 % se jednalo o adenokarcinom. Obdobných výsledků bylo dosaženo v posledních pěti letech na chirurgickém oddělení nemocnice a Komplexního onkologického centra (KOC) v Novém Jičíně, kde byly uplatněny zkušenosti olomoucké jícnové školy. Od roku 2007 zde byl zahájen pravidelný program chirurgického léčení nitrohrudních malignit. V KOC Nový Jičín bylo v tomto období vyšetřeno celkem 193 nemocných s karcinomem jícnu, k operaci bylo indikováno 38 % nemocných. Celkem bylo do konce roku 2011 provedeno 53 resekcí a náhrad jícnu (2 pro benigní strikturu). Pooperační mortalita do 30 dnů byla 3,8 % (2 nemocní). Celková morbidita je 23 %, nejčastější byly plicní a kardiální komplikace v 17 % a 6 %, píštěl v krční anastomóze vznikla v 7,5 %, paréza vratného nervu v 9 %. Takřka u všech nemocných byla operace zahájena laparoskopickou revizí k ověření operability a u 50 % operovaných byl využit videoasistovaný přístup k mobilizaci jícnu, 19× torakoskopický, 5× laparoskopický a 1× pomocí operačního robotu, 49 % nemocných mělo adenokarcinom [13]. Olomoucká pracoviště se zasloužila od počátku devadesátých let minulého století o zavedení miniinvazivního řešení polykání pomocí stentů u nemocných s inoperabilními nádory jícnu v České republice, což předtím bylo řešeno výhradně gastrostomií [96–98].
Literatura
- Takubo K. Patology of the Esophagus. An Atlas and Textbook. 2nd ed. Hong Kong: Springer; 2010.
- Siewert JR, Hölscher AH, Becker K, Gössner W. Kardiocarcinom: Versuch einer therapeutisch relevanten Klassifikation. Chirurg. 1987;58:25–32.
- Bollschweiler E, Hölscher AH. Deutliche Zunahme des Adenokarcinom sim Ösophagus. Dtsch Artztebl. 2000; 97:1896–1900.
- Corley DA, Buffler PA. Oesophageal and gastric cardia adenocarcinomas: Analysis of regional variation using the Cancer Incidence in Five Continents database. Int J Epidemiol. 2001; 30:1415–1425.
- Giuli R, Siewert JR, Couturier D, Scarpignato C, editors. Barretts Esophagus. Paris: John Libbey Eurotext; 2003.
- Gammon MD, Schoenberg JB, Ahsan H, et al. Tobacco, alkohol and cioeconomic status and adenocarcinoma of the esofagus and gastric cardia. J Nat Cancer Inst. 997;89:1277–1284.
- Brown LM, Silverman DT, Pottern LM, et al. Adenocarcinoma of the esophagus and esophagogastric junction in white men in the United States: alkohol, tabacco and socioeconomic factors. Cancer Causes Control. 1994;5:333–340.
- Kollárová H, Máchová L, Horáková D, Janoutová G, Čížek L, Janout V. Rizikové faktory u karcinomu jícnu. Čs Gastroent Hepatol. 2008;62(2):79–83.
- Lagergren J, Bergström R, Nyrén O. Assotiation between body mass and adenocarcinoma of the esophagus and gastric cardia. Ann Intern Med. 1999;130(11):883–890.
- Chang F, Syrjanen S, Shen Q, et al. Human papillomavirus involvement in esophageal carcinogenesis in the high-incidence area of China. Study of 700 cases by screening and type-specific in situ hybridization. Scand J Gastroenterol. 2000;35:123–130.
- O’Connor HJ. Helicobacter pylori and gastro-oesophageal reflux disease-clinical implications and management. Aliment Pharmacol Ther. 1999;13:117–127.
- Dušek L., editor. Czech cancer care in numberes. 2008–2009. Praha: Grada Publishing; 2009.
- Duda M, Adamčík L, Dušek L, Škrovina M, Jinek T. Zhoubné nádory jícnu v České republice. Rozhl Chir. 2012;91(3):132–140.
- Plukker JTM, van Westreenen HL. Staging in oesophageal cancer. Best Practice Research Clin Gastroenterol. 2006;20:877–891.
- Young PE, Gentry AB, Acosta RD, et al. Endoscopic ultrasound does not accurately stage early adenocarcinoma or high-grade dysplasia of the esofagus.Clin Gastroenterol Hepatolol. 2010;8:1037–1042.
- Edge SB, Byrth DR, Compton CC, editors. AJCC Cancer Staging Manual. 7th. New York: Springer; 2010.
- 17. Giovagnoni A, Valeri G, Ferra C. MRI of esophageal cancer. Abdom Imaging. 2002;27:361–366.
- Jamil LA, Gill KRS, Wallace MB. Staging end restaging of advanced esophageal cancer. Current Opinion in Gastroenterology. 2008;24:530–534.
- Salahudeen HM, Balam A, Naik K, et al. Impact of the introduction of integrated PET-CT into the preoperative paging pathway of patiens with potentially operable oesophageal carcinoma. Clinical Radiol. 2008;63:765–773.
- Walker AJ, Spier BJ, Perlmann SB, et al. Integrated PET-CT fusion imaging and endoscopic ultrasound in the pre-operative staging and evaluation of esophageal cancer. Mol Imaging Biol. 2011;13:166–171.
- Holub E, Šimeček C. Pneumomediastinography in carcinoma of the oesophagus. Thorax. 1968;23:77–82.
- Duda M, Roček V, Dlouhý M, Janda P, Häringová K. Přínos výpočetní tomografie (CT) v předoperační rozvaze chirurga u karcinomu jícnu. Čs Gastroent Výž. 1989; 43:312–318.
- Dlouhý M, Šimek I, Duda M, Janda P. Endokavitární sonografie jícnu. In: Válek V, editor. Zobrazovací a výpočetní technika v gastroenterologii. Učební texty. Brno: IDVPZ; 1994. p. 49–53.
- Vomáčková K, Neoral Č, Aujeský R, Vrba R, Kysučan J, Mysliveček M, Formánek R. Využití PET-CT v plánování léčby karcinomu jícnu. Miniinvazna chirurgia a endoskopia, chirurgia súčasnosti. 2010;14(4):24 -27.
- Liu SF, Shen Q, Dawsey SM, et al. Esophageal balloon cytology and subsequent risk of esophageal and gastric cardia cancer in a high-risk Chinese population. Int J Cancer. 1994;57:775–780.
- Stein HJ and panel of experts. Esophageal cancer: screening and surveillance. Results of a consensus conference. Dis Esoph. 1996;9(Suppl 1):3–19.
- Siewert JR, Stein HJ, Lordick F. Ösophaguskarcinom. In: Siewert JR, Rothmund M, Schumpelick V, Herausgeber. Praxis der Visceralchirurgie. Onkologische chirurgie. 2. Auflage. Heidelberg: Springer Verlag; 2006.
- Duda M, Žaloudík J, Ryska M, Dušek L. Chirurgická léčba solidních nádorů v České republice. Rozhl Chir. 2010;89(10):588–593.
- Kocáková I, Soumarová R. Chemoradioterapie karcinomu jícnu. In: Šlampa P, Soumarová R, Kocáková I, editors. Konkomitantní chemoradioterapie solidních nádorů. Praha: Galén; 2005.
- Triboulet JP, Mariette C, Chevalier D, Amrouni H. Surgical management of carcinoma of the hypopharynx and cervical esofagus: analysis of 209 cases. Arch Surg. 2001;136:1164–1170.
- Wang HW, Chu PY, Kuo KT, et al. A reappraisal of surgical management for squamous cell carcinoma in the pharyngooesophageal junction. J Surg Oncol. 2006;93:468–476.
- Peracchia A, Bonavina L, Botturi M, et al. Curent status of summary for carcinoma of the hypopharynx and cervical esofagus. Dis Esophagus.2001;14:95–97.
- Ott K, Lordick F, Molls M, et al. Limited resection and free jejunal graft interposition for squamous cell carcinoma of the cervical oesophagus. Br J Surg. 2009;96:258–266.
- Kadota H, Sakuraba M, Kymata Y, et al. Larynx – preserving esophagectomy and jejunal transfer for cervical esophageal carcinoma. Laryngoscope. 2009;119:1274–1280.
- Japanese Esophageal Society. Japanese Classification of Esophageal Cancer. 10th ed. Tokyo: Kanera & Co; 2008.
- Stein HJ, Feith M, Bruecher BL, et al. Early esophageal cancer: pattern of lymphatic spreat et prognostic factors for long-term survival after surgical resection. Ann Surg. 2005;242:566–573.
- Tachybana M, Hirahara N, Kinugasa S, Yoshimura H. Clinicopathologic features of superficial esophageal cancer: results of consecutive 100 patients. Ann Surg Oncol. 2008;15:104–116.
- Tachybana M, Kinugasa S, Shibakita M., et al. Surgigal treatment of superficial esophageal cancer. Langenbecks Arch Surg. 2006;391:304–321.
- Bollschweiler E, Baldus SE, Schroder M, et al. Highrate of lymf-node metastasis in submucosal esophageal squamosus-cell carcinomas and adenocarcinomas. Endoscopy. 2006;38:149–156.
- Ancona E, Rampado S, Cassaro M, et al. Prediction of lymph node status in superficial esophageal carcinoma. Ann Surg Oncol. 2008;15:3278–3288.
- Gardner-Thorpe J, Hardwick RH, Dwerryhouse SJ. Salvage esophagestomy after local failure of definitive chemoradiotherapy. Br J Surg. 2007;94:1059–1066.
- Tachymori Y, Kanamori N, Uemura N, et al. Salvage esophagectomy after high-dose chemoradiotherapy for esophageal squamous cell carcinoma. J Thorac Cardiovasc Surg. 2009;137:49–54.
- Jin HL, Zhu H, Ling TS, et al. Neoadjuvant chemoradiotherapy for resectable esophageal carcinoma: A meta-analysis. World J Gastroenterol. 2009;15:5983–5991.
- Pasini F, Fraccon AP, de Manzoni G. Neodjuvant treatment. In: de Manzoni G, editor. Treatment of Esophageal and Hypopharyngeal Squamous Cell Carcinoma. Milan: Springer-Ferlag Italia;2012. p.131–138.
- Gebski W, Burmeister B, Smithers BM, et al. Survival benefits for neoadjuvant chemoradiotherapy or chemotherapy in esophageal carcinoma: a meta-analysis. Lancet Oncol. 2007;8:226–234.
- Vyzula R, editor. Modrá kniha České onkologické společnosti. 15. vydání, Brno: Masarykův onkologický ústav Brno; 2012.
- Orringer MB, Marschall B, Chang AC, et al.Two thausand transhiatal esophagectomies: changing trend, lessons learned. Ann Surg. 2007; 246:363–372.
- Hulscher JB, van Sandick JW, De Boer AG, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esofagus. New Engl J Med. 2002;347:1662–1669.
- Boone J, Livestro DP, Elias SG, et al. International Survey on esophageal cancer: part I surgical techniques. Dis Esophagus. 2009;22:195–202.
- Biere SSAY, Maas KW, Cuesta MA, van der Pet. Cervical or thoracis anastomosis after esophagectomy for cancer: a systematic review and meta-analysis. Dig Surg. 2011;28:29–35.
- Urschel JD, Blewett CJ, Bennett WF, et al. Handsewn or stapled esophagogastric anastomoses after esophagectomy for cancer: meta-analysis of randomized controlled trials. Dis Esophagus. 2001;14:212–217.
- Urschel JD, Blewett CJ, Young JE, et al. Pyloric drainage (pyloroplasty) or no drainage in gastric reconstruction after esophagectomy: a meta-analysis of randomized controlled trials. Dig Surg. 2002;19:160–164.
- Altorki NK, Zhou XK, Stiles B, et al. Total number of resected lymph nodes predict survival in esophageal cancer. Ann Surg. 2008;248:221–226.
- Fumagalli U, Akiyama H, DeMeester T. Resective Surgery for Cancer of the Thoracic Esophagus: Results of a Consensus Conference held ad the VIth World Congres of the ISDE. Dis Esophagus. 1996;9:30–38.
- Skinner DB. En bloc resection for neoplasms of the esofagus and cardia. J Thorac Cardiovasc Surg. 1983;85:59–71.
- Altorki N, Kent M, Ferrara C, Port J. Three-field lymf node dissection for squamous cell and adenocarcinoma od the esofagus. Ann Surg. 2002;236:177–183.
- Chu KM, Law SYK, Fok M, Wong J. A prospective randomized comparison of transhiatal and transthoracic resection for lower-third esophageal carcinoma. Am J Surg. 1997;174: 320–324.
- Omloo JM, Lagarde SM, Hulscher JB. Extended transthoracic resection compared with limitid transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of randomized clinical trial. Ann Surg. 2007;246:992–1000.
- Johansson J, DeMeester TR, Hagen JA. En bloc vs transhiatal esophagectomy for stage T3N1 adenocarcinoma of the distal esofagus. Arch Surg. 2004;139:627–631.
- Buess G, Kipfmüller K, Nahrun A , Melzer A. Endoskopisch-mikrochirurgische Dissection des Ösophagus. In: Buess G. editor. Endoskopie. Köln: Deutsche Ärzte-Verlag;1990. s. 358–375.
- Cushieri A. Endoscopic subtotal oesophagectomy for cancer using the right thoracoscopic approach. 1993;2(Supl1):3–11.
- Collard JM, Lengele B, Otte JB, et al. En block and standard esophagectomies by thoracoscopy. Ann Thorac Surg. 1993;56:675–679.
- DePaula AL, Hashiba K, Fereira EA, et al. Laparoscopic transhiatal esophagectomy with esophagogastroplasty. Surg Laparosc Endosc. 1995;5:1–5.
- Azagra JS, Goergen M, Lens V, Ibánez-Aguirre JF, Schiltz M, Sciliano I. Present state of the Mini-Invasive Surgery(MIS) in esophageal and gastric cancer. Clin Transl Oncol. 2006;8:173–177.
- Law S. Minimally invasive techniques for esophageal cancer Surgery. Best Practice & Research Clinical Gastroenterology. 2006; 20:925–940.
- Kitagawa Y, Takeuchi H, Saikawa Y, Kitajima M. Surgical treatment of esophageal cancer: benefit and limitation of endoscopic surgery. Am J Surg. 2007;194/Suppl Oct:158–161.
- Dostalík J, Guňková P, Martínek L, Richter V, Guňka I, Mazur M, Mitták M. Optimální miniinvazivní přístup při náhradě jícnu žaludkem. Rozhl Chir. 2009;88(8):422–424.
- Aujeský R, Neoral Č, Král V, Vrba R,Vomáčková K. Videoasistovaná resekce jícnu pro karcinom – desetileté zkušenosti. Rozhl Chir. 2010;89(12):746–749.
- Butler N, Collins S, Memon B, et al. Minimally invasive oesophagectomy: current status and future direction. Surg Endosc. 2011;25:2071–2083.
- Nagpal K, Ahmed K, Vats A, et al. Is minimally invasive surgery beneficial in the management of esophageal cancer? A meta-analysis. Surg Endosc. 2010;24:1621–1629.
- Sgourakis G, Gockel I, Radtke A, et al. Minimally invasive versus open esophagectomy: meta-analysis of outcomes. Dig Dis Sci. 2010;55:3031–3040.
- Biere SS, Maas KW, Bonavina L, et al. Traditional invasive vs. minimally invasive esophagectomy: a multi-center, randomized trial (TIME-trial). BMC Surg. 2011;11:2.
- Puntambekar S, Cuesta MA. Atlas of Minimally Invasive Surgery in Esophageal Carcinoma. Heidelberg, London, New York: Springer; 2010.
- Uiama I, Giacopuzzi S, Isogaki J, de Manzoni G. In: de Manzoni G, editor. Treatment of Esophageal and Hypopharyngeal Squamous Cell Carcinoma. Milan: Springer-Ferlag Italia; 2012. p. 257–270.
- Goldminc M, Maddern G, Le Prise E, Meunier B, Campion JP, Launois B. Oesophagectomy by a transhiatal approach or thoracotomy: a prospective randomized trial. Br J Surg. 1993;80:370.
- Chu KM, Law SYK, Fok M, Wong J. A prospective randomized comparison of transhiatal and transthoracic resection for lower-third esophageal carcinoma. American J Surg. 1997;174:320–324.
- Dhungel B, Diggs BS, Hunter JG, et al. Patients and perioperative predictors of morbidity and mortality after esophagectomy: American College of Surgeons National Surgical Quality Improvement Program (ASC-NSQIP),2005–2008. J Gastrointest Surg. 2010;14:1492–1501.
- Bailey SH, Bull DA, Harpole DH et al. Outcomes after esophagectomy: a ten-year prospective cohort. Ann Thorac Surg. 2003;75:217–222.
- Wright CD, Kucharczuk JC, O’Brien SM, et al. Predictor of major morbidity and mortality after esophagectomy for esophageal cancer: a Society of Thoracic Surgeons General Thoracic Surgery Database risk adjustment model. J Thorac Cardiovasc Surg. 2009;137:587–595.
- Atkins BZ, Shah AS, Hutcheson KA, et al. Reducing hospital morbidity and mortality following esopohagectomy. 2004;78:1170–1176.
- Morita M, Nakanoko T, Fujinaka Y, et al. In-hospital mortality after a surgical resection for esophageal cancer: analyse of the associated factors and historical changes.Ann Surg Oncol. 2011;18:1757–1765.
- Zingg U, Smithers BM, Gotley DC, et al. Factor associated with postoperative pulmonary morbidity after esophagectomy for cancer. Ann Surg Oncol. 2011;18:1460–1468.
- Michelet P, D’Journo XB, Roch A, et al. Protective ventilation influences systemic inflammation after esophagectomy: a randomized controlled study. Anesthesiology. 2006;105:911–919.
- Casado D, Lopez F, Marti R. Perioperative fluid management and major respiratory complications in patiens undergoing esophagectomy. Dis Esophagus. 2010;23:523–528.
- Neal JM, Wilcox RT, Allen HW, Low DE. Near-total esophagectomy: the influence of standardized multimodal management and intraoperative fluid restriction. Reg Anesth Pain Med. 2003;28.328–334.
- Robertson SA, Skipworth RJ, Clarke DL, et al. Ventilatory and intensive care requirements following oesophageal resection. Ann R Coll Surg Engl. 2006;88:354–357.
- Lanuti M, de Delva PE, Maher A, et al. Feasebility and outcomes of an early extubation policy after esophagectomy. Ann Torac Surg. 2006;82:2037–2041.
- Yap FH, Lau JY, Joynt GM, et al. Early extubation after transthoracic oesophagectomy. Hong Kong Med J. 2003;9:98–102.
- Černá M, Köcher M, Dlouhý M, Neoral Č, Gryga A, Duda M, Buriánková E, Aujeský R, el Sheikh H. FerX Ella esophageal covered stent. Acta Univ Palacki Olomouc Fac med. 2000; 143:79–80.
- Duda M, Adamčík L, Czudek S, Škrovina M, Velkoborský M, Čech B, Bezděk R, Merenda M, Kamler A. Miniinvazivní řešení komplikací v jícnové chirurgii. Slovenská chirurgia. 2010; 7(1–2):21–24.
- Černá M, Köcher M, Válek V, Černá M, Kozák J, Neoral Č, Aujeský R, Andrašina T. Léčba benigních píštělí jícnu krytými biodegradabilními stenty. První výsledky. Čes Radiol. 2011;65:112–116.
- Munitz V, Martinez-de Haro LF, Ortiz A, et al. Effectiveness of a written clinical pathway for endhanced recovery after transthoracic (Ivor Lewis) oesophagectomy. Br J Surg.2010;97:714–718.
- Chen G, Wang Z, Liu XY, Liu FY. Recurrence pattern of squamous cell carcinoma in the middle thoracic esophagus after modified Yvor-Lewis esophagectomy. World J Surg. 2007;31:1107–1114.
- Nakagawa S, Kanda T, Kosugi S, et al. Recurrence pattern of squamous cell carcinoma of the thoracic esophagus after extend radical esophagectomy with three field lymphadectomy. J Am Coll Surg. 2004;198:205–211.
- Meredith KL, Weber JM, Turga KK, et al. Pathologic response after neoadjuvant therapy is the maior determinant of survival in patiens with esophageal cancer. Ann Surg Oncol. 2010;17:1129–1167.
- Dlouhý M, Köcher M, Duda M, Gryga A. New possibilities of miniinvasive traetment of esophageal stenoses. Acta Univ Palacki Olomuc (Olomouc) Fac Med. 1994;138:69–72.
- Köcher M, Dlouhý M, Hrbek J, Duda M, Gryga A. Léčba stenóz jícnu nitinolovými stenty. Čes Radiol. 1995;49:219–224.
- Köcher M, Dlouhý M, Neoral Č, Buriánková E, Gryga A, Duda M, Aujeský R. Esophageal stent with antireflux valve for tumors involving the cardia: work in progress. J Vasc Intervent Radiol. 1998;9:1007–1010.
- Dimick JB, Wainess R, Upchurch G et al. National trends in outcomes for esophageal resection. An Thorac Surg. 2005;79:212–218.
- Wenner J, Zilling T, Bladstroom A, Alvegard TA. The influence of surgical volume on hospital mortality and 5-year survival for carcinoma of the eosophagus and gastric cardia. Anticancer Res. 2005;25:419–424.
- Wouters MW, Wijnhoven BP, Karim-Kos HE et al. High-volume versus low-volume for esophageal resection for cancer: the essentials role of case mix adjustments based on clinical data. Ann Surg Oncol. 2008;15:80–87.
- Metzger R, Bollshweiler E, Vallböhmer D, et al. High volume centers for esophagectomy: what is the number needed to achive low postoperative mortality? Dis Esophagus. 2004;17:310–314.
- Wenner J, Zilling T, Bladstroom A, Alvegard TA. The influence of surgical volume on hospital mortality and 5-year survival for carcinoma of the eosophagus and gastric cardia. Anticancer Res. 2005;25:419–424.
- Metzger R, Bollshweiler E, Vallböhmer D, et al. High volume centers for esophagectomy: what is the number needed to achive low postoperative mortality? Dis Esophagus. 2004;17:310–314.
- Stavrou EP, Smith GS, Baker DF. Surgical outcomes associated with oesophagectomy in New South Wales: an investigation of hospital volume. J Gastrointest Surg. 2010;14:951–957.
- Verhoef C, van de Weyer R, Schaapveld M, et al. Better survival in patiens with esophageal cancer after surgical treatment in university hospitals: a plea for performance by surgical oncologist. Ann Surg Oncol. 2007;14:1678–1687.
- Thompson AM, Rapson T, Gilbert FG, Park KGM. Hospital volume does not influence longterm survival of patiens undergoing surgery for oesophageal or gastric cancer. Br J Surg. 2007;94:578–584.
- Dimick JB, Pronovost PJ, Cowan JA Jr, Lipsett PA. Surgical volume and quality of care for esophageal resection: do high-volume hospitals have fewer complications? Ann Thorac Surg. 2003;75:337–341.
- Schüttzner J. Registr hrudních výkonů v České republice 2007, 2008, 2009 a 2010. Praha: nepublikované sdělení; 2011.
- Duda M, Žaloudík J, Ryska M, Dušek L. Chirurgická léčba solidních nádorů v České republice. Rozhl Chir. 2010; 89(10):588–593.
- Neoral Č, Aujeský R, Král V, Klein J, Bohanes T, Vrba R, Koranda P. Technika získání sentinelových uzlin u tumorů v oblasti distálního jícnu a žaludku. Rozhl Chir. 2005;84(6): 307–309.
- Polanecký O, Pazdro A, Tvrdoň J, Teršíp T, Šmejkal P, Smejkal M, Hladík P, Pafko P. Paliativní ošetření karcinomu jícnu – naše zkušenosti. Rozhl Chir. 2006;85( 4):186–189.
- Pafko P, Pazdro A. Radikální léčba karcinomu jícnu (abstrakt). Bulletin HPB (Časopis české hepato-pankreato-biliární společnosti). 2008;16(1–2):14–16.
- Tvrdoň J, Haruštiak T, Pazdro A, Teršíp T, Pafko P. Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště. Rozhl Chir. 2008;87(7):355–359.
- Neoral Č, Aujeský R, Král V. Náhrady jícnu tlustým střevem – zkušenosti se 109 případy. Rozhl Chir. 2010;89(12):740–745.
- Holub E. Vzpomínky pamětníků na olomouckou chirurgii. In: Duda M, editor. Historie chirurgie, vybrané statě olomoucké a moravské chirurgie. Olomouc: Univerzita Palackého Olomouc; 2008. s. 52–61.
- Šerý Z, Duda M, Korhoň M, Gazárek F, Nitsche R. Chirurgie jícnu a kardie. Čas Lék Čes. 1976;115(31):954–958.
- Šerý Z, Duda M, Dlouhý M, Gazárek F, Roček V. Naše zkušenosti s léčbou nádorů jícnu. Plzeň lék Sborn. 1983;Suppl.47: 29–33.
- Duda M, Dlouhý M, Roček V, Gryga A, Janda P, Šerý Z. Die chirurgische Behandlung des Ösophauskarzinoms. Acta Univ Palacki Olomouc Fac Med. 1989;123:177–188.
- Dlouhý M, Duda M, Roček V, Janda P, Lovečková J. Komplexní diagnostika a strategie chirurgické léčby karcinomu jícnu. Klinická onkologie. 1993;2:51–55.