7 Vrozené vady jícnu
Kongenitální vady jícnu jsou závažným vrozeným postižením, které se vyskytuje buď samostatně, nebo v kombinaci s dalšími vrozenými vadami (více než v 50 % bývají současně přítomny další vrozené vady na zažívacím traktu, srdci, urogenitálním systému a muskuloskeletárním systému). Prenatální diagnostika těchto vad je možná díky zdokonalení ultrazvukového vyšetření až v posledních desetiletích. Prognóza této vady je velmi závažná, protože řada těchto dětí se rodí předčasně a přes pokroky dětské chirurgie není jejich řešení vždy úspěšné.
7.1 Historie a současnost
V roce 1697 popsal Thomass Gibson [1] dítě, které se při polykání dusilo a potrava se mu vracela nosem a ústy. V následujících letech bylo mnoho neúspěšných pokusů o operační řešení pacientů s ezofageální atrézií a tracheoezofageální píštělí. Marná snaha chirurgů vedla k závěru, že postižené děti těmito anomáliemi je nejlepší nechat zemřít. Teprve s rozvojem dětské chirurgie od poloviny minulého století dochází k postupnému zlepšování vyhlídek u dětí postižených touto vrozenou anomálií [2, 3]. Nezávisle na sobě v roce 1939 Leven [4] a Ladd [3] úspěšně operovali atrézii jícnu. Provedli gastrostomii a krční ezofagostomii, ligovali píštěl a následně vytvořili antesternální neoezofagus s úspěšným výsledkem. Haigh a Towsley provedli úspěšnou operaci o 2 roky později. Použili levostranný extrapleurální přístup k ligaci píštěle a primární anastomózu jícnu [5]. Tak začala moderní éra novorozenecké jícnové chirurgie. Podle Šnajdaufa [16] první úspěšnou anastomózu vrozené atrézie jícnu v českých zemích provedli v roce 1953 Vaněčková a Kafka. Později se této problematice věnoval M. Kabelka.
Chirurgická léčba vrozených vad jícnu byla v naších zemích po roce 1945 přirozeně vázána na pracoviště, kde se prováděla jícnová chirurgie, a k takovým patřilo i olomoucké po příchodu prof. MUDr. Rapanta na obnovenou Univerzitu Palackého v Olomouci v roce 1946. Z jeho žáků se touto problematikou zabýval především doc. MUDr. Eduard Fargaš, CSc., který se věnoval dětské chirurgii v celém rozsahu. Úspěšně operoval tyto vrozené vady i další Rapantův žák, pozdější primář chirurgického oddělení nemocnice ve Šternberku, Miloslav Čermák [6, 7]. Jedno z dětí operovaných M. Čermákem jsme měli možnost sledovat po dobu takřka padesáti let.
Kazuistika – sledování nemocné 48 roků po operaci atrézie jícnu
U holčičky narozené v roce 1960 byla po narození diagnostikována atrézie jícnu bez píštěle (Vogt II). První den po porodu byla operována, provedena primární end-to-end anastomóza. Pooperační průběh byl bez komplikací a rovněž další vývoj dítěte až do dospělosti byl normální až na příznaky chronického zánětu průdušek. V 15 letech prodělala zápal plic se zánětem pohrudnice. V dospělosti se stále více projevovaly příznaky gastroezofageálního refluxu s projevy pyrózy a občasnou regurgitací a po třicátém roku věku i s občasnou dysfagií. Na základě rentgenového a endoskopického vyšetření byla stanovena diagnóza fixované skluzné hiátové hernie, brachyezofagu a známky refluxní ezofagitidy. Mezi třicátým až pětatřicátým rokem věku brala dlouhodobě prokinetika, omeprazol a opakovaně byla prováděna dilatace jícnu. Dysfagické obtíže po této léčbě vymizely, ale výrazné refluxní obtíže přetrvávaly, včetně regurgitace, zvláště po vysazení medikamentózní terapie. Proto u ní byla ve 38 letech indikována antirefluxní operace. Vzhledem k ireponibilnímu krátkému jícnu nebyla možná obvyklá fundoplikace a bylo nutné provést tzv. nepřímý výkon, tj. resekci žaludku s rekonstrukcí pasáže Rouxovou kličkou. Refluxní obtíže po této operaci ustoupily. Po deseti letech byla pro neurčité bolesti břicha závislé na jídle kompletně vyšetřena gastroenterologem. Při gastroskopii přetrvávaly známky brachyezofagu, Z linie byla 35 cm od řezáků, nález na sliznici jícnu i v pahýlu žaludku po resekci byl však klidný. Při ultrazvukovém vyšetření břicha byla prokázána vícečetná cholecystolitiáza a pacientka v 48 letech věku podstoupila nekomplikovanou laparoskopickou cholecystektomii, po které došlo k ústupu zažívacích obtíží.
S odchodem doc. MUDr. Fargaše nejprve na zahraniční expertizu a po návratu po převzetí funkce přednosty II. chirurgické kliniky došlo postupně v Olomouci ke změně profilu dětských a zejména novorozeneckých operací, které se prováděly v menším počtu. Nepochybně na to měla vliv i celková reorganizace péče o děti v České republice, když se vytvořila dvě centra pro dětskou chirurgii, a to v Praze a v Brně, kam byla stále silnější tendence specializované operace koncentrovat [8–16]. Operace pro vrozené vady jícnu se tak v Olomouci od 70. let minulého století prováděly méně často [17]. Mimo centrum dětské chirurgie v Brně byla na Moravě Ostrava dalším místem, kde se novorozenecká chirurgie prováděla a provádí ve větší míře. To bylo také důvodem, proč jsem v této kapitole zvolil ke spolupráci toto pracoviště.
Soubor pacientů hospitalizovaných na jednotce intenzivní a resuscitační péče pro novorozence (JIRPN) v Ostravě
Spoluautorka této kapitoly (H. Podešvová) vedla neonatologické oddělení ve FN Ostrava v letech 1978 až 2009. Od roku 1988 do roku 2009 získala zkušenosti spolu s dětskými chirurgy (J. Kopecký, V. Richter) s 58 dětmi s vrozenou vadou jícnu.
V letech 1988 až 2009 bylo na Jednotce intenzivní a resuscitační péče pro novorozence (JIRPN) Krajské, později Fakultní nemocnice v Ostravě hospitalizováno 58 novorozenců s vrozenou vadou jícnu. Jednalo se o 33 chlapců a 25 dívek (57 : 43 %). U 43 dětí se jednalo o malformaci typu Vogt IIIb, po 6 dětech mělo typ Vogt II a izolovanou tracheoezofageální („H“) píštěl, u 3 dětí šlo o typ Vogt IIIc. Malformace typu Vogt IIIb se tedy vyskytla u 74 % pacientů, literatura udává výskyt této nejčastější formy až v 90 % [18].
Pacienti jsou rozděleni do dvou období, která se liší hlavně vybavením JIRPN. Teprve od roku 2000 byla na JIRPN adekvátní technika k umělé plicní ventilaci, která umožnila úspěšně zachraňovat nedonošené novorozence nižších gestačních týdnů a nižší porodní hmotnosti s uvedenými vrozenými vadami jícnu. V celé skupině pacientů z období 1988 až 2009 bylo z 58 hospitalizovaných dětí 23 donošených (narozených ve 38.–42. gestačním týdnu), tj. 39,7 %. Z nich 12 (52 %) mělo přidružené vrozené vývojové vady. Z této skupiny zemřelo pouze 1 dítě, tzn. přežití je 95,7 %, což je v souladu s údaji zahraničních autorů [19] (tab. 1, 2).
| Tab. 1 Soubor pacientů s atrézií jícnu v letech 1988–1999 |
|||||
| 1988–1999 | Průměrná porodní hmotnost |
Průměrný týden gestace |
Přidružené VVV* |
Počet zemřelých | |
| Počet novorozenců celkem | 37 | 20 (54 %) | 11 (29,7 %) | ||
| Počet operovaných novorozenců | 30 | 2498 g (1600–3850 g) |
36,0 (32–41) | 15 (50 %) | 4 (13,3 %) |
| Počet neoperovaných novorozenců | 7 | 1186 g (750–2100 g) |
30,6 (28–34) | 5 (71 %) | 7 (100 %) |
* VVV – vrozené vývojové vady
.
| Tab. 2 Soubor pacientů s atrézií jícnu v letech 2000–2009 |
|||||
| 2000–2009 | Průměrná porodní hmotnost | Průměrný týden gestace | PřidruženéVVV | Počet zemřelých | |
| Počet novorozenců celkem | 21 | 12 (57 %) | 4 (19,0 %) | ||
| Počet operovaných novorozenců | 19 | 2456 g (920–3500 g) |
36,2 (29–42) | 10 (53 %) | 2 (10,5 %) |
| Počet neoperovaných novorozenců | 2 | 695 g (650–740 g) |
27,0 (26–28) | 2 (100 %) | 2 (100 %) |
*VVV – vrozené vývojové vady
.
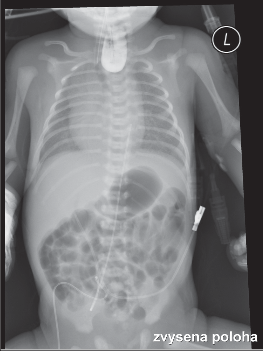
Obr. 1
Ezofagogram vrozené atrézie jícnu, v předozadní projekci kontrastní náplň dilatovaného horního pahýlu jícnu se zavedenou sondou (rtg snímek z osobního archivu H. Podešvové, zhotovený na radiologickém oddělení FN Ostrava, zveřejněný se souhlasem primářky tohoto oddělení MUDr. A. Jahodové)
U většiny malých pacientů byla atrézie jícnu diagnostikována až po narození, u některých bylo na tuto vadu podezření již prenatálně pro polyhydramnion u matky. Centralizací těhotenských patologií do Perinatologického centra se tyto děti ve velké míře narodily právě v tomto centru. Hlavním úkolem je dítě s touto anomálií po narození stabilizovat, zvláště je-li nedonošené. Dítě je třeba uložit na pravý bok se zvýšenou horní polovinou těla, aby se v případě přítomnosti tracheoezofageální píštěle minimalizoval reflux žaludečního obsahu do dýchacích cest. Do horní slepé části jícnu se zavede sonda, kterou musí být velmi frekventně odsávány sliny. V případě, že jde o dítě nezralé a vyžadující umělou plicní ventilaci, je dobré dítě zaintubovat spíše větší endotracheální kanylou a je nutná ventilace s co nejnižšími inspiračními tlaky, abychom minimalizovali únik plynů kolem endotracheální rourky do žaludku a střev, a předešli tak jejich nadměrné distenzi, vysokému stavu bránice a zhoršení ventilačních poměrů. Diagnostiku provádíme na lůžku, kdy ve svislé nebo alespoň zvýšené poloze provedeme rtg snímek s malým množstvím vodné kontrastní látky aplikované sondou, kterou po expozici okamžitě odsajeme (obr. 1). Pátráme po přidružených malformacích. Zkušený dětský kardiolog provádí echokardiografické vyšetření a nutné je i ultrazvukové vyšetření břicha. Po stabilizaci, zvláště novorozenců těžce nedonošených, dětí se závažnou srdeční vadou a dětí s aspirační pneumonií, spolu s dětským chirurgem naplánujeme operační řešení, které většinou snese určitý odklad, nejde o superurgentní výkon. Po operaci je dítě hospitalizované na JIRPN, má zavedenou nasogastrickou sondu, u které je nutné zabránit dislokaci. Několik pooperačních dnů je novorozenec podpůrně uměle ventilován a šetrně odsáván ze zavedeného pravostranného hrudního drénu, který odstraňujeme po dohodě s chirurgem. Vyhýbáme se hyperhydrataci dítěte zvláště při anastomóze jícnu pod napětím, ihned po obnovení peristaltiky začínáme s časným enterálním přívodem malými dávkami do nasogastrické sondy. Pooperační průběh je samozřejmě ovlivněn přidruženými vrozenými vývojovými vadami, které řešíme s příslušnými specialisty (kardiolog, nefrolog apod.).
7.2 Patogeneze vrozených vad
Vývoj trávicího a dýchacího ústrojí, tedy i jícnu, má svůj původ ve faryngeální membráně, složené z ektodermu ústní jamky a přední výchlipky střevní. Ve třetím týdnu embryonálního vývoje se membrána protrhne a dojde ke spojení ústní dutiny s faryngem. Kaudálním směrem se pak farynx nálevkovitě zužuje a vytváří základ jícnu. Pro vznik většiny kongenitálních odchylek, se kterými se v klinické praxi setkáváme, je rozhodující čtvrtý až dvanáctý týden embryonálního vývoje. Tehdy se společný základ jícnu a průdušnice diferencuje na dvě oddělené trubice. Nedojde-li z nějakého důvodu k takovému rozdělení, vznikají ezofagotracheální nebo méně obvyklé ezofagobronchiální píštěle. Atrézie, které je často provázejí, jsou důsledkem nedostatečného rozsahu vakuolizace epitelové výstelky prvotního jícnu.
7.3 Výskyt vrozených vad jícnu
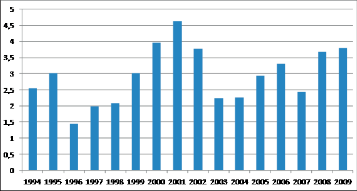
Velmi podrobné údaje o výskytu vrozených vad jícnu jsou u nás k dispozici díky práci A. Šípka a spolupracovníků z Ústavu pro péči o matku a dítě v Praze-Podolí, který zpracoval výskyt vrozených vad jícnu v České republice za období 1961–2010. S jeho svolením zde tato epidemiologická data uvádíme [20, 21]. Zdrojem těchto údajů bylo retrospektivní zpracování materiálů evidovaných v Ústavu pro péči o matku a dítě v Praze-Podolí a data z Ústavu zdravotnických informací a statistiky České republiky (ÚZIS). Takto bylo možno vyhodnotit více jak 5,5 milionů porodů z období let 1961–2000. V tomto období bylo diagnostikováno 804 vrozených vad jícnu a v uvedeném období byl zjištěn statisticky nevýznamný nevýrazný nárůst četnosti. Průměrná incidence této vady byla v tomto období 1,51 na 10 000 živě narozených. Podle pohlaví byli zastoupeni více chlapci (58 %). Podle srovnání provedeného Šípkem se Česká republika řadí ke státům s nižším výskytem této vady (tab. 3). Výskyt vrozených vad jícnu podle dat ÚZIS sestavený H. Podešvovou je uveden v grafech 1, 2 a 3.
Incidence je mírně vyšší u chlapců a u dětí starších a diabetických matek [22]. V příčinné souvislosti s vadou bývají uváděny kontraceptiva, progesteron, estrogen či thalidomid a jednoznačně diabetes mellitus. Ačkoli jde o anomálii sporadickou, byl zjištěn i familiární výskyt této vrozené vady. Dítě narozené takto postiženému rodiči má 3–4 % riziko, dítě mající takto postiženého sourozence má 0,5–2 % riziko a riziko roste až na 20 %, jestliže má takto postižené dva sourozence [23].
| Tab. 3: Vrozené vady jícnu na 10 000 živě narozených v různých státek světa z období 1974 až 1998. Přehled zpracován A. Šípkem a zveřejněn s jeho svolením, zkratky uvedené u jednotlivých států jsou označením národních registrů vrozených vývojových vad |
|||
| Stát/oblast | 1974–1988 | 1989–1994 | 1998 |
| Austrálie | 3,1 | 2,9 | 2,4 |
| Česká republika | 1,4 | 1,9 | 2,8 |
| Dánsko | 2,2 | 0,6 | – |
| Anglie a Wales | 1,6 | 0,9 | 0,8 |
| Finsko | 1,5 | 2,1 | 0,9 |
| Francie – CE Registr | 2,6 | 2,7 | 3,5 |
| Francie – Paříž | 2,5 | 3,8 | 2,2 |
| Francie – Štrasburk | 2,3 | 3,1 | 1,5 |
| Holandsko | – | 1,3 | 0,5 |
| Izrael | 2,0 | 3,3 | 1,9 |
| Itálie – IPIMC | 2,9 | 2,9 | 1,8 |
| Itálie – IMER | 3,6 | 4,0 | 1,2 |
| Japonsko – JAMW | 1,4 | 2,1 | 3,3 |
| Jihoafrická republika | – | 0,9 | – |
| Jižní Amerika– ECLAMC | 2,4 | 2,9 | 4,1 |
| Maďarsko | 1,8 | 1,5 | 0,4 |
| Mexiko | 1,4 | 2,5 | 3,2 |
| Nový Zéland | 1,9 | 2,3 | 2,3 |
| Norsko | 2,0 | 2,4 | 1,9 |
| Španělsko | 1,8 | 2,3 | 0,6 |
| Švédsko | 2,7 | 1,7 | 0,7 |
| USA – Atlanta | 2,3 | 1,9 | 0,7 |
.
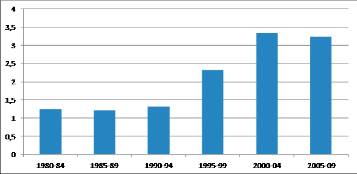
Graf 2
Pr ůměrný výskyt VVV jícnu na 10 000 živě narozených v ČR v pětiletých inter valech v letech 1980–2009
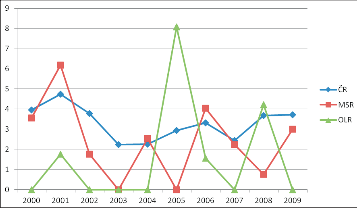
Graf 3
Srovná ní výskytu VVV jícnu na 10 000 živě narozených v Č eské republice (ČR), Moravskoslezském regionu (MSR) a Olomouckém regionu (OLR) v letech 2000–2009
7.4 Klasifikace vrozených vad jícnu
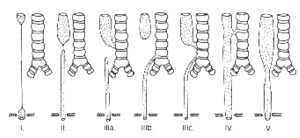
Existuje několik klasifikačních schémat popisujících anatomické varianty vrozených vad jícnu, mezi něž patří klasifikace Laddova a Grossova [2, 3]. U nás se nejčastěji užívá klasifikace podle Vogta z roku 1929 (obr. 2).
| Obr. 2 Vogtova klasifikace vrozených vad jícnu |
.
- Typ I – krátký horní i dolní segment, mezi nimi dlouhý atretický úsek
- Typ II – horní i dolní slepý vak bez ezofagotrachální píštěle
- Typ IIIa – horní a dolní slepý vak s horní ezofagotrachální píštělí
- Typ IIIb – horní a dolní slepý vak s dolní ezofagotrachální píštělí
(nejčastější forma – až 90 %) - Typ IIIc – horní i dolní ezofagotrachální píštěl
- Typ IV – průchozí ezofagus, ezofagotrachální píštěl – H-píštěl
- Typ V – stenóza ezofagu
.
7.4.1 Atrézie a píštěle
Frekvence výskytu atrézie jícnu se uvádí 1 na 2500 až 3000 porodů. Atrézie až ageneze jícnu se může vyskytovat bez píštěle (typ Vogt I a II) nebo s tracheoezofageální píštělí (Vogt IIIa, IIIb a IIIc) či jako samostatná píštěl bez atrézie (Vogt IV neboli H-píštěl).
Atrézie jícnu
Podezření na atrézii jícnu může zjistit ve II. trimestru prováděné ultrazvukové vyšetření plodu, když není viditelná žaludeční bublina [24]. V posledním trimestru gravidity na tuto vadu může upozornit polyhydramnion, jenž je vyvolán poruchou polykání plodové vody. U atrézií bez píštěle se polyhydramnion vyskytuje asi v 60%, u atrézií s dolní píštělí u 30% případů. Novorozenci se často rodí předčasně, u 40% novorozenců je porodní hmotnost < 2500g [25]. Atrézie jícnu bývá velmi často sdružena s dalšími malformacemi (tab. 4). V 10% bývají malformace mnohočetné. Protože operační a pooperační postupy tracheoezofageálních postižení se v posledních desetiletích dramaticky zdokonalily, přidružené anomálie se stávají stále důležitějšími faktory v prognóze těchto pacientů. Za mortalitu operovaných dětí již nejsou zodpovědné respirační problémy či sepse, ale přítomnost závažných vrozených vad, zvláště srdečních, které se mohou stát hlavní příčinou smrti [26]. Incidence přidružených anomálií je několikrát vyšší u dětí s porodní hmotností < 2000g, o něž zejména je péče problematická. Pečlivé zhodnocení přidružených anomálií je rozhodující pro konečnou prognózu těchto dětí [25, 30–34].
| Tab. 4 Přidružené vrozené vady u pacientů s atrézií jícnu [26–29] |
|
| Postižený systém | Potenciální anomálie |
| Kardiovaskulární [26] (asi ve 20–30 %) |
Defekt komorového septa a síňového septa, perzistující Botallova dučej, Fallotova tetralogie, anomálie aortálního oblouku, ageneze pupeční arterie |
| Gastrointestinální [27] (asi ve 25 %) |
Nejčastěji (asi ve 42 %) anorektální atrézie, duodenální atrézie, atrézie ilea, malrotace, Meckelův divertikl, anulární pankreas a pylorostenóza |
| Urogenitální [28] (asi ve 24 %) |
Jednostranná či oboustranná ageneze nebo dysplazie ledvin, podkovovité ledviny, polycystické ledviny, vezikoureterální reflux, hypospadi |
| Nervový a muskuloskeletární [29] (asi v 10 %) |
Defekty neurální trubice, hydrocefalus, skoliózy, hemivertebrae, dysplazie radia, amelie, polydaktylie, syndaktylie, anomálie žeber, vady dolních končetin |
.
Klinické příznaky
U novorozence se atrézie projevuje excesivním sliněním s tvorbou jezírka v zadním faryngu. To často vede k aspiraci, paroxysmálnímu kašli, dušení, cyanóze a respiračnímu distresu. V případě aspirace dochází k apnoi, bradykardii, a dokonce může následovat i úmrtí. Velmi záhy se rozvíjí aspirační pneumonie, která ztěžuje operační výkon a může ohrozit jeho výsledek. Jestliže není přítomna ezofagotracheální píštěl, má novorozenec člunkovitě vpadlé břicho. Přítomnost dolní píštěle distenduje střevní kličky a může vést k refluxu žaludečního obsahu do tracheobronchiálního stromu a vyvolat pneumonitidu s možností sepse.
Diagnostika
K zjištění atrézie vede nemožnost zavést cévku do žaludku při odsávání novorozence.
Na prostém snímku hrudníku a břicha nalézáme buď normální střevní plynatost, je-li přítomna dolní píštěl, nebo plyn v trávicí trubici chybí, pokud píštěl není přítomna. Pro velké riziko aspirace po aplikaci kontrastní látky do horního slepého pahýlu se doporučuje jeho lokalizaci upřesnit zavedením kontrastní cévky nebo aplikací vzduchu.
H-píštěle bez atrézie
Jsou lokalizovány v oblasti krční nebo horní hrudní krajiny a tvoří asi 3% až 5% případů vrozeného postižení jícnu.
Klinické příznaky
Projevují se paroxysmálním kašlem, zvláště při jídle, refluxem žaludečních šťáv do trachey, což způsobuje tracheobronchiální pneumonitidu, často oboustrannou a recidivující. Štěkavý kašel je pro děti s tracheoezofageální píštělí typický, je sekundární v souvislosti s tracheomalacií. Struktura trachey může být abnormální, s neuzavřenými chrupavčitými prstenci a výrazně nadbývající mukózou vytvářející vrstvení na přední i zadní stěně a způsobující štěkavý kašel [35]. Dalším významným příznakem je nadměrné rozepnutí žaludku a střev plynem. Závisí na velikosti píštěle, zda se projeví již v novorozeneckém období, nebo až později s růstem dítěte.
Diagnostika
Orientačním vyšetřením, které nezřídka potvrdí diagnózu, je Koopův test, při kterém se do žaludku zavede sonda a jejíž druhý konec se ponoří pod vodní hladinu. Sonda se pak pozvolna povytahuje jícnem. V místě komunikace průdušnice s jícnem pozorujeme únik vzduchu pod vodní hladinu. K upřesnění diagnózy se používá endoskopické vyšetření trachey, případně jícnu. Rentgenové vyšetření vodním kontrastem je spojené s rizikem aspirace.
Léčba
Chirurgické léčení vrozených vad jícnu je dnes doménou specializovaných dětských chirurgů v centrech novorozenecké chirurgie. Pokud není vzdálenost obou slepých konců jícnu příliš velká, provádí se primární end-to-end anastomóza. Při větší vzdálenosti existuje celá řada metod k elongaci jícnu, případně je třeba chybějící úsek jícnu nahradit. U atrézií spojených s píštělí je třeba fistulu resekovat a dýchací cesty uzavřít. U komplikovaných stavů je nutno operovat dvoufázově [8, 10, 12]. S rozvojem novorozenecké chirurgie a intenzivní péče o novorozence se procento úspěšně operovaných novorozenců, ať už primárně či dvoufázově, stále zvyšuje [13–15].
Komplikace
Z bezprostředních komplikací je nejzávažnější insuficience anastomózy. Její výskyt se uvádí až v 15%, z toho ve dvou třetinách je menšího rozsahu. Dehiscence anastomózy jsou významnou příčinou pooperační morbidity a letality [16]. Asi v 10% dochází k recidivě tracheoezofageální píštěle. K pozdním komplikacím patří striktura v místě anastomózy (až ve 30%), která dobře reaguje na dilataci [9, 11], a gastroezofageální reflux (u 20-60% operovaných). Většina dětí má různý stupeň tracheomalacie, která je příčinou respiračních komplikací. Jde o anatomickou a funkční chabost trachey, která způsobuje obstrukci. Bývá v oblasti původní tracheoezofageální píštěle v horní části hrudního jícnu. Jejím následkem je štěkavý kašel, který se s věkem zmírňuje.
Výsledky
Závisí zejména na přítomnosti či nepřítomnosti přidružených anomálií. Je uváděno přežití 95% u donošených novorozenců s izolovanou atrézií jícnu nebo tracheoezofegeální píštělí, ale klesá ke 20% u novorozenců s velmi nízkou porodní hmotností a závažnou srdeční vadou [19].
Laryngo-tracheoezofageální rozštěp
Je vzácná kongenitální anomálie charakterizovaná rozsáhlou komunikací mezi zadní stěnou laryngu a embranózní tracheou a přední stěnou jícnu.
Nejzávažnějším typem píštěle je laryngo-tracheoezofageální rozštěp (tracheoezofagus, ezofagotrachea). Tento efekt bývá provázen těžkými anomáliemi kardiovaskulárního, gastrointestinálního a urogenitálního systému [36]. Rozštěp je rozdělen do 4 podtypů podle délky defektu a stupně závažnosti operace [37–40].
- Typ I – rozštěp je limitován na hrtan a může pokračovat na prstenčitou chrupavku (asi 1/3 případů).
- Typ II – rozštěp se šíří přes prstenčité chrupavky krční trachey.
- Typ III – rozštěp sahá ke karině.
- Typ IV – rozštěp zahrnuje jeden nebo oba hlavní bronchy.
Klinické příznaky
Na rozsahu rozštěpu závisí tíže klinických symptomů, jako je dušení a cyanóza při krmení. Tyto děti mají také charakteristický afonický pláč. Aspirační pneumonie způsobená poruchou funkce postiženého hrtanu se objevuje brzy a obvykle končí smrtí novorozence. Dechové potíže se nedaří zvládnout ani intubací a umělou plicní ventilací.
Diagnostika
Je nutné provést endoskopické vyšetření laryngu a trachey.
Léčba
Chirurgická léčba této anomálie je obtížná. Je spojena s vysokou úmrtností a velikým počtem následných potíží. Tato anomálie, zejména typ IV rozštěpu, je často komplikována těžkou tracheomalacií a hypertrofickou sliznicí. Děti vyžadují dlouhodobou umělou plicní ventilaci k prevenci intermitentního kolapsu trachey. Prevencí kolapsu poddajných dýchacích cest je provedení tracheostomie a propuštění dětí se zavedenou tracheostomickou kanylou [40].
7.4.2 Cysty, duplikace (duplikatury) a vrozené divertikly
Cysty
Cysta byla poprvé popsána Blasiem v roce 1674 [41]. Více než o 100 let později Roth v roce 1881 popsal cystu mediastina adherující k páteři, nyní známou jako neuroenterogenní cysta. Enterální cysty nad bránicí tvoří 18 % všech střevních cyst [42]. Vznikají při vývoji z divertiklu předního střeva. Bývají umístěny na levé straně jícnu, většinou vzadu, a jsou vystlány zpravidla cylindrickým epitelem. Pouze 12 % z velké řady mediastinálních cyst bylo určeno jako cysty jícnu [43]. U dětí nejméně 30 % rezistencí v mediastinu má původ v předním střevu a nakonec se vyvíjí jako jícnová, neurogenní, bronchogenní nebo izolovaná cysta [44]. Ačkoliv se jícnové cysty považují za benigní, byl zaznamenán i maligní zvrat [45, 46].
Jícnové cysty byly popsány ve všech lokalitách podél jícnu [47–49]. Jsou méně obvyklé v krční oblasti [50]. Jícnové cysty mohou být intramurální nebo kompletně separované od jícnu. Ačkoliv zřídka komunikují s lumen jícnu, propojení mezi cystou a jícnem bylo popsáno [51]. Hrudní cysta mající původ v předním střevu může komunikovat s jinými břišními orgány, jako je střevo, žlučové cesty, nebo dokonce vývod pankreatu [52, 53]. Většina cyst je solitárních, ale byly popsány i mnohočetné cysty [54, 55]. Zejména zadní jícnové cysty bývají mnohočetné [56]. Tlusté cysty, většinou vyplněné viskózní tekutinou, ale i nekrotickými a zánětlivými buňkami a starou krví, mohou být komplikované ulcerací, infekcí nebo krvácením.
Duplikace (duplikatury)
Duplikace jícnu probíhají paralelně s jícnem a chovají se jako cysty. Jde v podstatě o intramurální jícnové cysty vystlané dlaždicovým nebo cylindrickým epitelem a jsou považovány za aberaci ve vakuolizaci primitivního jícnu.
Divertikl
Je uložen obvykle vpravo a vyklenuje se dozadu a do stran jako krátký, trubicovitý útvar. Obě formy získaných divertiklů, pulzní i trakční, vznikají herniací submukózy a mukózy defektem svalové vrstvy. Pravý kongenitální divertikl naopak obsahuje všechny vrstvy stěny jícnu (mukózu, submukózu a svalovinu) uvnitř výchlipky [57]. Kongenitální divertikly jsou extrémně vzácné a častěji bývají postiženi chlapci. Většinou se nacházejí v krční části jícnu okolo faryngoezofageálního spojení stejně jako získané, ale mohou být i ve střední části jícnu.
Klinické příznaky
Výskyt těchto anomálií je velmi vzácný. Jedna třetina pacientů s jícnovými cystami je v dětství asymptomatická a cysty jsou náhodně objeveny při rentgenovém vyšetření hrudníku. Většina dalších pacientů může mít minimální až mírnou dysfagii. Velmi velké jícnové cysty mohly mít za následek syndrom horní duté žíly [58] nebo v případě velkých distálních cyst se mohou prezentovat jako břišní masy [49]. Nejdramatičtější příznaky vyplývají ze ztížené ventilace u mladých pacientů. Symptomy mohou vznikat z redukce samotného dechového objemu, z mechanické komprese trachey [59] nebo ze zevního tlaku na velké bronchy způsobující emfyzém (air trapping a atelektázy) nebo konsolidaci (kompletní kolaps plíce) [60, 61]. Častější, ale méně dramatické formy respiračních potíží u pacientů s menšími jícnovými cystami zahrnují stridor, perzistující kašel nebo rekurentní pneumonie [42]. Závažné malformace vedou k úmrtí v raném věku, mírnější formy jsou slučitelné se životem. Dospělí jedinci jsou buď asymptomatičtí, nebo trpí dysfagií, pak je nutné provést exstirpaci.
Novorozenci s jícnovými divertikly se mohou projevovat excesivním sliněním a mohou tak simulovat atrézii jícnu. V případě velkého divertiklu mohou mít pacienti během krmení známky respirační obstrukce a jsou ohroženi aspirací.
Stenóza jícnu
Nejstarší zmínky o stenóze jícnu u novorozenců léčených dilatací jsou z let 1911 [62] a 1917 [63]. Větší soubor 50 případů je z roku 1928 [64]. Rezidua tracheobronchiální tkáně v jícnu byla popsána v roce 1936 [65] a hypertrofická stenóza o 23 let později [66]. Přestože je dilatace nejběžnější terapií, byly už v minulosti prováděny i resekce [67, 68].
Kongenitální jícnová stenóza je definována jako zúžení jícnu projevující se po narození a je vrozenou malformací struktury jeho stěny [69]. Incidence této vady je udávána 1 : 25 000–50 000 živě narozených [69, 70] s vyšším výskytem v Japonsku [71]. Ve světové literatuře bylo nalezeno pouze 500 popsaných případů [72].
V 17 až 33% je stenóza spojena s dalšími vrozenými vývojovými vadami – atrézií střeva, malrotací, anorektální malformací, srdeční vadou, hypospadií, chromozomální aberací a malformacemi hlavy, obličeje a končetin.
Vyskytují se 3 druhy stenózy:
- Fibromuskulární ztluštění, také nazývané idiopatická muskulární hypertrofie nebo fibromuskulární stenóza – tj. difuzní fibróza stěny se segmentární hypertrofií svaloviny a submukózy. Hypertrofické segmenty bývají v distálním jícnu, méně často v jeho střední třetině [73]. Tyto léze jsou dlouhé a ostré se značnou variabilitou ve stupni stenózy. Tento typ je nejčastěji spojen s atrézií jícnu [17].
- Rezidua tracheobronchiální tkáně tvořena chrupavkou, hlenovými žlázkami nebo řasinkovým epitelem, působí rigidní zúžení nejčastěji v distálním jícnu [65, 74]. Bývají spojena s atrézií jícnu a tracheoezofageálními fistulami [71, 75].
- Kongenitální membranózní výchlipky (nebo diafragma), nejvzácnější typ kongenitální stenózy. Mohou se nacházet na všech úrovních jícnu [62, 72], nejčastěji v jeho horní polovině.
Klinický obraz a diagnostika
Všechny formy se projevují opakovaným zvracením, často až v kojeneckém věku po přechodu na tužší stravu. Diagnostikují se kontrastním rentgenovým vyšetřením a endoskopií.
Terapie
Záleží na rozsahu postižení jícnu. Membranózní výchlipky se opakovaně dilatují balonkovým katétrem. Při neúspěšné dilataci je možná discize nebo resekce části jícnu s anastomózou. Chrupavčité zúžení většinou nelze dilatovat. Segmentární hypertrofie svaloviny menšího rozsahu se rovněž léčí dilatací. Někdy může hypertrofie postihnout jícen v celém rozsahu a po neúspěšném pokusu o dilataci je nutná jeho náhrada.
7.4.3 Dysphagia lusoria
Je to horní typ „dysfagie rozmarného průběhu“ (odtud jméno), způsobený vrozenou anomálií oblouku aorty a jejích větví. V roce 1945 provedl Gross první úspěšnou operaci cévního prstence u ročního chlapce, rozdělení zdvojeného oblouku aorty [76].
Patologické nálezy
V širším smyslu se tímto termínem označuje dysfagie u všech vrozených vad aortálního oblouku, v užším pak aberantní odstup pravostranné arteria suclavia (a. lusoria), která odstupuje z aortálního oblouku jako poslední a probíhá většinou za jícnem. Vzniká cévní prstenec, ve kterém jsou utlačovány jícen a trachea.
Klinické příznaky
Závisí na stupni komprese. Většinou se klinicky neprojevuje. Těsná komprese je charakterizována již v časném kojeneckém věku kašlem, respiračními infekty nebo polykacími potížemi někdy teprve tuhé stravy. Stále hrozí nebezpečí aspirace. Výrazný stridor se nemusí projevit v klidu, nýbrž až po námaze (při krmení, křiku apod.).
U menšiny postižených vznikají potíže ve středním věku, kdy se cévní stěny skleroticky mění a stávají se rigidními.
Diagnostika
Velmi cenným vyšetřením je ezofagografie, při níž je patrný mírný zářez na zadní stěně jícnu ve výši 3.–4. hrudního obratle. Trachea většinou nebývá komprimována [77].
Při ezofagoskopii se zjistí na zadní stěně jícnu pulzující val. Pokud prstenec tvoří a. subclavia dx., pak po kompresi pulzujícího valu ezofagoskopem vymizí pulz na pravé horní končetině. Bronchoskopie je důležitá ke zjištění související tracheální stenózy [78].
Léčba
Při dysfagii v dětství je nutné operovat co nejdříve, v dospělosti teprve tehdy, je-li dysfagie úporná a je-li ohrožena výživa.
Literatura
- Gibson T. The anatomy of Humane Bodies Epitomized. London: Awnsham & Churchill; 1697.
- Gross R. Atresia of the esofagus. In Gross R, editor. The Surgery of Infancy and Childhood. Philadephia: WB Saunders; 1953. p.75.
- Ladd W. The surgical treatment of esophageal atresia and tracheoesophageal fistula. N Engl J Med. 1944;230:625–637.
- Leven N. Congenital atresia of the esophagus with tracheoesophageal fistula. Report of succesful extrapleural ligation of fistulous communication and cervical esophagostomy. J Thorac surf. 1941;10:648–657.
- Haight C, Towsley H. Congenital atresia of the esophagus with tracheoesophageal fistula: Extrapleural ligation of fistula and end-to-end anastomosis of esophageal segments. Surg Gynecol Obstet. 1943;76:672–688.
- Čermák M, Jakubiček R, Králík J, Šmíd Z, Zajíček M. Naše zkušenosti s léčbou vrozené neprůchodnosti jícnu. Čas Lék Čes. 1963;102 (4):106–108.
- Duda M, a kolektiv. Historie chirurgie, vybrané statě olomoucké a moravské chirurgie. 1. a 2. vydání, Olomouc: Univerzita Palackého v Olomouci; 2008 a 2009.
- Šnajdauf J, Šintáková B. Elongace jícnu u novorozenců s atrézií jícnu. Rozhl chir. 1984;63: 18–22.
- Lisý J, Hetková M, Šnajdauf J, Vyhnánek M, Tůma S. Long – term outcomes of ballon dilatation of esophageal strictures in children. Acad Radiol. 1998;12(152):16–17.
- Šnajdauf J, Pýcha K, Vyhnánek M, Rožková M, Kalousová J, Mixa V, Mužíková V, Lisý J Náhrada jícnu žaludkem v dětském věku. Rozhl Chir. 1999;78:515–519.
- Lisý J, Šnajdauf J, Šimsová M, Heroldová D, Vyhnánek M, Rygl M, Zeman L, Tůma S, Neuwirth J. Kdy lze považovat balónkovou dilataci striktury jícnu za úspěšnou? Čs Radiol. 2002;56:82–86.
- Kalousová J, Šnajdauf J, Stýblová J, Fryč R, Pýcha K, Petrů O, Pachmanová D, Tomášek L Atrézie jícnu s velkou vzdáleností pahýlů. Mortalita a krátkodobá morbidita. Čes-slov Pediat.2004;59(4):171–175.
- Kalousová J, Šnajdauf J, Stýblová J, Fryč R, Pýcha K, Petrů O, Pachmanová D, Tomášek L.Dlouhodobé výsledky po operaci atrézie jícnu s velkou vzdáleností pahýlů. Vliv chirurgického řešení. Čes-slov Pediat. 2004;59(5): 219–224.
- Šnajdauf J, Kalousová J, Stýblová J, Fryč R, Pýcha K, Petrů O, Pachmanová D, Rygl M, Tomášek L. Současné výsledky léčby atrézie jícnu. Čas Lék čes. 2004;143:614–617.
- Kalousová J, Šnajdauf J, Rygl M, Pachmanová D, Stýblová J, Vyhnánek M, Šulc J, Fryč R, Křížová H, Tomášek L. Dlouhodobé výsledky náhrady jícnu transpozicí žaludku v dětském věku. Čes-slov Pediat. 2007;62:376–383.
- Šnajdauf J, Škába R, et al. Dětská chirurgie. 1. vydání. Praha: Galén; 2005. s. 150–161.
- Malý T, Neoral Č, Chudáček J, Kysučan J, Köcher M, Michálková K, et al. Esophageal atresia with congenital stenosis of the distal part of thoracic esofagus. Eur Surg. 2009;41(Suppl 228):
- Muntau AC. Pediatrie. 1. české vydání. Praha: Grada publishing; 2009. s. 358.
- Fox G, Hoque N, Watts T. Oxford handbook of neonatology. Oxford: Oxford University Press; 2010. p. 234–235.
- Šípek A, Gregor V, Horáček J, Mašátová D: Výskyt vrozených vad jícnu v ČR v období 1961–2000 – incidence, prenatální diagnostika a prevalence podle věku matky. Čes Gynek. 2002;67(Suppl 1):29–32.
- Šípek A, Gregor V, Šípek A Jr, Horáček J, Vencálek O, Lankhamer P, Petržílková L, Wiesnerová J. Vrozené vady u narozených dětí v jednotlivých krajích České republiky v období let 1994 –2007. Čes Gynek. 2010;75(1):15–40.
- Skandalakis J, Gray S, Ricketts R. The esophagus. In Skandalakis J, Gray S, editors. Embryology for Surgeons. Baltimore: Williams & Wilkins; 1994. p. 65–112.
- Pletcher BA, Friedes JS, Breg WR, Toulokian RJ. Familial occurence of esophageal atresia and without tracheoesophageal fistula. Report of two unusual kindreds. Am J Med Genet. 1991;39:380–384.
- Stringer MD, McKenna KM, Goldstein RB, et al. Prenatal diagnosis of esophageal atresia. J Pediatr Surg. 1995;30:1258–1263.
- Poenaru D, Laberge JM, Neilson IR, Guttman FM. A new prognostic classification for esophageal atresia. Surgery. 1993;113:426–432.
- Mee R, Beasley S, Auldist A, Myers N. Influence of congenital heart disease on manamegent of oesophageal atresia. Pediatr Surg Int. 1992;7:90–93.
- Holder T, Cloud D, Lewis E, Pilling G. Esophageal atresia and tracheoesophageal fistula: A survey of its members by the surgical section of the American Academy of Pediatrics. Pediatrics. 1964;34:542–549.
- Beasley S, Phelan E, Kelly J, et al. Urinary tract abnormalities in assotiation with oesophageal atresia: Frequency, significance, and influence on management. Pediatr Surg Int. 1992;7:94–96.
- Harris J, Kallen B, Robert E. Descriptive epidemiology of alimentary tract atresia. Teratology. 1995;52:15–29.
- Beasley S, Myers N. Trends in mortality in oesophageal atresia. Pediatr Surg Int. 1992;7:86–89.
- Waterston D, Bonham Carter R, Aberdeen E. Oesophageal atresia: Tracheo-oesophageal fistula: A study of survival in 218 infants. Lancet. 1962;1:819–822.
- Randolph JG, Newman KD, Anderson KD. Current results in repair of esophageal atresia with tracheoesophageal fistula using physiologic status as a guide to therapy. Ann Surg. 1989;209:526–531.
- Spitz L, Kiely EM, Morecroft JA, Drake DP. Oesophageal atresia: At-risk Groups for the 1990s. J Pediatr Surg. 1994;29:723–725.
- Spitz L. Esophageal atresia. Past, present, and future. J Pediatr Surg. 1996;31:19–25.
- Qi BQ, Merei J, Farmer P, et al. Tracheomalacia with esophageal atresia and tracheoesophageal fistula in fetal rats. J Pediatr Surg. 1997;32:1575–1979.
- DuBois JJ, Pokorny WJ, Harberg FJ, Smith RA. Current management of laryngeal and laryngotracheoesophageal clefts. J Pediatr Surg. 1990;25:855–860.
- Pettersson G. Laryngotracheoesophageal cleft. Z Kinderchir. 1969;7:43–49.
- Březovský P, Šnajdauf J, Černý M. Laryngotracheoezofageální rozštěp. Čs Pediat. 1990;45: 600–603.
- Ryan DP, Muehrcke DD, Doody DP, et al. Laryngotracheoesophageal cleft (type IV): Management and repair of lesions beyond the carina. J Pediatr Surg. 1991;26:962–970.
- Simpson BB, Ryan DP, Donahoe PK, et al. Type IV laryngotracheoesophageal clefts: Surgical management for long-term survival. J Pediatr Surg. 1996;31:1128–1133.
- Blasius G. Observata anatomica in homine, simia, quo. Amstelodam: Gaasbeeck; 1674.
- Grosfeld JL, O’Neill JA, Clatworthy WH. Enteric duplications in infancy and childhood: An 18-year review. Ann Surg. 1970;172:83.
- Haller JA, Mazur DO, Morgan WW. Diagnosis and management of mediastinal masses in children. J Thorac Cardiovasc Surg. 1969;58:385.
- O’Neill JA, Holcomb GW, Neblett WW. Recent experience with esophageal atresia. An Surg. 1979;114:48.
- Orr MM. Edwards AJ. Neoplastic change in duplications of the alimentary tract. Br J Surg.1975;62:269.
- Lee MY, Jensen E, Kwak S, Larson RA. Metastatic adenocarcinoma arising in a congenitalforegut cyst of the esophagus: A case report with review of the literature. Am J Clin Oncol. 1998;21:64–66.
- Plachta A: Benign tumors ot the esophagus: Review of the literature and report of 99 cases.Am J Gastroenterol. 1962;38:639.
- Cohen SR, Geller KA, Birns JW, et al. Foregut cysts in infants and children: Diagnosis and management. Ann Otol Rhinol Laryngol. 1982;91:622.
- Ruffin WK, Hansen DE. An esophageal duplication cyst presenting as an abdominal mass. Am J Gastroenterol. 1989;84:571.
- Borcar J, Hughes CF. Duplication of the cervical oesophagus in adults. Aust N Z J Surg. 1988;58:746.
- Pokorny WJ, Goldstein IR. Enteric thoracoabdominal duplications in children. J Thorac Cardiovasc Surg. 1984;87:821.
- Davis JE, Barnes WA. Intrathoracic duplications of the alimentary tract communicating with the small intestine. Ann Surg. 1952;136:287.
- Fitzgibbons RJ Jr, Nugent FW, Ellis FH Jr, et al. Unusual thoracoabdominal duplication associated with pancreaticopleural fistula. Gastroenterology. 1980;79:344.
- Harmand D, Grosdidir J, Hoeffel JC. Multiple bronchogenic cyst of the esophagus. Am J Gastroenterol. 1981;75:321.
- Robison RJ, Pavlina PM, Scherer LR, Grosfeld JL. Multiple esophageal duplication cysts.J Thorac Cardiovasc Surg. 1987;94:144.
- Superina RA, Ein SH, Humphreys RP. Cystic duplications of the esophagus and neurenteric cysts. J Pediatr Surg. 1984;19:527.
- Brintnall ES, Kridelbaugh WW. Congenital diverticulum of posterior hypopharynx simulating atresia of the esophagus. Ann Surg. 1950;131:564.
- Helund GL, Bissett GS II. Esophageal duplication cyst and aberrant right subclavian artery mimicking a symptomatic vascular ring. Pediatr Radiol. 1989;19:543.
- Sethi G, Marsden J, Johnson D. Duplication cysts of the esophagus. South Med J. 1974;67:616.
- Rogers LF, Osmer JC: Bronchogenic cysts. A review of 46 cases. Am J Roentgenol. 1964;91:273.
- Weichert RF, Lindsey ES, Pearce CW, Waring WW: Bronchogenic cysts with unilateral obstructive emphysema. J Thorac Cardiovasc Surg. 1970;59:287.
- Clark JP. Congenital web of the esophagus: Report of a case. Laryngoscope. 1911;21:810.
- Mosher HP. Webs nad pouches of the oesophagus: Their diagnosis and treatment. Surg Gynecol Obstet. 1917;25:175.
- Beatty CC. Congenital stenosis of the esophagus. Br J Child Dis. 1928;25:237.
- Frey EK, Duschl L. Der Kardiospasmus. Ergeb Chir Orthop. 1936;29:637.
- Bonilla KB, Bowers WF. Congenital esophageal stenosis: Pathologic studies following resection. Am J Surg. 1959;97:772.
- Gross RE. Treatment of short stricture of the esophagus by partial esophagectomy and esophageal reconstruction. Surgery. 1948;23:735.
- Tuttle WM, Day JC. The treatment of short esophageal strictures by resection and end-to-end anastomosis. J Thorac Cardiovasc Surg. 1950;19:534.
- Nihoul-Fékété C, De Backer A, Lortat-Jakob S, Pellerin D. Congenital esophageal stenosis.A review of 20 cases. Pediatr Surg Int. 1987;2:86.
- Valerio D, Jones PF, Steward AM. Congenital oesophageal stenosis. Arch Dis Child. 1977;52:414.
- Nishima T, Tsuchida Y, Saito S. Congenital esophageal stenosis due to tracheobronchial remnants and its associated anomalies. J Pediatr Surg. 1981;16:190.
- Murphy SG, Yazbeck S, Russo P. Isolated congenital esophageal stenosis. J Pediatr Surg. 1995;30:1238.
- Todani T, Watanabe Y, Mizuguchi T, et al. Congenital oesophageal stenosis due to fibromuscular thickening. Z Kinderchir. 1984;39:11.
- Kumar R. A case of congenital oesophageal stricture due to a cartilaginous ring. Br J Surg. 1962;49:533.
- Yeung CK, Spitz L, Brereton RJ, et al. Congenital esophageal stenosis due to tracheobronchial remnants: A rare but important association with esophageal atresia. J Pediatr Surg. 1992;27:852.
- Gross RE. Surgical treatment of dysfagia lusoria in the adult. Ann Surg. 1946;124:532.
- Backer CL, Ilbawi MN, Idriss FS, DeLeon SY. Vascular anomalies causing tracheoesophageal compression: Review of experience in children. J Thorac Cardiovasc Surg. 1989;97:725.
- Filston HC, Ferguson TB Jr, Oldham HN. Airway obstruction by vascular anomalies: Importance of telescopic bronchoskopy. Ann Surg. 1987;205:541.