4 Diagnostika a léčba varixů dolních končetin
TERMINOLOGIE
- Chronická žilní porucha – termín označuje celé spektrum morfologických a funkčních abnormalit žilního systému (asymptomatických/symptomatických, léčených/neléčených).
- Chronické žilní onemocnění – jakákoliv dlouhotrvající morfologická a funkční abnormalita žilního systému projevující se symptomy a/nebo známkami (viditelnými projevy), která vyžaduje vyšetření a/nebo léčbu.
- Varixy (C1–C2) – lehká forma chronického žilního onemocnění, venektazie, retikulární a uzlovité varixy.
- Chronická žilní insuficience (C3–C6) – termín označující pokročilé formy chronického žilního onemocnění – výrazné otoky, kožní změny nebo žilní vředy (floridní, zhojené).
- PrEVAIT – zkratka znamenající PREsence of Varices After In Tervention (přítomnost reziduálních nebo rekurentních varixů po léčbě).
- rekurentní (recidivující) varixy – znovuobjevení varixů v oblasti, ze které byly předtím úspěšně odstraněny.
- reziduální varixy – varixy, které zůstaly (byly ponechány) po léčbě (Eklof, 2009).
4.1 Chronická žilní onemocnění (žilní insuficience)
EPIDEMIOLOGIE
Žilní insuficience je nejrozšířenější civilizační onemocnění, projevující se pocity tíhy a bolestmi dolních končetin během stání, ale i v klidu po větší celodenní námaze. Už v časných stadiích onemocnění se může odpoledne a navečer objevovat otok kolem kotníků. Prevalence varixů (st. C1 a C2) u evropské populace je 73,4–74,9 %, chronická žilní insuficience (trofické kožní změny, st. C4–C6) se objevuje ve 3,6–8,6 %, přičemž zhojený žilní bércový vřed se vyskytuje u 0,6–1,4 % populace a floridní vřed přibližně u 0,5 % obyvatel Evropy.Mezi významné rizikové faktory v současnosti řadíme vyšší věk, pozitivní rodinnou anamnézu a počet těhotenství u žen. Pro rizikové faktory, jako je kouření, arteriální hypertenze, nízká fyzická aktivita nebo chronická zácpa, zatím neexistuje dostatečné množství věrohodných důkazů. Pokud přispívají k rozvoji onemocnění, potom pouze v malé míře.
ETIOLOGIE
Společnými rysy primárních varixů jsou patologické změny žilní stěny, valvulární insuficience a reflux.
Primární strukturální změny a fokální dilatace žilní stěny postupně vedou k valvulární dysfunkci a k rozvoji refluxu. Ten je následně příčinou sekundárních změn žilní stěny. Zvýšený žilní tlak vyvolává změny uspořádání a dysfunkci žilní stěny a dochází k další dilataci postižené žíly.
PATOGENEZE
Termín žilní insuficience označuje neschopnost žilně-svalové pumpy dolních končetin odčerpat zpět k srdci všechnu do končetin přiváděnou krev. Městnající krev vede ke vzniku žilní hypertenze. Příčinou je reflux, obstrukce nebo jejich kombinace.
Návrat krve z dolních končetin zajišťuje žilně-svalová pumpa. Pumpování krve začíná v žilách na noze, jejichž obsah je při každém kroku vytlačován nahoru do oblasti bérce a žilní tlak v dolní končetině klesá. Pro správné fungování žilně-svalové pumpy je potřebná součinnost kloubů, svalů a žil (žilní stěny a žilních chlopní). U pacientů s porušenou funkcí žilně-svalové pumpy se krev hromadí v dolních končetinách a žilní tlak stoupá. Při chůzi vzniká ambulantní žilní hypertenze (ambulantní z latinského ambulatio, f., procházka, procházení) s odezvou v makrocirkulaci, mikrocirkulaci a lymfatických cévách.Projevem žilní hypertenze v makrocirkulaci dolních končetin jsou varixy. Jde o jakékoliv dilatované, elongované nebo vinuté žíly s nefunkčními chlopněmi, bez ohledu na jejich velikost. Varix je tedy kožní nebo podkožní žíla, která definitivně ztratila funkci svých chlopní v důsledku trvalé dilatace. Takto postižená žíla se postupně prodlužuje, stáčí a dilatuje, její stěna podléhá remodelaci.
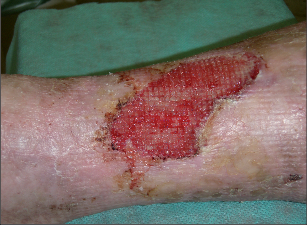
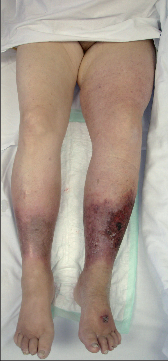
Důsledkem žilní hypertenze v mikrocirkulaci je kapilární hypertenze. V kapilárách stagnují trombocyty, erytrocyty a leukocyty a ucpávají je. Přísun kyslíku a živin do tkání se snižuje. Leukocyty uvolňováním kyslíkových radikálů a proteolytických enzymů poškozují tkáně, rozvíjí se sterilní zánět. Dokud se patologické změny týkají pouze žil různého kalibru, mluvíme o varixech (st. C1–C2 dle CEAP), lehké formě chronického žilního onemocnění. Když ale malnutrice a chronický sterilní zánět poškodí kůži a podkoží, jedná se o chronickou žilní insuficienci (st. C4–C6 dle CEAP), pokročilou formu chronického žilního onemocnění, kde komplexní porucha výživy kůže a podkoží usnadňuje rozvoj tkáňové nekrózy, projevující se lipodermatofibrózou, žilním vředem a event. i krvácením (obr. 1).
KLINICKÉ PROJEVY
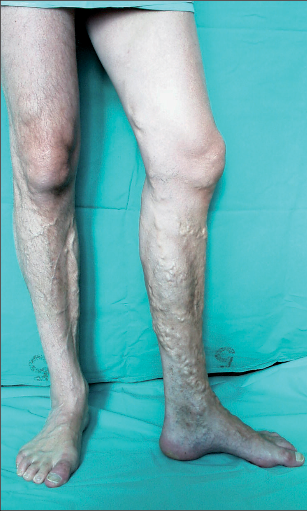
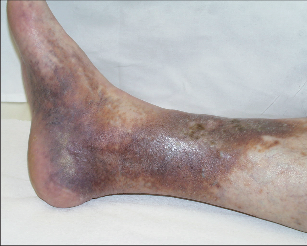
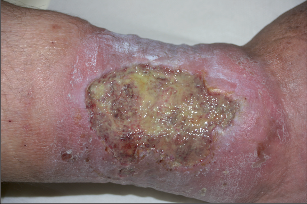
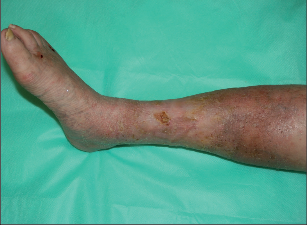
Klasickými viditelnými projevy chronického žilního onemocnění (žilní insuficience) jsou dilatované intradermární žíly (venektazie), podkožní žíly (retikulární a uzlovité varixy) a různě rozsáhlé otoky. Měkký žilní otok v místech nejvyššího hydrostatického tlaku (nejčastěji jsou to otoky kolem kotníků a v distální třetině bérce) se může objevovat již v časných stadiích onemocnění v odpoledních a večerních hodinách a do rána mizí (venózní otok). Při dlouholetém trvání se žilní otok kombinuje s tuhým lymfatickým otokem (lymfo-venózní otok při dynamické lymfatické insuficienci). Na objektivních příznacích (symptomatologii) je postavené v praxi běžně používané klinické třídění žilní insuficience v rámci CEAP klasifikace (Tab) (Consensus Statement, 1995, Eklof, 2004) (Obr. 2–6).Subjektivní pocity tíhy, tlaku, napětí až bolestí v DK a noční křeče v lýtkách tvoří spolu s otoky klasickou triádu potíží spojených s žilní insuficiencí.
|
Tabulka: |
|
| Třída C0 | – žádné viditelné nebo hmatné známky žilního onemocnění |
| Třída C1 | – teleangiektazie nebo retikulární varixy |
| Třída C2 | – uzlovité varixy |
| Třída C3 | – otok na dolní končetině |
| Třída C4 | – kožní změny v důsledku žilního onemocnění (např. pigmentace, žilní ekzém, lipodermatoskleróza) |
| Třída C5 | – kožní změny jak uvedeno výše s vyhojeným vředem |
| Třída C6 | – kožní změny jak uvedeno výše s aktivním vředem |
C = znamená klinické třídění chronického žilního onemocnění v rámci CEAP klasifikace přijaté na 6. výroční schůzi Amerického žilního fóra (American Venous Forum) 22.–25. 2. 1994 v Maui na Havaji. V CEAP klasifikaci jednotlivá písmena značí: C= klinickou klasifikaci, E = etiologickou klasifikaci (kongenitální, primární a sekundární žilní insuficience), A = anatomickou klasifikaci (přesná anatomická lokalizace žilní insuficience) a P = patofyziologickou klasifikaci žilní insuficience (reflux, obstrukce, reflux a obstrukce).
DIAGNOSTIKA
Zhodnotit chronické žilní onemocnění dolních končetin a odlišit ho od jiných nozologických jednotek je mnohem těžší než zhodnotit onemocnění tepen. Projevy žilní insuficience jsou nespecifické, pestré a proměnlivé. Nespecifické proto, že stejné příznaky jako u žilní insuficience můžeme pozorovat také u jiných chorob (postižení páteře, artróza nosných kloubů dolních končetin, flebotrombóza, tromboflebitida). Své potíže pacienti často nepřipisují zjevnému žilnímu onemocnění. Širokou škálu stesků provázejících žilní insuficienci lze někdy jen s obtížemi odlišit od vertebrogenních, neuropatických, artrotických a jiných skeletomuskulárních potíží.Závažnost subjektivních potíží nezávisí na velikosti a rozsahu varixů. Žena s drobnými venektaziemi může mít mnohem větší obtíže než muž s rozsáhlými uzlovitými varixy na obou stehnech a bércích.
Potíže spojené s žilní insuficiencí se zhoršují odpoledne a navečer, dlouhým stáním a sezením, v teplém prostředí, po větší fyzické námaze nebo psychickým stresem, na počátku menstruace a v těhotenství. Často nemocní přicházejí k lékaři pro výrazné noční bolesti a křeče v dolních končetinách, které jim nedovolí kvalitní spánek. Ke zlepšení dochází zvednutím dolních končetin, pohybem a ve studené vodě. Diagnóza chronického žilního onemocnění jako nozologické jednotky je výhradně klinická, vychází z anamnézy a objektivního vyšetření. Na základě anamnestických údajů a objektivního nálezu na dolních končetinách můžeme vyslovit diagnózu žilní insuficience. Ovšem diagnóza patofyziologická (přítomnost refluxu, obstrukce nebo refluxu a obstrukce) a anatomická (postižení povrchového, hlubokého žilního systému, perforátorů) vyžaduje pomocná laboratorní vyšetření, v dnešní době téměř výhradně ultrazvuk. Ultrazvukové vyšetření tak umožňuje upřesnit diagnózu žilní insuficience. Zhodnotí anatomický rozsah a závažnost onemocnění a pomáhá lékaři rozhodovat se o způsobu léčby. Zatímco v diagnostice žilní insuficience si vystačíme s anamnézou a objektivním nálezem, každý nemocný, u kterého plánujeme operační léčbu, včetně sklerotizace, musí mít předtím ultrazvukové vyšetření žilního systému dolních končetin.Cílem léčby žilní insuficience je eliminovat nebo alespoň snížit ambulantní žilní hypertenzi. Konzervativní léčbou jsou režimová a dietní opatření, elevace a komprese dolních končetin, celková a lokální farmakoterapie. U obézních pacientů nesmíme zapomenout na redukci tělesné hmotnosti. Tyto postupy však neřeší kauzální hemodynamickou poruchu, tedy reflux a/nebo obstrukci v žilním systému. Reflux v hlavních refluxních místech (safenofemorální a safenopopliteální junkce) povrchového žilního systému je možné zrušit pouze léčbou chirurgickou (klasická chirurgická a endoskopická léčba, endovenózní laserová nebo radiofrekvenční obliterace), u drobnějších, nekmenových varixů lze použít kompresivní skleroterapii.
Kompresivní terapie je základem léčby všech klinických tříd chronického žilního onemocnění. Jde o tlak aplikovaný na končetinu pomocí krátkotažné či dlouhotažné bandáže, elastické nebo neelastické punčochy. Účinnost správně založené bandáže nebo kompresivní punčochy je přitom srovnatelná (Švestková, 1996). Sebelépe naložená bandáž ale rychle povolí a je problém ji správně naložit, proto v kompresivní terapii dáváme přednost kompresivním punčochám.
Venofarmaka představují symptomatickou léčbu. Od venofarmaka nelze očekávat vymizení varixů, prevenci vzniku varixů nebo flebotrombózy, ale symptomatickou úlevu a potlačení otoků. Na venofarmaka bylo dlouho nahlíženo s určitým despektem. V posledních letech však byla tato léčiva podrobena kontrolovaným klinickým studiím, které jejich účinnost potvrdily (Norgen, 1997).K nejrozšířenějším venofarmakům patří přírodní flavonoidy (mikronizovaná, purifikovaná flavonoidní frakce), rutin, oxerutin a troxerutin, které mají při celkovém podávání minimum nežádoucích účinků, objevujících se u méně než 10 % léčených. Jde hlavně o nauzeu, kožní alergické projevy a bolesti břicha. Venofarmaka zlepšují žilní a lymfatický návrat, redukují tím žilní hypertenzi a mají tak pozitivní vliv na průtok krve mikrocirkulací, snižují viskozitu krve, agregabilitu erytrocytů, adhezi leukocytů k cévnímu endotelu, snižují propustnost kapilár, zvyšují fibrinolytickou aktivitu krve a mají membránoprotektivní působení.
Doba léčení venofarmaky není přesně stanovena. Úvodní podávání jakéhokoliv venofarmaka by mělo trvat alespoň 6–8 týdnů. Někdy je u nemocných vhodné dlouhodobé intermitentní podávání, tedy 4–6 týdnů venofarmaka podávat a stejnou dobu je vynechat, jindy je vhodnější delší kontinuální podávání, zejména v letních měsících. Trvání léčby by mělo být ponecháno na úvaze ošetřujícího lékaře.
Zatím neexistuje vědecký důkaz o účinnosti léků a komprese na teleangiektazie a retikulární varixy. Pokud neprokážeme reflux v hlavních kmenech povrchových žil, je v těchto případech možno doporučit kompresivní skleroterapii. Jde o injekční aplikaci chemických látek navozujících fibrotizaci žilní stěny s následným uzávěrem varixů. Nověji se používá ultrazvukem kontrolovaná skleroterapie (ultrasound-guided sclerotherapy, UGS). Účinnost této léčby je asi 80 %, ale část žil se časem opět rekanalizuje. Skleroterapie je adekvátní léčbou nekmenových varixů– reziduálních varixů po operaci, lokálních varixů a varikózních přítoků do kmene zatím dobře funkční velké nebo malé safeny. Krátkodobé výsledky této léčby jsou dobré, zatím ale chybí studie k posouzení dlouhodobých výsledků.
U rozsáhlých uzlovitých varixů by měla být léčbou první volby klasická chirurgická intervence formou ligace a stripingu kmene safeny. Odstranění safeny (striping) je buď totální, v celém jejím průběhu na dolní končetině od třísla po vnitřní kotník nebo subtotální, tj. odstranění žíly pouze na stehně. Mezi novější radikální léčebné metody řadíme laserovou a radiofrekvenční endovenózní obliteraci varixů.
Žilní bércový vřed představuje tvrdý terapeutický oříšek. Ulcerace nevykazující ani po třech měsících intenzivní léčby tendenci k hojení nazýváme rezistentní vůči terapii (cca 20 % vředů). Spektrum léčby žilních bércových vředů zahrnuje fyzioterapii, kompresivní léčbu, chirurgickou léčbu, lokální a celkovou farmakoterapii, přičemž je důraz kladený na lokální a kompresivní léčbu doplněnou režimovými opatřeními.
Fyzioterapie představuje intenzivní trénink chůzí, zlepšování pohyblivosti kloubů, zvláště talokrurálního, polohování dolních končetin (co nejčastější elevace), manuální lymfatickou drenáž a intermitentní pneumatickou kompresi.
Základním kamenem léčby bércových vředů žilního původu je účinná kompresivní terapie (tlak nad kotníkem alespoň 35 mm Hg). Přednost se dává mírně elastickým obvazům. Lokální tlak na oblast vředu se zvyšuje pomocí podložek. Ty jsou zvláště důležité pro vředy v retromaleolární jamce. Kontraindikací komprese je tepenná obliterující nemoc s tlakem v úrovní kotníku 60–80 mm Hg.
Lokální terapie má za cíl podpořit hojení. Nekrotická tkáň musí být vždy odstraněna. K vyčištění vředů se doporučuje sterilní fyziologický roztok.Zatím nebylo prokázáno, že by nějaký druh bakterií,kontaminujících vřed, ovlivnil diagnostiku, terapii nebo prognózu floridního žilního bércového vředu.V kontrolovaných studiích se vředy léčené antibiotiky hojily stejně rychle jako vředy léčené pouze účinnou kompresí. Systémová farmakoterapie (aspirin, pentoxyphyllin, prostaglandiny, flavonoidy atd.) zatím sehrává pouze pomocnou úlohu.
4.2 Akutní žilní onemocnění
4.2.1 Tromboflebitida
Jedná se o zánět kůže a podkoží spojený s postižením povrchové žíly, ve které vzniká trombóza. V některých případech dominuje spíše zánět, v jiných trombóza. Afekce bývá bolestivá. Jako Mondorovu flebitidu označujeme izolovanou flebitidu s fibroprodukcí, kdy na hrudníku nacházíme výrazně tuhé žíly bez typických známek zánětu v okolí. Na vzniku tromboflebitidy se různou měrou podílí porucha hemostázy, zánět a poruchy krevního toku. Tromboflebitida se může objevit na kterékoliv části těla, ale nejčastěji vzniká na dolních končetinách, kde postihuje varikózní žíly.
Podle lokalizace a etiopatogenze rozlišujeme na dolních končetinách tři základní klinické varianty tromboflebitidy:
- Tromboflebitis vulgaris superficialis – primární povrchová tromboflebitida/flebitida (zánět dosud zdravé podkožní žíly). Může se jednat o idiopatické onemocnění, ale zánět předtím zdravé žíly se někdy objevuje v rámci celkového onemocnění, např. při malignitě, kortikoterapii u mladých žen, při trombofilii, sepsi či bakteriémii. Tromboflebitida tak často bývá prvním varovným znamením doposud nerozpoznané malignity.
- Do této skupiny patří iatrogenně navozená infuzní flebitida, sterilní zánět žilní stěny u pacientů s dlouhodobě zavedeným intravenózním katétrem, ale i po opakovaných žilních odběrech. Trombóza vzniká mechanickým drážděním žilní stěny nebo chemickým a osmotickým působením intravenózně aplikované látky. Infuzní flebitidy se někdy mohou komplikovat hlubokou žilní trombózou. Za nepříznivých prokoagulačních podmínek se může rozvinout až hluboká trombóza brachiální, axillární a podklíčkové žíly.
- Při bakteriální infekci mluvíme o tzv. infekční (septické) flebitidě. Většinou se jedná o streptokokové a stafylokokové infekce.
- Varikoflebitida (zánět varixů – nejčastější varianta asi desetkrát častější než primární tromboflebitida). Je typickou komplikací varixů dolních končetin. Nejčastěji je lokalizována v průběhu varikózně změněného kmene velké a malé safeny. Ve varikózně změněné žíle dochází ke stagnaci krve, mění se chování buněčných složek krve, endotelu a lokálně se tak zvyšuje krevní srážlivost. Následně stačí menší vyvolávající podnět, jako je například drobné poranění v místě varixů, vytvoří se zánět žilní stěny a dojde k odstartování koagulační kaskády s vytvořením velikého nitrožilního trombu nasedajícího na poškozenou žilní stěnu.
- Tromboflebitis saltans seu migrans (migrující zánět podkožních žil). Jedná se o záněty kratších úseků žil, v atypických lokalizacích, které se stěhují z místa na místo, případně se šíří proximálně nebo distálně a mohou postihovat více míst současně na několika končetinách. Může být součástí závažného onemocnění: nádor, TBC, obliterující trombangiitida (Buergerova nemoc), vaskulitidy, kolagenózy. Etiologie zatím není jasná. Speciálním typem migrující tromboflebitidy je Mondorova choroba. Jedná se o vzácnou, idiopatickou, spontánně ustupující tromboflebitidu předtím zdravých žil na přední a boční straně hrudníku a břicha a jejich přeměnu ve vazivové pruhy.
Trvá-li tromboflebitida déle než 30 dní, mluvíme o chronické tromboflebitidě. V 60–80% tromboflebitida postihuje velkou safenu a její přítoky. Závažnou komplikací je flebotrombóza, ať již spojitá (trombus se z povrchových žil kontinuálně šíří safenofemorální, safenopopliteální junkcí nebo perforátory do hlubokých žil) nebo nespojitá (izolovaná tromboflebitida provázená izolovanou flebotrombózou). Mohou nastat i komplikace septické a recidiva.
Pro diagnostiku má význam anamnéza, klinické a ultrazvukové vyšetření. Klinický obraz je charakteristický lokální bolestivostí, citlivostí, zarudnutím a otokem v průběhu postižené žíly. Někdy je zvýšená teplota, u infekčních tromboflebitid horečka.Doplňujícím vyšetřením by mělo být pátrání po vyvolávající příčině primární tromboflebitidy (screening malignity a vaskulitidy). Po vyvolávající příčině tromboflebitidy bychom měli pátrat zejména při recidivující a/nebo multifokální primární tromboflebitidě a při současném výskytu nespojité rozsáhlé flebotrombózy.
TERAPIE TROMBOFLEBITIDY
- konzervativní (kompresivní, lokální a celková farmakoterapie),
- chirurgická.
Tromboflebitida je většinou řešena konzervativně. Kompresivní léčba spolu s lokální farmakoterapií (masti, gely) přinášejí většinou rychlou úlevu od subjektivních potíží. Lokální léčba neovlivňuje ascendentní progresi tromboflebitidy a vznik tromboembolické choroby. Celková farmakoterapie je spolu s pevnou kompresí a chůzí základem konzervativní léčby. Hepariny a nesteroidní antiflogistika dnes představují nejúčinnější farmakoterapii.
U pacientů nereagujících na konzervativní léčbu se provádí chirurgická intervence (flebotomie – incizea vymáčknutí trombu, přerušení safenofemorální/safenopopliteální junkce, striping safeny) Chirurgickým přerušením junkce safen lze doplnit heparinizaci při ascendentním šíření tromboflebitidy.
4.2.2 Flebotrombóza
Krevní sraženina, trombus, může vzniknout kdekoliv v cévním řečišti, v žilách, tepnách nebo v mikrocirkulaci. Trombus je složený z krevních buněk, erytrocytů, trombocytů a leukocytů, spojených fibrinem v jeden celek. Vzájemný poměr mezi fibrinem a buňkami závisí zejména na hemodynamických faktorech, při kterých se trombus tvoří.
Arteriální tromby vznikají v rychle proudící krvi, proto jsou tvořeny hlavně destičkovými agregáty, spojenými tenkými a dlouhými vlákny fibrinu. Mluvíme o destičkovém, bílém trombu. Naproti tomu žilní tromby vznikají v stagnující krvi a jsou složeny převážně z erytrocytů a velkého množství tlustých vláken fibrinu. Trombocytů je v tomto stagnačním červeném trombu málo. V pomalém krevním proudění se objevují smíšené, destičko-erytrocyto-fibrinové tromby.
Již v 19. století definoval Virchow tři základní etiologické faktory flebotrombózy – poškození cévní stěny, městnání krve a „změny ve složení krve“ (hyperkoagulabilita – hyperkoagulační stav).
Roční incidence tromboembolické nemoci (TEN), tedy hluboké žilní trombózy a plicní embolie, je u bílé populace asi 0,1–0,2 %. Před 20. rokem života se TEN vyskytuje velmi vzácně, ale po 45. roce života roční incidence rychle stoupá, v každé dekádě se přibližně zdvojnásobuje. Ve věku nad 75 let TEN postihuje 1 % populace (1 případ na 100 obyvatel za rok).
RIZIKOVÉ FAKTORY
- Věk nad 45 let, vyšší rizikovou kategorii představuje věk nad 75 let.
- Zevní rizikové faktory: operace (zejména ortopedické, traumatologické, neurochirurgické a operace pro nádor), hospitalizace, imobilizace, trauma, těhotenství, šestinedělí, hormonální antikoncepce a substituce, chemo/radioterapie, centrální žilní katétr.
- Vnitřní rizikové faktory: obezita, aktivní nádor, zánětlivá onemocnění, chronické srdeční a plicní selhání, nefrotický syndrom, polycytemia vera, získané a vrozené poruchy koagulace (APC rezistence, mutace protrombinu, deficit proteinu, C, S a antitrombinu III) (Musil, 2009).Klinické příznaky hluboké žilní trombózy vznikají obstrukcí odtoku žilní krve, zánětem žilní stěny a perivaskulární tkáně. Trombóza postihuje hlavně žíly pánve a dolních končetin. Trombus se začíná formovat v sinusech chlopní svalových žil lýtka a bércových žil (vv. tibiales ant. et post.). Většinou se zde po určité době spontánně rozpustí (cca 40 %) nebo organizuje bez další progrese (cca 40 %). Asi ve 20 % případů se neléčená bércová flebotrombóza šíří proximálně do podkolenní žíly a žil stehna a pánve. Děje se tak během jednoho týdne od začátku onemocnění. U proximální flebotrombózy hrozí přibližně v 50 % případů symptomatická nebo asymptomatická plicní embolie (Bates, 2004).
DIAGNOSTIKA
Spolehlivá diagnostika onemocnění pouze na základě anamnézy a fyzikálního vyšetření je velmi nespolehlivá, pokud odhlédneme od evidentních klinických obrazů spojených s phlegmasia dolens. Vždy se musíme opřít o pomocná laboratorní vyšetření.Od poloviny 80. let 20. století se v diagnostice flebotrombózy začala používat ultrasonografie (tzv. kompresní ultrazvuková metoda). Postupně se z ní stal nový diagnostický standard vytlačující z tohoto postu rentgenovou flebografii. Pouze pro zobrazení uzávěru žil pánve je vhodnější transfemorální ascendentní flebografie nebo MRI. Ultrasonografie má vysokou senzitivitu a specificitu. Dalšími přednostmi této metody jsou nízká cena, šetrnost, dostupnost a opakovatelnost. Dnes je pro diagnostiku flebotrombózy dolních končetin dostatečně senzitivní a specifická kombinace klinického hodnocení s kompresní ultrasonografií a vyšetřením D-dimérů. U pacientů s flebotrombózou je vždy nutné pátrat po klinických příznacích plicní embolie (dušnost, kašel, bolesti na hrudníku, synkopa, tachykardie).V diferenciální diagnostice musíme mít na mysli řadu onemocnění svalových, kloubních, kostních, vertebrogenních a nervových (onemocnění bederní páteře s kořenovou iradiací do jedné dolní končetiny, artrotické potíže – koxartróza, gonartróza, bolestivá lipodystrofie, diabetická periferní polyneuropatie, kloubní a svalový revmatismus, neuropatie – etylická, diabetická, metabolická, nádorová, posttraumatická, traumatická postižení – ruptura svalu nebo ligamenta, kontuze, podvrtnutí, podkožní cysty a nádory, podkožní nebo svalové hematomy). U všech pacientů s tromboflebitidou (trombóza povrchových žil, nejčastěji velké safeny a jejích větví) musíme sonograficky vyloučit trombózu hlubokých žil! Důvodem je vysoká koincidence těchto dvou onemocnění (průměrně kolem 30 %).
LÉČBA
- Terapie TEN má dva cíle:
- krátkodobé – úleva od subjektivních potíží, prevence proximálního šíření trombózy, prevenceplicní embolie,
- dlouhodobé – prevence posttrombotického syndromu, prevence recidivy TEN.
Léčba je antikoagulační, kompresivní, trombolytickáa chirurgická
- Antikoagulační
Antikoagulační léčba, jak vyplývá z názvu, nerozpouští trombózu (nejde o trombolytickou léčbu),ale snižuje krevní srážlivosti, a tím usnadňujea urychluje spontánní (endogenní) plazmatickoufibrinolýzu. Při správně vedené léčbě je během3 měsíců alespoň částečně rekanalizováno 99 %postižených žilních segmentů (Haenen, 2001).Antikoagulační léčba spočívá v podávání:- parenterálních heparinů (nefrakcionovaný heparin – UFH, nízkomolekulární hepariny – LMWH, u nás nadroparin/Fraxiparine, enoxaparin/Clexane, dalteparin/Fragmin), které zahajují léčbu TEN. LMWH umožňují domácí léčbu flebotrombózy u vybraných pacientů(dobře spolupracující, mladší pacienti s distální flebotrombózu – bércové žíly a svalové žíly bérce),
- perorálních antagonistů vitaminu K (warfarin), které se používají v dlouhodobé léčbě a prevenci TEN. Hepariny v krevní plazmě nepřímo blokují aktivované plazmatické koagulační faktory (FIIa, FXa). LMWH inaktivují zejména FXa, již méně trombin (FIIa). Antagonisté vitaminu K blokují syntézu plazmatických faktorů (F II, F V, F VII, F IX, F X, F XI) v játrech kompeticí s vitaminem K.
- Kompresivní terapie
Komprese vyprázdní povrchový žilní systém a urychlí krevní návrat. Tím se sníží otok a bolestivost dolní končetiny. Kompresivní léčba také představuje důležitou prevenci plicní embolie a pozdějšího rozvoje posttrombotického syndromu (Kahn, 2004) (Tab. 8). Pokud nemocného neomezuje bolest nebo otok dolní končetiny (phlegmasia) a je kardiopulmonálně kompenzovaný, musí chodit, nesmí zůstat ležet na lůžku! - Trombolýza
Trombolýza je indikována u osob mladších 50 lets rozsáhlou ileofemorální flebotrombózu, pokud klinické známky trvají méně než týden a není zvýšené riziko krvácení (aktivní nádor, nekorigovaná těžká arteriální hypertenze, recentní operace, porod, aktivní vředová choroba gastroduodena, závažná hepatopatie), dále u pacientů s flebotrombózou, která ohrožuje končetinu (phlegmasia cerulea dolens).- Mobilizace pacienta – pokud v chůzi nebrání otok nebo bolesti DK, kardiopulmonální dekompenzace či hypoxie při plicní embolii.
- Chirurgická trombektomie – Fogartyho katétr při akutním ohrožení DK, pokud je lokální trombolýza neproveditelná.
PREVENCE
Dlouhodobá primární nebo sekundární prevence TEN se většinou provádí perorálními antagonisty vitamínu K (kumariny). Výjimku tvoří nemocní s aktivním nádorem, u kterých LMWH snižují v porovnání s kumariny riziko recidivy na polovinu, při srovnatelném nebezpečí krvácení. U ostatních skupin nemocných je riziko recidivy TEN a krvácení při podávání kumarinů a heparinů obdobné. V sekundární prevenci TEN kumariny v prvních 3 měsících snižují riziko recidivy TEN asi o 90 %, při delším podávání tento jejich ochranný vliv klesá a narůstá riziko velkého krvácení. Proto by měla být dlouhodobá antikoagulační léčba náležitě zvážena a zdůvodněna trvajícím významným rizikem recidivy TEN.
V těhotenství a šestinedělí se v léčbě a profylaxi TEN také používají UFH nebo LMWH. Jejich bezpečnost a účinnost je srovnatelná.Trvání antikoagulační léčby v sekundární prevenci TEN se musí opírat o hodnocení aktuálního rizika recidivy TEN, o hodnocení rizika krvácení a o preference nemocného.
4.2.3 Cestovní trombóza
Během mnohahodinové imobilizace, a tedy i při dlouhém cestování ve stísněných prostorech auta, autobusu či letadla, může vzniknout flebotrombóza. Tento fenomén byl v odborné literatuře pojmenován„syndrom ekonomické (turistické) třídy“ a snažil se zdůraznit vliv znehybnění a tlaku hrany sedačky v dopravním letadle na vznik venostázy a následné flebotrombózy v dolních končetinách. Ve vyšší třídě, kde je více prostoru a možností pohybu, by se tento vliv podle autorů uplatňovat neměl.Obecně cestování na dlouhé vzdálenosti zvyšuje riziko flebotrombózy asi dvojnásobně a riziko spojené s leteckou dopravou se neliší od rizika cestování autem, autobusem nebo vlakem. Nebezpečí cestovní flebotrombózy však není u každého cestujícího stejné, zvyšuje se zejména u osob s Leidenskou mutací faktoru V, se zvýšeným BMI nad 30 kg/m2, vyšších než 190 cm a u žen užívajících hormonální antikoncepci.
4.2.4 Phlegmasia dolens
Jde o vzácnou komplikaci rozsáhlé žilní trombózy s nekrotickou devastací měkkých tkání, kdy je téměř zastaven odtok žilní krve z končetiny. Vyšší výskyt je popisován u pacientů s nádorem (Trousseauův syndrom) nebo u jiných závažných stavů (nekrotizující pankreatitida).
Flegmazie se vyskytuje ve dvou klinických formách:
- Phlegmasia alba dolens – vzniká při rozsáhlé trombóze hlubokých žil pánve, stehna a povrchových žil dolní končetiny, se zachovalým kolaterálním hlubokým žilním systémem. Klinicky je patrný rozsáhlý otok jedné dolní končetiny, která je bledá a silně spontánně bolestivá, zejména při svěšení.Tato mírnější forma flegmazie je spojená s menším rizikem žilní gangrény a amputace. Vzácně může flegmazie postihnout obě dolní končetiny současně.
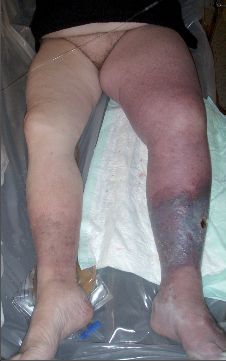
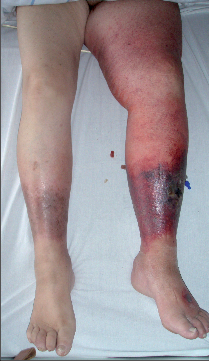
- Phlegmasia coerulea dolens – závažná forma flegmazie, kdy je akutní masivní trombózou postižený nejenom hluboký a povrchový žilní systém, ale také žilní kolaterály (svalové kolaterály a mikrokolaterály). Tepny jsou postižené výrazným spazmem. Klinický obraz je charakterizovaný triádou: otok, cyanóza a ischemická bolest. Postižená končetina je oteklá, výrazně bolestivá, na kůži se objevují nepravidelné modré cyanotické skvrny. Na stehenní tepně v třísle, na podkolenní tepně ani na a. dorsalis pedis nebo a. tibialis posterior nelze nahmatat pulzace. Často vzniká žilní gangréna a kompartmentový syndrom s vysokým rizikem amputace končetiny nebo smrti.U této závažné formy žilní trombózy je diagnostika snadná a jednoznačná již na základě klinického vyšetření. Pomocné laboratorní metody (ultrazvuk, CT nebo MRI) upřesní rozsah žilní a arteriální obliterace a určí velikost nekrotického postižení měkkých tkání. Rychlá diagnostika a zahájení léčby jsou nejlepší prevencí žilní gangrény, amputace končetiny a smrti nemocného (obr. 7–9).
LÉČBA
Celkový závažný stav vyžaduje klid na lůžku s elevací postižené končetiny. K zprůchodnění cévního řečiště se používá antikoagulace hepariny, trombolýza a chirurgická trombektomie.
4.2.5 Posttrombotický syndrom
Jedná se o chronický stav, který se během 1–2 let rozvíjí u 20–50% pacientů po symptomatické flebotrombóze (Kahn, 2004). Patofyziologickým podkladem je ambulantní žilní hypertenze v důsledku sekundární chlopenní žilní nedostatečnosti a/nebo zbytkové žilní obstrukce. Nejzávažnější klinické projevy mají nemocní, u kterých se kombinuje chlopenní žilní insuficience s žilní obstrukcí.
Klinicky je syndrom charakterizován chronickou bolestí, otokem a trofickými změnami kůže a podkoží postižené končetiny. U čtvrtiny až třetiny nemocných se objevuje chronický žilní vřed.
Pro diagnostiku posttrombotického syndromu má význam přítomnost klinických projevů, flebotrombóza v anamnéze a ultrasonografický průkaz žilní insuficience (chlopenní dysfunkce) a/nebo obstrukce.
Léčebné možnosti jsou zde omezené, spočívají v podstatě v nošení kompresivních punčoch a podávaní venofarmak.
4.3 Diagnostika žilních onemocnění
4.3.1 Klinická diagnostika žilních onemocnění – anamnéza
V klinické praxi se nejčastěji setkáme s žilní insuficiencí a žilní trombózou. Žilní malformace a aneuryzmata jsou vzácné. Žilní trombóza se může vyskytnout v jakémkoliv věku, ale v dětství je u zdravých jedinců extrémně vzácná. U mladých žen vzniká žilní trombóza nejčastěji v souvislosti s užíváním hormonální antikoncepce.Trombóza povrchových (podkožních, epifasciálních) žil je častá na dolních končetinách, zejména pokud pacient trpí varixy (varikoflebitida). Na horních končetinách je tromboflebitida vzácná, většinou iatrogenně podmíněná, objevující se po kanylaci žíly. Spontánní tromboflebitidy mohou ohlašovat maligní onemocnění, trombofilii nebo systémová onemocnění.
- rodinná anamnéza
Klíčem rodinné predispozice ke vzniku flebotrombózy jsou údaje o amputacích končetin (flegmazie),opakovaných potratech a předčasných porodech,o náhlých úmrtích ve věku do 50 let, o výskytu flebotrombózy u dalších členů rodiny, zejména potom opakované flebotrombózy a žilní uzávěry v atypických oblastech (žíly horních končetin, viscerální žíly, mozkové splavy). - Osobní anamnéza
Tady jsou důležité údaje o prodělaných erysipelech,operacích a úrazech dolních končetin, tromboflebitidách a flebotrombózách. - Léková anamnéza
Ptáme se na intravenózní aplikaci léčiv, zejména hyperosmolárních roztoků (chemická iritační tromboflebitida a flebotrombóza), na užívání hormonální antikoncepce či substituční hormonální léčby, psychiatrických léků (antipsychotika, anticholinergika). - Pracovní anamnéza
Je důležitá u žilních onemocnění dolních končetin. Žilní insuficience se vyskytuje častěji u profesí,které většinu času tráví vsedě nebo vestoje – zubaři, prodavačky, kadeřnice, holiči, číšníci, řidiči,pokladní, skladníci atd. Zaměstnání nebo sportys velkou fyzickou zátěží horních a dolních končetin(řezníci, dělníci) predisponují ke vzniku žilní trombózy dolních končetin nebo flebotrombózy namáhané horní končetiny (námahová flebotrombóza,effort thrombosis).
4.3.2 Klinické projevy žilních onemocnění
Mezi hlavní klinické projevy žilních onemocnění patří otok, barevné změny kůže v místě otoku, lo kální bolestivost (spontánní, palpační nebo náma hová) a na dolních končetinách pocity tíhy, únavy, bolesti a noční svalové křeče. U konkrétního pacienta nemusí být nutně současně vyjádřeny všechny symptomy. Jindy žilní onemocnění probíhá zcela asymptomaticky či s nespecifickými projevy.
- Fyzikální (objektivní) vyšetření končetin Nejjednodušeji a nejspolehlivěji lze získat objektivní informaci o postižené končetině pohledem a pohmatem a jejím srovnáním s kontralaterální končetinou. Dolní končetiny musíme vyšetřit vleže i vestoje.
- Pohledem zjišťujeme: otok, hypertrofii, změny barvy, přítomnost podkožních žilních kolaterál, jizvy a místa vpichů, známky proběhlého traumatu, zavedení žilních kanyl, kožní exkoriace a trofické změny.
- Pohmatem zjišťujeme: teplotu končetiny nebo jejích částí, citlivost v průběhu postižené podkožní žíly, v nadklíčkové jamce nebo v axile, zvětšení lymfatických uzlin (příčina zevní žilní obstrukce, známka zánětu kůže a podkoží), hmatné tuhé podkožní žíly po proběhlé tromboflebitidě, přítomnost pulzací na zvyklých místech nebo naopak abnormální pulzace (arteriovenózní píštěle, cévní malformace), přítomnost edému.
- Průběh podkožních žil, zejména pokud jde o kmenovou insuficienci velké a malé safeny, lze ověřit lehkým přímým poklepem. Perkuzí na varix při současné lehké palpaci druhou rukou nad nebo pod místem poklepu lze vystopovat jeho průběh. Tento manévr je vhodný zejména u obézních osob, kde nejsou podkožní žíly viditelné.
- Auskultací pátráme po šelestech (arterio-venózní píštěle, cévní malformace).
Při vyšetření jednostranného otoku horní končetiny nesmíme zapomenout na pohmat axily k vyloučení lymfadenopatie a u žen na mamologické vyšetření. - Žilní otok
Otok je nahromadění intersticiální tekutiny (tkáňového moku) v mezibuněčném vazivovém prostoru (intersticiu), tj. v extracelulárním a extrakapilárním (extravazálním) kompartmentu. V případě žilního otoku je důvodem hromadění intersticiální tekutiny nadměrná filtrace plazmy z krevních kapilárdo intersticia při zvýšeném intrakapilárním hydrostatickém tlaku. Příčinou je městnání žilní a kapilární krve a/nebo vazodilatace. Volná (nebuněčná)tekutina se hromadí v kůži a podkoží.
DIFERENCIÁLNÍ DIAGNOSTIKA ŽILNÍHO OTOKU
Při podezření na žilní otok musíme vyloučit některé další patologické stavy, které jej mohou napodobovat:
- Lipedém je běžné, zato velmi zřídka diagnostikované postižení dolních končetin, vyskytující se téměř výhradně u žen. Je zaměňován za obezitu, často ho ale gynoidní typ obezity (hýždě, stehna) provází. Tuková podkožní tkáň lipedému symetricky obaluje obě dolní končetiny od třísel po kotníky, většinou je přítomný také lymfedém. Vynechává nárty nohou, kde není podkožní tuková tkáň. Pokud se objeví otok nártu, jde o projev přidruženého lymfedému. Charakteristickými vlastnostmi lipedému jsou spontánní bolestivost, bolestivost při tlaku rukou nebo ultrazvukovou sondou, zejména na mediální straně stehen, a tendence k častým podkožním hematomům. Nelze v něm vytlačit důlek jako při nahromadění intersticiální tekutiny, ale jsou patrné drobné dolíčky, zejména na stehnech. Je to projev lipodystrofie, místní drobné nepravidelnosti a úbytku tukové tkáně a kolagenního podkožního vaziva, nesprávně označované jako celulitida.
- Myxedém vzniká při hypotyreóze zduřením koriových vláken a nahromaděním mukoidních hmot v podkoží. Je tuhý, kůže na povrchu je suchá, hrubá a nažloutlá. Postihuje obličej, kůži na hřbetu rukou a nohou. Na ventrální a laterální straně bérce se objevuje ohraničený pretibiální myxedém. Rozsahem bývá velký asi jako dlaň, ale někdy může sahat až na hřbet nohy.
- Hypertrofie podkožní tkáně – postihuje asymetricky jednu dolní končetinu nebo její část (noha, prsty) u Klippelova-Trenaunayova syndromu a Parkesova-Weberova syndromu. Může imitovat otok, zejména v kombinaci s varixy, atypickými podkožními žílami a difuzními kapilárními malformacemi, které se zde vyskytují.
- Lymfedém – postihuje především akrální části horní a dolní končetiny (prsty, nárty, kotníky, dorzum ruky) a šíří se proximálně. Ostatní části těla jsou postižené zřídka. Může se objevit na jedné nebo na obou dolních končetinách (tab. 1 a 2), na horních končetinách je jednostranný (stavy po ablaci prsu s následnou radioterapií). V časných stadiích ho při klinickém vyšetření nelze odlišit od žilního otoku. Je měkký, lze do něj vytlačit důlek, je reverzibilní, do rána ustupuje nebo zcela mizí. Od žilního otoku se začíná odlišovat až po několika týdnech nebo měsících, kdy je tuhý, bledší než okolní kůže, chladnější, spontánně a na tlak nebolestivý, je zcela ireverzibilní, během noci neustupuje, nemění se.
- Angioneurotický edém (Quinckeho edém) – vzniká působením určitého alergenu. Rozvíjí se rychle a recidivuje. Nejčastěji postihuje tváře, víčka a rty, méně často končetiny.
| Oboustranné otoky dolních končetin | |
| Otok | Příčina |
| Statický („fyziologický“) | imobilizace a vyřazení žilně-svalové pumpy lýtka |
| Těhotenský a premenstruační | zadržování sodíku + zvýšená kapilární propustnost pro bílkovinu |
| Alergický (Quinckeho) | dilatace arteriol a prekapilárních svěračů + venokonstrikce + zvýšení kapitární propustnosti působením alergenu |
| Polékový (iatrogenní) | různý mechanismus podle druhu léku |
| Srdeční | snížení srdečního výdeje + neurohumorální změny + zadržení vody a minerálů |
| Ledvinný | zadržení vody a minerálů, hypoproteinemie |
| Jaterní | periferní vazodilatace + neurohumorální změny |
| Hypoproteinemický (hypoalbuminemie, anémie) | pokles onkotického tlaku plazmy |
| Žilní | porucha žilně-svalové pumpy, žilní hypertenze |
| Primární lymfatický | porucha vývoje lymfatických cév + asymptomatický zánět? Lipedém nahromadění tukové tkáně v podkoží při gynoidní obezitě |
| Oboustranné otoky dolních končetin | |
| Otok | Příčina |
| Statický („fyziologický“) | imobilizace a vyřazení žilně-svalové pumpy lýtka |
| Těhotenský | zadržování sodíku + zvýšená kapilární propustnost pro bílkovinu |
| Alergický (Quinckeho) | dilatace arteriol a prekapilárních svěračů + venokonstrikce + zvýšení kapilární propustnosti působením alergenu |
| Polékový (iatrogenní) | různý mechanismus podle druhu léku |
| Srdeční | snížení srdečního výdeje + neurohumorální změny + zadržení vody a minerálů |
| Ledvinný | zadržení vody a minerálů, hypoproteinemie |
| Jaterní | periferní vazodilatace + neurohumorální změny |
| Hypoproteinemický (hypoalbuminemie, anémie) | pokles onkotického tlaku plazmy |
| Žilní | porucha žilně-svalové pumpy, žilní hypertenze |
| Primární lymfatický | porucha vývoje lymfatických cév + asymptomatický zánět? Lipedém nahromadění tukové tkáně v podkoží při gynoidní obezitě |
| Jednostranné otoky dolních končetin | |
| Otok | Příčina |
| Flebotrombóza | ucpání hlubokých žil dolní končetiny |
| Tromboflebitida | zánět a ucpání podkožních žil dolní končetiny |
| Posttrombotický syndrom | obstrukce + reflux v hlubokých žilách dolní končetiny vznikající po prodě- lané flebotrombóze |
| Lymfatický | nedostatečný vývoj periferních lymfatických cév a uzlin = vrozený lymfatický otok, poškození periferních lymfatických cév a uzlin = sekundární lymfatický otok, porucha vývoje lymfatických cév + asymptomatický zánět? = primární lymfatický otok |
| Žilní | porucha žilně-svalové pumpy, žilní hypertenze |
4.3.3 Laboratorní diagnostika žilních onemocnění
DIAGNOSTIKA ŽILNÍ INSUFICIENCE
Žilní insuficienci lze diagnostikovat pouze na základě klinického vyšetření – anamnézy a objektivního fyzikálního nálezu.
Důvodem ultrazvukového vyšetření v této fázi mohou být:
- netypické subjektivní potíže,
- nevýrazný objektivní nález,
- zvažování jiné příčiny otoků dolních končetin, zejména u symetrických otoků, u obézních a polymorbidních pacientů (např. srdeční, jaterní a ledvinná onemocnění),
- podezření na spolupodíl dalších lokálních faktorů kromě žilní insuficience, které by mohly vyvolávat subjektivní potíže v oblasti dolních končetin(Bakerova cysta při gonartróze, tromboflebitida,flebotrombóza, podkožní nádory, zvětšené lymfatické uzliny, cysty, výpotky, hematomy atd.),
- podezření na vrozené žilní malformace.
Ultrazvukové vyšetření žil dolních končetin je nutné před každou plánovanou invazivní léčbou žilní insuficience, včetně skleroterapie. Chirurgická léčba varixů dolních končetin se v posledních letech změnila. Již se běžně neprovádí totální striping velké safeny jako univerzální operační postup. Základním principem je eliminace patologického refluxu z hlubokého do povrchového žilního systému a odstranění inkompetentních žilních úseků (Herman, 1999). Aby mohla být provedena operace takto cíleně, je třeba určit místa insuficience.
DIAGNOSTIKA FLEBOTROMBÓZY
Pokud mluvíme o diagnostice flebotrombózy, máme na mysli především flebotrombózu dolních končetin a kyčelních žil. Flebotrombóza však může postihovat kteroukoliv část žilního řečiště.
Klinická diagnóza hluboké žilní trombózy je značně zatížená subjektivním hodnocením postižené končetiny konkrétním lékařem a senzitivita klinického vyšetření, bez použití laboratorních vyšetření, zřejmě nepřekračuje 25–30 %. Spolehlivá diagnostika pouze na základě anamnézy a fyzikálního vyšetření je často nemožná nebo pochybná. Vždy se musíme opřít o pomocná laboratorní vyšetření.
Současné laboratorní diagnostické metody k průkazu flebotrombózy můžeme rozdělit na nepřímé a přímé. Nepřímé diagnostické metody nezobrazují trombus v žilním řečišti, pouze nepřímo ukazují na jeho možnou přítomnost. Patří sem vyšetření D-dimérů a fibrin degradačních produktů v krevní plazmě a impedanční pletyzmografie. Přednost se dává přímým zobrazovacím metodám, které umožňují lékaři přímo vidět trombus v žíle, posoudit rozsah trombózy a stupeň obliterace žilního lumen.
- Nepřímé diagnostické metody
- Impedanční pletyzmografie (IPG)
Impedanční pletyzmografie je neinvazivní vyšetření původně vyvinuté NASA pro měření impedance hrudníku při srdeční akci, založené na snímání malých změn elektrického odporu těla. Elektrický odpor tkání se mění podle aktuálního obsahu krve. V dolní končetině se přitrombóze objem krve zvětšuje a elektrický odporklesá a nepřímo tak indikuje přítomnost žilní trombózy. Při vyšetření se nafoukne pneumatická manžeta kolem stehna tak, aby byl zcela přerušený žilní tok při zachování tepenného průtoku, takže žilní tlak v končetině stoupne na tlak v manžetě. Při vyfouknutí pneumatické manžety začne žilní krev z končetiny rychle odtékat, dokud není dosaženo klidového (výchozího) krevního objemu. Při žilní trombóze se tato reakce na přechodnou žilní obstrukci charakteristicky změní. Nárůst objemu krve v postižené končetině po nafouknutí manžety bude menší než ve zdravé končetině a také vyprazdňování žilního systému po uvolnění turniketu bude pomalejší. To se odrazí v menším počátečním poklesu a následném pomalejším vzestupu impedance.S nástupem ultrazvukových vyšetřovacích metod ztratila IPG v diagnostice flebotrombózy svůj význam. - D-diméry
Představují konečný produkt degradace fibrinové mřížky. Vznikají proteolýzou fibrínu působením plazminu. Zvýšené hladiny D-dimérů svědčí o aktivaci zevního a vnitřního systémukoagulace a také fibrinolýzy.Stupeň zvýšení D-dimérů odráží rozsah trom-bózy, trvání příznaků a použití antikoagulačníléčby. Vysoká hladina Ddimérů svědčí provětší rozsah trombózy, krátké trvání klinických příznaků bez aplikace antikoagulancia. Nízká hladina D-dimérů je naopak známkou malého rozsahu trombózy, dlouhého trvání klinických příznaků a podání antikoagulancia. D-diméry mají vysokou negativní prediktivní hodnotu, jsou senzitivním, ale nespecifickým vyšetřením, proto se používají k vyloučení tromboembolické nemoci.
- Impedanční pletyzmografie (IPG)
- Přímé diagnostické metody
- Rentgenová venografie (flebografie, digitální subtrakční flebografie)
Jejími nevýhodami jsou invazivnost (kanylace podkožní žíly na bérci nebo na noze), cena, rizika spojená s intravenózní aplikací jodové kontrastní látky (lokální dráždění, celková alergická reakce, vznik iritační tromboflebitidy nebo renálního selhání), radiační zátěž a nepohod lípro pacienta i lékaře. Dnes se většinou používá v kombinaci s trombolytickou léčbou. Kontrastní látka se při flebografii aplikuje do žilního řečiště přímou punkcí žíly nebo katétrem.
Přímou punkcí a aplikací kontrastní látky jehlou do žilního systému se vyšetřuje žilní systém horních i dolních končetin.Hluboký žilní systém dolních končetin se vyšetřuje dvojím způsobem, a to ascendentní nebo descendentní flebografií. Ascendentní flebografie se provádí aplikací kontrastní látky do oblasti povrchových žil palce nebo dorza nohy. Do hlubokého žilního systému se tok kontrastní látky směruje zaškrcením povrchových žil ve výši talokrurálního kloubu. Je tak možné dobře zhodnotit průchodnost hlubokého žilního systému,homogenitu náplně žil i funkci jejich chlopenního aparátu a funkci perforátorů. Při descendentní flebografii se kontrastní látka aplikuje do femorální žíly a sleduje se, zda je zadržována chlopněmi nebo protéká retrográdně přes nedomykavé chlopně. Pokud je potřeba zobrazit žilní systém ve většívzdálenosti od obvyklých míst punkce žilního systému, provádí se flebografie katetrizačně Seldigerovou technikou. Přístupovým místem pro flebografii je v. femoralis, v. jugularis interna nebo v. mediana cubiti. Touto technikou sevyšetřují kyčelní žíly, horní a dolní dutá žíla (kavografie) a jejich přítoky.Žilní systém horních končetin se vyšetřuje vpichem do žíly na dorzu ruky, případně vpichem do co nejperifernější povrchové žíly. Je možné zhodnotit jak hluboký, tak povrchový žilní systém horní končetiny včetně centrálního žilního výtokového traktu. - Radioizotopové vyšetřovací metody
Radioizotopy se v diagnostice flebotrombózy používají dvěma způsoby. Prvním je radioizotopová venografie, obdoba rentgenové venografie, kdy se do žíly na noze aplikuje makroagregát albuminu (MAA) značený techneciem. Druhým způsobem využití radioizotopů je přímá vizu alizace trombu značenými trombocyty nebo fibrinogenem. Trombocyty značené techneciem 99m mají 80–90 % pozitivní prediktivní hodnotu. - Ultrazvukové vyšetření
Od poloviny 80. let 20. století se v diagnostice flebotrombózy začala používat ultrasonografie (tzv. kompresní ultrazvuková metoda). Je to metoda s vysokou senzitivitou a specificitou. - CT flebografie
Ve srovnání s magnetickou rezonancí jde o rychlejší a levnější vyšetření. Jeho výhodou je také současné zobrazení patologických procesů(kalcifikované granulomatózní lymfatické uzliny) nebo metastáz komprimujících postižené kyčelní žíly. CT flebografii lze s výhodou kombinovat s CT plicní angiografií k vyloučení plicní embolie. Hlavními nevýhodami jsou radiační zátěž a aplikace jodové kontrastní látky (alergie na jód, renální insuficience). - Magnetická rezonance (MrI – magnetic resonance imaging) a magnetická rezonanční venografie (MrV – magnetic resonance venography) MR je stejně jako CT využívána k diagnostickému zobrazování především centrálních žil, portálního řečiště a u onemocnění žilního systému CNS. Primární indikací je proto vyšetření pánevního žilního řečiště, kde je MR senzitivnějším vyšetřením než ultrazvuk a diagnostika trombózy mozkových žilních splavů. MR je také preferována, pokud chceme zjistit přesný rozsah žilního trombotického postižení. Ve srovnání s CT vyšetřením není MRI zatížena artefakty vyvolanými krevním prouděním.
- Rentgenová venografie (flebografie, digitální subtrakční flebografie)
DIAGNOSTIKA PERIFERNÍCH ŽILNÍCH MALFORMACÍ
U vrozených cévních malformací je z hlediska následné léčby zásadní rozlišit nízkoprůtokové malformace od vysokoprůtokových (s arteriální složkou). Dále je potřeba určit lokalizaci, rozsah a vztah k okolním strukturám a orgánům.
Vyšetření dopplerovskou ultrasonografií je levné a dostupné. Dobře rozliší nízkoprůtokové a vysokoprůtokové léze. Magnetická rezonance je základní vyšetřovací metodou, která rozliší nízkoprůtokové malformace od vysokoprůtokových a velmi dobře zobrazí lokalizaci a rozsah léze, její vztah k okolním strukturám a orgánům (Fayad, 2006, Yakes, 2008). Digitální subtrakční angiografie je dnes součástí léčebných výkonů.
| Tabulka 1 Přehled používaných venofarmak |
|
| 1. VENOFARMAKA NA BÁZI PŘÍRODNÍCH LÁTEK | |
| Účinná látka | Název léku |
| Aescin – výtažek s kaštanu koňského – jírovec maďal (Aesculus hippocastanum) | Aescin-Polfa tbl. 20 mg Aescin-Teva tbl. 20 mg Yellon cps. 20 mg |
| Aescin + anthokyanosidy z borůvek + výtažek z listnatce bodlinatého (Ruscus aculeatus) + výtažek z gotu kola (Centella asiatica) |
Varixinal tbl. |
| Flavonoidy (bioflavonoidy, bioflavonoidní glykosidy, vitamin P) | |
| Rutin – výtažek z brazilské bobokvěté rostliny (Dimorphandra mollis) | |
| Rutin (+ vitamin C) | Ascorutin tbl. |
| Rutin (+ aescin + dihydroergokristin) | Anavenol tbl. |
| Rutin (+ hesperidin + vitamin C) | Cyklo 3 Fort |
| Kvercetin – výtažek z červených listů vinné révy (Vitus viniferae) | Antistax cps. 180 mg |
| Hesperidin – výtažek z oplodí pomerančů Hesperidin (+ diosmin = dehydrohesperidin – syntetický derivát hesperidinu) |
Detralex tbl |
| 2. VENOFARMAKA NA BÁZI POLYSYNTETICKÝCH LÁTEK | |
| Rutosidy (vznikají chemickou modifikací přírodního rutinu) | |
| Troxerutin = oxerutin (hydroxyethylrutosid) | Cilkanol cps. 300 mg Venoruton cps. 300 mg Venoruton F cps. 500 mg |
| Troxerutin (+ heptaminol + ginkgo biloba) | Ginkor Fort cps. |
| 3. VENOFARMAKA NA BÁZI SYNTETICKÝCH LÁTEK | |
| Dobesilát vápenatý (sůl kyseliny dihydroxybenzensulfonové) |
Doxium tbl. 500 mg Danium tbl. 250 mg Dobica tbl. 250 mg |
| Heptaminol (+ troxerutin + ginkgo biloba) | Ginkor Fort cps. |
Nízkoprůtokové žilní malformace na prostém snímku tvoří měkkotkáňovou expanzi případně s flebolity a abnormalitami skeletu. Flebolity jsou pro žilní malformace patognomonické (Dubois, 2001).
4.4 Léčba žilních onemocnění
4.4.1 Konzervativní léčba – venofarmaka
Venofarmaka jsou přírodní, polosyntetické nebo syntetické látky používané v léčbě žilních onemocnění (tab. 1). Jejich léčebný účinek je založený na protizánětlivém, antioxidačním, antiedematózním a proteolytickém působení ve tkáních, na snižování propustnosti stěny kapilár a na zvyšování tonu stěn žil a lymfatických cév. Od farmakologické léčby lze očekávat úlevu od subjektivních potíží spojených s žilní insuficiencí (pocity napětí, tlaku a bolesti) a ústup otoků dolních končetin. Venofarmaka nepředstavují prevenci rozvoje varixů, trofických změn kůže a podkoží nebo prevenci žilní trombózy, povrchové nebo hluboké.
4.4.2 Antikoagulační léčba
Antikoagulační léčba je od čtyřicátých let 20. století primární léčbou tromboembolické nemoci a svou významnou roli od devadesátých let 20. století hraje také ve farmakoterapii tromboflebitidy. U tromboembolické nemoci při včasném nasazení snižuje riziko plicní embolie, brání šíření trombózy a snižuje pravděpodobnost její recidivy. Antikoagulancia jsou podávána celkově intravenózně, subkutánně nebo perorálně. V současné klinické praxi se v antikoagulační léčbě používají hepariny, antagonisté vitaminu K (perorální antikoagulancia), přímé inhibitory trombinu (syntetické deriváty hirudinu /lepirudin, bivalirudin, desirudin/, argatroban a gatrany) a přímé inhibitory aktivovaného faktoru X (rivaroxaban, apixaban, otamixaban).
HEPARINY
Heparin je směs polysacharidů, přírodní antikoagulační látka, produkována některými živočišnými tkáněmi, bílými krvinkami (bazofilní leukocyty) a mastocyty (žírné buňky, heparinocyty).
Nefrakcionovaný heparin obsahuje sacharidové polymery (polysacharidy) s molekulovou hmotností 5000–35 000 daltonů (průměrně 13 000–20 000 D). Funguje jako nepřímý neselektivní inhibitor trombinu a aktivovaného faktoru X.Léčba je zahajována úvodní nitrožilní aplikací bolusu (5000–10 000 j.) a pak následuje kontinuální podávání, nejčastěji v dávce 20 000–40 000 j./24 hod. infuzní pumpou nebo injektorem. Účinnost léčby je kontrolována stanovením aPTT (prodloužení aPTT1, 5–2krát proti kontrole). Současně s podáváním heparinu zahajujeme perorální antikoagulační léčbu warfarinem. Heparin je vysazen při dosažení INR2–3 ve dvou po sobě následujících dnech. Antidotem heparinu je protamin sulfát, který je podáván jen při masivním krvácení v dávce 1 mg na 100 j. heparinu aplikovaných v posledních 8–12 hodinách. Při léčbě heparinem se mohou asi u 1 % nemocných vytvořit protilátky proti destičkám s následným rozvojem trombocytopenie. Po 2–7 dnech léčby se proto doporučuje kontrola počtu trombocytů a při jejich poklesu pod 100.109/l je nutné heparin zaměnit za perorální antikoagulancia nebo jiné inhibitory trombinu. V současnosti je nefrakcionovaný heparin nahrazován nízkomolekulárními hepariny (LMWH).Nízkomolekulární hepariny (LMWH, Low Molecular Weight Heparins) jsou heparinové frakce (produkty enzymového štěpení standardního heparinu) o průměrné molekulové hmotnosti 3500–5000 daltonů, které inaktivují zejména faktor Xa a jen málo trombin (f. II). Lze je podávat ve fixní dávce podle tělesné hmotnosti, většinou bez laboratorního monitorování. Jsou účinnější a bezpečnější než nefrakcionovaný heparin, podávaný podle aktuálních hodnot aPTT. Mezi výhody LMWH patří nižší riziko krvácení, menší protidestičková aktivita (souvisí s nižším rizikem krvácení) (tab. 2 a 3). Rozdíly mezi jednotlivými LMWH spočívají především v různé molekulové hmotnosti a z toho vyplývajících rozdílů ve farmakodynamice a farmakokinetice. Terapeutické dávkování je u každého preparátu různé a závisí na hmotnosti nemocného (tab. 4). Úprava dávkování a monitorování plazmatické antiXa aktivity jsou potřebné u pacientů s tělesnou hmotností pod 40 kg nebo nad 150 kg, u těhotných žen (tab. 5) a nemocných s renálním selháním. Pro sekundární profylaxi tromboembolické nemoci u pacientů s nádorem v jakémkoliv stadiu onemocnění je dlouhodobé podávání fixní dávky LMWH efektivnější a bezpečnější než podávání warfarinu. Optimální délka léčby zatím není jasná, ale pacienti s aktivním nádorem jsou pacienti se získanou trombofilií, a proto je u nich většinou doporučována trvalá léčba.
| Tabulka 2 Hepariny |
|
|
Tabulka 3 |
|
| Tabulka 4 Dávkování nejčastěji používaných LMWH v ČR |
||
| Účinná látka (přípravek) | Dávkování (antiXa aktivita) | Dávkování (mg nebo ml/kg) |
| Enoxaparin (Clexane) | 100 IU/kg 2× denně s.c. | 1 mg/kg 2× denně s.c. |
| Enoxaparin (Clexane Forte) | 150 IU/kg 1× denně s.c. | 1,5 mg/kg 1× denně s.c. |
| Nadroparin (Fraxiparine) | 95 IU/kg 2× denně s.c. | 0,1 ml/10 kg 2× denně s.c. |
| Nadroparin (Fraxiparine Forte) | 190 IU/kg 1× denně s.c. | 0,1 ml/10 kg 1× denně s.c. |
| Dalteparin (Fragmin) | 100–120 IU/kg 2× denně s.c. | 0,1 ml/10 kg 2× denně s.c. |
| (Broulíková, 2008) | ||
| Tabulka 5 Doporučené dávkování LMWH u těhotných žen podle tělesné hmotnosti a rizika TEN |
||||
| LMWH | Tělesná hmotnost | |||
| pod 50 kg | 50–90 kg | nad 90 kg | velmi vysoké riziko TEN | |
| Enoxaparin | 20 mg/den | 40 mg/den | 40 mg/12 hod. | 0,5–1,0 mg/kg/12 hod. |
| Dalteparin | 2500 U/den | 5000 U/den | 5000 U/12 hod | 0–100 U/kg/12 hod. |
| Tinzaparin | 3500 U/den | 4500 U/den | 500 U/12 hod. | 4500 U/12 hod. |
| (Marik, 2008) | ||||
ANTAGONISTÉ VITAMINU K (PERORÁLNÍ ANTIKOAGULANCIA)
Existují dva typy antagonistů vitaminu K, kumariny (deriváty dikumarolu) a indanediony. Působí v játrech jako antagonisté vitaminu K, kde antagonizují syntézu koagulačních faktorů závislých na vitaminu K (II, VII, IX, X). Již vytvořené koagulační faktory nejsou ovlivněny, proto antikoagulační účinek plně nastupuje s latencí, která je závislá na rychlosti přirozeného zániku těchto faktorů (u warfarinu za 4–5 dnů). Deriváty dikumarolu mají úzké terapeutické rozmezí a četné lékové i dietní interakce. Při jejich léčbě jsou nutná dietní opatření a opakované monitorování protrombinového času (Quickův test) nebo lépe INR (International Normalized Ratio – poměr protrombinového času pacienta ke kontrolnímu normálu používajícímu mezinárodní referenční preparát). Cílem podávání warfarinu je INR mezi 2 a 3.Perorální antikoagulancia jsou absolutně kontraindikována u těžké nekontrolované arteriální hypertenze, netromboembolické CMP, u aktivní peptické ulcerace, při těžké jaterní nebo ledvinové nedostatečnosti, u preexistujících defektů hemostázy a u nespolupracujících pacientů. Pro svou teratogenitu a nebezpečí fetálního krvácení nesmějí být použity také v těhotenství.
PŘÍMÉ INHIBITORY TROMBINU
- Syntetické deriváty hirudinu (lepirudin, desirudin, bivalirudin)
Extrakt se slin pijavky lékařské (Hirudo medicinalis) brání srážení krve díky peptidu hirudinu, Přímému ireverzibilnímu inhibitoru trombinu.
Hirudin sám nemohl být v humánní medicíně prosvou toxicitu nikdy využitý. Ke slovu přišly až jeho syntetické deriváty lepirudin, bivalirudin, desirudin, jejichž působení může být monitorováno pomocí aPTT. Jsou vylučovány ledvinami, proto jenutná opatrnost při renální insuficienci. Lepirudin (Refludan) se používá pro léčbu HIT a spolu s kyselinou acetylsalicylovou u akutního koronární-ho syndromu. Desirudin (Revasc) ke krátkodobé tromboprofylaxi při totální endoprotéze kyčelní-ho kloubů ve 20 evropských zemích a bivalirudin(syntetický polypeptidový analog hirudinu) je schválený FDA (US Food and Drug Administration) u pacientů po PTCA (perkutánní transluminární koronární angioplastika) pro akutní koronární syndrom. - Argatroban
Tento nízkomolekulární derivát argininu se neko-valentně váže na aktivní místo trombinu, s nímžvytváří reverzibilní komplex. Plazmatický poločas argatrobanu je 45 minut a lék je metabolizován játry, proto musí být u onemocnění jater podáván s velkou opatrností. Naopak bezpečně ho lze použít u renální insuficience. Indikací argatrobanu je HIT. - Gatrany
Z této skupiny přímých reverzibilních inhibitorů trombinu se v běžné klinické praxi zatím používá dabigatran etexilát (Pradaxa).
PŘÍMÉ INHIBITORY AKTIVOVANÉHO FAKTORU X (XABANY )
Aplikují se buď perorálně (rivaroxaban, apixaban) nebo parenterálně (otamixaban). Jejich předností je vysoká selektivita pro aktivovaný faktor X (f. Xa) a podávání jednou nebo dvakrát denně. Další výhodou je duální vylučování močí i stolicí. Rivaroxaban (Xarelto) v dávkovém rozmezí 5–20 mg denně prokázal v profylaxi tromboembolické nemoci u ortopedických pacientů stejný terapeutický a krvácivý potenciál jako enoxaparin.
HEPARINEM VYVOLANÁ TROMBOCYTOPENIE (HIT = HEPARIN-INDUCED THROMBOCYTOPENIA)
Heparinem vyvolaná trombocytopenie (HIT) je závažným nežádoucím účinkem heparinu s velkým rizikem vzniku trombotických komplikací. Příčinou je tvorba autoprotilátek proti heparinové molekule, která vede k aktivaci trombocytů a tvorbě trombinu. Přestože se protilátky proti heparinu tvoří u 10–20 % pacientů léčených heparinem, u většiny z nich nikdy nevznikne HIT. Protilátky jsou přechodné a z cirkulace vymizí průměrně během 85 dnů po ukončení léčby.
Diagnóza spočívá na klinických a laboratorních nálezech. Klinicky asi v 50 % případů vzniká nová akutní žilní trombóza. Arteriální trombóza je méně častá (uzávěry končetinových tepen, CMP, infarkt myokardu). Atypickými projevy mohou být kožní nekrózy (10–20 %), žilní končetinová gangréna a anafylaktická reakce (po bolusové dávce nefrakcionovaného heparinu). Trombocytopenie může předcházet nebo následovat klinické projevy. Počet trombocytů většinou klesá pod 50 % původních hodnot, v některých případech ale nemusí poklesnout pod 100 000 mm3. Pokles trombocytů v typických případech začíná 5–10 dnů od začátku podávání heparinu a pokračuje 2–4 dny. Jindy se trombocytopenie může objevit až po 20 dnech nebo naopak náhle, do 24 hodin od začátku podávání heparinu. Diagnózu HIT potvrdí průkaz protilátek proti heparinu (funkční testy – vyšetření uvolňování serotoninu, vyšetření heparinové aktivace trombocytů a vyšetření agregace trombocytů). Léčba spočívá v okamžitém vysazení heparinu (nefrakcionovaného i nízkomolekulárního) a v podávání přímých inhibitorů trombinu (lepirudin, bivalirudin, argatroban, dabigatran).
4.4.3 Chirurgická terapie
4.4.3.1 Chirurgie povrchových žil
Při terapii varixů dolních končetin je nutno vyjít z přesné diagnózy, jejímž základem je důkladné klinické vyšetření spolu s pečlivým odběrem anamnézy, podpořené vyšetřením duplexní sonografií a vzácně pak flebografií. Cílem chirurgické léčby je vyřazení patologického refluxu v epifasciálním žilním systému, případně přerušení inkompetentních perforátorů a resekce inkompetentních žilních úseků. Zásadní význam mají insuficientní ústí obou safen, ale téměř u 10 % nemocných je reflux přítomen v žilách přívodných a ne v kmenových. Počet insuficientních přívodných žil se pohybuje od jedné do pěti na jedné končetině. Nejčastěji je postižena v. arcuata posterior, poté v. saphena accessoria medialis a v. arcuata anterior. Tento reflux je přítomen bez insuficience vena saphena magna et parva (VSM, VSP), perforátorů i hlubokého žilního systému a může se vyvinout v kterékoliv véně bez zjevného zdroje. Při indikaci typu výkonu je třeba si uvědomit, že všechny tři systémy, tj. epifasciální, spojkový a hluboký, spolu souvisejí a tvoří funkční jednotku. Změny v jednom systému mají za následek změny v ostatních.
INDIKACE K CHIRURGICKÉ LÉČBĚ:
- subjektivní potíže nemocného,
- předejití komplikacím varixů,
- kosmetické hledisko,
- thrombophlebitis superficialis.
KONTRAINDIKACE:
- akutní hluboká žilní trombóza,
- zánětlivý proces kůže dolních končetin,
- gravidida,
- věk nad 70 let,
- těžké aterotrombotické změny tepen dolních končetin,
- všeobecné kontraindikace operace,
- (akutní tromboflebitida).
Akutní tromboflebitida je indikací k chirurgickému řešení tehdy, jedná-li se o flebitis VSM, která se propaguje k ústí do v. femoralis. Zde je nebezpečí embolizace.
PŘEDOPERAČNÍ PŘÍPRAVA
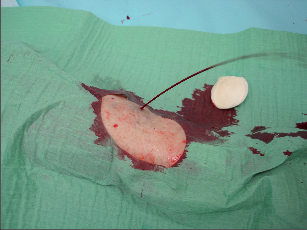
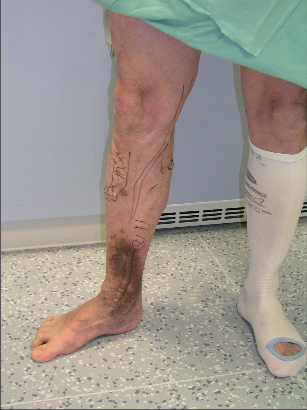
Před operací je pacientovi oholena celá operovaná končetina a oblast třísla. Vzhledem k tomu, že při holení vznikají drobná traumata s možností infekce, je pacient oholen těsně před operací. Poté operatér na stojícím nemocném nesmývatelnou tužkou označí varixy, neboť v horizontální poloze na operačním stole dojde ke kolapsu a vyprázdnění vén a ty již nejsou vidět. Peroperační vyhledání neoznačených vén také zhoršuje použití barevného dezinfekčního roztoku (obr. 10).
4.4.3.1.1 Striping VSM
Pacient je na operačním stole uložen v poloze na zádech. Provádíme toiletu operačního pole a jeho zarouškování s důrazem na oblast genitálu. Řez je veden v třísle, mediálně od hmatné pulzace femorální tepny, dostatečně vysoko, téměř v ohybové rýze, paralelně s ní. Je třeba se vyvarovat nízko uloženého řezu. Je nebezpečí ponechání větve safeny, která pak může být zdrojem recidivy. Velký význam má pečlivá preparace v třísle a podvaz všech větví bulbu. Je vhodné vypreparovat ústí safeny do v. femoralis, aby nedošlo k přehlédnutí eventuálně samostatně ústící větévky do femorální žíly. Myslíme i na řadu anatomických variant, zejména na tzv. H-variantu, kdy inguinální nebo abdominální vény komunikují se žílami stehna, aniž by ústily do hvězdice VSM. Po vypreparování velké safeny a ligatuře jejich přítoků je tato mezi dvěma peány proťata a centrální pahýl dvakrát ligován nevstřebatelným vláknem. Hovoříme o tzv. krosektomii (z franc. crosse – biskupská berla, kterou ústí VSM do VF připomíná). Název krosektomie se používá i pro výkon v oblasti vyústění VSP, i když zde je morfologie odlišná. Krosektomii musíme odlišit od vysoké ligatury VSM, při které jsou její větve ponechány. V praxi ale nejsou oba termíny důsledně rozlišovány.Provádíme-li totální striping, tj. odstraňujeme-li celou VSM, pronikneme lankem striperu až k vnitřnímu kotníku. Retrográdní pronikání může být obtížné, a někdy je proto vhodnější vyhledat počátek VSM před vnitřním kotníkem. Sondu pak zavádíme z periferie směrem do třísla.Průběh lanka striperu kontrolujeme palpačně i vizuálně, abychom se přesvědčili o jeho epifasciálním průběhu. Zejména při pronikání sondou z periferie směrem centrálním může dojít k jejímu sklouznutí do hlubokého žilního systému. Olivku pak hmatáme v třísle ve v. femoralis. Pokud bychom to přehlédli, mohlo by dojít k jejímu poranění. Striping VSM je vhodné provádět až na konec operace, tj. po odstranění uzlů a/nebo stripingu malé safeny, současně s naložením elastické bandáže od špiček prstů přes patu až po tříslo. Véna je stripována pomalým stálým tahem směrem kraniálním. Cílem tohoto postupu je zabránit tvorbě hematomu. Je samozřejmě možné stripovat směrem periferním.Upřednostňujeme limitovaný striping před odstraněním celé safeny, pokud je to možné. Z třísla retrográdně zavedeme sondu pod kolenní kloub. Zde z malé incize vyhledáme velkou safenu, protneme ji, periferní část ligujeme vstřebatelným materiálem a ponecháváme in situ, centrální stripujeme. Retrográdní pronikání sondou je obtížnější vzhledem k přítomnosti chlopní, po získání cviku ale nečiní větší potíže. Není-li přece jenom možné takto sondu zavést, pak je nutno velkou safenu vyhledat pod kolenem na ventromediální ploše bérce a zavést ji z periferie směrem centrálním.V distální části bérce má VSM intimní vztah k n. saphenus. Při stripingu může dojít k jeho traumatizacis následnou několikaměsíční až trvalou anestezií nebo parestezií v oblasti vnitřního kotníku. Limitovaný striping ponechává periferní nepostiženou VSM in situ, což má význam i pro případný rekonstrukční tepenný výkon v budoucnosti, neboť VSM je stále ideální materiál pro rekonstrukční výkony. Při limitovaném stripingu je vhodné vést řez pod kolenním kloubem. Z tohoto místa lze dobře odstranit uzly stehna i bérce Smetanovým nožem.Velké varikózní uzly se odstraňují z malých incizí, buď za použití Smetanova nože, nebo je možno použít více malých incizí s vědomím horšího kosmetického efektu a uzly exstirpovat pomocí peánů. Z jednoho řezu lze často získat přístup k více oblastem a vyvarovat se tak zbytečně mnoha incizí. Velké uzly a konvoluty lze touto technikou snadno odstranit, aniž by došlo k poškození jiných struktur. Exstirpovat velké uzly z jednotlivých incizí je kosmeticky méně příznivé. Kosmetické hledisko ale musí ustoupit při rozsáhlých varixech a již počínajících trofických změnách. Kožní řez má být tak velký, jak je nutné, a tak malý, jak je možné.
4.4.3.1.2 Striping VSP
Chirurgie VSP spočívá v krosektomii (i když není tento termín pro VSP zcela správný) a parciální nebo kompletní resekci kmene VSP. Striping malé skryté žíly se řídí stejnými pravidly jako striping velké. V blízkosti vyústění VSP do v. poplitea jsou a. poplitea a n. tibialis. Navíc zde mohou být variace vyústění VSP. Důležité je vysoké vyústění. Pokud je přehlédnuto, má za následek ligaturu umístěnou příliš nízko s ponecháním větví VSP, které pak mohou být zdrojem recidivy.Před operací je nutno zjistit typ ústí VSP. To můžeme provést až na operačním sále u pacienta ležícího na boku nebo na břiše s mírným sklopením stolu hlavou dolů. Po punkci větve VSP aplikujeme kontrastní látku a na obrazovce identifikujeme místo ústí VSP. Tento postup prodlužuje operaci a je zatěžující z hlediska radiační hygieny. Za vhodnější považujeme vyšetření duplexní ultrasonografií před operací, nejlépe operatérem.Výkon provádíme v poloze nemocného na břiše s mírně podloženou nohou v oblasti nártu, méně vhodná je poloha na boku. Je-li současně prováděn výkon i na VSM, pak operujeme v poloze na zádech s tím, že asistent elevuje končetinu a po celou dobu preparace ji drží v této poloze, nebo během operace pacienta obrátíme z polohy na zádech do polohy na břiše a zpět. Je nutná nová toileta operačního pole a přerouškování.
Vedeme příčný řez ve fossa poplitea, při vysokém ústí výše, dle předoperačního klinického a zejména ultrazvukového vyšetření. Příčně protneme fascii, pod kterou najdeme VSP. Tu protneme, provedeme ligaturu centrálního pahýlu a do periferního zavedeme striper, kterým pronikneme do poloviny bérce nebo až nad kotník. Je možný i postup obrácený, kdy z malé incize za zevním kotníkem vyhledáme počátek VSP. Vénu protneme, periferní pahýl uzavřeme jemnou vstřebatelnou ligaturou a do centrálního zavedeme striper, kterým pronikneme až do fossa poplitea. Zde nad hmatnou sondou vedeme příčnou incizi, vyhledáme ústí malé safeny do v.poplitea a malou skrytou žílu protínáme a ligujeme (obr. 11). Před suturou kůže uzavřeme fascii ve fossa poplitea.I při operaci VSP upřednostňujeme limitovaný striping, čímž se vyhneme poranění periferních nervů s následnými nepříjemnými paresteziemi v inervační oblasti n. suralis.
FLEBEKTOMIE Z MINIINCIZÍ
Techniku flebektomie z miniincizí propracoval dermatolog Muller. Používal jemné háčky, kterými z bodové incize zachytil vénu a luxoval ji do rány. Následně ji extrahoval za pomoci malého peánu. Incize mají velikost od 1 do 4 mm. Menší nejsou uzavírány vůbec, větší náplasťovým stehen. Tento postup redukuje perioperační trauma, a snižuje tak nároky na analgezii při i po operaci. Je prováděn v lokální anestezii, během výkonu bývá doporučována elevace dolních končetin nad úroveň srdce s cílem zajistit vyprázdnění žil. Kosmetický efekt je výborný. Na rozdíl od sklerotizace lze operovat i v takových oblastech, kde je sklerotizace riskantní, například v oblasti vnitřního kotníku nebo dorza nohy. Nevýhodou je časová náročnost. K takovému postupu je nutno mít vhodné instrumentárium (háčky dle Oesche, Rameleta, Tretbara, Mullera či Varadyho).
KRYOCHIRURGIE
Nepatří mezi rozšířené postupy. Při kryostripingu je kryosonda zavedena do kmene vény a působením chladu se stěna žíly nalepí na sondu, se kterou je následně invaginačním stripingem odstraněna (intraluminální kryostriping). U malých varixů lze k véně zavést sondu a aplikací chladu ji přerušit, fixovat k sondě a odstranit (extraluminální striping). K přednostem kryochirurgie patří bezkrevnost a možnost provedení i po předchozí sklerotizaci VSM. Vzhledem k tomu, že odpadají incize při distálním konci sondy a při odstraňování postranních větví, zkracuje se i doba operace a celková délka hospitalizace.
ENDOVASKULÁRNÍ METODY
Spočívají v termickém poškození vény s její následnou obliterací. Do vény se pod ultrazvukovou kontrolou zavede sonda, která vénu poškodí přeměnou radiofrekvenčního proudu (VNUS Closure) nebo světelného paprsku (endovenózní laser) v termickou energii.
4.4.3.1.3 Jednodenní a ambulantní chirurgie
Ne každý pacient je postižen velkými uzlovými varixy, které zasahují celou dolní končetinu a vyžadují pooperační hospitalizaci. Tam, kde je ze strany pacienta zájem a klinický nález to dovolí, lze od pobytu ve zdravotnickém zařízení upustit, nebo jej zkrátit. V rámci jednodenní chirurgie je pacient operován v nemocnici a je propuštěn v den operace nebo následující den, při ambulantní chirurgii nemá pacient k dispozici zázemí nemocnice.Veškerá předoperační vyšetření jsou provedena ambulantně, pacient přichází lačný a po označení varixů jde na operační sál. Výkon je prováděn v místní, spinální nebo celkové anestezii. Může být použit blok n. femoralis pro operaci na ventromediální ploše stehna nebo blok n. cutaneus femoris lateralis, který inervuje laterální stranu stehna. Celková anestezie je většinou indikována při stripingu VSM, i když i tento výkon lze provádět v lokální anestezii nebo za použití bloku n. femoralis. U endovenózních metod typu RF (radiofrekvenční) nebo laserové okluze je používána perivenózní tumescentní anestezie. V pooperačním období jsou sledovány oběhové parametry a operovaná končetina, nedochází-li k prosakování. Pacient je pak propuštěn podle rozsahu operace týž den, následující nebo i později. Operace varixů v rámci ambulantní či jednodenní chirurgie může mít mnoho variant a každé pracoviště si vytvoří vlastní postup.
4.4.3.1.4 Chirurgie perforátorů
Názory na význam perforátorů nejsou zcela jednotné a diskuze na toto téma se oživila s nástupem miniinvazivních postupů. Počáteční nadšení bylo postupně opuštěno a v současné době je patrná snaha o nalezení konsenzu v indikaci přerušení perforátorů. Na perforátory nelze nahlížet izolovaně, ale vždy v souvislosti s povrchovým a hlubokým žilním systémem. Základní podmínkou je vyšetření duplexní sonografií, která posoudí funkci chlopenního aparátu. Chlopenní nedostatečnost je příčinou refluxu, který je možno barevnou duplexní sonografií nejen zjistit, ale do jisté míry i kvantifikovat. Je-li přítomen typ postižení žilního systému, při kterém je indikováno přerušení perforátorů, pak metodou volby je dnes endoskopická varianta. Je všeobecně dostupná, není náročná na materiální vybavení a má příznivé výsledky. Zkracuje dobu hospitalizace a eliminuje sekundární hojení ran u pacientů v pokročilých stadiích chronické venózní insuficience.
POSTUPY UŽÍVANÉ K ELIMINACI PERFORÁTORŮ:
- Otevřená ligatura (modifikováno dle Cocketta)
- Endoskopická subfasciální disekce perforátorů –ESDP (Subfascial Endoscopic Perforator Surgery– SEPS, Endoscopic Subfascial Division of Perforating veins – ESDP, die endoskopische subfaszialeDiszision der Perforansvenen – ESDP)
- Sklerotizace
- Otevřená ligatura
Subfasciální disekci a ligaturu perforátorů poprvépopsal Linton v roce 1938 jako metodu vhodnouk léčbě pokročilých stadií chronické venózní insuficience. Provedl ligaturu v. femoralis superficialis,striping celé VSM, striping VSP od fossa poplitea až k zevnímu kotníku a subfasciální ligaturu všech vv.perforantes na bérci z dlouhého podélného řezu.
Výkon zakončil resekcí části fascie a jejím stehem.Linton podvazuje perforátory subfasciálně, Cockett extrafasciálně. Cockett vede dlouhý řez na mediální ploše distální třetiny bérce, za hranou tibiae.
Je-li přítomen ulcus cruris, tak jej exciduje. Celývýkon je extrafasciální. Tato metoda byla mnoha dalšími autory modifikována. Doddova modifikace spočívala v subfasciálním podvazu perforátorů. Rozšířená je segmentální Cockettova operace, kdy je insuficientní perforátor vypreparován z malého řezu a subfasciálně ligován. K přerušení perforátorů se používala i různá dlátka a tzv. komunikotom. V roce 1955 popsal Felder operaci perforátorů ze zadního přístupu. Výkon prováděl v celkové nebo spinální anestezii, v poloze nemocného na břiše. Incizi vedl v celé délce lýtka v linii punčochového švu od fossa poplitea po úroveň kotníků a v případě potřeby ji prodloužil pod vnitřní kotník. Proťal fascii v celé délce kožní rány a odstranil celou VSP. Tupou disekcí oddělil fascii od svalu a postupně přitom podvazoval všechny perforátory. Výkon ukončil suturou fascie, podkoží a kůže, naložil krytí a pacientovi naordinoval klid na lůžku po dobu deseti dnů. - Endoskopická disekce
Předchůdcem dnešních endoskopických postupů byla endoskopická obliterace Cockettových perforátorů pomocí laryngoskopu, kterou v roce 1972popsal Bentley.
Výkon prováděl v celkové anestezii, z podélného řezu, asi 4 cm dlouhého, jenž byl veden 3 cm mediálně za hranou tibie, přibližně 10–15 cm pod kolenním kloubem. Rovněž tak fascii natínal podélně a osvětleným laryngoskopem ji elevoval. Perforátory uzavíral Cushingovými klipy.Metoda však doznala většího rozšíření až v roce 1985 díky Hauerovi, který použil nově vyvinuté instrumentarium firmy Wolf. V současnosti je aparatura nabízena více firmami, přičemž mezi nimi nejsou podstatné rozdíly. Až na výjimky jsou všechny přístroje napojeny na obrazovku s možností videozáznamu.Operatér s asistentem stojí na straně operované končetiny, video pak u nohou pacienta. Incizi, cca3 cm dlouhou, provedeme na ventromediální ploše bérce v jeho horní polovině. Musí být umístěna do zdravé kůže, prosté trofických změn, které jsou vždy přítomny u pacientů s CVI indikovaných k ESDP. Vhodné je incidovat kůži nad varikózním uzlem, který je současně odstraněn. Pronikáme k fascii a po jejím ozřejmění ji podélně protínáme.Digitálně pronikáme do subfasciálního prostoru,kde vytváříme dostatek prostoru pro zavedení endoskopu. Toho lze docílit i pomoci firemních balonů, výsledek je stejný, operace se ale prodražuje.Nejdříve zavádíme tubus mezi fascii a sval a tupě je od sebe oddělujeme, poté je do tubusu zasunuta kamera.
Aplikujeme kysličník uhličitý, následkem čehož je operační pole velmi dobře přehledné. Perforátory jsou patrné jako svisle probíhající vény mezi svalem a fascií. Pod přímou kontrolou zrakem je koagulujeme a protínáme.Za indikaci k ESDP považujeme přítomnost insuficientních perforátorů v terénu poškozené kožní trofiky, kde klasický postup nezaručuje optimální výsledky. Jedná se o pacienty ve stadiu C4–C6 chronické venózní insuficience. - Sklerotizace
Sklerotizaci perforátorů neprovádíme pro riziko průniku sklerotizačního roztoku do hlubokého žilního systému.
4.4.3.1.5 Komplikace chirurgické terapie
Komplikace v chirurgii žilního systému jsou vzácné a většinou výrazně neohrožují pacienta. Můžeme se s nimi setkat jak při operaci, tak po ní.
PEROPERAČNÍ KOMPLIKACE
- Krvácení
Striping VSM/VSP je doprovázen krvácením z jejích větví. Toto krvácení ustane po naložení elastické bandáže. Proto provádíme striping až na konci operace a současně s ním nakládáme elastickou bandáž. Při invaginačním stripingu bývá krvácení menší. Každé krvácení je nutno pečlivě ošetřit z hlediska prevence vzniku hematomu v ráně. - Poranění velkých cév
Se závažnějším peroperačním krvácením se setkáváme většinou při preparaci v oblasti bulbu VSM nebo ve fossa poplitea. Může nastat jednak méně závažné krvácení z poranění větví bulbu či samotné safeny, tak hrozivější krvácení při poranění femorálních cév, častěji vén. Poranění vény je 5× častější než tepny. Je popsána ligatura femorální i popliteální arterie i striping tepny.Poranění větví bulbu a samotné safeny řešíme ligaturou, poranění femorálních cév pak stehem. Při stavění krvácení je nutno postupovat velmi šetrně, abychom nezpůsobili další škody, například naložením peánů naslepo. Krvácení vždy nejdříve zastavíme tlakem prstu a určíme jeho zdroj, v případě potřeby zvětšíme ránu. Steh nakládáme na nekrvácející vénu při její kompresi dvěma tampony nad a pod lézí.Při větším poškození, podvazu nebo protětí hluboké vény se řídíme zásadami cévní chirurgie. Poranění velkých cév by se nemělo vyskytovat. Vždy musíme pečlivě vypreparovat ústí VSM/VSP do hlubokého žilního systému. Jsme-li na pochybách, nikdy nesmíme vénu podvázat, nebo dokonce stripovat. - Vniknutí cizího tělesa do hlubokého žilního systému
S touto komplikací jsme se sami setkali pouze jedenkrát (Herman, 2000). Jednalo se o odlomení konce stripovací sondy a její vycestování do v. iliaca interna, což si vyžádalo operační revizi s vypreparováním ilických vén. Alternativním postupem by bylo odstranění metodami intervenční radiologie. Častěji se s cizím tělesem v hlubokém žilním systému můžeme setkat v souvislosti s intervenční radiologií.
POOPERAČNÍ KOMPLIKACE
- Hematom
Hematom se nejčastěji vyskytuje v oblasti ventromediální plochy bérce a stehna, tj. v průběhu velké safeny. Jsou-li hematomy malé, vstřebají se bez větších problémů. U rozsáhlejších hematomů dochází ke vzniku infiltrátů, často bolestivých, s nebezpečím jejich infekce. Vstřebávání trvá delší dobu a vedle aplikace mastí a obvazů si může vyžádat i incize a evakuace.Prevencí je šetrná operační technika, nakládání elastické bandáže současně se stripingem tam, kde je to možné. U rozsáhlejších výkonů je nutná peroperační komprese, ať již asistentem longetou přes kůži nebo vsunutím longety do rány. Velkou i malou skrytou žílu stripujeme vždy až na konec operace a jen v takovém rozsahu, kam až sahají patologické změny (limitovaný striping).
Hematom v třísle může vzniknout při nešetrné preparaci v této oblasti z poranění větví bulbu nebo samotné safeny, vzácněji pak z poranění femorálních cév. Další příčinou může být sklouznutí ligatury.Je zde nebezpečí jeho infekce, a proto je nutné oblast třísla na konci operace důkladně zkontrolovat a vysušit. Musíme myslet i na tzv. „zatečenou“ krev z kanálu po odstraněné velké safeně. - Neurologické komplikace
Nejčastější neurologickou komplikací jsou parestezie v distální části ventromediální plochy bérce,způsobené poraněním n. saphenus. Výskyt parestezií je udáván od 4,2 % po 39 %. Nižší procento je přítomno u tzv. limitovaného stripingu, kdy je VSM stripována jen pod koleno. Vyšší procento pak u kompletního stripingu od hlezna po tříslo.Holme našel 6× vyšší výskyt léze nervu u kompletního stripingu proti limitovanému při 10% recidivě v obou skupinách. Větší nebezpečí poranění n.saphenus je při ortográdním než při retrográdním stripingu.
Vzácnou, ale závažnou komplikací je léze n. peroneus communis, který probíhá po mediálním okraji m. biceps femoris a nejsnáze zranitelný je v oblasti caput fibulae. Zde probíhá povrchově a je kryt pouze fascií a kůží. Tuto komplikaci popsal Critchley při operaci VSP. Ústí do v. poplitea bylo6 cm nad popliteální řasou a při jeho preparaci bylo nutno retrahovat nerv s cílem dosáhnout vysoké ligatury VSP. Komplikace se projevila znecitlivěním dorza nohy, váznutím extenze prstů a dorzální flexe nohy v hleznu. Potíže přetrvávaly dva roky. - Lymfatická píštěl
Lymfatická píštěl se vyskytuje v třísle, častěji u reoperací než u primárních výkonů. Příčinou bývají dlouhé příčné incize v jizevnaté tkáni. Léčba spočívá v revizi a sutuře v lokální anestezii nebo v kompresi třísla současně s klidovým režimem.Lymfatická píštěl může být přítomna i v místě flebektomie. - Dehiscence rány
Dehiscence rány v třísle je komplikací vzácnou. Nevýhodou je prodloužení doby léčení. Častější může být výskyt komplikovaného hojení rány na bérci,zejména u pacientů s CVI v pokročilém stadiu, kde jsou již přítomny trofické změny. V takových případech je nutno pacienty na možnost sekundárního hojení rány upozornit před operací. - Tromboflebitida
Vzácně může postihnout periferní část kmene VSM/VSP při limitovaném stripingu nebo podvazu VSM nebo varixy, které nebyly kompletně odstraněny. Koagulum z vény exprimujeme po její Incizi nebo vénu v lokální anestezii exstirpujeme.
Jeli proces rozsáhlejší, aplikujeme lokálně antiflogistika a kompresivní bandáž. - Flebotrombóza a plicní embolie
Incidence hluboké žilní trombózy po operaci varixů je udávána v rozmezí 0,15–0,5 % a plicní embolie 0,06 % až 0,16 %. Pravděpodobně zde nenísouvislost s užíváním hormonálních preparátů,včetně kontraceptiv. - Tetováž
Při použití inkoustových tužek k předoperačnímu značení varixů je možno se setkat se vznikem tetováže. Sami jsme takovouto komplikaci nezaznamenali.
4.4.3.1.6 Reoperace
Recidiva postihuje přibližně 20–30 % pacientů operovaných pro varixy dolních končetin. Při dlouhodobém sledování je udávána recidiva až u 80 %. Jones našel při vyšetření duplexní ultrasonografií recidivu za dva roky u 43 % pacientů po krosektomii VSM a u 25 % pacientů po krosektomii se stripingem, i když 89 % pacientů bylo s výsledkem operace spokojeno. Rekurence narůstá s časem. Průměrná doba mezi první a druhou operací je 6–20 let. Vyšší procento reoperací je pozorováno po operacích provedených všeobecným chirurgem ve srovnání s operacemi, které provedl cévní chirurg.Recidiva je jednak nepříjemná pro pacienta, jednak zatěžující pro chirurgické pracoviště i pro pojišťovnu.Krajíček s Vaňkem rozlišují reziduální městky, tj. takové, které byly ponechány při operaci, pravé recidivy, způsobené nedomykavou přímou či nepřímou spojkou, a nepravé recidivy, vznikající následkem progrese onemocnění ve formě novotvořených primárních varixů nebo sekundárních v důsledku rekanalizace po proběhlé hluboké žilní trombóze. Ta má za následek vznik nedomykavých spojek a následně varixů.Za recidivu lze označovat ty stavy, kdy je přítomen centrifugální reflux z hlubokého do povrchového žilního systému, eventuálně z výše uložené větve povrchového systému do nižších větví. Neníli přítomen reflux, nejedná se o recidivu, ale o progresi choroby. Recidivu definujeme jako přítomnost varikózních žil na dolní končetině pro varixy již dříve operované.Většinou je příčina v ponechaném refluxu v safenofemorální junkci. Závažnou chybou je nízké uloženířezu na stehně, distálně od sulcus genitofemoralis.
Může být ponechána celá VSM, když chirurg při operaci odstranil akcesorní safenu a hlavní kmen ponechal in situ. Tato situace nastává tehdy, jestliže chirurgnesleduje VSM až k jejímu ústí do v. femoralis. I při odstranění VSM může dojít k recidivě, a to tehdy, je-li ponechán její pahýl dlouhý. Z pahýlu může odstupovat větev, která se v důsledku refluxu dilatuje a je příčinou vzniku varixů. Suchý s Rečkem popisují recidivu, kdy krev proudí z jedné větve v epifasciálním žilním systému do druhé, pro kterou navrhli označení„hitchhike“, převzatý z chirurgie tepenného systému.Nejde o reflux z hlubokého do povrchového systému.Takové uspořádání v oblasti bulbu bývá označováno jako tzv. Hvarianta. VSM stripujeme až pod koleno, čímž současně eliminujeme stehenní perforátor, který může být zdrojem refluxu. Proto samotná vysoká ligatura VSM má až 45% výskyt recidivy ve VSM na bérci, jejíž příčinou je většinou přítomnost stehenního perforátoru. Striping dává lepší výsledky než vysoká ligatura kombinovaná se sklerotizací.Z části recidivy je obviňován proces označovaný jako neovaskularizace. Při ní dochází k tvorbě novýchtenkostěnných vinutých žil, což je běžný doprovodný jev při hojení ran. Tyto nově vytvořené vény pak mohou spojit femorální vénu s epifasciální vénou nebo přímo s ponechanou safenou. K zabránění neovaskularizace byly navrženy postupy, při kterých je safenofemorální pahýl zanořen, překryt transpozicí fascie m. pectineus nebo syntetickým materiálem. Tyto operace se nerozšířily.Příčinou recidivy může být ponechaný insuficientní perforátor, i když názory na jeho význam se v poslední době mění. Dle našeho názoru je indikace ke zrušení perforátorů tehdy, je-li postižen hluboký žilní systém. Při izolovaném refluxu v epifasciálním systému pouze tehdy, je-li perforátor širší než 3 mm. V takovém případě se jeho funkce většinou neobnoví, ani když eliminujeme reflux v povrchovém žilním systému. S tímto názorem ale ne všichni souhlasí a doporučují přerušit každý insuficientní perforátor.
Inkompetence VSP je méně častá než u VSM, proto je i recidiva v jejím povodí vzácnější. Chceme-li zabránit recidivě, musíme vyhledat ústí VSP subfasciálně. Předoperačně nám pomůže vyšetření duplexní sonografií. Pacienti s recidivou v povodí VSP se dostavují k reoperaci dříve (50 % za 6 let) než pacienti s recidivou v povodí VSM (50 % za 12 let). K recidivě varixů může přispět i inkompetence ovariálních žil. Při jedné operaci může vzniknout více chyb. Proto je důležité každého pacienta před reoperací důkladně vyšetřit jak klinicky, tak duplexní sonografií.V malém procentu se příčina recidivy nezjistí. Chceme-li zabránit vzniku recidivy, měli bychom dodržovat následující zásady:
- Před operací pacienta důkladně vyšetříme (vždy operatér) a označíme varixy a zejména místa refluxu nesmývatelnou tužkou.
- Každého pacienta vyšetříme duplexní sonografií,kterou provádí sám operatér nebo jeden zkušený lékař. Vyšetření duplexní sonografií je považováno za zlatý standard, je zde ale možnost různé interpretace výsledků vyšetření.
- Pokud operaci neprovádí erudovaný nebo cévní chirurg, měl by jí alespoň asistovat. Recidivu musí operovat zkušený nebo cévní chirurg.
- Vyhledání počátku VSM při vnitřním kotníku, zavedení sondy až do třísla, vytažení sondy z malé incize nad jejím hmatným proximálním koncem a následný striping je postup sice rychlý, ale opuštěný. Je zde nebezpečí ponechání větví VSM při jejím ústí, navíc je stripována celá véna, což nebývá většinou nutné, a vede častěji k neurologickým komplikacím. Preparaci zahájíme v třísle, vyhledáme ústí VSM do VF a podvážeme všechny větve bulbu.
Poté provedeme vysokou ligaturu VSM a do jejího periferního pahýlu zavedeme sondu a pronikneme tak distálně, kam až sahá insuficience kmene VSM (zjištěno klinicky a duplexní sonografií) – tj. podkolenní kloub nebo ještě distálněji. Výskyt recidiv lze snížit správnou krosektomií, při níž sledujeme VSM až k jejímu ústí do VF. - Ponecháváme-li VSP in situ, musíme si být jisti kompetencí jejího ústí.
REOPERACE
V terapii recidivujících varixů lze použít léčbu chirurgickou, sklerotizační i jejich kombinaci. K podpůrné terapii patří léčba medikamentózní a kompresivní. Zásadní význam v terapii recidiv má předoperační vyšetření, které určí místo nebo místa refluxu. Ta je nutno eliminovat. Prosté odstranění varixů bez ohledu na zdroj refluxu má jen dočasný efekt a je příčinou další recidivy. Není tedy jeden typ operace pro recidivu, ale vždy se zaměřujeme na zdroje refluxu. Jen pokud tato místa neurčíme, provedeme prostou exstirpaci varikozit.
Dlouhodobá úspěšnost reoperací závisí také na příčině recidivy. Bude lepší u primárních varixů, s horšími výsledky lze počítat u posttrombotických stavů.Preparace v třísle při reoperaci představuje vyšší riziko vzniku hematomu, infekce, lymfatické píštěle nebo poranění velkých cév, než je tomu u primární operace. Obávanou komplikací je vznik lymfedému. Proto je nutné důkladné předoperační vyšetření, včetně duplexního ultrazvuku, k určení příčiny recidivy, a není-li tato v ponechané velké či akcesorní safeně, v třísle neoperujeme. Preparace v třísle při reoperaci je v jizevnaté tkáni s křehkými, snadno krvácejícími vénami velmi obtížná. Je proto vhodné zvolit laterální přístup, při kterém vedeme řez laterálně od původního a pronikáme směrem mediálním k femorální tepně. Její pulzace nám slouží jako vodítko. Mediálně od ní pak vyhledáme femorální vénu (VF) spolu s ponechaným ústím VSM. Vypreparujeme safenofemorální ústí, naložíme vysokou ligaturu (flush ligature) a VSM protneme.Je možno použít i mediální přístup. Řez je veden v třísle mediálně a nad původní jizvou. Pronikneme přímo k přední ploše VF a ligujeme VSM. Operatér stojí na opačné straně, než je operovaná končetina.Přístup ze standardního řezu v třísle zvolíme, jeli původní řez umístěn atypicky, nejčastěji distálně na stehně. Nepreparujeme v jizevnaté tkáni a výkon probíhá jako primární operace.
Vychází-li recidiva z fossa poplitea, preparace je obtížnější jednak vzhledem k těsnému vztahu VSP k okolním strukturám (a. et v. poplitea, n. tibialis), jednak pro variabilitu ústí VSP do popliteální vény (VP). Důležité je správné umístění kožního řezu, nejlépe na podkladě předoperačního ultrazvukového vyšetření. Ústíli VSP výše, můžeme si pomoci flexí v kolenním kloubu. Tím se incize posune kraniálněji. VSP, resp. její ponechaný pahýl, vypreparujeme až k ústí do VP a zde jej ligujeme. Vychází-li z pahýlu VSP větev, běžící podkožně k VSM, můžeme ji vystripovat. Zavádění sondy kontrolujeme vizuálně i palpací, abychom si byli jisti jejím epifasciálním průběhem.
4.5 Literatura
- Bates SM. Treatment of deep venous thrombosis. N Eng J Med. 2004;351:452–463.
- Bergan JJ. The Vein Book. Elsevier Academic Press Inc; 2007.
- Broulíková A. Antikogulační léčba žilní trombózy. In: Eliška O, Spáčil J, Švrtinová V, editoři. Angio logie 2008. Trendy soudobé angiologie. Praha: Galén; 2008. s. 41–45.
- Cronenwett JL, Johnston KW, editors. Ruther ford’s Vascular Surgery. 7th Edition. Saunders El sevier; 2010.
- Ethunandan M, Mellor TK. Hemangiomas and vascular malformations of the maxillofacial region – a review. Br J Oral Maxillofac Surg. 2006; 44:263–272.
- Firt P, Hejnal J, Vaněk I. Cévní chirurgie. Praha: Karolinum; 2006.
- Glowiczki P. Handbook of Venous Disorders. 3rd Edition. Hodder Arnold; 2009.
- Heberer G, van Dongen RJAM. Gefässchirurgie. Berlin Heidelberg New York: Springer-Verlag; 1987.
- Herman J, Duda M. Chronická venózní insuficience pohledem miniinvazivního chirurga. Prakt Flebol. 1999;8:49–60.
- Herman J, Lovecek M, Duda M, Svach I. A rare complication of varicose vein surgery. Phlebology. 2000;15:43–45.
- Herman J, Musil D. Klippel-Trenaunay syndrome associated with great saphenous vein aplasia. Phlebology. 2010;1:35–37.
- Kahn SR. Relationship between deep venous thrombosis and the postthrombotic syndrome. Arch Int Med. 2004;164:17–26.
- Kaletová M, Musil D. Akutní stavy ve flebologii. Int Med. 2006;9:380–384.
- Lee BB, Laredo J, Lee TS, Huh S, Neville R. Ter minology and classification of congenital vascular malformations. Phlebology. 2007;22:249–252.
- Lee BB, Bergan J, Glowiczki P, et al. Diagnosis and treatment of venous malformations. Consensus Document of the Internationeal Union of Phle bology (IUP)-2009. Int Angiol. 2009;28:434–451.
- Lumley JSP, Hoballah JJ. Vascular Surgery. Berlin Heidelberg: Springer-Verlag; 2009.
- Marik PE, Plante LA. Venous thromboembolic disease and pregnancy. N Engl J Med. 2008; 359:2025–2031.
- Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 982;69:412–422.
- Musil D. Rizika a prevence tromboembolické choroby. Med Pro Praxi. 2009;6(2):61–65.