5 Anatomie a fyziologie jícnu
5.1 Anatomická a funkční definice
Obr. 1
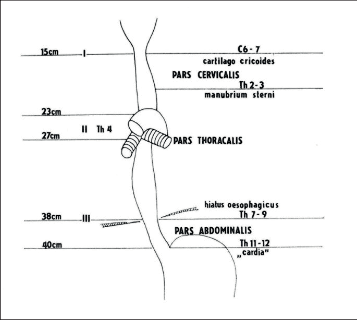
Anatomické členění jícnu a jeho topografické vztahy k okolí. Vlevo: přibližná vzdálenost od / horních řezáků, I, II, III – fyziologická zúžení jícnu
Jícen je svalová trubice spojující farynx se žaludkem, která zajišťuje transport potravy a sekretů mezi těmito dvěma orgány.
V klidu je jícen prázdný a obsah patogenních mikrobů je dán komunikací s dutinou ústní a potravou. Ezofagus začíná ve výši cartilago cricoidea, což odpovídá 6.-7. krčnímu obratli. V krčním úseku probíhá více vlevo, naléhá na páteř a jeho svalstvo je ventrálně v úzkém vztahu k průdušnici a aborálněji k levému bronchu. Ve žlábku mezi tracheou a jícnem probíhá vratný nerv. V hrudníku vytváří aortální oblouk na jícnu různě výraznou impresi zleva a sestupná aorta ho provází dále po jeho levé straně. Na jícen zde naléhá levostranná mediastinální pleura. V dolním mezihrudí zahýbá jícen poněkud ventrálněji a doleva, prochází bránicí v hiatus oesophageus, ležící před hiátem aortálním (obr. 1).
Na obou koncích je jícen opatřen sfinktery: horní, krikofaryngeální, je v klidu uzavřen a brání vstupu vzduchu při dýchání, dolní jícnový svěrač, který není výrazněji anatomicky definován, umožňuje prostup sousta do žaludku, ale brání zpětnému toku žaludečního obsahu do ezofagu.
Jícen se výrazně odlišuje svou stavbou a skladbou od ostatních úseků trávicí trubice. Nejpevnější vrstvou stěny jícnu je sliznice, jejíž dokonalá sutura musí být provedena při operaci s maximální pozorností. Druhým základním rozdílem je nepřítomnost serózy, což přispívá k technické náročnosti a obtížnosti jícnové chirurgie. Sliznice jícnu je složena v podélné řasy, což působí hvězdicovitý průsvit ezofagu. Na povrchu je kryta mnohovrstevným dlaždicovým epitelem. Svalovina jícnu je tvořena v horní třetině převážně příčně pruhovaným svalstvem, ve střední třetině postupně přechází ve svalstvo hladké, kterým je tvořena dolní třetina jícnu. Klasická anatomie rozlišuje zevní longitudinální a vnitřní cirkulární svalovinu. Podle Müllera [1] jsou obě vrstvy spojeny svalovými snopci, které se místy větví a v závislosti na funkčním stavu vytvářejí zkříženou mřížovitou strukturu. Hlavní svalová masa však zachovává podélné a cirkulární uspořádání. Podle Stelznera a Lierse [2] je svalovina jícnu tvořena apolárním systémem spirálních svalových vláken (viz kapitola 5.4.2.2, obr. 6). Arteriální zásobení jícnu je z okolních arterií. V horní části z a. thyroidea inferior, a. subclavia, dále z aa. intercostales, rr. bronchiales a rr. oesophagei z hrudní aorty a v abdominální části z a. gastrica sin. a aa. phrenicae inferiores. Odtok žilní krve se uskutečňuje ze submukózních pletení do povrchních plexů a dále do okolních vén (vv. thyroideae inf., vv. intercostales, v. azygos a hemiazygos a v. coronaria ventriculi) [1a]. Jícen je inervován z obou nn. vagi a krčního a hrudního sympatiku.
5.2 Faryngoezofageální přechod
5.2.1 Anatomie
Obr. 2
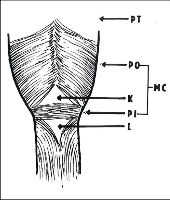
Pohled na faryngoezofageální přechod z dorzální strany.
M. constrictor pharynx inferior:
PT – pars thyreopharingea
PO – pars obliqua
PF – pars fundiformis
MC – musculus cricopharyngeus
K – Kilianův trojúhelník
L – Laimerův trojúhelník
Svalový plášť faryngu, který se rozprostírá od báze lební do výše C 6–7, kde přechází v jícen, je tvořen svalovými vlákny začínajícími z raphe pharyngis a probíhajícími převážně šikmo shora zezadu obloukovitě dopředu (obr. 2). Dolní část tohoto svalového masivu tvoří m. constrictor pharyngis inferior, členící se v pars thyropharyngea a pars cricopharyngea. Složitý průběh svalových vláken pars cricopharyngea, který bývá označován též jako m. cricopharyngeus, zde vytváří svým členěním na pars obliqua a pars fundiformis dvě místa s relativně oslabenou svalovinou – horní Killianův a dolní Laimerův trojúhelník. M. cricopharyngeusse upíná oběma konci na cartilago cricoidea, šálovitě obepíná vstup jícnu a při své kontrakci uzavírá vchod do ezofagu, a to tlakem proti prstenčité chrupavce. Tento sval spolu s cirkulární svalovinou počátku jícnu vytváří anatomický substrát horního jícnového svěrače. Jeho inervaci obstarávají vlákna nn. vagi a z menší části IX. a XI. hlavový nerv. Podle Romana sympatická inervace jeho motoriku pravděpodobně neovlivňuje [1].
5.2.2 Fyziologie faryngoezofageálního transportu
Horní jícnový svěrač (HJS) odděluje svým klidovým napětím dutinu ústní a farynx, které komunikují se zevním atmosférickým tlakem, od jícnu, kde je v klidu negativní tlak –0,266 až –1,064 kPa (–2 až –8 mm Hg). Existence HJS je dnes bezpečně prokázána nejen morfologickými, ale i rentgenologickými, elektromyografickými a zejména manometrickými studiemi. Od prvních manometrických měření provedených Fykem a Codem [3] v roce 1955 se zdokonalila manometrická technika zejména užitím perfundovaných katétrů. V oblasti HJS můžeme identifikovat zónu zvýšeného tlaku v délce 35 mm s maximem v délce asi 10 mm. Naměřené hodnoty [4] se pohybují v rozmezí 7,98–13,3 kPa (60–100 mm Hg). Měření s perfundovaným katétrem s několika bočními otvory ve stejné výši prokazují v sagitální rovině asymetrii měřených tlaků. Ventrálně a dorzálně kolem 13,3 kPa (100 mm Hg), zprava a zleva 3,325–3,99 kPa (25–30 mm Hg). Tuto asymetrii si lze lehce vysvětlit, uvědomíme-li si, že m. cricopharyngeus komprimuje jícen proti prstenčité chrupavce jako smyčka, a tím vytváří uzávěr vstupu do jícnu jako napříč probíhající štěrbinu.
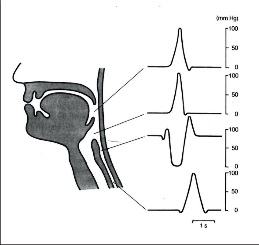
Při polykacím aktu dochází k volnímu posunu sousta zpracovaného v ústech směrem do hltanu (fáze orální). Kontakt sousta s hltanem vyvolává vůlí neovladatelný reflex přesunující sousto do jícnu za současného uzávěru dutiny nosní a faryngu (fáze faryngeální) a ve fázi ezofageální je sousto transportováno do žaludku. Velmi důležitá je funkční koordinace a návaznost kontrakce a relaxace jednotlivých svalových skupin, protože na polykacím aktu se ve faryngoezofageální fázi podílí více jak 30 jednotlivých svalů inervovaných pěti hlavovými nervy. Při polykání dochází během několika sekund ve faryngu, oblasti HJS a jícnu ke značným tlakovým výkyvům a sousto je doslova vystřelováno do jícnu pod tlakem, který může v hypofaryngu dosáhnout hodnot 26,6–33,25 kPa (200–250 mm Hg) těsně před relaxací HJS, která trvá asi 0,8 sekundy [5] (obr. 3).
5.3 Tubulární jícen (tělo jícnu)
V klidovém stavu je jícen prakticky prázdný, oddělený na obou koncích od sousedních oddílů zažívacího traktu horním a dolním jícnovým svěračem. Při polykání navazuje na faryngeální fázi primární peristaltická kontrakce. Je vyvolána polykacím aktem, proběhne postupně od faryngu až po terminální jícen, přičemž rychlost peristaltické vlny se v dolní části jícnu snižuje. Sekundární peristaltika vzniká rozepětím jícnu soustem nebo jeho zbytkem a může být vyvolána i rozepjatým balonem či elektrickým podrážděním. Peristaltika začíná proximálně od místa podráždění, nejčastěji v horní části ezofagu a proběhne postupně až ke kardii. Od těchto fyziologických typů peristaltiky je nutno odlišovat tzv. terciární kontrakce. Neovlivňují posun potravy, jsou stacionární. Mohou vzniknout v různých oddílech jícnu, častěji v distálních partiích. Vzácně je můžeme pozorovat bez klinické symptomatologie u zdravých jedinců, častější jsou ve vyšším věku a zpravidla jsou projevem patologických stavů.
5.4 Uzávěrový mechanizmus gastroezofageálního spojení (GES)
5.4.1 Definice GES
Přestože od dob Galenových, který jako první užil termínu kardie, uplynula více jak dvě tisíciletí, není vymezení tohoto pojmu jednoznačně definováno [6, 7, 8]. V roce 1961 podal Hayward [9] z klinického hlediska výhodnou definici kardie (obr. 4).
Orálně ji ohraničuje úpon frenoezofageální membrány a aborálně řasa peritonea, přecházející z bránice na žaludek. GES lze charakterizovat z různých hledisek. Jiná je definice anatomická, histologická, endoskopická, manometrická nebo pH-metrická.
Vedle výrazu kardie se setkáváme s pojmenováním terminální jícen [6, 10], gastroezofageální junkce, úsek, spojení či přechod [7, 11].
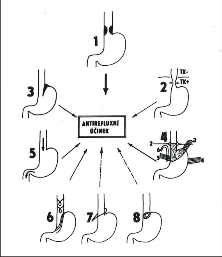
GES funguje jako ventil, který umožňuje volný transport potravy do žaludku a na druhé straně chrání jícen před škodlivým vlivem gastroezofageálního refluxu, aniž by však zabraňoval zvracení či odříhnutí. V antirefluxním mechanizmu (obr. 5) se prolínají prvky anatomické a funkční.
.
5.4.2 Dolní jícnový svěrač (DJS)
DJS je lokalizován v oblasti terminálního jícnu a je definován jako funkční jednotka, postrádající charakteristiky anatomického svěrače. Od okolní svaloviny se odlišuje především zvýšeným napětím a odlišnou reakcí na hormonální, farmakologické a nervové podněty [1].
5.4.2.1 Manometrická charakteristika
Oddělení jícnu od žaludku je dosaženo zvýšeným svalovým tonusem DJS, jehož manometricky zjistitelným ekvivalentem je zóna zvýšeného intraluminálního tlaku. Cohen, Harris a další autoři potvrdili, že intraluminální tlak lze považovat za vhodnou míru svalové kontrakce [12]. Maximální tlak sfinkteru v klidové fázi, měřený Waldeckem zavedenou metodikou infuzního katétru za kontinuálního tahu ze žaludku do jícnu, kolísá mezi 2,9–2,93 kPa (15–22 mm Hg); (nulová hodnota je tlak v žaludečním fundu). Délka zóny zvýšeného tlaku se v závislosti na dýchání pohybuje od 28 do 32 mm. Zjištěné hodnoty kolísají podle použité metody a jednotlivých pracovišť [13, 14, 15] (tab. 1). Klidový tlak se mění při polykání, uplatnění břišního lisu, za patologických stavů a podléhá hormonálním a farmakologickým vlivům.
| Tab. 1 Hodnoty intraluminálního tlaku v oblasti DJS u člověka (podle Waldecka a Jenneweina [1] a našich zkušeností [14]) |
|
| Manometrická metoda – autor | Klidový tlak DJS |
| Uzavřený katétr: | |
| Fyke 1956 Affolter, Rossetti 1964 Gilda 1969 |
1,050 kPa (10,7 cm H2O) 0,665 kPa (5,0 mm Hg) 1,158 ± 0,118 kPa (11,8 ± 1,2 cm H2O) |
| Infuzní katétr: | |
| Castell, Harris 1970 Isenberg 1971 Cohen 1971 Roling 1972 Winans 1972 |
2,0 ± 1,57 kPa (15,0 ± 11,7 mm Hg) 1,66 ± 0,138 kPa (12,4 ± 1,4 mm Hg) 2,58 ± 0,135 kPa (19,4 ± 1,3 mm Hg) 1,92 ± 0,135 kPa (14,6 ± 1,3 mm Hg) 2,98 ± 0,400 kPa (22,7 ± 3,1 mm Hg) |
| Infuzní katétr – kontinuální tah: | |
| Waldeck 1973 Dodds 1975 Dlouhý, Duda, Minařík 1979 |
2,53 ± 0,139 kPa (19,0 ± 1,6 mm Hg) 3,25 ± 1,28 kPa (24,3 ± 9,5 mm Hg) 2,8 ± 0,9 kPa (21,0 ± 6,9 mm Hg) |
.
5.4.2.2 Svalový plášť terminálního jícnu
Obr. 6
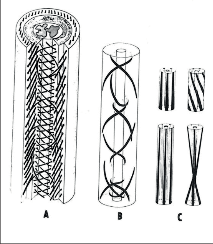
A. Schéma apolárního spirálního systému svalových vláken jícnu u člověka. Vlákna probíhají převážně kraniokaudálně, zatáčejí se a kříží ve směru a proti směru hodinových ručiček.
B. Průběh jednotlivých svalových snopců, které začínají v zevní vrstvě longitudinálním průběhem a šroubovitě se zatáčejí dovnitř. Na kaudálním konci jícnu v místě uzavírajícího segmentu je jejich průběh blízký horizontále.
C. Modelová situace odpovídající tažnému uzávěru
terminálního jícnu („Dehnverschluss“): válec se stěnou tvořenou elastickými vlákny, dole silnějšími. Podélný tah při spirálním průběhu vláken (vpravo) vede k uzávěru lumen v dolní třetině. Při paralelním průběhu vláken (vlevo) je tah bez efektu. Převzato podle Stelznera a Lierse (2).
Svalovina terminálního jícnu představuje anatomický podklad DJS, aniž by zde byl vytvořen anatomicky definovatelný svěrač. Jícnová muskulatura přechází plynule na žaludek, kde mimo podélnou a cirkulární vrstvu vytváří tzv. fibrae obliquae, zvané též Helvetiův nebo Willisův sval (viz obr. 5). Většina těchto vláken obepíná ve tvaru smyčky incisura cardiaca a napomáhá při udržování Hisova úhlu.
Zajímavá je koncepce tzv. angiomuskulárního tažného uzávěru terminálního jícnu, kterou na základě svých studií zveřejnil Stelzner a Lierse [2]. Podle nich je svalovina jícnu tvořena apolárním systémem spirálních vláken. Jejich průběh je v terminálním jícnu blízký horizontální rovině, takže na izolovaných preparátech se snopce jeví cirkulárně (obr. 6). Systém pracuje jako spirála, která při svém podélném natažení uzavírá dolní segment jícnu. Na uzávěru se podílí i náplň subepitelně probíhajících venózních pletení. I když se v těchto svalových strukturách zatím nepodařilo prokázat klasicky definovaný svěrač, není pochyb o existenci svěrače funkčního s odlišnou reakcí hormonální a nervovou proti okolí.
5.4.2.3 Hormonální a farmakologická regulace
V roce 1969 upozornili poprvé britští [16] a američtí [17] pracovníci, že endogenní a exogenní gastrin vyvolává vzestup tlaku v oblasti DJS. V následujících letech byl zkoumán i vliv jiných hormonů, farmak a různých zevních vlivů (tab. 2).
Studie na zvířatech potvrdily rovněž citlivost DJS na gastrin. Ukázalo se, že antisérum gastrinu ruší trvající tonus DJS u vačice. Všechny tyto poznatky vedly k závěru, že gastrin je hlavním determinantem tonusu DJS. Z toho bylo vyvozeno, že zmenšené uvolňování endogenního gastrinu nebo necitlivost DJS na gastrin je příčinou snížení intraluminálního tlaku v této oblasti u gastroezofageálního refluxu. S tím souvisí lákavá představa možného terapeutického ovlivnění. Tato „teorie gastrinu“ však byla bohužel dalšími výzkumy otřesena. Především přímá měření hladiny gastrinu u nemocných s gastroezofageálním refluxem a kontrolních skupin neukázala rozdíly [18]. Dosud zůstává otevřená i otázka přímého či vagem zprostředkovaného působení gastrinu na DJS.
| Tab. 2 Působení různých látek na intraluminální tlak v oblasti DJS (sestaveno podle Jenneweina, Waldecka a dalších autorů [1]) |
|
| Ovlivnění klidového tlaku DJS | |
| Vzestup | Pokles |
| gastrin pentagastrin parathormon histamin kalcium katecholamin parasympatikomimetika alfa adrenergika beta adrenolytika prostaglandin F2 metoclopramid (paspertin) anacida bílkovinná strava |
sekretin glukagon caerulein cholecystokinin (CCK) CCK – octapeptid motilin parasympatikolytika alfa adrenolytika beta adrenoergika prostaglandin E1 narkotika (barbiturany) nikotin, alkohol, kofein tuky |
.
5.4.2.4 Nervová regulace
Inervace terminálního jícnu je z obou větví nn. vagi a z hrudní části sympatiku. Vlákna se větví na povrchu jícnu a mimo to vytvářejí pleteně v submukóze – plexus submucosus Meissneri – a mezi svalovými vrstvami – plexus myentericus Auerbachi. Řízení motility DJS není jen interakcí cholinergního (parasympatického) a adrenergního (sympatického) systému, ale na regulaci se podílí i tzv. purinergní nervový systém. Jak ukázaly četné studie, jeho efekt není zprostředkován vagální a sympatickou inervací a rovněž mediátor přenosu je nejistý. Snad jde o adenosintrifosfát nebo jiné puriny, podle nichž vzniklo pojmenování [19].
Podle převládajících názorů je tonus DJS udržován hlavně vagální cholinergní iner vací, kdežto relaxace je zajištěna noncholinergním, nonadrenergním purinergním systémem. Vliv sympatiku je patrně zanedbatelný [20]. Předpokládá se, že autonomní reflexy mají vysvětlit změny tlaku DJS spojené se žaludeční kontrakcí a zvýšením nitrobřišního tlaku. Intramurální nervové pleteně jsou schopny udržet klidový tonus, zajistit relaxaci při polykání a reakci DJS na zvýšení intraabdominálního tlaku i při přerušení zevní inervace.
5.4.3 Ostatní faktory podílející se na antirefluxním mechanizmu
Abdominální jícen začíná topograficky ve výši bráničního hiátu a je dlouhý 10–20 mm (obr. 1). Jeho šikmé vyústění do žaludku spolu s klenutým fundem vytváří hluboký zářez – incisura cardiaca – zvaný Hisův úhel. Intraluminálně zářezu odpovídá Gubaroffova řasa. Na vytvoření Hisova úhlu se podílí Helvetiův-Willisův sval.
Mechanickým stlačením abdominálního ezofagu nitrobřišním tlakem se podpoří funkce DJS [21] (obr. 5). Tato teorie tzv. kolabovatelného jícnu vysvětluje podle Borsta a Earlama i možnost působení nitrobřišního tlaku při fundoplikaci konstruované nad bránicí. Rovněž hypotéza, že terminální jícen funguje jako tzv. „flutter valve“ (kmitající chlopeň), se zakládá na předpokladu, že jícen kolabuje při přechodu z negativního intratorakálního tlaku do pozitivního intraabdominálního tlaku.
Význam Hisova úhlu vysvětluje teorie ventilovaného uzávěru kardie, které věnoval především z hlediska praktického chirurgického využití velkou pozornost Rossetti [22]. Podstata této teorie spočívá v tom, že intraabdominální, a tím i intragastrický tlak se přenáší na Gubaroffovu řasu a na intraabdominální jícen a vytváří záklopkovitý uzávěr GES.
Ezofagogastrické spojení je místem přechodu jícnového dlaždicového epitelu v cylindrický žaludeční. Mezi oba typy je vsunuta zóna tzv. junkčního jednovrstevného cylindrického epitelu, kterému se přičítá význam při ochraně sliznice jícnu před peptickým účinkem žaludeční šťávy [23, 24]. Slizniční řasy jsou zde prověšeny do lumina a vytvářejí obraz slizniční rozety, které bývá připisován význam zátky utěsňující vstup do žaludku. O Stelznerově angiomuskulárním tažném uzávěru terminálního jícnu byla již zmínka.
Na udržení zvyklé polohy a tvaru GES se podílejí následující struktury (obr. 5):
- retroperitoneální fixace zadní stěny GES,
- frenoezofageální Laimerova membrána, zprostředkující vztah jícnu k ezofageálnímu hiátu,
- ligamentum gastrophrenicum,
- ligamentum gastrolienale,
- ligamentum gastrohepaticum,
- arteria gastrica sinistra.
Některé složky tohoto fixačního aparátu byly pro udržení kompetence GES zvláště zdůrazňovány.
Frenoezofageální membrána představuje anatomické a funkční spojení jícnu s hiátem ezofageálním a bránicí. Je pokračováním horní a dolní brániční fascie, přičemž dolní fascie je hlavním elementem. Na jícen přechází ve dvou listech, které se jako kraniální a kaudální raménko přikládají ke stěně jícnu, do které jsou pevně zakotveny. Horní raménko se upíná nad kraniální okraj DJS. Membrána je pevně zakotvena i ve strukturách bránice, zatímco proti okrajům hiátu je volně pohyblivá. To spolu s její elasticitou umožňuje poměrně volný kraniokaudální pohyb jícnu v rozsahu několika centimetrů [25]. Eliška upozorňuje [26] na charakteristické změny frenoezofageální membrány ve vyšším věku, které se blíží nálezům u skluzné hiátové hernie. Podle Dillarda a Bombecka má lokalizace úponu frenoezofageální membrány vliv na funkci gastroezofageálního spojení [27].
Byl zkoumán vliv ezofageálního hiátu na funkci GES [28, 29]. Známa je Jacksonova teorie bráničního pinchocku, která předpokládá sevření jícnu kontrakcí bráničních pilířů v období mimo polykání. Allison [30] předpokládal, že pravé brániční crus svou kontrakcí při inspiriu uzavírá kardii.
Šetka zdůrazňuje význam koordinace motility celého gastrointestinálního traktu [8]. Důležité je dobré vyprazdňování žaludku a v patogenezi refluxní nemoci má význam i duodenogastrický reflux. Selye v roce 1938 podvazem pyloru u experimentálních zvířat dosáhl vzniku hemoragické refluxní ezofagitidy [31]. Dobře je rovněž znám význam peristaltiky jícnu pro jeho samočisticí schopnost.
5.5 Kritické zhodnocení jednotlivých komponent antirefluxního mechanizmu
Atkinson [32] v roce 1962 shrnuje důležité poznatky o významu ezofageálního hiátu. Ke gastroezofageálnímu refluxu nedochází po protětí hiátu nebo paréze bránice a zóna zvýšeného tlaku v terminálním jícnu, který je mimo dosah bránice, je prokazatelná i u skluzných hiátových hernií. Rovněž rentgenologická pozorování svědčí proti účasti hiátu na zábraně gastroezofageálního refluxu [6]. Mukózní rozeta nemá pro uzávěr GES zásadnější význam. Pokud se na zábraně refluxu podílí sliznice, je to spíše významem zóny junkčního epitelu. Je známé, že u skluzné hiátové hernie, u níž je abdominální jícen dislokován do hrudníku a Hisův úhel zpravidla vymizel, nemusí být inkompetence GES. K redukci Hisova úhlu a porušení fixačního aparátu GES dochází po resekci žaludku. S gastroezofageálním refluxem se zde můžeme setkat, ale rozhodně to není pravidlem [33]. Poškození fixačního aparátu GES, včetně Laimerovy membrány, může vést ke vzniku skluzné hiátové hernie, což však není synonymem refluxu. Na druhé straně experimentální [34, 35] a klinické[9, 36, 37] zkušenosti prokazují, že rekonstrukce abdominálního jícnu a Hisova úhlu vede k zábraně refluxu.Nejdůležitější složkou antirefluxního mechanizmu je DJS, který je schopný zesilovat svou funkci při zvýšení nitrobřišního tlaku bez ohledu na svou lokalizaci nad bránicí či pod ní, jak prokázali Cohen a Haris [38]. Zjištění této nezávislosti na ostatních mechanických faktorech vedlo k názoru, že tonus DJS je primární, nebo dokonce jedinou zábranou refluxu.
Dodds [39] upozorňuje na dvě skutečnosti, které by mohly objasnit některé rozpory v získaných výsledcích:
- Většina experimentálních důkazů byla získána pokusy na psech. Ti však nejsou pravděpodobně vhodným zvířecím modelem pro aplikaci závěrů na člověka. Rozdílná je skladba svaloviny jícnu, která je u psa tvořena převážně pruhovaným svalstvem, a rozdíly jsou i ve stavbě frenoezofageální membrány. Za vhodnější zvíře považuje Dodds opici.
- Není jisté, zdali je při lokalizaci DJS nad bránicí skutečně vyloučena veškerá spoluúčast mechanických antirefluxních faktorů (mukózní ucpávka, fibrae obliquae, Hisův úhel u větších hernií), jak se v úvahách většinou předpokládá.
O tom, že se na činnosti DJS podílejí další extrasfinkterické, pravděpodobně mechanické faktory, svědčí následující pozorování:
- Byla zjištěna radiální asymetrie tlaku DJS. V závislosti na orientaci otvorů infuzního měřicího katétru byly registrovány nejvyšší tlakové hodnoty v levém posterolaterálním kvadrantu svěrače.
- Zvýšení tlaku bylo naměřeno i v poloze vyšetřovaného na boku ve srovnání s polohou na zádech.
- Mírný vzestup intraluminálního tlaku na úrovni hiátu byl pozorován při herniaci DJS do hrudníku.
- Při snížení tlaku DJS atropinem nedochází obvykle ke zvýšení výskytu refluxu [40].
- Ačkoliv během polykání dochází ke kompletní relaxaci DJS, bylo zjištěno fluoroskopickým vyšetřením u dobrovolníků, že při poloze hlavou dolů nedocházelo při polykání na sucho k refluxu do jícnu. Doddsova pracovní skupina rovněž prokázala, že relaxace svěrače není ekvivalentní s jeho otevřením.
Další zajímavé poznatky poskytují vyšetření pacientů s prokazatelným refluxem do jícnu:
- Ačkoliv průměrné hodnoty tlaku DJS u nemocných s GER jsou nižší než u kontrolní asymptomatické skupiny [60, 346], mohou se u jednotlivců vyskytovat hodnoty opačné.
- Je zajímavé, že u některých nemocných přes farmakologické značné zvýšení tlaku DJS na 4,0 kPa (30 mm Hg i více) přetrvává GER, stejně jako u některých operovaných přes vymizení GER nedojde k výraznému zvýšení tlaku DJS [41].
Ve druhé polovině minulého století, kdy byla výzkumu funkce GES věnována velká pozornost, můžeme sledovat tři období nazírání na podstatu antirefluxního mechanizmu GES. V prvním je shledávána odpověď v celé řadě mechanicky koncipovaných hypotéz. Ve druhém období je považován dolní jícnový svěrač za jediný faktor zodpovědný za kompetenci GES. Konečně poslední desetiletí přinášejí střízlivý pohled respektující hlavní roli DJS, ale praktické zkušenosti doložené experimentálními pracemi ukazují, že ani význam ostatních komponent tohoto mechanizmu nelze přehlížet. Ani současné názory anatomů, kteří se zabývají problematikou jícnu, nepřinášejí v tomto ohledu změny proti popsaným závěrům (41, 42, 43, 44, 45, 46).
Literatura
- Siewert RJ, Blum AL, Waldeck F, editors. Funktionsstörungen der Speiseröhre. Berlin Heidelberg, New York: Springer-Verlag; 1976. 1a. Seichert V, Šramhauser J. Arteriální zásobení jícnu. Československá morfologie. 1963;11(3): 221–228.
- Stelzner F, Lierse W. Über das Verschlusssystem der terminalen Spiseröhre. Thorax-chirurgie. 1967;15(6):676–679.
- Fyke FE Jr, Code CF. Resting and deglutition pressure in the pharyngoesophageal region. Gastroenterology. 1955;29:24–34.
- Sokol EM, Heitmann P, Wolf BS, Cohen BR. Simultaneous cineradiographic and mano- metric study of the pharynx, hypopharynx and cervical esophagus. Gastroenterology. 1966;51:960–974.
- Ellis FH Jr. Upper esophageal sphincter Iin healths and diseases. Surg Clin N Amer. 1971;51:553–565.
- Imdahl H. Der terminale Ösophagus. Stuttgart: F. K. Schattauer-Verlag; 1963.
- Botha GSM. The Gastro-Oesophageal Junction. London: J. & L. Churchill Ltd.; 1962.
- Šetka J. Onemocnění jícnu v internistické a gastroenterologické praxi. Praha: Státní zdravotnické nakladatelství; 1970.
- Hayward J. The lower end of the oesophagus. Thorax. 1961;16(1):36–41.
- Korhoň M, Krč C. K otázce nedostatečnosti kardie po resekci žaludku. Rozhl Chir. 1964;43(1):6–11.
- Thal AP, Hatafuku T, Kurtzman R. A New Method for Recontruction of the Esophago-gastric Junction. Surg Gynecol Obstet. 1965;120(6):1225–1231.
- Cohen S, Harris LD. Lower Esophageal Sphincter Pressure as an Index of Lower Esophageal Sphincter Strength. Gastroenterology. 1970;58(2):157–162.
- Winans CS. Alternation of Lower Esophageal Sphincter Characteristics with Respiration and Proximal Esophageal Balloon Distension. Gastroenterology. 1972;62(3):380–388.
- Dlouhý M, Duda M, Minařík L. Přínos jícnové manometrie pro chirurgii esofagogastrického spojení. Čs Gastroent Výž. 1982;36(8):411–414.
- Králík J, Minařík L, Korhoň M. Manometrie jícnu. Čas Lék čes. 1968;107(43):1284–1290.
- Giles GR, Mason MS, Humphries C, Clark CG. Action of gastrin on the lower oesophageal sphincter in man. Gut. 1969;10(9):730–734.
- Castell DO, Harris LD. The link between control of gastric acid secretion and control of lower esophageal sphincter strength. Gastroenterology. 1969;56(6):1249.
- Farrel RL, Castel DO, McGuigan JE. Measurements and comparisons of lower esophageal sphincter pressures and serum gastrin levels in patients with gastroesophageal reflux. Gastroenterology. 1974;67(3):415–422.
- Burnstock G. Purinergic nerves. Pharm Rev. 1972;24(4):508–581.
- Di Marino AJ, Cohen S. The adrenergic control of lower esophageal sphincter function: An experimental model of denervation supersensitivity. J Clin Invest. 1973;52(6):2264–2271.
- Borst HG, Earlam R. Physiologie und Pathophysiologie der Kardia und des unteren Oeso- phagus. Langenbecks arch. Klin Chir. (Kongressbericht) 1968;322:340–349.
- Rossetti M. Bedeutung des ösophagogastrischen Winkels in der Physiologie und Pathophy- siologie der Cardia. Schweiz Med Wschr. 89(49):1280–1284.
- Allison PR, Johnstone AS. The oesophagus lined with gastric mucous membrane. Thorax. 1953;8(2):87–101.
- Korhoň M, Králík J, Tichý A. Die Schleimhautadaptation im Anastomosengebiet nach Oesophagoplastik mit Hilfe eines plastisch gebildeten Magentubus im Experiment. Exper Chir. 1969;3(6):369–374.
- Šerý Z, Králík J. Příspěvek k anatomii, histologii a fysiologii hiátové části bránice. IV. Frenooesofageální membrána. Acta Univ Olomuc Fac Med. 1956;11:257–262.
- Eliška O. Phreno-oesophageal membrane and its role in the development of hiatal hernia. Acta Anat. 1973;86:137–150.
- 2Bombeck CTH, Dillard DH, Nyhus L. Muscular anatomy of the gastrooesophageal ligament. Autopsy study of sphincter mechanism. Ann Surg. 1966;164(4):643–654.
- Šerý Z. Příspěvek k anatomii, histologii a fysiologii hiátové části bránice. In: O účasti hiatus oesophagicus na uzávěrovém mechanismu esofagokardiálního úseku. Acta Univ Olomuc Fac Med. 1958;16:295–307.
- Šerý Z, Králík J. Über die Innervation des Zwerchfells in der Gegen des Hiatus oesophagus. Bruns Beitr Klin Chir. 1993;1956:157–166.
- Allison PR. Reflux oesophagitis, sliding hiatal hernia and the anatomy of repair. Surg Gyn Obst. 1951;92(4):419–431.
- Selye H. The experimental production of peptic haemorrhagic oesophagitis. Can Med Ass J. 1938;39(5):447–448.
- Atkinson M. Mechanism protecting against gastrooesophageal reflux. Gut. 1962;3(1):1–15.
- Korhoň M, Krč C. K otázce nedostatečnosti kardie po resekci žaludku. Rozhl Chir. 1964;43(1):6–11.
- Králík J. Die Bedeutung der abdominellen Speiseröhre im Verschlussmechanismus der oeso- phagogastrischen Verbindung. Eine experimentelle Studie. Thoraxchirurgie. 1970;18(3):207–214.
- Duda M, Dlouhý M, Minařík L, Skoumal P. Funkce gastroezofageálního spojení v experimentu. Rozhl Chir. 1987;66(8–9):570–583.
- Rapant V, Schwarzer M. Skluzné kýly hiatu esophageálního. Čas Lék čes. 1960;99(30–31): 946–952.
- Rossetti M. Bedeutung des ösophagogastrischen Winkels in der Physiologie und Pathophy- siologie der Cardia. Schweiz Med Wschr. 89(49):1280–1284.
- Cohen S, Harris LD. Does hiatus hernia affect competence of the gastroesophageal sphincter. New Engl J Med. 1971;284(5):1053–1056.
- Dodds WJ, Hogan WJ, Miller WN. Reflux Esophagitis. Digestive Diseases. 1976;21(1):49–67.
- Skinner DB, Camp TF. Relation of Esophageal Reflux to Lower Esophageal Reflux to Lower Esophageal Sphincter Pressures Decreased by Atropine. Gastroenterology. 1968;54(4): 543–551.
- Eliška O, Elišková M. Hernie brániční. In: Petrovický P, editor. Systematická, topografická a klinická anatomie (XI. Kůže a chirurgické přístupy). Praha: Vydavatelství Karolinum; 1996. s. 143–147.
- Eliška O. Osobní sdělení; 2011.
- Dylevsky I, Druga R, Mrázková O. Funkční anatomie člověka. Praha: Grada Publishing; 2000.
- Čihák R, editor. Anatomie. Praha: Grada Publishing; 2002.
- Chandrasoma PT, DeMeester T. Normal anatomy; Present definition of the Gastroesophageal Juntion. In: Chandrasoma PT, DeMeester T. GERD Reflux to Esophageal, Adenocarcinoma. Burlington, San Diego, London: Elsevier Inc; 2006. p. 65–87.
- Takubo K. Structure of the Esophagus. In: Takubo K. Patology of the Esophagus. Hong Kong: Springer, 2010. p. 8–45.



![Obr. 4<br />Ezofagogastrické spojení podle Haywarda [9] FM – frenoezofageální membrána Obr. 4<br />Ezofagogastrické spojení podle Haywarda [9] FM – frenoezofageální membrána](https://eportal.chirurgie.upol.cz/portal_final/wp-content/uploads/2013/03/Image_071.png)