5 Onemocnění plic
5.1 Anatomie
5.1.1 Plicní laloky a segmenty
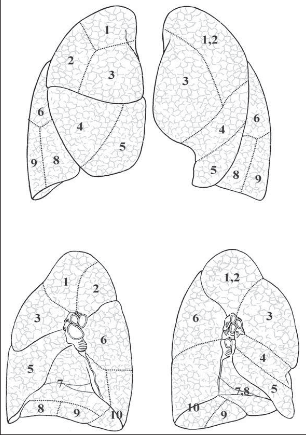
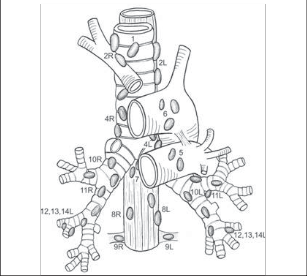
Pravá plíce je členěna dvěma interlobárními zářezy (fissurami) na 3 laloky: horní lalok, střední lalok a dolní lalok. Hlavní (šikmý) interlobární zářez odděluje dolní plicní lalok od obou zbývajících a ve svém průběhu kopíruje přibližně průběh 6. žebra. V polovině této rýhy, tedy asi ve střední axilární čáře, odstupuje z hlavního interlobia fissura vedlejší (horizontální), která probíhá ventrálně směrem ke 4. sternokostálnímu skloubení. Tento zářez odděluje horní lalok od středního. Levá plíce má pouze 2 laloky oddělené hlavní (šikmou) fissurou. Plicní laloky se dále dělí po anatomické i fyziologické stránce na plicní segmenty, což jsou okrsky plicní tkáně, které mají vlastní terciální hilus, vlastní segmentární arterii a průdušku, drobnou intrasegmentární žílu a jsou obklopeny drenážní oblastí intersegmentálních plicních žil. Pravá plíce má 10 segmentů, levá pouze 8. Je to dáno tím, že vlevo je obvykle společná průduška i arterie pro apikoposteriorní segment (S1,2), který tvoří společnou anatomickou jednotku. Druhým rozdílem je chybění mediobazálního segmentu levé plíce, jehož místo zaujímá srdce (S7,8) (obr. 1).
5.1.2 Plicní hilus
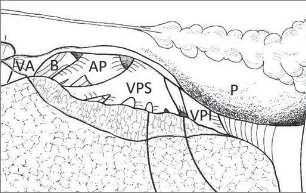
Plicní hilus poutá plíci k mezihrudí, obsahuje základní anatomické struktury, které se dále dělí v plíci do struktur nižších řádů. Pravostranný plicní hilus leží za horní dutou žílou, z horní strany je ohraničen obloučkem v. azygos. Ve ventrálním a kraniálním pólu plicního hilu probíhá pulmonální tepna, distálně od ní v kraniokaudálním směru vystupuje z perikardu horní a dolní plicní žíla, někdy vystupuje na spojnici žil z perikardu anomálně drobná samostatná žíla střední. Dorzálně nejvýše v horním pólu hilu se nalézá hlavní průduška, která směřuje šikmo kraniokaudálně. Po přední straně plicního hilu probíhá pod mediastinální pleurou n. phrenicus, vasa pericardiophrenica a drobné bronchiální tepny. Z dorzální strany vstupují do plíce po zadní stěně průdušky rami pulmonales nn. vagi a jedna nebo několik větších bronchiálních tepen.
Vlevo leží plicní hilus v konkavitě aortálního oblouku a před descendentní aortou. V kraniokaudálním směru je pořadí jednotlivých stuktur takové: pulmonální tepna, horní plicní žíla, hlavní průduška. Dolní plicní žíla je nejkaudálnější strukturou plicního hilu, leží v kraniální části pulmonálního ligamenta. Zepředu naléhá na plicní stopku n. phrenicus a vasa pericardiophrenica, zezadu n. vagus a jícen (obr. 2).
5.1.3 Anatomie trachey a bronchiálního stromu
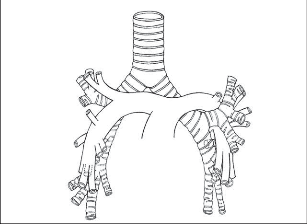
Trachea je elastická trubice přibližné délky 10–13 cm, vyztužená 18–22 podkovovitými chrupavčitými prstenci, které jí dávají šířku mezi 18–28 mm. Ve výši 2. sternokostálního skloubení, tedy ve výši těla Th4-Th5, se trachea dělí na pravý a levý hlavní bronchus. Bifurkace leží vpravo od větvení plicnice, více za pravou plicní tepnou. Pravý hlavní bronchus (bronchus principalis dexter) odstupuje v ostrém úhlu cca 30° doprava a vstupuje do pravého hemitoraxu dorzálně od pravé plicnice pod obloučkem vena azygos, nebývá delší než 2 cm. Kolmo z jeho horního obvodu vystupuje asi 1cm dlouhý horní lobární bronchus (bronchus lobaris superior). Úsek průdušky mezi odstupy horního a středního bronchu dlouhý 1–3 cm se nazývá spojný bronchus (bronchus intermedius). Směrem ventrokaudálním ze spojného bronchu odstupuje průduška pro střední lalok (bronchus lobaris medius). Segmentální větvení průdušek pro dolní lalok začíná již ve výši středního bronchu.
Naprosto typicky totiž průduška pro apikální segment dolního laloku (bronchus apicalis inferior event. bronchus superior lobiinf. – b6) odstupuje naproti odstupu středního lobárního bronchu. Asi 1–1,5 cm pod odstupem b6 je další dělení průdušky pro bazální pyramidu. Levý hlavní bronchus (bronchus principalis sinister) odstupuje z bifurkace v úhlu 50–60°, zezadu naléhá na větvení kmene plicnice. Vstupuje distálně od levé plicnice do levého hemitoraxu a naléhá na ventrální plochu středního hrudního jícnu a přední stěnu sestupné aorty. Je dlouhý asi 4–4,5cm. Jeho první větví je průduška levého horního laloku, bronchus lobaris superior. Takřka ihned po odstupu, nejdále 1 cm od horního lobárního bronchu, začíná segmentální větvení dolního laloku odstupem průdušky pro apikální segment dolního laloku vlevo (bronchus apicalis inferior seu bronchus superior lobi inf. – b6), pod ním se dále větví průdušky pro bazální segmenty.
5.1.4 Plícní tepna
Plicnice vystupuje z pravé srdeční komory vlevo vpředu od ascendentní aorty, směřuje nahoru, stáčí se dorzálně pod oblouk aorty a ještě v perikardu se dělí na své dvě hlavní větve. V úhlu 90o odstupuje doprava za ascendentní aortu pravá plicní tepna, která dále probíhá retroperikardiálně za zadní stěnou ascendentní aorty a horní duté žíly. Pravá plicní tepna je u dospělého poměrně dlouhá (až 4 cm) a široká (až 2,5 cm). Zpoza horní duté žíly, resp. okraje perikardu, vystupuje tepna laterálně, klade se na přední plochu hlavního bronchu, stáčí se podél něj směrem distálním, ventrálně od pravé horní průdušky. Probíhá za horní plicní žilou do interlobia, zde se klade za střední průdušku a posléze se terminálně větví na anterolaterální ploše dělení bronchu pro dolní lalok dorzálně od přítoků dolní plicní žíly. Levá plicní tepna (arteria pulmonalis sinistra) z kmene plicnice odstupuje v tupém úhlu laterálně doleva, v perikardu probíhá přibližně l cm. Bezprostředně extraperikardiálně je fixována k oblouku aorty Botallovým ligamentem. Po výstupu z perikardu kříží levá plicnice v horizontální rovině z ventrální strany levý hlavní bronchus, klade se za levý horní bronchus a poté se stáčí laterokaudálně k terminálnímu větvení zevně od bronchu (obr. 3).
5.1.5 Plicní žíly
Vpravo jsou stejně jako vlevo 2 plicní žíly, které vstupují do levé předsíně odděleně. Horní plicní žíla vpravo (vena pulmonalis superior dextra) má krátký intraperikardiální průběh, ale je zepředu ze 3/4 kryta epikardem, takže k vlastnímu perikardu je fixována jen úzkým mezokardiem, které lze snadno protnout při intraperikardiální preparaci. Dolní plicní žíla (vena pulmonalis inferior dextra) je v perikardu více ukryta, epikardem je kryta jen z přední strany. Perikardiální duplikatura pokračuje z dolní plicní žíly na ústí dolní duté žíly. Do perikardu vstupují plicní žíly na přední straně plicního hilu jako prostřední a distální struktura. Levá plíce má 2 žilní kmeny, horní a dolní plicní žílu (vena pulmonalis superior sinistra a vena pulmonalis inferior sinistra). Obě žíly mají delší, asi centimetrový intraperikardiální průběh a obě mají užší (volnější) mezokardiální závěs, než je tomu vpravo, proto je jejich intraperikardiální preparace jednodušší.
5.1.6 Nutritivní cévy plíce
Nutritivní bronchiální tepny (arteriae bronchiales) jsou systémové cévy zajišťující výživu průduškového stromu okysličenou krví z aorty. Jejich počet i odstupy jsou variabilní. Nejčastěji existuje 1 bronchiální tepna pro pravou plíci a 2 pro plíci levou (obr. 4). Žilní krev z nutritivního oběhu končí v žilách malého oběhu.
5.1.7 Lymfatický systém plic a mediastina
Lymfatické cévy plic začínají jako perialveolární pleteně bez vlastní endoteliální výstelky, centrálnější lymfatické kapiláry jsou již vystlané endotelem. Lymfatické cévy hluboké (bronchoalveolární) sítě provázejí plicní arterie a žíly. Každou plicní tepnu provázejí2 paralelní lymfatické cévy, další 2–3 kmeny probíhají v intersticiu podél větví plicních žil. V průduškách vedou lymfatické cévy zčásti submukózně, převážně však obalují bronchy ve formě peribronchiální lymfatické pleteně, do níž jsou vřazeny jednotlivé lymfatické folikuly a uzliny. Všechny tyto lymfatické cévy spolu bohatě anastomózují. Lymfatické kmeny drénující hluboký systém tvoří spolu s uzlinami hilu pleteň, do které ústí také subpleurální lymfatická síť. Tato pleteň pokračuje podél tracheobronchiálního úhlu na laterální partie průdušnice. Zde ležící lymfatické uzliny a lymfatické cévy formují dva hlavní kmeny – trunci mediastinales posteriores seu bronchomediastinales. Truncus bronchomediastinalis dx. ústí do pravého venózního úhlu, vzácněji do samostatného truncus thoracicus dx. Truncus bronchomediastinalis sinister ústí do ductus thoracicus či do některé ze žilních větví při levém venózním úhlu.
5.1.7.1 Klasifikace lymfatických uzlin
Anatomickou klasifikaci intra a extrapulmonálních uzlin rozpracovali Naruke (1967) a později Mountain (1997), a to z klinického hlediska. Jejich klasifikační schémata se stala základem pro systematicky prováděnou lymfadenektomii při resekcích pro plicní karcinom (obr. 5, tab. 1).
5.1.8 Inervace plic
Na vegetativní inervaci plic se podílí parasympatikus a sympatikus v typicky antagonistickém pojetí. Somatická inervace plic je chudá, plicní parenchym je necitlivý, opačně je tomu u sliznice větších průdušek, která je naopak vysoce senzitivní. Parasympatickou inervaci plic zprostředkovává n. vagus. Dráždění jeho vláken vyvolává bronchokonstrikci a vazodilataci. Pravostranný bloudivý nerv (n. vagus dx.) vstupuje do hrudníku horní hrudní aperturou podél trachey. Vysoko v kupule z něj odstupuje pravostranný vratný nerv (n. recurrens dx.), který zespodu obtáčí podklíčkovou tepnu a stoupá k hrtanu. N. vagus podbíhá oblouk v. azygos, přikládá se k boční stěně jícnu a zatáčí se na jeho dorzolaterální stranu. Levostranný n. vagus se od průdušnice na úrovni horní hrudní apertury vzdaluje laterálně, kříží zevní stranu aortálního oblouku, zde vydává řadu větví k srdci a perikardu a posléze n. recurrens sin., který podbíhá aortální oblouk mediálně od Bottallova ligamenta a stoupá ezofagotracheálním zářezem k laryngu. Podél aorty pokračuje n. vagus na zadní stranu levého plicního hilu, přikládá se k levému a přednímu obvodu jícnu, kde se podílí na formování plexus oesophageus, a pokračuje k hiatus oesophageus. Sympatická inervace plic jde cestou 3.–5. ganglia hrudního sympatiku z míšních segmentů Th1–5. Sympatikus působí na plíce ve smyslu bronchodilatace a vazokonstrikce.
| Tab. 1 Pozice regionálních lymfatických uzlin (Goldstraw et al.): |
| 1. horní mediastinální |
| 2. horní paratracheální |
| 3. prevaskulární a retrotracheální |
| 4. dolní paratracheální, včetně uzlin při v. azygos |
| 5. subaortální (aortopulmonálního okénka) |
| 6. paraaortální – při ascendentní aortě a n. phrenicus |
| 7. subkarinální |
| 8. paraezofageální – distálně od uzlin subkarinálních |
| 9. uzliny plicního ligamenta |
| . |
| 10. hilové |
| 11. interlobární |
| 12. lobární |
| 13. segmentální |
| 14. subsegmentáln |
5.2 Vrozená onemocnění plic
Nejzávažnější vývojové vady plic vedou k porodu mrtvého plodu nebo těžké asfyxii a časné smrti novorozence. Méně vážné plicní vady mohou zůstat dlouho asymptomatické a bývají diagnostikovány při pátrání po příčině recidivujících plicních zánětů a opakovaných hemoptýz v dětském věku či adolescenci. Při pátrání po nespecifických potížích lokalizovaných do hrudníku bývají někdy jejich konečným vysvětlením i v dospělosti. Někdy nás k diagnóze bezpříznakových vrozených onemocnění přivede vedlejší nález některé ze zobrazovacích metod.
5.2.1 Ageneze, aplazie, hypoplazie
Ageneze plic je nevytvoření plíce, chybí tepna i průduška. Oboustranná není slučitelná se životem. Aplazie může postihovat lalok nebo celé plicní křídlo, je založen zárodek bronchu, chybí plicní tkáň. U hypoplazie jsou průdušky a plicní cévy nedokonale vyvinuté, stejně jako periferní plicní tkáň. Pokud je aplastický, resp. hypoplastický pouze lalok, může být průběh asymptomatický. Nevyvinutí celého plicního křídla se může obejít také bez příznaků. Hemoptýza může být důsledkem plicní hypertenze, kašel spolu s plicními záněty projevem dysplastických průdušek.
5.2.2 Kongenitální lobární emfyzém
Kongenitální lobární emfyzém je definován nadměrným rozepnutím jednoho nebo více laloků histologicky normálních plic. Stav je způsoben popraskáním interalveolárních sept v časném novorozeneckém období zapříčiněném ventilovou obstrukcí segmentálních nebo lobárních průdušek. Zčásti se na ní může podílet nedokonale vyvinutý chrupavčitý skelet bronchu. Většina případů se klinicky projeví do 6. týdne života různým stupněm dechové tísně. Postižený hemitorax je vyklenutý, ale se slabšími dýchacími fenomény, na snímku je hyperinflace parenchymu postižené strany a přetlačení mediastina na stranu druhou. CT, případně bronchoskopie jsou indikovány spíše z důvodu diferenciální diagnózy, resp. k vyloučení jiných anomálií či endobronchiální obstrukce. Léčbou volby je resekce postiženého laloku, naléhavost operace závisí na tíži dechových potíží, nezřídka bývá nutná do 6 hodin po porodu. Sporadické reference hovoří o bronchiální stentáži, implantaci endobronchiálních ventilů či staplerové volumredukci, ale pouze v případech s pozvolným vývojem.
5.2.3 Plicní sekvestrace
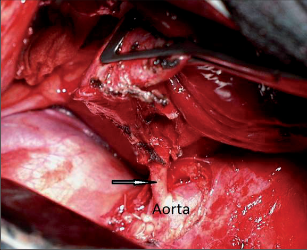
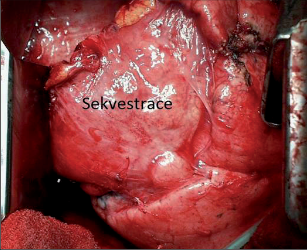
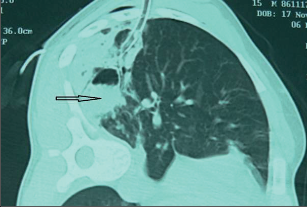
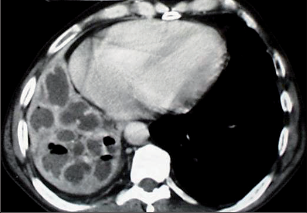
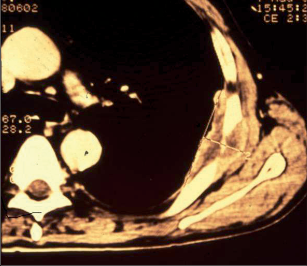
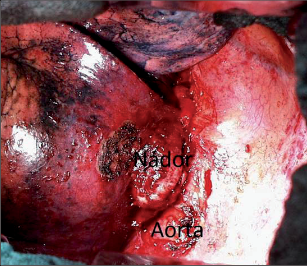
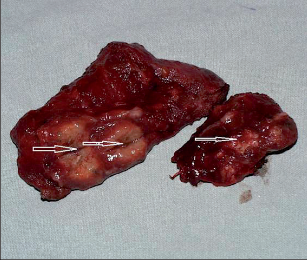
Jako plicní sekvestraci označujeme nefunkční část plicní tkáně, která nekomunikuje s tracheobronchiálním stromem (obr. 6). Typickým atributem sekvestrace je arteriální krevní zásobení ze systémového oběhu (z hrudní či břišní aorty).
Rozeznáváme intralobární sekvestraci, kdy je patologická tkáň uložena uvnitř plíce a žilní krev je drenována do plicních žil, a extralobární sekvestraci, kdy je postižený okrsek od plíce zcela oddělen, má vlastní žilní drenáž do systémového oběhu a je obalen vlastní pleurou. Může tak imitovat akcesorní plicní lalok, který má na rozdíl od sekvestrace typickou bronchovaskulární strukturu. Diagnóza se opírá o klinické potíže (kašel, dyspnoe, febrilní stavy), na snímku lze nalézt zastínění odpovídající nevzdušné tkáni, některé intralobární sekvestrace mohou mít obraz komplikované cysty či abscesu (obr. 7). Angiografie (CTAG, MRAG, aortografie) potvrdí podezření a mohou poskytnout cenné informace pro chirurgický výkon. Léčba je chirurgická, resekce extralobární sekvestrace i operace pro intralobární sekvestraci by měly začínat podvazem přívodné tepny, pokud odstupuje infradiafragmaticky, může být nutný torakoabdominální přístup nebo kombinovaný postup – radioinvazivní okluze tepny a následná resekce.
Někteří autoři preferují u intralobárních sekvestrací obligátně lobektomii, jiní doporučují zachovat normálně utvářený parenchym postiženého laloku cestou sublobární resekce.
5.3 Zánětlivá onemocnění plic
5.3.1 Pneumonie
Pneumonie je akutní zánětlivé onemocnění plicního parenchymu (alveolů, bronchiolů, intersticia), charakterizované přítomností nově vzniklého rentgenologického nálezu (jeli snímek proveden) provázeného alespoň dvěma typickými příznaky či nálezy (febrilie, kašel, bolesti na hrudi, typický poslechový nález, leukocytóza). Dříve používané dělení na pneumonie typické a atypické, reflektující spíše předpokládané vyvolávající agens, pomalu ztrácí na významu. Z klinického hlediska má význam dělení podle závažnosti na
- pneumonie lehké, dovolující empirickou ambulantní léčbu,
- pneumonie střední závažnosti, kdy se o nutnosti hospitalizace rozhoduje podle efektu empiricky nasazené léčby a komorbidit nemocného,
- pneumonie těžké, kdy jsou ohroženy základní vitální funkce, léčba tedy musí být razantní a za hospitalizace (často na intenzivním lůžku).
- pneumonie komunitní, které vznikají mimo nemocniční prostředí, většinou jsou způsobeny obvyklými patogeny citlivými na obvyklá antibiotika(Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydia pneumoniae, Haemophilus influensae, Staphylococcus aureus),
- pneumonie nozokomiální, které vznikají v souvislosti s pobytem v nemocničním zařízení.
Pokud vznikne nozokomiální nákaza do 4 dnů od přijetí,označuje se pneumonie za časnou nozokomiální nákazu, po 4 dnech pak za pozdní, která je charakterizována výrazně nebezpečnějším spektrem polyrezistentních patogenů (Klebsiella species, Klebsiella pneumoniae, Pseudomonas aeruginosa, Escherichia coli, Staph. aureus, Strept. pyogenes, Bacteroides).
Obzvlášť závažné jsou pneumonie u dlouhodobě ventilovaných pacientů (ventilátorové pneumonie).Diagnostika se opírá o anamnézu (infekční onemocnění v okolí, cestování, epidemiologická situace), klinické vyšetření (zkrácený poklep, utlumené, trubicové či vymizelé dýchání s vlhkými fenomény, krepitus), laboratorní nález (zvýšená sedimentace, leukocytóza, elevace CRP) a rentgenologický nález (čerstvý infiltrát v segmentálním, lobárním či alárním rozsahu, výpotek). V případě pochybností a z důvodu diferenciální rozvahy je někdy nutné CT, bronchoskopie má význam podobný, navíc dovoluje tracheobronchiální toaletu a cílené odběry materiálu pro mikrobiologa. Léčba je povětšinou nechirurgická (antibiotika dle citlivosti, mukolytika, expektorancia, oxygenoterapie, ECMO, toaleta bronchiálního stromu, fyzioterapie). Invazivní, event. chirurgická léčba je indikována zcela výjimečně, a to pro komplikace (empyém, absces, sek. pneumotorax).
5.3.2 Plicní absces
Plicní absces je lokalizovaný hnisavý proces v dutině vytvořené destrukcí parenchymu. Nejčastěji vzniká v důsledku aspirace nebo zatečení infikovaného sekretu či žaludeční šťávy do dýchacích cest, např. u nemocných s poruchami vědomí nebo na arteficiální plicní ventilaci. U imunokompromitovaných nemocných bývá typickou a vážnou komplikací nekrotizující pneumonie. Akumulace bronchiálního sekretu za stenózou (nádorovou i benigní) bývá další typickou příčinou vzniku abscesu. Abscedovat mohou preexistující plicní léze – nádory, kaverny, infarkty, septické emboly, mnohočetné abscesy mohou provázet těžké septické stavy, kanylovou sepsi apod. Plicní absces, ale spíše empyem, může vzniknout šířením hnisavého procesu z podbráničních nebo hlubokých krčních prostorů. Kultivačně lze nalézt nejčastěji Staph. aureus, Strept. pyogenes, Strept. pneumoniae, Klebsiella sp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus species, Escherichia coli, Enterobacter, u aspirací a u imunokompromitovaných nemocných jsou častější anaerobní gramnegativní bakterie – Bacteroides, Peptococcus, Peptostreptococcus, Fusobacterium, většinou v kombinaci. Diagnostika se opírá o typické symptomy: febrilie, kašel s expektorací hnisavého nebo až putridního sputa, malátnost, únavnost, váhový úbytek, dyspnoe, pleurální bolest, výjimečně hemoptýza. Fyzikální nález však většinou bývá chudý. Při podezření na plicní absces je proto nutné zhotovit zadopřední a bočný snímek, typickým nálezem je infiltrát a později dutina s hladinkou. Hladinka nebývá vidět u ventilovaných nemocných snímkovaných na lůžku vertikálním paprskem. Přesnější diagnostika sporných infiltrátů je možná pomocí CT, lze odlišit jiné kavitované léze (nádorové či specifické kaverny) či empyém. Z laboratorních výsledků lze vysledovat leukocytózu, elevaci CRP, anemizaci, při teplotních špičkách je vhodné odebrat hemokulturu. Materiál k aerobní i anaerobní kultivaci lze kromě sputa získat při bronchoskopii, která je indikována k vyloučení aspirace či obstrukce, nebo transparietální punkcí, pokud jsou předchozí kroky nepřínosné.
Léčba je antibiotická, zprvu empirická a intravenózní (1–2 týdny), co nejdříve řízená dle citlivosti, po pominutí toxických známek infekce i perorální v délce 4–6 týdnů. K empirickému nastavení terapie slouží znalost epidemiologické situace ve spádu a v nemocnici, zejména u nozokomiálních nákaz a aspirací je třeba počítat s gramnegativní a anaerobní flórou. Velké abscesy nereagující na konzervativní terapii je někdy nutné punktovat, resp. lépe drénovat transparietálně, pod skiaskopickou, sonografickou či CT navigací (obr. 8). Jen v naprosto výjimečných případech je nutná terapie chirurgická – drenáž na způsob kavernostomie nebo resekce plíce s abscesovou dutinou. Separace neoperované plíce během operace je velmi žádoucí.
Indikací k chirurgické léčbě jsou:
- přetrvávající abscesová dutina,
- mykotická superinfekce,
- masivní hemoptýza,
- bronchopleurální píštěl,
- aspirované cizí těleso,
- podezření na neoplazii.
5.3.3 Bronchiektázie
Bronchiektázie jsou definovány jako ireverzibilní dilatace průdušek. Mohou být vrozené nebo častěji získané, lokalizované i difuzní. Typicky jsou provázeny městnáním bronchiálního sekretu a infekcí, což vede k chronické infiltraci bronchiálních a peribronchiálních struktur a k postupné progresi v čase.
V patogenezi se uplatňuje vrozená slabost bronchiální stěny, ciliární dysfunkce, patologické složení hlenu (např. u mukoviscidózy). Inflamace indukuje destrukci svalů a chrupavek stěny průdušek a jejich substituci vazivem, retinovaný sekret tvoří zátky, které při kašli zvyšují intrabronchiální tlak a prohlubují další destrukci. Klinicky se projevují zpočátku jako recidivující plicní infekty, přidává se hojná expektorace, která se časem váže na změnu polohy. Může se objevit hemoptýza z podrážděné bronchiální sliznice, při které spolupůsobí častá hypertrofie bronchiálních tepen. V diagnostice byla bronchografie uspokojivě nahrazena HRCT, proto ztratily na významu obsáhlé popisné klasifikace jednotlivých tvarů bronchiektázií. Z dalších vyšetření má význam kultivace sputa a monitorace markerů zánětu.Léčba je antibiotická, cílená dle vykultivované flóry, v trvání 2–3 týdnů. Expektorace je podporována mukolytiky, mukomodulačními léky, expektoranciemi, vibračními a poklepovými masážemi a v dřívější době klasickou polohovou drenáží. Dechová rehabilitace, fyzioterapie a klimatická léčba mají také svůj význam.
Resekční léčba je indikována pouze u lokalizovaných lézí refrakterních na konzervativní terapii, cílem je odstranění infekčního fokusu při maximálním šetření nepostiženého parenchymu (obr. 9). Důvodem k operaci mohou být také recidivující hemoptýzy, u nemocných s limitem ventilační rezervy lze namísto resekce katetrizační technikou selektivně embolizovat dilatované bronchiální tepny.
5.3.4 Plicní tuberkulóza
Tuberkulóza je infekční onemocnění způsobené Mycobacterium tuberculosis. Postihuje nejčastěji plíce (plicní tuberkulóza), ostatním orgánům a tkáním se nevyhýbá (mimoplicní tuberkulóza). Pro diagnostiku má význam anamnéza (kontakt s TBC), fyzikální nález je většinou chudý i při významném postižení a je nespecifický. Pro tuberkulózu na skiagramu hrudníku svědčí infiltrát či oboustranný miliární rozsev v horních plicních polích, rozpadová kaverna, kalcifikované uzliny mediastina, pleurální výpotek, fibrózní pruhy. Diagnóza by měla být postavena na základě kultivačního vyšetření (sputum, bronchiální aspirát, punktát z hrudníku). Histologický rozbor prokazující epiteloidní granulom s kaseifikační nekrózou by měl být také doplněn kultivačním průkazem. Léčba plicní tuberkulózy je medikamentózní. Podává se kombinace standardních antituberkulotik (Rifampicin, Etambutol, Pyrazinamid, Izoniazid, Streptomycin) v různých schématech po dobu nejméně 6 měsíců. Chirurgická léčba je indikována v současnosti už jen zcela výjimečně, po iniciální medikamentózní terapii. Kolapsová terapie (terapeutický pneumotorax, apikolýza) už byla zcela opuštěna. Torakoplastiky jsou indikovány naprosto raritně jako doplňující výkony po komplikovaných resekčních výkonech. Chirurgická léčba bývá poslední instancí v těchto případech:
- životohrožující hemoptýza,
- tuberkulom,
- destrukce plíce (plicního laloku),
- endoskopicky neřešitelná striktura bronchu,
- objemná kaverna či zbytkový prostor.
Principem chirurgie tuberkulózy je parenchym šetřící resekční výkon (staplerová resekce, segmentektomie, lobektomie) a mobilizace zbylé plíce, v případě těžkých jizevnatých striktur průdušek připadá v úvahu i pneumonektomie. Bronchoplastické výkony jsou z povahy nemoci značně komplikované. V případě masivní hemoptýzy je nezbytné před samotnou resekcí lokalizovat bronchoskopicky alespoň stranu krvácení, jeli to v možnostech pracoviště, vytamponovat bronchus nebo zavést ventilační rourku do zdravé plíce. Krvácení má zdroj povětšinou v arodované bronchiální tepně, výhodné je proto zasvorkovat odpovídající průdušku na počátku resekce z důvodu hemostázy a prevence zalití kontralaterální plíce.
5.4 Intersticiální plicní procesy
Intersticiální plicní procesy (IPP) zahrnuji velmi širokou skupinu nemocí, pro které je charakteristické difuzní postižení plicního intersticia a plicních sklípků aseptickým zánětem a fibrózou. Pokud převažují zánětlivé změny, lze předpokládat lepší prognózu a reverzibilitu procesu, např. u sarkoidózy či exogenních alveolitid. Průběh fibrotizujících procesů je většinou ireverzibilní s různou rychlostí progrese. IPP lze dělit na primární (sarkoidóza, amyloidóza, histiocytóza, lymfangioleiomymatóza) a sekundární, vázané na jiné nemoci, syndromy, léčbu nebo na expozici různým noxám. Z hlediska vyvolávajících příčin rozeznáváme IPP idiopatické (např. akutní intersticiální pneumonie HammanRich, idiopatická plicní fibróza) a IPP autoimunní (např. idiopatická trombocytopenická purpura, biliární cirhóza, autoimunní hemolytická anémie).
Diagnostika se opírá o klinické symptomy (dušnost, unavitelnost, někdy kašel, hemoptýza, v pokročilých stadiích hypoxemická cyanóza). Laboratorní vyšetření má význam u systémových onemocnění pojiva a vaskulitid (revmatoidní markery, autoprotilátky). O stavu postižení plic nás nejlépe informuje funkční vyšetření (snížení vitální kapacity, funkční reziduální kapacity, transfer faktoru). Klesá tolerace zátěže a lze prokázat různě vyjádřenou poruchu výměny plynů. Ze zobrazovacích metod má význam skiagram (nodulace, retikulace, prchavé infiltráty, opacity mléčného skla). Daleko věší význam má high resolution CT (HRCT). Bronchoalveolární laváží lze získat vzorky tekutiny, buněk, inhalovaných částic či mikrobů z dolních dýchacích cest. Nejspolehlivější cesta k určení diagnózy je validní biopsie korelovaná s klinickým stavem. Lze ji provést transparietálně, ale většinou je vyžadován dostateně velký vzorek z míst s maximem patologických změn. Ten lze získat videotorakoskopicky, videoasistovaně či z malé torakotomie. Základem léčby IPP jsou kortikoidy a imunosupresiva, v poslední době se u některých syndromů používá biologická léčba. V konečných stadiích je indikována domácí oxygenoterapie, definitivním řešením může být transplantace plic.
5.5 Plicní emfyzém
Plicní emfyzém je definován jako dilatace plicních struktur distálně od terminálních bronchiolů spojená s destrukcí stěn alveolů a výjimečně s limitovanou fibrózou. Tento stav je dán zvýšenou distenzibilitou plíce a její sníženou retraktibilitou. Emfyzematózní plíce potřebuje menší inflační tlak, zato desuflace parenchymu je obtížnější. Ve většině případů není distribuce emfyzematozních změn homogenní, proto více postižené okrsky parenchymu mají tendenci neventilovat a rozpínat se na úkor zbylé plíce se zachovalou strukturou. Negativní roli sehrává i neefektivní pohyb vzduchu mezi zdravými a nemocnými okrsky plicní tkáně při dýchání daný rozdílnými inflačními tlaky, vzduch ze zdravějších okrsků namísto vydechnutí směřuje zčásti do emfyzematózní plíce. Takto je limitována výměna vzduchu se zevním prostředím i na alveolokapilární membráně. Hyperinflace plíce může vést až k pozitivnímu alveolárnímu tlaku na konci expirace (autoPEEP), který dále zhoršuje možnost výměny vzduchu v alveolech, protože k vytvoření negativního inspiračního tlaku v alveolech je zapotřebí vyššího úsilí. Zvětšování objemu plíce vede k oploštění bránice, rozšíření a napřímení mezižebří, to vše je nevýhodné pro mechaniku dýchání a vyžaduje zvýšenou práci vlastních i auxiliárních dýchacích svalů. Důsledkem těchto změn je různý stupeň dyspnoe. Smyslem volumreduktivní chirurgie plic je odstranit nefunkční okrsky plíce, a tak redukovat hyperinflaci a mrtvý prostor, zlepšit proudění vzduchu v dýchacích cestách a výměnu plynů na alveolokapilární membráně ve zbylé plíci.
5.5.1 Evaluace a selekce
Volumreduktivní chirurgie plic je paliativní léčba s jistou morbiditou a nezanedbatelnou mortalitou. Základním cílem je vyhledat nemocné, kterým emfyzém navzdory medikamentózní terapii výrazně komplikuje běžný život, a z nich vybrat takové, kteří mají dobrou šanci profitovat z volumredukce při malém operačním riziku. Dobrou šanci mají nemocní s nerovnoměrnou distribucí emfyzému s bulózními okrsky přístupnými resekci a známkami hyperinflace hrudníku. Z paraklinických vyšetření je důležitá spirometrie (zvýšený celkový i reziduální plicní volum, snížená výdechová rychlost) a snížená difuzní kapacita. Rentgenogram a zejména CT zobrazí objem hrudníku a distribuci bul. Ventilačně perfuzní scan může posoudit stupeň emfyzematózní destrukce a její heterogenitu a pomoci určit rozsah resekce, případně limitovat operaci na jednu stranu. Uspokojivé výsledky operace lze očekávat u nekuřáků pod 70 let, s ideálním BMI, s FEV1 a DLCO v intervalu 20–40%, s PaCO2< 45 a PaO2>50. Nemocní s difuzní kapacitou pro CO pod 20% nebo s homogenní distribucí emfyzému nejsou k volumredukci indikováni.
5.5.2 Příprava
Před samotnou operací je nutná dokonalá rehabilitace v zájmu dosažení optimálních plicních funkcí. Tento program zahrnuje vyloučení kouření, bronchodilatační léčbu, optimalizaci kortikoterapie a případnou vakcinaci proti chřipce a pneumokokové infekci, nutriční podporu a event. psychologickou přípravu.
5.5.3 Operace
5.5.3.1 Bulektomie
Při nálezu jednotlivé či několika bul je možné odstranit je parenchym šetřící resekcí miniinvazivním přístupem nebo z malé torakotomie (obr. 10). Většina menších solitárních bul je asymptomatická. Operují se, pokud se objeví symptomy, komplikace nebo objem buly přesáhne třetinu až polovinu hemitoraxu.
5.5.3.2 Volumreduktivní chirurgie
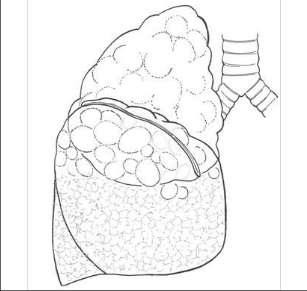
Typicky se provádí z oboustranného přístupu (sternotomie, bilaterální malé torakotomie, bilaterální miniinvazivní přístup (VTS, VATS) v jedné době), výjimečně sekvenčně nebo pouze jednostranně. Principem operace je zresekovat tangenciálně do 30 % nejvíce změněného parenchymu s prezervací funkce zbylé plíce (tak, aby ze segmentu či laloku nezůstaly pouze hilové struktury). Nejvíce bývají postiženy apexy plic, princip operace ukazuje nákres (obr. 11).
Většinou se používají postupně nakládané lineární (endo)staplery. Z důvodu prevence úniku vzduchu z resekčních linií lze svorky podkládat pleurou, perikardem, goretexovými či kolagenovými návleky nebo ošetřit resekční linie tkáňovými lepidly.
5.5.4 Pooperační péče
Většinou je podstatně náročnější než po klasických plicních resekcích. Je to dáno obecně špatnou kondicí nemocných, malnutricí, důsledky dlouhodobé kortikoterapie a častými komorbiditami. Aktivní sání někteří autoři nedoporučují, jiní ho aplikují jen na první hodiny po operaci. Nezbytná je dechová rehabilitace a fyzioterapie.
5.6 Benigní plicní nádory
Benigní plicní nádory jsou poměrně vzácné, tvoří asi 3–4 % všech plicních nádorů. Nezhoubná povaha je determinována těmito atributy: nemetastázují, nepřerůstají přirozené tkáňové bariéry a po kompletní resekci nerecidivují. Klasifikace je nejednotná, protože tyto neoplazie vycházejí z různých struktur.
5.6.1 Klasifikace (zjednodušeně):
Epiteliální nádory:
- papilom
- adenom
- bronchiální cystadenom
Mezenchymální nádory:
- fibrom
- lipom
- leiomyom
- chondrom
- granulocelulární nádor
- sklerozující hemangiom
- fibrózní histiocytom
Jiné a nejasného původu:
- hamartom
- nádor z jasných buněk (sugar tumor)
- xantom
- teratom
- mucosaassociated lymphoid tumor (MALT)
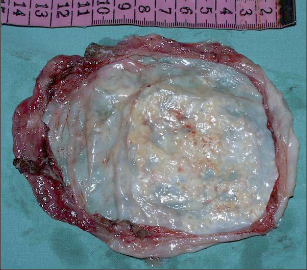
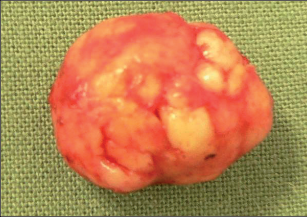
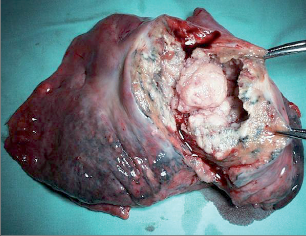
Nejčastějším benigním novotvarem plic je hamartom, představuje asi 70% nezhoubných plicních ložisek, druhé v pořadí jsou adenomy. Hamartomy jsou v naprosté většině případů asymptomatické, histologicky se skládají z nepravidelně uspořádáných okrsků zralé tkáně hyalinní chrupavky, myxoidní pojivové tkáně a tukových a respiračních buněk (obr. 12).
5.6.2 Diagnostika
Méně než desetina nádorů se manifestuje kašlem, recidivujícími infekty či hemoptýzou, v těchto případech je důvodem endobronchiální propagace či zevní útlak průdušky při těsném peribronchiálním růstu. Diagnostika se opírá o rentgenologický (CT) průkaz dobře ohraničeného uzlu často s hrudkovitými kalcifikacemi. Transparietální biopsie může potvrdit benigní povahu léze, nediagnostický nález může být vyřešen chirurgicky. Endobronchiální hamartomy bývají diagnostikovány často až v důsledku sekundárních zánětlivých změn plicního parenchymu za zúžením. Analogickou symptomatologii mají i ostatní benigní nádory. Pokud jsou uloženy periferně a extrabronchiálně, je jejich symptomatologie velmi chudá a často jsou pouze náhodným nálezem na rentgenogramu (lipomy, teratomy, fibromy, granulomy). Nádory s intrabronchiálním růstem nebo takové, které při těsném peribronchiálním uložení způsobují útlak průdušky, vyvolávají potíže (kašel, recidivující infekty nebo hemoptýzy), někdy bývají diagnostikovány až během pátrání po zdroji sekundárních změn plicního parenchymu (adenomy, papilomy, endobronchiální fibrózní histiocytomy).V diagnostice je typický sled vyšetření RTG, CT, bronchoskopie, u dosažitelných lézí transparietální biopsie pod sono nebo CT navigací. Hranice diagnostické bronchoskopie posunují možnosti elektromagnetické či endosonografické navigace.
5.6.3 Indikace
Základní důvod k revizi je vyloučení potenciální malignity léze, druhým je prevence nebo odstranění příznaků u symptomatických nádorů. V dnešní době už většinou není nutné revidovat nádor předpokládané benigní povahy ze široké torakotomie.
5.6.4 Léčba
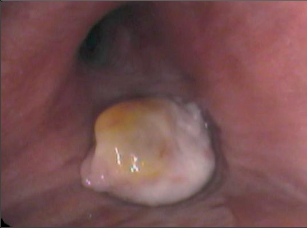
Periferní uzly mohou být enukleovány či resekovány cestou parenchym šetřících neanatomických operací videotorakoskopicky či videoasistovaně. Centrálnější léze je někdy nutné řešit resekcemi anatomickými do rozsahu laloku. Endobronchiálně či centrálně uložené léze lze řešit excizí z bronchotomie, resekcí bronchu či bronchoplastickou resekcí. Pneumonektomie u benigní plicní léze není relevantním řešením.Polypoidní nádory velkých průdušek lze odstranit endobronchiálně (obr. 13). Cílem je dosažení zdravé stopky léze, což je např. u laseroterapie obtížně představitelné, nicméně dlouhodobé výsledky i takto odstraněných endobronchiálních tumorů (karcinoidy) jsou uspokojivé.
5.7 Maligní plicní nádory, karcinom plic
Viz obr. 14.
5.7.1 Epidemiologie
1.7.1.1 Plicní rakovina je nejčastějším typem zhoubného nádoru v lidské populaci a patří obecně k nádorovým onemocněním s nejvyšší letalitou. V roce 2007 bylo na světě diagnostikováno 1,5 milionu nových případů, tomu odpovídalo 1,35 milionu úmrtí na tento novotvar. V ČR byla ve stejném roce relativní incidence 91/100 000 mužů a 33/100 000 žen, čemuž odpovídá celková relativní incidence rakoviny plic 61,6/100 000 obyvatel.
5.7.2 Etiologie
Přestože vznik rakoviny plic je jistě multifaktoriální (jde o onemocnění genomu), pravdou je, že přibližně 90 % nemocných bylo vystaveno aktivně či pasivně tabákovému kouři. Existuje řada dalších škodlivin,které mohou při déletrvající expozici vyvolat plicní nádorové bujení. Nejčastěji zmiňovanými noxami jsou azbest, arsen, chrom, nikl a vinylchlorid, exhaláty dieselových motorů, v naší zemi je specifická problematika uranu a radonu. Naopak řada dalších látek může působit preventivně, a tedy riziko karcinomu snižovat (například zvýšená konzumace ovoce a zeleniny, nízkotuková dieta).
5.7.3 Histologická klasifikace
Plicní karcinom dělíme z histologického hlediska na 2 základní subtypy: malobuněčný plicní karcinom (small cell lung cancer – SCLC) a nemalobuněčný plicní karcinom (nonsmall cell lung cancer – NSCLC). Zatímco malobuněčný plicní karcinom (asi 15–20 % všech karcinomů) je většinou již v době diagnózy systémovým onemocněním, protože časně metastázuje krevní i lymfatickou cestou, nemalobuněčný karcinom roste pomaleji, preferuje lymfogenní cestu metastatického rozsevu a v počátku svého růstu si zachovává lokální charakter proliferace. Z toho se odvíjí terapie a předpokládaná prognóza. SCLC reaguje zpočátku velmi dobře na různé režimy radioa chemoterapie. Po iniciální remisi však v intervalu měsíců dochází k relapsu s limitovanou reakcí na léčbu. Onemocnění končí letálně většinou během několika měsíců od zjištění diagnózy. Chirurgická terapie má v případě SCLC význam pouze podružný, a to u velmi časných stadií nebo u negeneralizovaných reziduálních nádorů po ukončení systémové léčby. NSCLC má diferencovanou citlivost na radioterapii a chemoterapii, generalizuje později, chirurgická léčba má u nemetastatické nemoci kurativní potenciál a dává u radikálně odoperovaných nemocných šanci na dlouhodobé přežití. Proto je včasná a správná histologická klasifikace každého nádoru vitálně důležitá. Nejčastějším typem nemalobuněčné plicní rakoviny je dlaždicobuněčný karcinom (asi 35 % všech plicních karcinomů). Je charakterizován spíše centrálnějším růstem a relativně příznivější prognózou. Adenokarcinomy jsou druhým nejčastějším histologickým typem (asi 30 %), ve Spojených státech dokonce nejčastějším. Vznikají v bronchiálních žlázkách, proto bývají uloženy periferně. Bronchioloalveolární karcinomy vycházejí z pneumocytů II. řádu, rostou podél alveolárních sept jako periferní uzly, vícečetné léze nebo se mohou manifestovat jako rychle progredující pneumonické formy. Velkobuněčný karcinom představuje asi10–15 % z podílu primárních plicních novotvarů, je tvořen velkými atypickými buňkami nevykazujícími ani keratinizaci, ani glandulární formace. Plicní karcinom se může diferencovat v jakýkoli typ, resp. subtyp nádoru, a to do kteréhokoli stupně, navíc v jednom a tomtéž nádoru mohou být okrsky různě diferencované nádorové tkáně. Stejně tak se v jednom nádoru mohou kombinovat různé histologické typy nádoru. Terapeutická a prognostická rozvaha pak odpovídá horší variantě tumoru.
5.7.3.1 Zkrácená klasifikace primárních plicních nádorů
karcinom:
- dlaždicobuněčný karcinom
- adenokarcinom
- velkobuněčný karcinom
- malobuněčný karcinom
- karcinosarkom
- karcinom typu slinných žláz
karcinoid:
- typický karcinoid
- atypický karcinoid sarkommezoteliomplazmocytomlymfommelanomneklasifikované nádory
5.7.4 Klinická prezentace
Plicní karcinom je onemocnění typické dlouhým asymptomatickým průběhem. Protože léčba karcinomu v časném stadiu (early cancer) je jednodušší a má podstatně lepší výsledky než terapie pokročilých stadií, má pro nemocného zcela zásadní význam včasná diagnóza. Kromě screeningových metod (skiagram hrudníku, cytologie sputa), které však nejsou pro depistáž rutinně využívány, má pro rozpoznání plicní rakoviny vitální důležitost detailní znalost klinické symptomatologie. Bohužel stanovení diagnózy na podkladě klinických potíží je možné pouze u pozdních, lokálně pokročilých či generalizovaných nádorů. Samotný nádor se může projevovat příznaky z lokálního růstu, symptomy z regionální extenze, symptomatologií metastáz a paraneoplastickými jevy.
- Projevy lokálního růstu
Základním a nejčastějším projevem (až 70 % případů) lokálního růstu plicního karcinomu je kašel, jehož vyvolávající příčinou může být postižení bronchiální sliznice, nadprodukce hlenu, pneumonie za strikturou, rozpad tumoru nebo pleurální výpotek. Varujícím příznakem je kašel trvající déle jak 4 týdny, změna jeho charakteru nebo jeho koincidence s dalšími příznaky, zejména hemoptýzou.
Přibližně u třetiny nemocných se plicní rakovina může projevit hemoptýzou vyvolanou nekrózou tumoru, ulceracemi bronchiální sliznice, arozí plicních cév či postobstrukční pneumonií. Přibližně třetina až polovina nemocných trpí některýmz kombinace příznaků vyvolaných zánětem za nádorovou strikturou či inflamací přímo v tumoru(teploty, třesavky, hnisavá expektorace, pleurální výpotek). Čtvrtina až polovina nemocných si stěžuje na bolesti hrudníku dané nádorovou infiltrací pleury, hrudní stěny či mediastina. Zbylé příznaky jsou příliš nespecifické pro stanovení klinické suspekce na plicní rakovinu. - Projevy regionální
Příznaky regionální (torakální) jsou více specifické, bohužel svědčí již o velmi pokročilém (většinou inoperabilním) nádoru. Čtvrtina až polovina nemocných si stěžuje na bolesti hrudníku dané nádorovou infiltrací pleury, hrudní stěny či mediastina. Typickými projevy, danými přímou propagací centrálního nádoru do mediastinálních struktur či metastatickým postižením mediastinálních uzlin, jsou jednostranné léze bráničního, event. levostranného vratného nervu, kterým odpovídají parézy stejnostranné bránice, resp. hlasivky. Dysfagie je typickým projevem tlaku mediastinálních uzlin na jícen,pokud nejde o direktní invazi. Ezofagobronchiální píštěl se projevuje vykašláváním potravy po jídle,podobným způsobem se ale může manifestovat také aspirace při paréze hlasivky. Postižení perikardu (srdce) je nejčastěji provázeno výpotkem,většinou asymptomatickým, vzácněji způsobujícím tachyarytmie či tamponádu. Karcinom plic a prsuje nejčastější příčinou maligního pleurálního výpotku, jehož příčinou může být karcinóza pleury, obstrukce lymfatických struktur, pneumonie, chylotorax, plicní embolizace, hypoalbuminemie nebokomplikace terapie. Každý suspektní výpotek musí být vyšetřen opakovaně cytologicky, a není-li výsledek jednoznačný, je indikována torakoskopie. Maligní buňky ve výpotku kontraindikují chirurgickou resekci. Syndrom horní duté žíly je soubor příznaků provázejících uzávěr horní duté žíly objemnými uzlinami horního mediastina vpravo, přímým růstem nádoru pravého tracheobronchiálního úhlu či kombinací obou příčin. Projevuje se bolestmi hlavy, otokem, zarudnutím až cyanózou obličeje a sliznic, chemózou spojivek a nápadnými kolaterálami na horní polovině hrudníku. Pancoastův syndrom, způsobený prorůstáním nádoru apexu plíce do cévních a nervových struktur horní hrudní apertury, se projevuje bolestmi v oblasti lopatky a ramene, iritačními nebo zánikovými jevy v oblasti distálních krčních a l. hrudního kořene (C7, C8, Th1), Hornerovou triádou (ptóza, mióza, enoftalmus). - Projevy metastatické
Extratorakální metastické projevy jsou většinou pozdními, preterminálními příznaky pokročilých stadií nemoci. Malobuněčný karcinom metastázuje dříve a mnohočetně, je považován za systémovou nemoc již v době diagnózy. Nemalobuněčný plicníkarcinom bývá diagnostikován ve stadiu metastatické nemoci asi ve 40–50 %. Nejčastějšími cílovými orgány či tkáněmi pro metastatický rozsev plicní rakoviny jsou plíce, nadledviny, játra, CNS a skelet.Solitární metastázy nadledvin, jater či CNS nevylučují kurativní chirurgický zákrok, samozřejmě jako součást komplexní léčby. - Paraneoplastické projevy
Paraneoplastické (extratorakální nemetastatické)projevy jsou na plicní karcinom a zejména na jeho malobuněčný subtyp vázany asi ve 20 %. Jde o celou řadu většinou nespecifických projevů působených ektopickou produkcí biologicky aktivních peptidů, cytokinů, protilátek a dalších substancí charakteru hormonů. Častá je hyperkalcemie daná sekrecí ektopického paratyroidhormonrelatedpeptidu, hyponatremie a retence vody z ektopicképrodukce antidiuretického hormonu, Cushingův syndrom z nádorové sekrece corticotropin releasing hormonu, karcinoidní syndrom u karcinoidůa malobuněčných karcinomů a řada dalších endokrinních odchylek. Další paraneoplastické projevy mohou být kožní (dermatomyositis, acantosis nigricans, erytémy, hyperpigmentace), muskuloskeletální (hypertrofická osteoartropatie, polymyositida, myopatie), neurologické (pseudomyastenie, periferní neuropatie, polyradikulopatie), hematologické (anémie, polycytemie, hyperkoagulační stavy, leukocytóza, eozinofilie) a renální (glomerulonefritida, tubulointersticiální nemoci, nefrotický syndrom).
5.7.5 Diagnostika
- Klinické vyšetření
Pečlivé klinické vyšetření hodnotí z komplexního pohledu všechny důležité, méně důležité i marginální aspekty celkového klinického stavu se zvláštním zaměřením na respirační systém. Oslabené či vymizelé dýchání, zkrácený poklep či trubicové dýchání mohou svědčit pro atelektázu nebo výpotek, jde však o symptomy značně nespecifické. Je nezbytné vyšetřit uzliny nadklíčku, na krku a v axilách. Důležité je posouzení celkového zdravotního stavu, který může být alterován jak samotným nádorovým onemocněním, tak dalšími komorbiditami. - Skiagram hrudníku
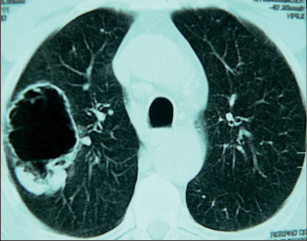
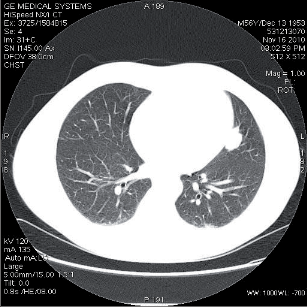
Kromě standardní zadopřední projekce je indikována i projekce boční z důvodu možné sumace centrálně uložených nádorů vlevo se srdečním stínema bazálních lézí s kupulemi bráničními. Bohužel přibližně 4 % nemocných s plicním nádorem mají snímek bez patologie a přibližně u jedné pětiny nemocných s plicním novotvarem bývá léze patrná na snímku přehlédnuta. V řadě případů dá nativní snímek informace relevantní pro staging (velikost tumoru, lokalizace, přítomnost satelitních ložisek,invaze do skeletu, žeber, výpotek). Nádor se může na snímku zobrazit jako okrouhlý periferní stín, jednostranné rozšíření plicního hilu, rozšíření mediastina, atelektáza, apikální stín či pleurální výpotek. Pro malignitu svědčí velikost léze nad 3 cm,lokalizace v horním laloku, spikulace, nepřítomnost, resp. excentricita kalcifikací, progrese v čase. - Výpočetní tomografie (computed tomography– CT)
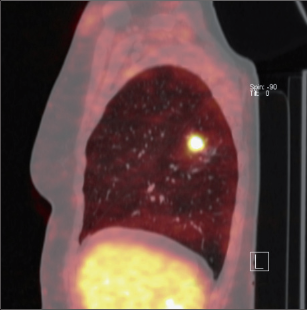
Kromě velikosti a lokalizace tumoru umožňuje CT posoudit známky invaze (do hrudní stěny, apikálních struktur, bránice, mediastina a mediastinálních struktur), satelitní plicní uzly a pleurální výpotek či pleurální nodulace (obr. 15). Penetrace do okolních struktur není vždy pomocí CT věrohodně diagnostikovatelná, důkazem direktní infiltrace je např. destrukce skeletu, extratorakální propagace či exofytické formace v dutých strukturách(vena cava sup., předsíň).CT nemůže spolehlivě rozhodnout o metastatickém, resp. morfologickém postižení uzlin. Pouhé zvětšení uzliny není přesným ukazatelem možné infiltrace. Obvykle se za ,,pozitivní“ považuje uzlina větší než 1 cm. Uzliny menší než 1 cm bývají postiženy metastázami méně než v 10 % případů, častěji u a denokarcinomu, vzácně u spinocelulárního karcinomu. Senzitivita, resp. specificita CT diagnostiky lymfadenopatie mediastina se pohybuje kolem 50 až 70 %, kombinace s pozitronovou emisní tomografií (PET) podstatně zvyšuje diagnostickou výtěžnost (v obou parametrech nad 90 %). Z důvodu statistické pravděpodobnosti diseminaceplicní rakoviny do predilekčních orgánů či tkání se doporučuje provádět CT hrudníku v rozsahu od nadklíčkové krajiny po dolní póly ledvin – tak lze zachytit léze v hlubokých krčních a skalenických uzlinách, v játrech, nadledvinách, ledvinách a abdominálních či retroperitoneálních lymfatickýchuzlinách. Postprocesingové zpracování údajů z počítače dovoluje trojdimenzionální rekonstrukci.Takto lze vytvořit např. věrný obraz průduškového stromu – virtuální bronchoskopii, která je výhodná u nemocných, kteří normální bronchoskopii netolerují, u lézí, které nejsou bronchoskopem dostupné(za zúžením), v rámci pooperačních kontrol apod. - Magnetická rezonance
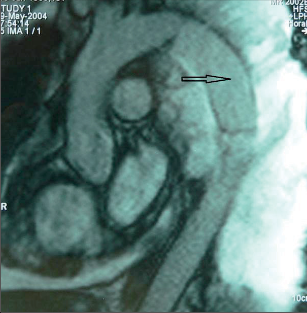
Magnetická rezonance (magnetic resonance imaging, MRI) nepřináší v rámci běžného klinické ho využití zásadnější změnu kvality informace, má ale výhodu nulové radiační zátěže. Samotná plíce obsahuje málo vody, proto nevytváří dostatečně silný rezonanční signál. Jednoznačnou přednost před CT má MRI u Pancoastova tumoru, zejména v posouzení invaze do žeber, obratlů a brachiálního plexu a případné intraspinální propagace, přesnější je touto cestou také posouzení invaze do hrudní stěny, bránice, mediastina či perikardu (obr. 16). - Sonografie
Sonografie hrudníku bývá někdy neoprávněně opomíjena. Dovoluje například diagnostiku výpotků nebo ohraničených nitrohrudních kolekcí, případně umožňuje navigaci při punkcích, biopsiích či drenážích.- Sonografie břicha
Sonograficky lze vyloučit nebo potvrdit patologická ložiska v játrech, ledvinách či nadledvinách. Pokud není proveditelná CT (některé přístroje jsou např.limitovány hmotností pacienta), je akceptovatelnou alternativou CT.
- Sonografie břicha
- Scintigrafie skeletu
Rutinně je využívána k vyloučení kostních metastáz malobuněčného karcinomu, u nemalobuněčných tumorů je indikována pouze u symptomatických pacientů (bolesti, hmatná ložiska) a při elevaci některých sérových parametrů (ALP, Ca). Vyšetření samo o sobě je vzhledem na svou citlivost značně nespecifické s vysokým počtem falešně pozitivních výsledků. - Pozitronová emisní tomografie (PET)
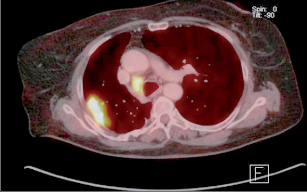
PET vykazuje poměrně vysokou spolehlivost v diferenciální diagnostice fokálních plicních lézí o průměru větším než 10 mm. V případě mediastinální lymfadenopatie jsou zatím výsledky rozpačité, nicméně v kombinaci PETCT bývá popisována až 100% senzitivita a 95% specificita. Zásadním přínosem PET je možnost vyloučit okultní vzdálené metastázy (obr. 17). - Bronchoskopie
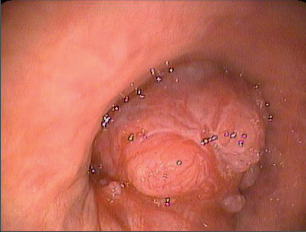
Bývá indikována na podkladě suspektního rentgenologického nálezu s cílem opticky a histologicky či cytologicky potvrdit nebo vyloučit nádorový proces a odhadnout jeho rozsah. Optický nález může být neobyčejně variabilní, od nepatrných změn až po exulcerované krvácející léze obturující velké dýchací cesty, nicméně až 40–50 % plicních karcinomů je mimo dosah optiky.V případě periferních lézí může pomoci MRI navigace či endobronchiální sonografie. Za přímé optické známky nádoru lze považovat exofytické a polypózní léze, infiltraci či nepravidelnost endobronchiální slizniční výstelky či ztrátu chrupavčité kresby (obr. 18). Nepřímé známky jsou dány tlakem nádoru či uzliny na bronchus ze zevnějšku,projevují se jako zúžení nebo rozšíření kariny. Pomocí bronchoskopie lze získat materiál k cytologickému vyšetření cestou aspirace bronchiálníhosekretu, sondáže či výplachu bronchu, bronchoalveolární laváže, kartáčkové abraze, punkce nádoru a transbronchiální, resp. transtracheální punkce.
Větší vzorek k histologickému vyšetření lze většinou získat pouze přímou, např. klíšťkovou biopsií. Topografické údaje získané touto cestou mají zásadní význam při volbě rozsahu resekce u centrálních nádorů a v úvaze o bronchoplastických a tracheoplastických výkonech. Časná diagnostika recidiv v pahýlu bronchu je bez bronchoskopických kontrol v rámci followup nemyslitelná.
Na okraj je třeba zmínit fluorescenční bronchoskopii, která využívá buď rozdílné autofluorescence zdravé a nádorové tkáně, nebo detekuje fluorescenci fotosenzitivujících látek v rámci fotodynamické diagnostiky. - Transparietální plicní biopsie
Tímto způsobem lze ověřit periferní plicní léze,stejně jako afekce dosahující mediastina nebo penetrující do hrudní stěny. K punkci se používají tenké jehly, trucut jehlami lze získat váleček tkáně k histologickému vyšetření. Zavedení jehly je možné u periferních lézí navigovat sonograficky,obvykle se však používá skiaskopická nebo CT monitorace. - Biopsie supraklavikulárních uzlin
Potřeba explorovat supraklavikulární uzliny je povětšinou dána pozitivním nálezem zobrazovacích metod (USG, CT, PET). V případě dobře hmatné uzliny nad klíčkem je většinou dostatečná punkční biopsie, negativní histopatologický nález indikujechirurgickou biopsii. Pozitivita supraklavikulárn uzliny u rakoviny plic určuje N3 lymfadenopatii. - Krční mediastinoskopie
Dovoluje bioptovat paratracheální a přední bifurkační uzliny, může tedy u karcinomu plic rozlišitN2 a N3 postižení, a pokud jsou bioptovány hilové uzliny (pozice 10), lze rozlišit mezi postižením N1 a N2 uzlin. V určitých situacích může být mediastinoskopie nápomocna v posouzení resekability centrálních nádorů, zejména v pravém tracheobronchiálním úhlu (diagnóza invaze do horní duté žíly či do stěny průdušnice). Diagnostická výtěžnost mediastinoskopie je limitována tím, že uzliny podél a před obloukem aorty (pozice 5 a 6), stejně jako uzliny dolního mediastinálního kompartmentu (zadní bifurkační z pozice 7, pozice 8 a 9) jsou touto cestou nedostupné (obr. 19). Videomediastinoskopie má výhodu zvětšení obrazu na monitoru. - Rozšířená mediastinoskopie
Umožňuje odebrat uzliny aortopulmonálního okénka a před obloukem aorty (pozice 5 a 6), které bývají pravidelně postiženy při nádorech horních plicních laloků vlevo. Rozšířená mediastinoskopiese většinou neprovádí samostatně, ale po dokončení mediastinoskopie klasické se mediastinoskop zavede do tunelu vytvořeného tupou preparací nad obloukem aorty mezi truncus brachiocephalicusa levou karotickou tepnou. - Přední mediastinotomie
Chamberlainova operace je výkon umožňující posouzení lymfadenopatie v aortopulmonálním okénku či mediastinální invaze u tumorů horního laloku vlevo. - Torakoskopie a videotorakoskopie
Videotorakoskopie v poslední době nahradila jednostranné postupy (přední mediastinoskopii, resp.přední mediastinotomii) a v některých indikacích zčásti i klasickou mediastinoskopii. Zpravidla bývá indikována k ověření a definitivní diagnostice plicních a pleurálních procesů a uzlin nedostupných mediastinoskopii (uzliny aortopulmonální a preaortální pozice 5 a 6, uzliny dolního mediastinálního kompartmentu z pozice 8 a 9). Kromě stagingu uzlinového postižení může přinést také zásadní informace o resekabilitě tumoru, event. jeho generalizaci. - Otevřená plicní biopsie
Dnes už téměř obsoletní metoda sloužící k rychlé diagnostice plicního postižení nebo generalizace,prováděná většinou z malého anterolaterálního přístupu. - Torakotomie
Všechny výše uvedené medoty vedou ke správné diagnóze a případně k určení stadia nemoci až v 90 % případů. Jinak nezbývá než se uchýlit k probatorní torakotomii, která dovoluje korelovat nálezy paraklinických vyšetření se skutečným rozsahem primárního nádoru, potvrdit či vyloučit jeho operabilitu, posoudit afekce na pleuře či v mediastinu nebo vyhodnotit stav stejnostranných mediastinálních uzlin.
5.7.5.1 TNM klasifikace
TNM klasifikace popisuje rozsah nádoru na podkladě vyhodnocení 3 parametrů:
- T – rozsah primárního nádoru,
- N – rozsah postižení regionálních lymfatických uzlin,
- M – přítomnost či nepřítomnost vzdálených metastáz.
TNM k lasifi kace bronchogenní ho karcinomu z roku 2009
T: primární nádor
- TX: primární nádor nehodnotitelný, je pozitivní cytologie, nádor nebyl prokázán bronchoskopickyani zobrazovacími vyšetřeními
- T0: beze známek primárního nádoru
- Tis: karcinom in situ
- T1: nádor ≤ 3cm v největším rozměru, bez pleurální (mediastinální) invaze, limitovaný na lobárníbronchus
- T1a: nádor ≤ 2cm v největším rozměru
- T1b: nádor > 2cm a ≤ 3cm
- T2: nádor je > 3cm a zároveň ≤ 7cm nebo splňuje nejméně jedno z následujících kritérií
– infiltruje hlavní bronchus do vzdálenosti ≥ 2cm distálně od kariny
– invaduje do viscerální pleury
– podmiňuje atelektázu nebo obstrukční bronchopneumonii v subalárním rozsahu- T2a: nádor v intervalu > 3cm a ≤ 5cm
- T2b: nádor v intervalu > 5cm a ≤ 7cm
- T3: nádor je > 7cm, podmiňující atelektázu celého plicního křídla, vytvářející satelitní uzel ve stejnémlaloku nebo infiltrující některou z následujících struktur:
– hrudní stěna
– bránice
– brániční nerv
– mediastinální pleura
– perikard
– hlavní bronchus ve vzdálenosti < 2 cm od kariny - T4: nádor jakékoli velikosti, který má satelitní lézi v jiném stejnostranném laloku nebo se šíří do:
– mediastina
– srdce
–velkých cév
– průdušnice
– zvratého nervu
– jícnu
– obratlových těl
– bifurkace průdušnice
N: regionální lymfatické uzliny
- NX: regionální lymfatické uzliny není možné hodnotit
- N0: bez přítomnosti metastáz v regionálních lymfatických uzlinách
- N1: metastázy v ipsilaterálních peribronchiálních a/nebo ipsilaterálních hilových uzlinách a intrapulmonálních uzlinách
- N2: metastázy v ipsilaterálních mediastinálních a/nebo subkarinních lymfatických uzlinách
- N3: metastázy v:
– kontralaterálních hilových nebo mediastinálních uzlinách
– v ipsilaterálních nebo kontralaterálních skalenových anebo supraklavikulárních lymfatickýchuzlinách
M: vzdálené metastázy
- MX: vzdálené metastázy není možné hodnotit
- M0: vzdálené metastázy nejsou přítomny
- M1a: – separátní nádorové uzly v kontralaterálním laloku
– maligní pleurální nebo perikardiální výpotek - M1b: vzdálené metastázy
- M1a: – separátní nádorové uzly v kontralaterálním laloku
Stadia nemoci dle TNM:
- O – TisN0M0
- IA – T1N0M0
- IB – T2aN0M0
- IIA – T1N1M0 / T2bN0M0 / T2aN1M0
- IIB – T2bN1M0 / T3N1M0
- IIIA – T1N2M0 / T2N2M0 / T3N1M0 / T3N2M0 / T4N0M0 / T4N1M0
- IIIB – T1N3M0 / T2N3M0 / T3N3M0 / T4N2M0 / T4N3M0
- IV – jakékoli T, jakékoli N, M1
5.7.6 Léčba
Chirurgie stadia I TNM klasifikace
Základním typem resekce pro karcinom ve stadiu I je asi v 75 % lobektomie s odstraněním lymfatických uzlin plíce, plicního hilu a mediastina minimálně v rozsahu, který dovoluje relevantní staging. Centrální růst tumoru nebo prorůstání nádoru přes interlobární rýhu je nutno řešit výkonem větším než lobektomie asi v 15–20 %. Naopak 5–10 % případů většinou T1 tumorů je dnes řešeno menšími, parenchym záchovnými výkony (videotorakoskopickými staplerovými resekcemi nebo otevřenými či asistovanými anatomickými segmentektomiemi). Tyto výkony jsou dobrou alternativou pro nemocné s limitem respirační nebo kardiální rezervy. Podobnou chirurgickou ekvilibristikou se zdají být video-asistované či robotické lobektomie. V dnešní době přibývá prací popisujících spolehlivost i onkologickou bezpečnost video-asistovanýchi robotických anatomických plicních resekcí. Rozdíl nákladů na robotickou resekci oproti torakoskopické však stěží nalezne adekvátní odraz v přínosu pro nemocného. Přibližně 30 % radikálně odoperovaných ve stadiu I se dočká recidivy. Menší část těchto recidiv může být diagnostikována ještě v operabilním stadiu a vyřešena chirurgicky s uspokojivými dlouhodobými výsledky. Většina recidiv (asi 70 %) je však systémových, které většinou i přes onkologickou terapii neodvratně spějí k fatálnímu konci. Adjuvantní systémová terapie není ve stadiu I dle TNM obecně indikována, radioterapie pak pouze v případě nekompletní resekce bez možnosti korekce reoperací. Velké procento systémových recidiv provokuje pneumoonkology a molekulární biology ke stále podrobnějším výzkumům ve snaze v předstihu identifikovat nádory s vysoce maligním fenotypem, u kterých lze předpokládat riziko selhání prosté lokoregionální terapie. Ty by si pak zasloužily adjuvantní léčbu. Existuje řada parametrů, které v univariantních či multivariantních analýzách vykazují korelaci s výskytem metastatického rozsevu po operaci, avšak žádný z nich ani jejich kombinace zatím nejsou v klinickém měřítku používány jako vodítka k nasazení adjuvantní léčby po resekci nemalobuněčného plicního karcinomu ve stadiu I (obr. 20).
Chirurgie stadia II TNM klasifikace
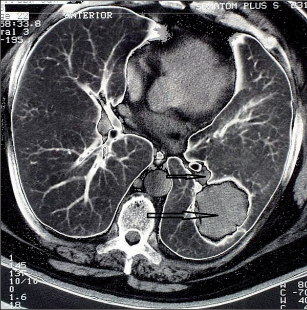
Obr. 21
Nádor T IIb N1 (stadium IIB), větší šipka ukazuje tumor o průměru 6 cm, menší šipka uzlinu N1
Klasickým výkonem pro T12N1 tumory je lobektomie, pokud jsou lokalizovány v horních lalocích.Nádory dolních laloků s postižením hilových uzlinči interlobia by zasluhovaly pneumonektomii, lze akceptovat lobektomii s pečlivou lymfadenektomií uzlininterlobia, hilu a mediastina. Nízký věk nemocnéhoa histologická diagnóza adenokarcinomu velí přidat na radikalitě (obr. 21). Nádory charakterizovanéjako T3N0 mají dobrou prognózu, jsouli resekoványkompletně. Proto je třeba vyšetřit resekční linie všechdotčených struktur, stejně jako provést lymfadenektomii hilových a mediastinálních uzlin k potvrzení stadia N0. Bronchoplastické postupy jsou samozřejmě
indikovány pro centrální nádory postihující hlavní bronchus či ústí lobárních bronchů. Recidivy lze očekávat asi v 50 % případů po kurativní resekci ve stadiu II NSCLC. Asi 70 % z nich jsou vzdálené, častější jsou u adenokarcinomů než u jiných histologických typů. To dává racionální důvod k indikaci adjuvantní terapie. Radioterapie u nemocných s N1 lymfadenopatií snižuje počet lokálních recidiv, ale na dlouhodobé přežití vliv nemá. Úloha neoadjuvantní chemoterapie je nejednoznačná, adjuvantní terapie je považována za standard.
Chirurgie stadia III TNM klasifikace
Základním atributem tohoto stadia je lokální progresea nepřítomnost vzdálených metastáz.Toto stadium jeznačně nesourodé jak z hlediska předpokládané prognózy, tak v možnostech terapeutického zásahu. Protoje výhodnější pojednat zvlášť o tumorech definovaných jako T3, T4, N2, event. N3.
Operace nádorů T3
Tumory definované jako T3 infiltrují ve svém růstu:
- periferní struktury – hrudní stěnu nebo bránici,
- mediastinální pleuru, perikard, n. phrenicus, v. azygos, a. pulmonalis,
- hlavní bronchus – méně než 2 cm od kariny, bezpostižení bifurkace,
- struktury v horní hrudní apertuře – proximální žebra, obratle, brachiální plexus, subklaviální cévní svazek, sympatikus.
Pětileté přežití kompletně resekovaných bez postižení uzlin (N0), event. při lymfadenopatii limitované na plíci (N1) je mezi 20–30 %. Pokud jsou postiženy mediastinální uzliny (N2, N3), nedosahuje pětileté přežití 10 %. V případě nekompletní resekce nelze očekávat přežití přes 2 roky. Problematika relevantního stagingu je kruciální, klinický staging je totiž zatížen chybou až 40 %. Přibližně 20 % případů hodnocených klinicky jako T3 je definitivně zařazeno jako T2, stejné procento naopak jako T4 nebo N2. Videotorakoskopie dokáže odhalit hranici mezi neexistující invazí a infiltrací okolních struktur (tedy T2 versus T3–4). Posouzení o kvalitu výše, tedy mezi resekabilním a neresekabilním nádorem (T3 versus T4), je obvykle možné pouze během torakotomie. Infiltrace hrudní stěny: Morbidita vázaná na resekci hrudní stěny je nevýrazná ve srovnání s rizikem lokální recidivy, proto v případech, kdy nejde o evidentní pozánětlivou adhezi plíce k hrudní stěně, je bloková resekce plíce a segmentu hrudní stěny metodou volby. Inkompletní resekce dává neuspokojivé výsledky, ani její zajištění radioterapií nebo radiochemoterapií tento stav významně nezlepší (obr. 22).
Výskyt nádorů infiltrujících bránici je vzácný. V případě T3N0 je dlouhodobé přežití stejné jako v případě postižení hrudní stěny. Často však zůstává takový nádor dlouho nepoznán, pro rentgenology skryt za stínem bránice, a bývá diagnostikován ve stadiu generalizace. Pouhá lymfatická diseminace do uzlin plíce zhoršuje prognózu významně, nemocní s nádory infiltrujícími bránici a mediastinální lymfadenopatií přežívají 5 let od operace zcela výjimečně.Nádory prorůstající do mediastina postihují nejčastěji mediastinální pleuru, mediastinální tuk a hlavní plicní cévy. Průměrné pětileté přežití radikálně resekovaných se blíží 30 % nezávisle na tom, zda jde o nemocné s N0 či N1 lymfadenopatií. Základním negativním prognostickým parametrem je nekompletnost resekce.Nádory infiltrující hlavní bronchus je možné také resekovat kompletně. Pak mají šanci na přežití opět blízkou 40 %, jdeli o N0, a 30 %, jde-li o N1. Postižení mediastinálních uzlin vylučuje naději na dlouhodobé přežití.Apikální léze Pancoastova typu lze odstranit kompletně s předpokladem pětiletého přežití okolo 40 % v případě N0. Průměrné přežití v neselektovaných souborech je kolem 30 %. N2 lymfadenopatie, postižení brachiálního plexu nad kořen C8 a předoperačně prokázaná intraspinální propagace kontraindikují operaci.T3N2 nádory mají obecně velmi špatnou prognózu, avšak i v jejich případě lze provést v kombinovaném protokolu kompletní resekci. V případě mnohočetného postižení uzlin mediastina je pětileté přežití pod 10%. Mediastinální lymfadenopatie rozpoznaná až při operaci a postižení pouze jedné mediastinální uzliny (singlenodal involvement) dávají asi 20% šanci na pětileté přežití.
Operace nádorů T4
Nádory mohou infiltrovat kteroukoli okolní tkáň či strukturu. Podle Grunewalda (2000) jsou T4 nádory potenciálně resekabilní (infiltrace horní duté žíly, kariny, dolní části průdušnice, levé předsíně) – T41, na rozdíl od definitivně neresekabilních – (infiltrace jícnu, obratlů, maligní pleurální či perikardiální výpotek) – T42. Poměrně vysoké riziko operační (až 20%) je vysokou cenou za šanci na delší přežití. V případě karinálních resekcí lze dosáhnout pětiletého přežití přes 20%. Ostatní struktury lze řešit chirurgicky se šancí jen nepatrně menší za předpokladu, že mediastinální uzliny nejsou postiženy a nejsou prokázány vzdálené metastázy (obr. 23).
Operace při stejnostranné mediastinální lymfadenopatii (N2 dle TNM)
Maligní lymfadenopatie mediastina představuje závažný negativní prognostický faktor. Prognóza neléčených je špatná, medián přežití je přibližně 7 měsíců, 1leté přežití do 10 %, nikdo nepřežije 2 roky od stanovení diagnózy. Kompletní resekce dává šanci až na 30% přežívání v případě postižení pouze jedné uzliny mediastina (single node disease), při minimálním postižení uzlin mediastina (klinicky neprokázaném, objeveném až při operaci) a při T1 primárním tumoru. Ještě lepší výsledky dává kompletní resekce nádorů levé plíce s postižením uzlin pozice 5 a 6, tedy preaortálních a subaortálních. Naproti tomu dlouhodobé výsledky operovaných, kteří mají radiograficky patrné uzliny (bulky disease) a v definitivním preparátu prokázaný extrakapsulární růst metastáz, jsou neuspokojivé. Pětileté přežití nedosahuje 10 %, většina nemocných zemře do 3 let od operace na generalizaci, která tvoří přibližně 80 % všech recidiv. Tato čísla jasně ukazují, že chirurgie jako samostatná modalita má jen velmi omezenou úlohu v terapii stadia IIIA/N2. Radioterapie jako metoda lokoregionální také nemůže vyřešit otázku systémového selhání, i když může snížit počet lokálních recidiv. Pouze systémová léčba dává racionální předpoklad pro zlepšení prognózy těchto stadií plicní rakoviny, i když doposud stále není jasné, jaká kombinace a časový sled jednotlivých léčebných modalit je nejvhodnější, jaké mají být dávky chemoterapeutik nebo záření, jak aplikovat biologickou léčbu a jaká je vůbec úloha chirurga v tomto stadiu.
Chirurgie při kontralaterální mediastinální lymfadenopatii (N3 dle TNM)
Stadium IIIB/N3 nadále platí za nechirurgické. Nicméně zejména japonští autoři dokládají, že i u těchto nemocných lze dosáhnout pětiletého přežití po chirurgické intervenci. Jsou to však ojedinělé studie, které nemají obdobu v evropské ani severoamerické literatuře. Nicméně zavedení principu indukční terapie do klinické praxe znamenalo oživení zájmu o chirurgii tohoto stadia. Některé práce dokládají více jak 20% pětileté přežití u nemocných s biopticky ověřeným stadiem IIIB/N3 léčených kombinací agresivní radiochemoterapie a radikální (kompletní – R0) chirurgické operace. Údajů je však zatím málo na to, aby byla role chirurgie při kontralaterální maligní lymfadenopatii přehodnocena (10).Z výše uvedených skutečností plyne, že III. stadium plicní rakoviny, stadium lokálně pokročilé nemoci, je nutno léčit kombinovanými protokoly, ve kterých má chirurgie ne zcela jasně definovanou roli. Tak jako je nepředstavitelný úspěch systémové terapie bez lokální kontroly tumoru, 80 % systémových recidiv po operaci zcela jasně ukazuje, že bez systémové léčby má chirurgie smysl jen u ojedinělých nemocných v tomto stadiu.Samotnou chirurgickou terapii lze u III. stadia akceptovat za těchto okolností:1. Velmi limitované stadium III dané pouze jedním parametrem (jen T3, N2, nebo jen T4).2. Lze předpokládat kompletní (R0) resekci.3. Je vyloučena pečlivě kontralaterální lymfadenopatiea generalizace.
Chirurgie stadia IV TNM klasifikace
Metastazující plicní karcinom má velmi minimální šance na kurativní léčbu, a to pro mnohočetnost metastatického procesu a jeho pravidelnou multilokalitu.
Nejčastějším cílovým orgánem, resp. tkání je skelet (33%), mozek (18%), kontralaterální plíce, resp. pleura (16%, resp. 12%), játra (9%) a nadledviny (6%).Jen zcela výjimečně metastázuje plicní karcinom solitárně (ať už synchronně či metachronně). V takovém případě může metastazektomie zlepšit dlouhodobé přežití.
5.8 Sekundární plicní novotvary
5.8.1 Patofyziologie metastatického procesu
Kromě lokální invazivity tumoru je druhým základním atributem maligního nádoru potenciál k metastatickému rozsevu. V první řadě se musí vitální nádorová buňka uvolnit z primárního nádoru a skrze stroma, bazální membránu a endotel vycestovat do cévy (intravazace). Pomocí krevního nebo lymfatického systému se musí dostat do tkáně, ve které jsou příhodné podmínky pro další růst metastázy. V této tkáni či orgánu se musí zastavit, resp. přichytit k endotelu příslušné cévy a pomocí analogických mechanismů, které nádorové buňce pomohly do oběhu vcestovat, systém zase opustit (extravazace). Na příhodném místě pak znovu začíná kolotoč proliferace a lokální invaze. Metastázy solidních novotvarů jsou nejčastěji lokalizovány v játrech, druhým nejčastěji postiženým orgánem jsou plíce.
5.8.2 Histologie
Nejčastějšími kandidáty chirurgie jsou nemocní s metastázami sarkomů, ať už měkkých tkání či osteosarkomu. Pro nádory hlavy a krku je kromě lymfogenního rozsevu metastázování do plic typické. Kolorektální karcinom metastázuje nejčastěji do jater, ale asi u 10 % nemocných se v průběhu nemoci vyvinou i plicní metastázy. Resekabilní bývají zřídka zejména pro časté synchronní postižení jater. Také u karcinomu prsu je metastázování pouze do plic vzácné. Solitární či nečetné metastázy mohou být resekovány s benefitem prodloužení přežití. U nádorů ledvin je naopak solitární metastázování poměrně časté, pokud jde o metachronní výskyt a nejsou postiženy uzliny, je resekce i více ložisek metodou volby. Testikulární nádory metastázují do plic často, ale reagují velmi dobře na radiochemoterapii, chirurgická intervence se omezuje většinou na resekci reziduálních ložisek, ve kterých lze očekávat nekrózu, reziduální tumor či vyzrálý teratom. Operace je pak důležitá pro posouzení nutnosti další léčby. Gynekologické nádory se nejčastěji projevují maligním peritoneálním/pleurálním výpotkem, oligometastatický rozsev může být léčen chirugicky, ale výsledky nejsou zcela uspokojivé. U řady dalších solidních nádorů (melanoblastom, karcinom prostaty, nádory štítné žlázy) může být metastazektomie benefitem za předpokladu kontroly primárního ložiska a kompletní resekce.
5.8.3 Diagnostika
Až 90% nemocných s plicními metastázami je asymptomatických, protože léze rostou často periferně, někdy je naopak metastáza diagnostikována dříve než primární nádor. Kašel ani hemoptýza nejsou typické, objevují se jen u centrálních ložisek nebo u vzácných endobronchiálních metastáz. Dušnost je pak projevem masivní infiltrace parenchymu či lymfatických cest, indukovaného výpotku nebo obstrukce dýchacích cest. Pokud se tedy metastatický rozsev manifestuje klinicky, jde většinou o terminální, inkurabilní stav.
Diagnostický protokol je podobný jako u karcinomu plic, asi tři čtvrtiny plicních metastáz bývají diagnostikovány pomocí RTG/CT pod obrazem vícečetných (mnohočetných) plicních uzlů, obvykle kulatých a dobře ohraničených. Většinou postrádají kalcifikace (s výjimkou sekundárních ložisek osteoči chondrosarkomů, teratomů). V diferenciální diagnostice je třeba uvažovat o nodulárních specifických infekcích či plicních abscesech. Pro CT je typické, že většinou podhodnocuje skutečný stav metastatického rozsevu, zavedení PET/CT do diagnostického protokolu přineslo zřetelný posun, ale diagnostika lézí menších než1 cm také není zcela spolehlivá. Výhodou PET/CT je možnost zhodnocení intrai extratorakálního rozsevu, možnost nálezu primárního ložiska či vyloučení lokální recidivy. Kromě plicního parenchymu mohou být postiženy i lymfatické uzliny mediastina, stává se tak u testikulárních nádorů, melanoblastomů, nádorů prsu, ledvin.Bronchoskopie bývá často negativní, diagnostika se proto opírá o bioptické metody, transparietální biopsii nebo častěji videotorakoskopickou či videoasistovanou excizi. Chirurgické excize mohou být vedeny při validním peroperačním histologickém vyšetření jako terapeutické.
5.8.4 Chirurgická léčba
Metastazektomie je indikována za přepokladu, že není jiná lepší alternativa léčby a jsou splněny tyto podmínky:
- primární tumor je vyřešen,
- nejsou extrapulmonální metastázy (až na raritní výjimky),
- z lokálního i celkového hlediska je proveditelná kompletní resekce.
Principem chirurgie sekundárních plicních novotvarů je kompletní resekce při dosažení negativních resekčních linií (požaduje se 1 cm) a zachování maximálního množství zbylého funkčního parenchymu (obr. 24). Klínovitě lze resekovat metastázy na periferii laloků, hlouběji uložené léze lze řešit kráteriformními excizemi, centrálněji uložené léze vyžadují anatomické výkony v rozsahu segmentů či laloků. Pneumonektomie je naprosto výjimečnou cenou za kontrolu metastatického procesu, bronchoplastický, resp. angioplastický výkon by měl být v každém případě preferován. Metastázy lze operovat videotorakoskopicky, videoasistovaně či otevřeným přístupem. Při
bilaterálním výskytu lze operovat v jedné době cestou 2 laterálních přístupů či transsternálně, nebo ve dvoudobách, zaleží na lokalizaci metastáz a kondici nemocného. Remetastazektomie jsou možné za splnění výše uvedených kautel a dostatečné funkční rezervěplic. Lymfadenektomie mediastinálních uzlin je považována za nutnou součást operace, PET/CT negativníscan mediastina při akumulujících metastázách tuto podmínku relativizuje.
5.8.5 Prognóza
U kompletně resekovaných nemocných lze u výše uvedených diagnóz očekávat po metastazektomii pětileté přežití přibližně v 13–60 %. Z prognostických ukazatelů má největší váhu kompletnost resekce, solitární nález a dlouhý inteval mezi primární operací a metastazektomií.
5.9 Využití laseru v plicní chirurgii
Užití laseru v plicní chirurgii má dlouhou historii sahající do 60. let minulého století, kdy byl pulzní typ laseru užíván při léčbě plicních metastáz. S vývojem a zdokonalováním laserových přístrojů se užívání laserového paprsku zvláště v chirurgii plicních metastáz v posledních desetiletích stále více rozšiřuje. Úpravou vlnové délky laserového paprsku bylo dosaženo zlepšené vaporizace a koagulace plicní tkáně. Jako optimální pro užití v plicní chirurgii se v současnosti jeví Nd:YAG Laser System s vlnovou délkou 1,318 nm. Mezi přednosti užití laseru se uvádí možnost precizní resekce periferních i centrálně uložených metastáz, optimální kontrola resekční plochy s dokonalým uzávěrem bronchů a cév, a tím minimalizace krvácení. Užití laseru umožňuje excizi mnohočetných metastáz při maximálním šetření plicního parenchymu. K nevýhodám patří poněkud větší časová náročnost výkonu a vyšší náklady na pořízení laserového přístroje. V současnosti používá tuto techniku v České republice chirurgická klinika v Plzni a chirurgické oddělení nemocnice a Komplexního onkologického centra v Novém Jičíně (obr. 25, 26, 27, 28).
5.10 Literatura
- Becker HD, Hohenberger W, Junginger T, Schlag PM, editors. Chirurgická onkologie. Praha: Grada Publishing; 2005.
- Cahan WG, Watson WL, Pool JL. Radical pneumonectomy. J Thorac Surg. 1951;22:476–483.
- Ginsberg RA. Atlas of clinical oncology. Lung cancer. Hamilton: BC Decker Inc; 2002.
- Grunenwald DH. Surgery for advanced stage lung cancer. Semin Surg Oncol. 2000;18:137–142.
- Klein J. Chirurgie karcinomu plic. Praha: GradaPublishing; 2006.
- Kolek V, Vašák V. Pneumologie. Praha: Maxdorf;2010.
- LoCicero J, Hartz RS, Frederiksen JW, MichaelisLL. New applications of the laser in pulmonarysurgery. Hemostasis and sealing of air leaks. AnnThorac Surg. 1985;40:546–550.
- Mathisen DJ, Grillo HC. Carinal resection forbronchogenic carcinoma. J Thorac Cardo VascSurg. 1991;102:16–23.
- Minton JP, Andrews NC, Jesseph JE. Pulsed laserenergy in the management of multiple metastase. J Thorac Cardiovasc Surg. 1967;54:707–713.
- Nakahara H, Ohno K, Matsumura A. Extendedoperation for lung cancer invading the aorticarch and superior vena cava. J Thorac CardiovascSurg. 1989;97:428–433.
- Pearson GF, Cooper JD, Deslauriers J, Ginsberg RJ, Hiebert CA, Patterson GA, Urschel HC. Thoracic surgery. New York: Churchil Livingstone;2002.
- Pitz CC, Brutel de la Riviere A, van Swieten HA,Westermann CJJ, Lammers JWJ, Bosch JMM. Results of surgical treatment of T4 nonsmall celllung cancer. Europ J Cardio Thorac Surg. 2003;24:1013–1018.
- Pichlmaier H, Schildberg FW. Thoraxchirurgie.Heidelberg: Springer; 2006.
- PriceThomas C. Conser vative resection ofthe bronchial three. J R Coll Sulg Edinb. 1956;1:169–173.
- Procházka J. Resekce plic. Praha. SZN; 1954.
- Rendina EA, Venuta F, De Giacomo T, Ciccone AM, Ruvolo G, Coloni GF, Ricci C. Inductionchemotherapy for T4 centrally located nonsmalllung cancer. J Thorac Cardiovasc Surg. 1999;117:225–29.
- Rolle A, Pereszlenyi A, Koch R, Bis B, Baier B. Laser Resection Technique and Results of MultipleLung Metastasectomies Using a New 1,318 nmNd: ZAG Laser Systém. Laser Med Surg. 2006;38:26–2.
- Řehák F, Šmat V. Chirurgie plic a mediastina.Praha: Avicenum; 1986.
- Tsuchiya R, Asamura H, Kondo H. Extended resection of the left atrium, reat vessels, or both forlung cancer. Ann Thorac Surg. 1994;57:960–965.