9 Refluxní nemoc jícnu
9.1 Definice
Gastroezofageálním refluxem (GER) rozumíme průnik žaludečního, respektive duodenálního a jejunálního obsahu do jícnu. Můžeme se s ním ojediněle setkat za fyziologických situací, při zvýšení intraabdominálního tlaku nebo postprandiálně. Zpravidla jde ale o patologický reflux, jehož příčinou je funkční nebo morfologická nedostatečnost gastroezofageálního spojení, označovaná také jako inkompetence. Refluxní nemoc [1] nebo jiné užívané názvy – kardioezofageální iritace [2], refluxní syndrom [3] – je každá patologická reakce jícnu a nemocného – subjektivní nebo objektivní – na dráždivý vliv GER.
9.2 Etiopatogeneze
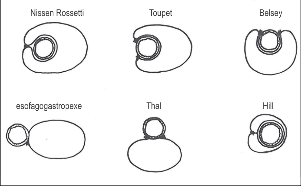
Na vzniku refluxní nemoci jícnu se podílejí následující složky (obr. 1):
- Inkompetence antirefluxního mechanizmu,
- Charakter refluxního sekretu,
- Samočistící schopnost jícnu,
- Odolnost stěny jícnu.
9.2.1 Inkompetence antirefluxního mechanizmu
Normální funkci uzavírajícího mechanizmu gastroezofageálního spojení označujeme jako jeho kompetenci. Její poruchou – inkompetencí – vzniká gastroezofageální reflux, který je příčinou dalšího rozvoje patogenetického řetězce celého onemocnění.
9.2.1.1 Dolní jícnový svěrač (DJS)
Nejdůležitější složkou antirefluxního mechanizmu je DJS. Při vzniku inkompetence GES může jít o jeho primární poškození nebo o poruchu jeho regulačních mechanizmů. Bylo prokázáno mnoha pracovníky, že jeho funkce není závislá na topografické poloze [4]. Otevřená je otázka významu gastrinu a jiných gastrointestinálních hormonů pro jeho funkci, stejně jako vliv nervové regulace [5, 6]. Manometricky je obvyklý nález snížených hodnot klidového tlaku v oblasti DJS u pacientů s refluxní nemocí jícnu ve srovnání se zdravými dobrovolníky. K těmto závěrům dospělo shodně několik pracovních skupin (tab. 1). Výrazem insuficience antirefluxního mechanizmu je rovněž snížení tzv. funkční rezervy DJS.
| Tab. 1 Klidový tlak v oblasti DJS u refluxní nemoci jícnu [7, 8] |
||
| Refluxní nemoc jícnu | Kontrolní skupina | |
| Cohen a Haris (1971) | 0,400 ± 0,133 kPa (3 ± 1 mm Hg) |
2,53 ± 0,133 kPa (19 ± 1 mm Hg) |
| Siewert (1974) | 1,47 ± 0,400 kPa (11 ± 3 mm Hg) |
2,53 ± 0,933 (19 ± 7 mm Hg) |
| Krejs (1976) | 1,60 ± 0,800 kPa (12 ± 6 mm Hg) |
2,40 ± 1,07 kPa (18 ± 8 mm Hg) |
| Dlouhý, Duda, Minařík (1979) | 1,6 ± 1,9 kPa (12,3 ± 14,5 mm Hg) |
2,8 ± 0,9 kPa (21,0 ± 6,9 mm Hg) |
.
9.2.1.2 Hiátové hernie
Skluzná a smíšená hiátová hernie je často provázena gastroezofageálním refluxem. Můžeme se s ním setkat i bez herniace, ale častá koincidence obou stavů svědčí pro to, že mezi nimi existuje kauzální vztah. Šetka u 665 nemocných s kardioezofageální iritací prokazuje hiátovou hernii v 85% [9]. Siewert se spolupracovníky [10] z 254 pacientů s HH zjistil GER v 66%. Obdobné jsou i zkušenosti dalších autorů [11].
9.2.1.3 Chalázie
U novorozenců se v prvních týdnech života pravidelně setkáváme s insuficiencí ezofagogastrického spojení, aniž by byla prokazatelná HH. Do druhého měsíce lze tento stav, označovaný jako chalázie nebo Forme Mineure hiátové hernie (Shmerling), považovat za fyziologický [8]. Pokud se u novorozence a malých dětí vyvine symptomatologie refluxní nemoci (úporné zvracení, úbytek hmotnosti, plicní komplikace, krvácení s anémií), snažíme se ji zvládnout konzervativní léčbou [12, 13]. Průkaz HH se obvykle daří u méně než poloviny operovaných dětí. Pro tento věk je charakteristické nebezpečí komplikací. Patří mezi ně zejména plicní symptomatologie, krvácení a vznik peptických striktur jícnu [14, 15, 16, 17]. V období před zavedením moderní medikamentózní léčby doporučovali Vose [13] a Prinsen [12] trvání konzervativní léčby maximálně 2–3 měsíce. Při dnešním způsobu léčby se obtíže z GER upraví obvykle do 18 měsíců a frekvence závažných komplikací nepřesahuje 10%. Při neúspěchu je indikována chirurgická terapie, jejíž zásady se neliší od postupů v dospělosti. „Čistá“ inkompetence gastroezofageálního spojení bez nálezu hiátové hernie bývá někdy i v dospělosti označována jako hypotenzní svěrač. Mezi 6491 vyšetřenými nemocnými na Mayo klinice zjistili tuto vzácnou odchylku v 1,65% [18]. Zvláště při využití všech diagnostických možností se za ní často skrývá obtížně prokazatelná HH.
9.2.1.4 Další exogenní a endogenní faktory
Pochopitelný je vznik inkompetence GES po operačních výkonech, tangujících přímo tuto oblast, jako je resekce, kardioplastika nebo ezofagokardiomyotomie.
Poruchou anatomických poměrů se stav vysvětluje rovněž po subtotální nebo dvoutřetinové resekci žaludku [19, 20, 21, 22, 23]. Souvislost s jinými operačními výkony je problematická. V souboru 396 nemocných operovaných v Olomouci do roku 1982 pro refluxní nemoc jícnu se toto onemocnění manifestovalo u 17 nemocných v různém odstupu po resekci žaludku. Resekce žaludku předcházela vzniku RNJ ještě u dalších 9 pacientů, kteří nebyli operováni. U 5 z nich vznikla peptická striktura terminálního jícnu. U 23 operovaných byla provedena obvyklá dvoutřetinová resekce a u 3 subtotální resekce žaludku. Pasáž byla rekonstruována dvacetkrát podle typu Billroth II a šestkrát podle typu Billroth I. Doba, o kterou resekce předcházela vzniku refluxní symptomatologie, kolísala od několika týdnů až do 23 let. Více než u poloviny operovaných šlo o dobu poměrně krátkou, nepřesahující 6 měsíců. Zvláště krátký byl tento interval u striktur, kde kolísal od jednoho do dvanácti týdnů. Devět nemocných bylo léčeno konzervativně a sedmnáct operací (jedenkrát Allisonova, jedenkrát Haywardova, jedenkrát Collisova operace, jedenkrát ezofagogastropexe, dvakrát interpozice, jedenkrát Thalova, třikrát Belseyho a sedmkrát Nissen-Rossettiho operace).
Mezi příčinami vedoucími ke vzniku refluxní nemoci jícnu po resekci žaludku se uvažuje o řadě možností. Na prvním místě je to poškození závěsného aparátu ezofagogastrického spojení a redukce Hisova úhlu jako důsledek provedené operace [21, 22, 23]. Význam mohou mít i endokrinně-sekretorické změny po resekci žaludečního antra. Poklesu hladiny krevního gastrinu se přisuzoval vliv na vznik insuficience DJS [24, 25]. Další výzkumy však přímý vliv hladiny gastrinu v krvi na vznik refluxní nemoci nepotvrzují [6, 26]. Resekce žaludku vytváří předpoklady pro vliv alkalického sekretu a žluči na distální jícen, což může vést ke vzniku insuficience DJS [27, 28]. Konečně může dojít po resekci žaludku k manifestaci již před operací existující nerozpoznané refluxní nemoci jícnu.
Obdobně je soustředěn zájem na otázku vlivu vagotomie na funkci DJS. Provedené experimentální i klinické studie si mnohdy protiřečí. Přesto lze vcelku říci, že vyšší trunkální vagotomie vede k poklesu tlaku v oblasti DJS [29, 30, 31]. Naproti tomu vagotomie v těsné blízkosti terminálního jícnu a zejména proximální gastrická vagotomie neovlivňuje tonus DJS [32, 33, 34]. V prospektivní studii na počátku 80. let minulého století jsme sledovali vliv resekce žaludku a proximální gastrické vagotomie na kompetenci DJS. Prováděli jsme manometrii DJS se stanovením klidového tlaku a reakci svěrače na břišní kompresi. Nemocní byli vyšetřeni rentgenologicky, endoskopicky a biopticky. Vyšetření jsme prováděli před operací a po operaci v intervalu 3 týdnů, 3 měsíců a po 1 roce (tab. 2).
| Tab. 2 Klidový tonus dolního jícnového svěrače u nemocných před resekcí žaludku a superselektivní vagotomií a po ní |
||||
| Výkon Počet Jednotky |
Před operací | Po operaci | ||
| 3 týdny | 3 měsíce | 1 rok | ||
| Resekce:n: 20 kPa mm Hg |
3,0 ± 1,6 (22,7 ± 11,7) | 5,0 ± 2,5 (37,5 ± 19,1) | 3,3 ± 1,0 (24,7 ± 7,4) | 2,8 ± 0,9 (20,9 ± 6,8) |
| Vagotomie:n: 13 kPa mm Hg |
3,4 ± 1,9 (25,4 ± 14,1) | 4,6 ± 2,3 (34,6 ± 17,6) | 3,1 ± 1,3 (23,2 ± 9,8) | 3,0 ± 1,4 (22,7 ± 10,6) |
.
V obou skupinách nemocných byl klidový tonus dolního jícnového svěrače před operací normální, stejně jako reflektorické zvýšení tlaku při břišní kompresi. Totéž platí pro rentgenologické, endoskopické a bioptické vyšetření. Nikdy nebyly prokázány známky refluxní nemoci jícnu. U třech vyšetřených prokazovala manometrie při kompresi břicha subkompetentní kardii. Po provedené resekci žaludku došlo u těchto nemocných k normalizaci manometrického nálezu. Po resekci žaludku a zejména po proximální vagotomii byl klidový tonus v oblasti DJS při první pooperační kontrole zvýšen. Po třech měsících došlo k jeho normalizaci a tento nález trval i po jednom roce. Klinické, rentgenologické, manometrické, endoskopické a bioptické vyšetření po operaci neprokazovalo žádnou funkční poruchu GES. Získané výsledky nesvědčí pro příčinný vztah mezi provedenou resekcí žaludku a vznikem gastroezofageálního refluxu. Tento fakt podporuje i skutečnost, že snížení tlakových hodnot v oblasti DJS a procento výskytu gastroezofageálního refluxu po resekci žaludku, které se pohybuje mezi 11–23% (jen menší část má klinickou symptomatologii), se příliš neliší od výsledků zjištěných při vyšetření kontrolních asymptomatických skupin dobrovolníků, u nichž je frekvence 15–18% [35, 36, 37]. Naopak úspěšný léčebný zásah (resekce) pro duodenální vřed vedl k úpravě předtím subkompetentní kardie u dvou nemocných.
Naše vyšetření rovněž nepotvrzuje přímý vliv proximální gastrické vagotomie na funkci gastroezofageálního spojení, což odpovídá i zkušenostem jiných [32, 33, 34]. Zvýšení tonusu DJS v prvních pooperačních týdnech lze vysvětlit operační traumatizací. Vznikem pooperačního edému v této oblasti je možné vysvětlit i přechodnou dysfagii v prvních týdnech po vagotomii, která se spontánně upraví. Vznik refluxní nemoci jícnu po proximální gastrické vagotomii není popisován. Sami jsme pozorovali u jednoho nemocného s recidivou duodenálního vředu po proximální gastrické vagotomii manifestaci refluxní choroby jícnu, což si vysvětlujeme spíše jako sekundární gastroezofageální reflux v souvislosti s duodenálním vředem.
Na častou koincidenci refluxní ezofagitidy a peptického duodenálního vředu upozornil již v roce 1935 Winkelstein [38]. Současný výskyt se udává mezi 1–20% [39, 40]. S ještě vyšší koincidencí se můžeme setkat u cholelitiázy [40]. Známá je Saintova trias (hiátová hernie, cholelitiáza a divertikulóza tlustého střeva). Opakovaně je v literatuře diskutován vztah hiátových hernií a refluxní symptomatologie s kardiálními obtížemi [41]. Většina těchto onemocnění patří mezi civilizační choroby. Jejich frekvence v populaci stoupá a jejich vzájemný patogenetický vztah zůstává nedořešenou otázkou.
Se známkami inkompetence gastroezofageálního spojení se můžeme setkat u obézních jedinců a stavů vedoucích ke zvýšení intraabdominálního tlaku. Nejčastěji je to gravidita a ascites [42]. Může tomu tak být i u dlouhodobě ležících anebo při delším ponechání gastroduodenální sondy [43]. Mezi exogenní faktory, které mohou mít spoluúčast na vzniku refluxních obtíží, patří i některé medikamenty, na tuk bohatá jídla, nikotin, alkohol a kofein.
Objev Heliobacter pylori významně zasáhl v gastroenterologii zejména do léčby gastroduodenálního vředu. V případě RNJ je však náhled na jeho eradikaci kontroverzní. V gastroenterologické veřejnosti je často zastáván názor, že eradikace je vhodná při léčbě RNJ. V Maastrichtských doporučeních GERD (RNJ) však není uvedena absolutní indikace k eradikaci Helicobacter pylori. Tato infekce podle dnešních znalostí pravděpodobně nehraje roli v etiopatogenezi RNJ. Otázka, zda přítomnost Helicobacter pylori je protektivním, či predisponujícím faktorem při vzniku RE, není rozřešena a navíc se ukazuje, že po jeho eradikaci se spíše snižuje účinnost blokátorů protonové pumpy [145, 280].
9.2.2 Charakter refluxního sekretu
Nejdůležitější součástí refluxního sekretu je obvykle kyselina chlorovodíková a pepsin. Často se hovoří o peptické ezofagitidě. Mimo svůj přímý účinek na jícnovou sliznici se kyselina podílí hlavně na aktivaci pepsinu, který je nejúčinnější při hodnotách kolem pH 2 [6]. Předpoklad zvýšeného výskytu refluxní symptomatologie při hypersekreci žaludeční ve spojení s dvanácterníkovým vředem [44] nebo Zollinger-Ellisonovým syndromem [45] však nebyl jednoznačně potvrzen. Pouhá žaludeční hypersekrece bez poruchy funkce DJS nevede ke vzniku refluxní nemoci jícnu. Casasa u 155 dětí s refluxní symptomatologií zjistil, že v případech spojených s hyperaciditou byla konzervativní léčba neúspěšná. Hyperaciditu proto považuje za vhodné indikační kritérium pro volbu operace [15]. Naproti tomu se můžeme s RNJ setkat ve vyšším věku při snížené žaludeční aciditě, dokonce i u nemocných s achlorhydrií.
Symptomatologii RNJ může vyvolat i sekret jejunální a dvanácterníkový s bohatým obsahem žlučových kyselin a pankreatické sekrety [28]. K této alkalické ezofagitidě dochází buď v důsledku duodenogastrickoezofageálního refluxu [27], nebo po resekčních chirurgických výkonech na žaludku a zejména kardii.
9.2.3 Samočisticí schopnost jícnu
Doba, po kterou refluxní sekret setrvává v jícnu, má velký význam pro vznik refluxní nemoci jícnu. Je určována motorickou funkcí ezofagu a označujeme ji jako samočisticí schopnost. U většiny nemocných se ezofagitida vyvíjí zpočátku hlavně během noci, kdy je polykání, a tím i primární jícnová peristaltika velmi řídká. Významnou roli má i peristaltika sekundární. Dobrá funkce horního jícnového svěrače brání zejména vzniku plicních komplikací [6]. U nemocných s refluxní symptomatologií je pravidelně pozorována motorická dysfunkce jícnu. Jde hlavně o poruchu primární peristaltiky a vznik terciárních kontrakcí [46]. Zůstává dosud otevřenou otázkou, zda jsou tyto změny primárním nebo sekundárním následkem GER. Bez ohledu na tuto nejasnost jednou vzniklé poruchy motoriky hrají významnou roli v dalším rozvoji patogenetického řetězce tohoto onemocnění.
Na význam jícnové motoriky ukazuje častý výskyt ezofagitidy u sklerodermie, u níž je významně oslabena jícnová peristaltika [47]. Stejným způsobem lze vysvětlit i vznik pooperačního zánětu jícnu.
9.2.4 Odolnost stěny jícnu
Dlaždicobuněčná výstelka jícnu vykazuje zejména v experimentu značně nižší odolnost vůči digestivním účinkům gastrointestinálních sekretů ve srovnání s jinými typy epitelu [48]. V praxi je individuální citlivost značně rozdílná. Dlouholetý reflux nemusí vést k výraznějším morfologickým změnám ve stěně jícnu. Naproti tomu krátkodobá anamnéza refluxních obtíží může být sledována rozvojem těžkých fibroproduktivních změn se vznikem striktury a vředu.
9.3 Klasifikace
Z hlediska patogenetického rozlišujeme primární gastroezofageální reflux, respektive primární refluxní nemoc. Příčinou je inkompetence GES (viz obr. 1). Náleží sem i stavy spojené se skluznou hiátovou hernií, protože tato anatomická úchylka je sama o sobě většinou bez klinického významu. Sekundární gastroezofageální reflux či sekundární refluxní nemoc jícnu je následkem porušení GES operačními výkony nebo jinými onemocněními (sklerodermie, diabetická vaskulární neuropatie apod.). Řadíme sem i pylorostenózu, zvýšený intraabdominální tlak, dietní, medikamentózní, terapeutické vlivy apod., jsou-li jedinou příčinou gastrozofageálního refluxu. Tyto faktory mohou ovšem zhoršovat i primární onemocnění.
V klinické praxi se uplatňuje hlavně morfologicko-funkční členění. Mezi nekomplikované stavy patří nemocní s obtížemi funkčního charakteru bez prokazatelných morfologických změn na sliznici jícnu. Řadíme sem i endoskopicky a biopticky prokazatelnou lehčí formu refluxní ezofagitidy. Konzervativní léčba je u těchto nemocných zpravidla úspěšná. Komplikované stavy představují následky těžké refluxní ezofagitidy. Jako synonymum navrhl Rossetti označení funkční a organická RNJ [49]. Dnes se spíše uplatňuje rozdělení na neerozivní a erozivní refluxní nemoc (ezofagitidu) – viz podrobně kap. 9.5 Refluxní ezofagitida.
Pomocí jícnové manometrie je možno zjišťovat funkční rezervu DJS. Podle toho, zda reaguje vzestupem intraluminálního tlaku na abdominální kompresi a na podání pentagastrinu, rozlišujeme kompenzovanou nebo dekompenzovanou insuficienci DJS. Dekompenzovaný stav, který odpovídá zpravidla těžší formě refluxní ezofagitidy, má obvykle menší naději na zlepšení konzervativní léčbou [39].
9.4 Epidemiologie
O výskytu skluzných hiátových hernií a refluxní nemoci jícnu a jejich vzájemném vztahu již bylo pojednáno v kapitole o hiátových herniích. Vztah mezi HH a RNJ je stále předmětem kontroverzních diskuzí. Faktem však je, že HH prokazujeme u 54–94% pacientů s refluxní ezofagitidou, což je významně více než ve zdravé populaci [50]. Holloway uvádí následující faktory, kterými hiátová kýla ovlivňuje antirefluxní bariéru: oslabení bráničního hiátu, poškození frenoezofageální membrány, retence tekutiny v kýlním vaku, ztráta intraabdominálního segmentu jícnu, ztráta podpory dolního jícnového svěrače bránicí a jeho zkrácení dislokací do mediastina [51]. Epidemiologicko-statistické průzkumy jsou zaměřeny především na výskyt refluxních obtíží, jako je pyróza a regurgitace, a udávaný výskyt v jednotlivých šetřeních a zemích kolísá ve velkém rozsahu. Locke (1997) ve svém šetření z Minessoty v USA uvádí, že pyrózu a regurgitaci v posledním roce mělo 42–45% populace a 20% mělo tyto potíže nejméně jednou týdně [52]. Podle šetření z Evropy mělo refluxní symptomy 7% obyvatel ve Švýcarsku a 27% ve Finsku [53]. Dentova studie z roku 2005 uvádí, že erozivní ezofagitidou trpí 7% osob v USA a v Evropě tato frekvence kolísá mezi 2–10% [54]. I když lze spekulovat o spolehlivosti těchto údajů, je jisté, že refluxní obtíže ztěžují život velkému počtu obyvatel ve vyspělých zemích. Refluxní nemoc patří mezi chronická civilizační onemocnění snižující kvalitu života postiženým osobám přibližně na stejné úrovni, jako je tomu u artritidy, kardiálních obtíží či u hypertenze [55].
9.5 Refluxní ezofagitida
9.5.1 Definice
Výraz refluxní ezofagitida (RE) se stále velmi často užívá jako synonymum pro refluxní nemoc jícnu. O RE je správné mluvit jen při patologickém nálezu na sliznici. Můžeme ji charakterizovat makroskopicky, dle endoskopického nebo mikroskopického vyšetření.
9.5.2 Makroskopický (endoskopický) obraz
Endoskopickou problematikou gastroezofageálního refluxu se v československé literatuře zabývali jako první především Škeřík, Šetka a Chvojka [2, 56, 57]. Změny postihující obvykle dolní třetinu jícnu lze rozdělit podle stupně postižení na několik stadií. Existuje celá řada klasifikací, ve kterých jsou určité rozdíly, a žádná není celosvětově užívaná. Většinou jde o různé modifikace v Evropě akceptované klasifikace Savaryho-Millera [58, 59, 60]. V USA je často užívaná Hetzelova [61] a losangelská [62] klasifikace. Od roku 1976 pracuje komise pro terminologii Evropské a světové společnosti pro gastrointestinální endoskopii (OMED – Organisation Mondiale d’Endoscopie Digestive), na jejíž činnosti se významně podílel český gastroenterolog prof. MUDr. Zdeněk Mařatka, DrSc. [63]. Její klasifikaci reflexní ezofagitidy uvádí tab. 3. Ve všech klasifikačních schématech je základním poznatkem, že typickým projevem ezofagitidy jsou slizniční eroze, jejichž vzhled a počet se liší podle stupně zánětu.
| Tab. 3 Standardizovaná klasifikace OMED [63] |
|
| Kategorie | Popis nálezu |
| 0 |
|
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
.
9.5.3 Mikroskopický obraz
První mikroskopický popis refluxní ezofagitidy pochází od Quinckeho z roku 1879. S rozvojem endoskopické a bioptické techniky se objevila snaha o vymezení charakteristických histologických znaků. Klinickopatologickými aspekty refluxní ezofagitidy se v naší literatuře zabýval Šoustek [64] a z Olomouce Korhoň [65, 66]. Krejs se spolupracovníky charakterizoval ezofagitidu histologicky jako zánětlivou infiltraci lamina propria. Za patologický stav považoval pouze nález nejméně jednoho neutrofilního nebo eozinofilního granulocytu, minimálně v 50% všech vyšetřovaných polí při 450násobném zvětšení. Nálezu plazmocytů a lymfocytů nepřikládal patologický význam [67]. V roce 1970 popsali Ismail-Begi a Pope specifické změny, které považovali za charakteristické pro refluxní ezofagitidu: hyperplazii bazálních buněk a prodloužení papil, které se tak přibližují k povrchu sliznice [68]. Ottenjan označoval tento obraz jako hyperregenerační ezofagopatii [59]. Spolehlivost uvedených kritérií však nebyla všeobecně přijata. Weinstein ve své studii došel k závěru, že popisované odchylky jsou přítomny často i u zdravých osob [69]. Rovněž novější práce hodnotící bioptické nálezy u RNJ potvrzují poměrně nespecifické histologické změny. Popisované reaktivní epiteliální změny odpovídají původnímu popisu Ismail-Begiho a Popea, charakterizované hyperplazií bazálních buněk a prstovitým prodloužením papil, je potvrzený rovněž i v biopsiích u takřka 50% zdravých jedinců [70, 71]. Role a význam biopsie pro diagnózu RNJ se v průběhu let měnily a v dnešní době je hlavní indikací k biopsii především průkaz Barrettova jícnu, případně eozinofilní ezofagitidy. Eozinofilní ezofagitida je novou patogenetickou jednotkou, pro kterou je charakteristické nahromadění eozinofilů ve stěně jícnu, a jako samostatná forma ezofagitidy odlišné etiologie od zánětu způsobeného kyselým refluxem je popisována od konce 70. let minulého století [72]. Je řazena mezi chronická alergická onemocnění, primární léčbou je antialergická terapie, včetně kortikoidů [73].
9.5.4 Neerozivní a erozivní refluxní nemoc (ezofagitida)
Již Šetka se spolupracovníky poukazoval na častou neshodu mezi intenzitou subjektivních obtíží a mezi endoskopickým a bioptickým nálezem ezofagitidy. Skutečně histologicky ověřených ezofagitid je poměrně méně. Stejně tak není korelace mezi obtížemi nemocného a histologicky ověřeným zánětem jícnu. Výrazné klinické symptomatologii může odpovídat negativní mikroskopický nález a naopak. Zajímavý je i současný vysoký výskyt gastritidy. Šetka mezi 70 vyšetřenými nemocnými s klinickou symptomatologií kardioezofageální iritace nalezl v 84% histologicky ověřenou chronickou gastritidu a jen v 15% ezofagitidu [74]. K závěru, že neexistuje přímá závislost mezi intenzitou klinických obtíží, endoskopickým a histologickým nálezem, dospěli i jiní autoři [59, 75]. Tuto skutečnost potvrzují i další studie. Liší se pouze údaje, jaké procento pacientů s RNJ má prokázanou ezofagitidu. Údaje kolísají mezi 30–50% [76, 77].
Jak bylo již uvedeno, charakteristickým projevem ezofagitidy je vznik slizničních erozí. Klinický obraz a průběh onemocnění do značné míry závisí na tom, zda má pacient při prvotním stanovení diagnózy erozivní či neerozivní formu ezofagitidy. U nemocných obvykle nebývá tendence spontánní změny jedné formy v druhou. Při dlouhodobém sledování v rozmezí 6 měsíců až 5 let se jen u 15% nemocných s neerozivní formou RNJ vyvinula ezofagitida či komplikace RE [78, 79].
V praxi se většinou setkáváme s různými kombinacemi komplikujících stavů, které lze členit následovně: 1. Barrettův jícen a adenokarcinom, 2. brachyezofagus, 3. striktura, 4. ulkus, 5. krvácení, 6. plicní komplikace.
9.6.1 Barrettův jícen (endobrachyezofagus)

Obr. 2
Barrett, Norman Rupert (1903–1979), anglický hrudní chirurg, narozený v Adelaide v Austrálii. Chirurgickou erudici získal ve Velké Británii, kde pak působil jako vedoucí hrudní chirurg v St. Thomas’ and Brompton Hospitals
Historický pohled
V roce 1950 popsal Barrett vysokou strikturu jícnu s vředem [80]. Sliznice jícnu pod strikturou byla kryta cylindrobuněčnou výstelkou podobnou žaludeční. Původně pokládal tento úsek za kongenitálně intratorakálně uloženou část žaludku a teprve později svůj názor změnil [81, 82]. Allison a Johnson na základě rentgenologických a anatomických studií v roce 1953 ukázali, že nejde o intratorakální žaludek, ale o jícen vystlaný žaludečním epitelem [83]. Totéž potvrzuje v roce 1963 rentgenologicky a manometricky Cohen se spolupracovníky [84]. Lortat-Jacob zavedl v roce 1957 pro jícen vystlaný v distální části cylindrickým epitelem název endobrachyezofagus [85] a tento termín byl užíván jako synonymum Barrettova jícnu, podobně jako Allison-Johnstonův syndrom („the columnarepitelial lined lower esophagus“). Cylindrický epitel v distálním jícnu nemá takřka nikdy charakter sekretoricky aktivní žaludeční sliznice, nebo dokonce střevní mukózy, ale odpovídá popisu tzv. junkčního epitelu GES. Schopnost junkčního epitelu přerůstat kraniálně a hojit slizniční eroze a ulcerace v dlaždicobuněčné výstelce dolního jícnu byla známá řadu let [86]. Tuto teorii metaplazie a ná hrady dlaždicobuněčného epitelu cylindrickým potvrzovaly i další studie [87]. Endoskopicky vytvářejí tyto změny charakteristický obraz lokalizované nebo difuzní formy cylindrocelulární metaplazie [59]. U převážné většiny nemocných je nález endobrachyezofagu spojen se známkami rentgenologicky a manometricky prokazatelné insufi cience DJS spolu s axiální hiátovou hernií [88, 89, 90]. Byla pozorována jeho vysoká koincidence s komplikacemi RE. Savary [58] nalezl u svých nemocných současně s endobrachyezofagem v 87%
těžkou erozivní ezofagitidu, v 96% hiátovou hernii, v 36% peptickou strikturu a v 9% ulkus. Cylindrickým epitelem vystlaný jícen byl všeobecně pokládán za následek gastroezofageálního refluxu. Kongenitální perzistence cylindrického epitelu v různých etážích jícnu byla opakovaně popsána a výjimečně byl připouštěn i vrozený původ endobrachyezofagu. Vznik vředu nebo striktury jícnu při plně kompetentním gastroezofageálním spojení bylo možno vysvětlit pouze lokální produkcí žaludečního sekretu kongenitálně perzistujícího sekretoricky aktivního cylindrického epitelu v jícnu [84].
Otázka vztahu hiátové hernie a refluxní ezofagitidy s maligním bujením v oblasti ezofagogastrické junkce byla zpočátku považována za spornou. Brzy však byla dokumentována zvýšená vzájemná koincidence adenokarcinomu terminálního jícnu s endobrachyezofagem v rozmezí 2–15% [91, 92]. Pro oprávněnost jeho zařazení mezi prekancerózy svědčilo i to, že maligní bujení při endobrachyezofagu vzniká převážně z junkčního epitelu a je nápadná jeho podobnost s buňkami adenokarcinomu v této lokalizaci [93].
Současný pohled na Barrettův jícen
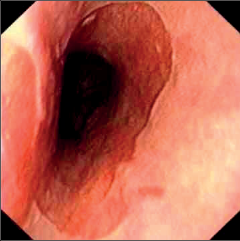
Obr. 3
Endoskopický obraz Barrettova jícnu: sametově zarudlá sliznice se zrnitým povrchem v terminálním jícnu, typická „Z“ linie přechodu cylindrického a dlaždicového epitelu je posunuta různě vysoko do hrudníku
Studiu „the columnarepitelial lined lower esophagus“ věnoval R. N. Barrett podstatnou část svého celoživotního profesního úsilí. Právem proto pro označení tohoto stavu zdomácnělo takřka výhradně označení Barrettův jícen a nahradilo historický název endobrachyezofagus. Barrett dal základ rozsáhlému výzkumu v této oblasti, jemuž bylo v posledních desetiletích věnováno mimořádné množství publikací jdoucí do tisíců.
Podle dnešních názorů je Barrettův jícen komplikací GER, kdy jeho následkem dochází k poškození dlaždicobuněčného epitelu terminálního jícnu. Při hojení však nedochází k regeneraci spinocelulární výstelky, ale k metaplazii dlaždicového epitelu na cylindrický a tyto změny jsou patrné makroskopicky [94, 95]. Pro diagnózu je rozhodující nález endoskopický (obr. 3) a bioptický.
Nově vytvořený epitel má tzv. junkční – přechodný charakter, vzácně žaludeční, v převaze jde o specializovaný epitel střevní, tzv. intestinální metaplazii. Histologický průkaz těchto změn orálně nad úrovni ezofagogastrického přechodu je pro diagnózu nezbytný [96]. Jsou-li tyto změny kratší než 3 cm, hovoříme o krátkém segmentu Barrettova jícnu, při délce nad 3 cm o dlouhém segmentu. V sestavě nemocných, u kterých byla provedena endoskopie pro refluxní obtíže, nalezl Spechler [94] dlouhý segment Barrettova jícnu u 3–5% vyšetřených a krátký segment u 10–20%. U Barrettova jícnu je prokázané zvýšené riziko vzniku karcinomu a je namístě endoskopické sledování s odběrem biopsií. Větší riziko maligní transformace je u dlouhého segmentu [97, 98]. Pravidelné sledování těchto nemocných vedlo k podstatnému zvýšení podílu zjištěných časných adenokarcinomů [99] – viz kap. 13. Údaje, jak velké je riziko vzniku karcinomu u Barretova jícnu, se liší. Novější studie dříve uváděné riziko kolem 10% za rok nepotvrzují. Studie z roku 2001 a 2006 uvádějí riziko 0,27–0,5% [100, 101, 102]. Stejně tak údaje o výskytu Barretova jícnu v populaci jsou nejisté. Onemocnění je diagnostikováno ve středním až vyšším věku, podle jedné ze studií průměrně v 55 letech, ale kdy se přesně tyto změny vyvinuly, nelze spolehlivě určit [103]. Ve skupině 961 pacientů, kteří byli odesláni k plánované kolonoskopii a zároveň souhlasili s gastroskopií z výzkumných důvodů, byl převážně krátký segment Barrettova jícnu zjištěn v 6,8% [104]. Ve švédské studii byla v běžné populaci při endoskopickém vyšetření zjištěna prevalence Barrettova jícnu v 1,6% [105].
V řadě souborných publikací je snaha shrnout a utřídit rozsáhlý výzkum o různých aspektech problematiky Barrettova jícnu [106, 107]. Přesto zůstává nadále nejasné, proč tato komplikace vzniká jen u malé části nemocných s GER, a stejně tak přes výzkum v oblasti molekulární biologie nejsou dosud ani zdaleka objasněny mechanizmy maligní transformace junkčního epitelu u části nemocných [108, 109, 110, 111]. Karcinom se v Barrettově jícnu vyvíjí přes sérii genetických alterací, které vedou v postižených buňkách ke změnám, jež je odlišují od okolní tkáně. Vzniklá dysplazie je tak histologickým projevem těchto genetických alterací vedoucích k maligní přeměně [112]. K charakteristickým cytologickým a histologickým změnám při dysplazii patří změny buněčných jader, jejich zvětšení, polymorfismus, atypické mitózy, cytoplazmatická maturace a další změny [113]. Podle stupně těchto změn se rozlišuje dysplazie nižšího a vyššího stupně (low-grade či high-grade).
Přesný výskyt Barrettova jícnu v našem materiálu z období klasické chirurgie nebylo možné vyčíslit. Do počátku 90. let minulého století nebyla u všech nemocných prováděna endoskopie s bioptickým odběrem a histologickým vyšetřením. V našem souboru nemocných z tohoto období jsme pozorovali 52 refluxních striktur a 28 vředů ezofagu, ale sliznice nad a pod vředem či strikturou jícnu nebyla většinou při endoskopii, pokud byla dělána, biopticky vyšetřena. Přesné histologické vyšetření terminálního jícnu se zaměřením na současný výskyt endobrachyezofagu jsme měli možnost provést jen u operovaných, kde byla provedena resekce gastroezofageálního spojení, nebo při pitvě zemřelých nemocných. Na počátku osmdesátých let minuléhostoletí jsme histologicky vyšetřili na Patologickoanatomickém ústavu UP v Olomouci (Dušek, Korhoň, přednosta prof. MUDr. R. Koďousek, DrSc.) resekát 16 nemocných s jícnovým vředem, u nichž byla sedmkrát současně striktura a čtyřikrát striktura jícnu bez přítomnosti vředu. Ani u jednoho nemocného nebyla v terminálním jícnu prokázána cylindrocelulární výstelka charakteristická pro Barrettův jícen. Vždy se jednalo o marginální vřed či strikturu lokalizovanou v místě anatomické kardie, často v kombinaci s brachyezofagem [114, 115]. V tomto souboru se tak nepotvrdila vysoká koincidence endobrachyezofagu se strikturou a vředem jícnu, jak to uváděl v té době Savary [58]. V pozdějších letech se zájem olomouckých chirurgů a gastroenterologů soustředil na klinické a výzkumné aspekty této problematiky.
K novým endoskopickým metodám patří využití zobrazení na principu optické filtrace světla, tzv. systém typu NBI (narrow band imaging), který umožňuje kvalitnější zobrazení slizničních změn. Lze tak vyslovit podezření na dysplastické či neoplastické léze už při endoskopii a lépe zacílit biopsii. Přesnost a pozitivní prediktivní hodnota při endoskopickém vyšetření v odhadu dysplastických změn v Barrettově jícnu je při užití této metody až 90%. V současné době je tato metoda už dostupná i v ČR, a to v centrech, které se problematikou Barrettova jícnu zabývají (FN Olomouc, ÚVN Praha a Nemocnice Vítkovice) [275, 279], stejně jako moderní metody endoskopické terapie Barrettova jícnu, které využívají jak endoskopickou mukózní resekci, případně endoskopické submukózní disekce, tak nově i metodu RFA (radiofrekvenční ablace) [276]. Velká pozornost při sledování pacientů s Barrettovým jícnem je věnována i markerům obecným, např. K-ras, Ki 67, tak pro jícen specifickým, např. CDX2, MUC2, MMP9, H2AX, imunohistochemickému vyšetření a metodám molekulární patologie či genové analýze. Tyto metody nám mohou do jisté míry predikovat maligní potenciál tkáňových změn, jak to vyplývá i z prací olomouckých autorů [277, 278]. V práci publikované z I. chirurgické kliniky v Olomouci v roce 2005 byla u 20 pacientů s Barrettovým jícnem zjištěna významná korelace mezi expresí p53 ze sliznice jícnu a stupněm zjištěné dysplazie u těchto nemocných [110].
9.6.2 Brachyezofagus
Krátký jícen představuje na rozdíl od endobrachyezofagu celkové zkrácení stěny jícnu s vytažením a fixací kardie v hrudníku. Akerlund považoval tento stav za kongenitální [116]. Další zkušenosti však tento názor nepotvrdily, jak to ve své práci The Myth of the Short Esophagus v roce 1964 shrnuli Lam a Gahan [75]. Získaný neboli sekundární brachyezofagus je dnes všeobecně považován za zánětlivou podélnou retrakci jícnu následkem GER (obr. 4).
Je zajímavé, že postižení mukózy je často velmi diskrétní. Nevysvětlený zůstává i podíl cirkulární a longitudinální svaloviny na tomto zkrácení, jak na to upozornil Johnson [117]. Kongenitální forma, pokud existuje, je zcela výjimečná a její průkaz předpokládá angiograficky ověřené zásobení intratorakální části žaludku přímo z větví aorty, jak na to upozornil již Barrett [89, 118]. Sekundární zkrácení jícnu (sekundární brachyezofagus) může vzniknout u velkých, v hrudníku fixovaných hiátových hernií, jako následek poleptání jícnu či pozdní komplikace po operaci jícnové atrézie.
.
9.6.3 Striktura
Zúžení jícnu následkem gastroezofageálního refluxu může mít charakter krátké, prstenčité striktury, nazývané též podle autora prvého popisu Schatzkiho prstenec (lower oesophageal ring) [119]. Dříve převládal názor, že jde o lézi kongenitální, ale výskyt tohoto stavu nejčastěji ve středním věku pro vrozený původ příliš nesvědčí. Proto byl nález těchto anulárních zúžení často řazen ke komplikacím GER [82,
120, 121]. Jednoznačná etiopatogeneze těchto prstenčitých striktur není často jasná. Jiným typem striktury je tubulární zúžení, které v extrémním případě může postihnout i větší část ezofagu a bývá pak označováno jako ascendentní fibróza jícnu [122, 123]. Výskyt striktur jícnu u GER je udáván ve značném rozmezí (7–23%), častěji pak u neléčených a starších jedinců s refluxními obtížemi, tam, kde byla dlouhodobě zavedena nasogastrická sonda, nebo po dlouhodobém podávání nesteroidních antiflogistik [124, 125]. Je častá koincidence striktur s Barrettovým jícnem [58] a zdá se, že po zavedení a širokém využívání moderní antirefluxní léčby blokátory protonové pumpy výskyt refluxních striktur významně poklesl.
Chronicky probíhající fibroproduktivní zánět je anatomickým podkladem organické striktury, při které změny postihují i hlubší vrstvy stěny. Někdy však nápadně rychlý vznik zúžení nelze vysvětlit jinak než podílem edematózních změn a hlavně spazmem svaloviny jícnu, která může být i hypertroficky zbytnělá [64, 126]. Tento funkční podíl na vzniku striktury vysvětluje někdy pozorovaný rozpor mezi rentgenologickým rozsahem striktury a peroperačním menším nálezem. Umožňuje to i paliativní řešení řady striktur dilatací, zatímco resekční výkon je nutno indikovat u menšího počtu [126, 127, 128].
Siewert zdůrazňuje význam rozdělení striktur na floridní a jizevnatý typ, především z hlediska prognostického a volby léčebného postupu [128]. U prvního typu jsou přítomny známky floridní erozivní ezofagitidy, u druhého převládají fibrózní změny. Založení fundoplikace spolu s dilatací má dobrou prognózu u floridní ezofagitidy. I při jizevnaté striktuře vystačí často s pouhou dilatací a při neúspěchu indikuje resekci.
Striktura je obvykle lokalizována v místě přechodu dlaždicového epitelu v cylindrický. Pokud tento přechod odpovídá anatomické kardii, mluvíme o tzv. terminální nebo marginální striktuře. Zúžení v kombinaci s Barrettovým jícnem různě vysoko nad anatomickou kardií, obvykle též na přechodu dlaždicového a cylindrického epitelu, je označováno jako tzv. vysoká striktura.
Detailní vyšetření endoskopické, bioptické a manometrické umožňuje rozlišit tři typy striktur [129] (obr. 5, 6):
- Vysoká striktura s insuficientním DJS, infrastenotický úsek je vystlán cylindrickým junkčním epitelem – Barrettův jícen.
- Vysoká striktura se suficientním DJS, infrastenotický úsek je vystlán sekretoricky aktivním cylindrickým epitelem fundu (vzácná forma Barrettova jícnu).
- Terminální striktura s insuficientním DJS.
.
9.6.4 Ulkus
Již v roce 1935 vymezil Winkelstein [38] základní typy peptických lézí jícnu:
- povrchní peptickou ezofagitidu,
- vřed v heterotopické sliznici,
- krátký jícen s marginálním vředem.
I v československém písemnictví se touto tematikou zabývala řada prací [64, 65, 130, 131]. Za hlavní etiologický faktor vzniku vředových lézí jícnu je všeobecně považován GER [65, 132]. Patogeneze a patologická anatomie jícnového vředu je však poněkud odlišnější proti RE. Z tohoto hlediska je proto správné pokládat oba procesy za samostatné jednotky, a nikoliv jen rozdílné fáze jednoho onemocnění [65]. Nicméně zkušenosti ukazují, že u těžké erozivní formy ezofagitidy se častěji setkáváme s komplikacemi, jako je vřed, striktura či vývoj Barrettova jícnu. Ve velké evropské studii [133] se během šestiletého sledování nemocných s erozivní refluxní ezofagitidou vyskytly komplikace v 21% (13× vřed, 13× striktura, 45× Barrettův jícen). Naproti tomu francouzská studie prokázala v souvislosti s ezofagitidou podstatně nižší frekvenci komplikací jen v 0,26% [134].
Podle lokalizace lze rozlišovat tzv. marginální vřed, vznikající v místě přechodu dlaždicového epitelu v cylindrický, zpravidla při současném Barrettově jícnu. Je velmi často provázen strikturou a dalšími komplikacemi [65, 135] (obr. 6, 7).
Ulkus lokalizovaný v oblasti endobrachyezofagu, tedy v zóně cylindrického, nejčastěji junkčního epitelu, je nazýván Barrettův vřed. Často inklinuje k penetraci a krvácení [80]. Je ovšem otázkou, zda nejde jen o vývojové stadium marginálního vředu, který byl v důsledku orálně postupující reepitelizace zcela obklopen cylindrickým epitelem. Perforace jícnového vředu je většinou fatální, ale naštěstí, zvláště v dnešní době účinné konzervativní léčby, enormně vzácnou příhodou (obr. 8).
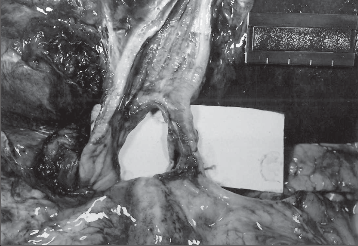
Obr. 8
Pitevní preparát marginálního vředu jícnu perforovaného do mediastina. Fotodokumentace pořízena na Ústavu s o udního léka ř s tví a medicínského práva LF UP a FN Olomouc
9.6.5 Krvácení
Při krvácení z horní části gastrointestinálního traktu je podíl způsobený refluxní nemocí jícnu a hiátovou hernií obvykle nižší než 10% [136]. Refluxní ezofagitida je komplikována krvácením až v 30%. Zdrojem je erozivní ezofagitida a vřed jícnu, ale takřka v 50% může mít krvácení u těchto nemocných jinou příčinu, nejčastěji duodenální nebo žaludeční vřed. Může-li být RE vyvolávajícím momentem při krvácení z jícnových varixů, není zcela jisté [135, 137]. Krvácení má nejčastěji charakter chronické recidivující melény či hematemézy. Rozhodující význam při určení přesného zdroje krvácení má endoskopie. Akutní ataku krvácení lze zpravidla zvládnout konzervativně. Jen výjimečně je nutná urgentní operace.
9.6.6 Plicní komplikace
Plicní komplikace mohou vznikat jako následek aspirace při gastroezofageálním refluxu do bronchiálního stromu, zejména v noci. Tato komplikace je typická pro dětský věk. U dospělých není vztah GER k respirační symptomatologii tak jednoznačný. Mimo opravdu kauzální závislost může jít jen o koincidenci s velmi častou respirační symptomatologií v populaci [138, 139, 140]. I při využití moderních diagnostických prostředků, jako je pH-metrie, není tento průkaz jednoznačný [141]. Tato problematika je i v současnosti předmětem četných studií a empirické zkušenosti s antirefluxní léčbou u celé škály extraezofageálních obtíží z oblasti otorinolaryngologické, astmatických potíží a nekardiálních bolestí na hrudníku jsou příznivé [142, 143, 144, 145].
9.7 Klinický obraz a diagnostika
Klinický obraz
Symptomatologii nemocných s refluxní nemoci jícnu uvádíme tak, jak jsme ji vyhodnotili u souboru našich nemocných [146]. Tyto příznaky a jejich frekvence odpovídají obdobným šetřením, která provedli i jiní autoři [147].
Subjektivní obtíže nemocných s refluxní nemocí jícnu jsme vyhodnotili u skupiny pacientů, kteří netrpěli současně žádným jiným onemocněním. Zhodnotili jsme zvlášť skupinu 112 nemocných s nekomplikovanou RNJ a 31 nemocných s komplikacemi RNJ.
U nekomplikované formy RNJ jsme se stejně často (v 82%) setkávali s pyrózou a bolestí, která byla v 45% lokalizována v epigastriu, v 30% za sternem a v 6% na krku (obr. 9).
Průměrná délka anamnézy byla 5,6 roku a kolísala mezi půl rokem až 25 lety. Příznaky jsme analyzovali jako vedoucí a vedlejší. V popředí klinického obrazu stojí u menšiny nemocných i méně typické příznaky jako globus hystericus apod., což může být zdrojem diagnostických obtíží. Jednou jsme zaznamenali rodinný výskyt onemocnění, když k operaci byli indikováni otec, jeho dcera a syn.
U komplikované RNJ je frekvence příznaků jiná. Nejčastějším a vedoucím příznakem byla v 78% dysfagie různého stupně. Následovala pyróza (61%) a bolest (39%) (obr. 10).
.
Častý, a se základním symptomem kauzálně související, je i větší úbytek hmotnosti, což může být zdrojem diferenciálně diagnostických obtíží proti malignímu onemocnění. Průměrná délka anamnézy je proti nekomplikovaným stavům kratší a činila 2,5 roku. Mnohdy byla dokonce jen několik měsíců či týdnů. Jen u 20% nemocných předcházela vzniku dysfagických obtíží dlouhodobější anamnéza svědčící pro refluxní obtíže.
RNJ se vyskytuje nejčastěji ve středním věku. Věkové rozvrstvení operovaných ukazuje obr. 11. Jen 23% nemocných bylo starších 60 let. Průměrný věk byl 49 let. Nejmladší operovaný měl 1 rok a nejstarší 78 let. Bylo operováno 230 mužů a 165 žen.
Koincidenci RNJ s jinými onemocněními bývá někdy přičítán význam i v etiopatogenezi tohoto onemocnění. Mezi 309 operovanými pro RNJ do roku 1977 byla nejčastějším průvodním onemocněním cholelitiáza u 61 nemocných (19%). U 29 (9%) byla výkonem na žlučových cestách většinou prostá cholecystektomie provedená současně s antirefluxní operací. Koincidenci s duodenálním vředem jsme zaznamenali do roku 1980 mezi 353 operovanými v 11% (39 nemocných) [148].
Diagnostika
Vedle přesné anamnézy má pro zodpovězení důležitých otázek při stanovení diagnózy, diferenciální diagnostiku a stanovení léčby význam řada dalších vyšetření (tab. 4).
| Tab. 4 Důležité otázky při diagnostice RNJ a nejdůležitější vyšetření pro jejich zodpovězení |
|
| Otázka | Vhodné vyšetření |
| 1. Průkaz gastroezofageálního refluxu a posouzení tomu odpovídající symptomatologie | diagnosticko-terapeutický test pH-metrie rentgen scintigrafie perfuzní test |
| 2. Posouzení morfologických změn, přítomnost ezofagitidy a komplikací | endoskopie + biopsie rentgen (dvojitý kontrast) |
| 3. Posouzení funkčních poruch, zhodnocení peristaltiky a funkce DJS | manometrie rentgen |
| 4. Průkaz hernie | rentgen endoskopie |
.
Podle klinického obrazu, ale i dostupnosti jednotlivých vyšetření je možno různě modifikovat základní diagnostický algoritmus. Při klasické symptomatologii pálení žáhy (pyrózy), zejména u mladších nemocných, kde nejsou přítomny žádné alarmující příznaky, jako dysfagie, hubnutí, anémie a známky krvácení do GIT, je možno po zhodnocení klinické symptomatologie od dalších vyšetření upustit a nasadit hned příslušnou léčbu.
Diagnosticko-terapeutický test
Jde o jednoduchou, nemocného nezatěžující metodu ke stanovení diagnózy RNJ. Tento dnes všeobecně doporučovaný test [145, 149] spočívá v tom, že u nemocných s příznaky svědčícími pro RNJ se podává omeprazol v dávce 40 mg denně po dobu 2 týdnů. Vymizení příznaků potvrzuje diagnózu. Dosavadní zkušenosti svědčí pro to, že svou spolehlivostí je test srovnatelný s 24hodinovou pH-metrií [150, 151].
Endoskopie
Endoskopie je základním vyšetřením pro stanovení diagnózy RNJ a RE. Provádí se jako vyšetření vstupní a pak kontrolní po ukončení léčby. Nezastupitelnou roli má při těžších formách RE a u Barrettova jícnu. Endoskopické vyšetření umožňuje rozlišit dva základní typy refluxní nemoci: RNJ s endoskopicky normálním nálezem na sliznici – neerozivní forma RNJ a RNJ endoskopicky pozitivní, kde je víceméně typický nález ezofagitidy a jejích komplikací – erozivní forma RNJ. Na rozhraní obou typů onemocnění stojí nález difuzního zarudnutí dolní části jícnu, což někteří označují termínem ezofagitida erytematózní. Difuzní hyperemie sice často provází refluxní ezofagitidu, ale sama o sobě k její diagnóze nestačí; hyperemie je často přechodná a není provázena histologickým nálezem zánětu. Proto termín ezofagitida erytematózní není vhodný a nepatří do klasifikačního schématu refluxní nemoci jícnu.
O endoskopickou identifikaci a klasifikaci refluxní ezofagitidy se zasloužili Savary a Miller a jejich popis je základem všech klasifikací, i když s různými dodatky a modifikacemi. Zásadní je poznatek, že typickým projevem jsou slizniční léze – eroze, jejichž lokalizace a vzhled odpovídají patofyziologii refluxu.
Charakteristická je supravestibulární lokalizace: slizniční změny začínají a jsou nejvíce vyvinuty na horním pólu gastroezofageálního vestibula, tj. 1,5 až 2 cm nad linií Z, kde je totiž výchozí hranice peptické agresivity. Zde vznikají první změny na hřebenu střední řasy na zadní stěně jícnu, nejprve histologické, prokazatelné biopsií z tohoto místa, pak i endoskopické. Jde o podélné pruhy, zprvu rudé, později žlutě povleklé s rudým okrajem: typický je lineární průběh a víceméně normální vzhled sliznice mezi vrcholky řas. Vzácněji nalézáme eroze kulovité nebo oválné, rovněž s rudým lemem. O endoskopické klasifikaci a bioptických nálezech bylo již pojednáno v kapitole 9.5.
Rentgenové vyšetření
Rentgenová kontrastní pasáž horní části GIT (obr. 12) je schopna přesně diagnostikovat typ hiátové hernie, komplikace RNJ, jako strikturu a vřed, a většinou potvrdí gastroezofageální reflux, ale není schopna ho kvantitativně posoudit. Spolehlivost jeho průkazu stoupá užitím různých provokačních manévrů, zejména vyšetřením acidifikovaným baryem (Donnerův test), avšak absence rentgenového průkazu reflux nevylučuje. Posouzení ezofagitidy a jemnějších slizničních změn není konvenčním vyšetřením možné, ale výtěžnost vyšetření zvyšuje užití dvojího kontrastu. Rentgenová kontrastní pasáž dolní části GIT i dnes často vhodně doplňuje diagnostiku RNJ [152].
.
pH-metrie

Obr. 13
Prof. Tom R. DeMeester, M.D., přednosta chirurgické kliniky univerzitní nemocnice, Jižní Kalifornie, USA
Nejspolehlivější metodou k průkazu GER je pH-metrie. Stala se základní metodou diagnostiky u pacientů s typickými příznaky, ale málo přesvědčivým nebo negativním endoskopickým nálezem.
O propracování této metody a její zavedení do klinické praxe se významě zasloužil americký chirurg Tom R. DeMeester (obr. 13) [153, 154].
Analýza záznamu umožňuje výpočet některých standardizovaných údajů. Nejspolehlivější je procentuální výpočet doby s jícnovým pH pod 4, vypočítaný z celkového času obvykle 24hodinové registrace. Zvlášť se hodnotí noční a denní refluxní epizody. Procenta refluxu vestoje nad 10,5%, vleže nad 6% jsou patologická. Za závažnou refluxní epizodu je považován pokles pH pod 4 a trvání delší než 5 minut. Přídatná kritéria jsou frekvence závažných epizod a trvání nejdelší z nich. Analýza vztahu mezi hrudní bolesti a refluxem je prováděna pomocí Wardova symptomového indexu. Čím vyšší je ovšem počet epizod, tím vyšší je možná souvislost obou jevů. U pacienta s pyrózou jsou už hodnoty indexu nad 50% vysoce specifické, při sledování bolesti hrudníku jsou to asi hodnoty vyšší než 75% (tab. 5).
| Tab. 5 Symptomový index refluxní choroby |
|
| (Počet registrovaných refluxních epizod s hodnotou pod 4 provázených symptomy / celkový počet symptomatických epizod) × 100 | |
| Hodnocení | |
| 75% a více | – vysoce pravděpodobná souvislost obtíží s refluxem |
| 50% a více | – možná souvislost obtíží s refluxem |
.

Obr. 14a
Přenosný kazetový přístroj pro 24hodinovou pH-metrii
s měřicí sondou pro zavedení do jícnu (vpravo) a s referenční elektrodou
k nalepení na kůži (vlevo)
Metoda se stále technicky zdokonaluje a hlavními indikacemi 24hodinové pH-metrie v praxi jsou nemocní s nevýrazným endoskopickým nálezem a současnými chronickými projevy refluxu, jako je pyróza a regurgitace bez ezofagitidy , častá ranní ochraptělost a projevy recidivující laryngitidy, bronchopulmonální projevy při podezření na reflux jako vyvolávající faktor, nekoronární bolest hrudníku a spánková apnoe [155, 156, 157] (obr. 14).
Hodnocení tzv. alkalického refluxu v patogenezi refluxní choroby pH-metrií je problematické. Tento typ refluxu je při normální funkci žaludku málo pravděpodobný. Alkalické hodnoty pH v dolním jícnu jsou asi výlučně způsobené salivací a aktivní sekrecí hydrogenkarbonátu v jícnové sliznici. Vyskytuje se převážně po resekčních operacích na žaludku. Účast duodenogastrického refluxu je možné měřit pomocí fibrooptické sondy připojené ke spektrofotometrickému zařízení, nepřímo na základě koncentrace bilirubinu v refl uxním materiálu.
.
Scintigrafie
Refluxní scintigrafie při použití gamakamery může doplnit informace získané pH-metrií. Krátké trvání vyšetření je ale limitujícím faktorem kvantitativního hodnocení refluxu. Má význam pro detekci postprandiálního refluxu, který není možné zjistit pH-metrií pro vyšší hodnoty pH v žaludku v době časné fáze trávení. Senzitivita metody je přibližně pouze 60% (viz kap. 6.8).
Perfuzní zkouška
Jde již o historickou metodu, používala se perfuze jícnu 0,1N roztokem HCl střídavě s fyziologickým roztokem. Přímá pozitivita zkoušky, tj. vyvolání reprodukovatelných příznaků při perfuzi HCl (bolest nebo pyróza), svědčí v podstatě pro souvislost pacientových potíží s refluxem. Senzitivita tohoto testu je nižší než při ambulantní pH-metrii, a dnes se již neužívá.
Manometrie jícnu
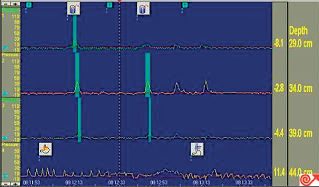
Obr. 15
Manometrický nález u RNJ s koordinovanou, ale nedostatečně silnou peristaltickou vlnou, plně relaxující hypotonický DJS
Není při diagnostice refluxní choroby standardně požadovaným vyšetřením. Klidový tonus dolního svěrače měřený stacionární manometrií je obvykle u pacientů s refluxní chorobou trvale snížený. Pacienti s velmi nízkými hodnotami pod 5 mm Hg (0,667 kPa) mají ale většinou závažné stupně ezofagitidy. Manometrie přispívá k odhalení účasti poruch motility tubulárního jícnu. Bývá přítomna nižší amplituda a frekvence peristaltických kontrakcí, porucha propagace peristaltiky, popř. segmentální chybění kontrakcí. Dysfunkce se týká primární i sekundární peristaltiky. 24hodinová manometrie významně přispěla k odhalení frekvence i trvání tranzitorních relaxací dolního svěrače. Je indikována před každým antirefluxním chirurgickým výkonem k vyloučení jiné funkční poruchy jícnu. V případě poruchy motility může rozhodovat o volbě typu fundoplikace [158, 159] (obr. 15).
9.8 Léčení
9.8.1 Léčení konzervativní
Konzervativní léčba vychází ze znalostí patofyziologie RNJ. Žádný ze známých způsobů léčby však zatím není schopný postihnout hlavní etiopatogenetický faktor onemocnění, tj. posílit funkci DJS. Jde tedy v podstatě o léčbu symptomatickou. Léčebně se využívají režimová opatření, upravující vhodně životosprávu, dieta a medikamentózní léčba. Jednotlivé prostředky mohou působit často více mechanizmy, ale přímé ovlivnění funkce DJS se zatím nedaří. Z těchto důvodů musí být léčba komplexní, dlouhodobá a individuálně přizpůsobená pro každého nemocného. I po zlepšení stavu je nutné dodržovat potřebný režim jako prevenci recidivy onemocnění. Zásady konzervativní léčby, pokud jde o režimová a dietní opatření, nedoznaly v průběhu posledních desetiletí významných změn [2, 160, 161, 162, 163] a shodují se i se současnými doporučeními [145, 164]. Režimová opatření omezují vše, co zvyšuje intraabdominální tlak: boj proti obezitě, zvýšená horní poloha těla ve spánku, omezení práce v předklonu a v kleče atd. Z dietních opatření je doporučeno vyloučit to, co snižuje tonus DJS a zvyšuje žaludeční kyselost a dráždění jícnu: vyloučení či omezení kouření, alkoholu, tučných a dráždivých jídel a nápojů s přihlédnutím k individuální snášenlivosti, změna stravovacích návyků, zmenšit jednotlivé porce jídla, omezit večerní a noční konzumaci a zvýšit celkovou tělesnou aktivitu. Medikamentózní léčba je zaměřena především na zmenšení objemu a škodlivosti refluxního sekretu (žaludeční šťávy pronikající do jícnu), na zlepšení motility, a tím zkrácení doby působení na sliznici jícnu, a konečně na zvýšení odolnosti tkání proti refluxní tekutině. Z lokálně působících léků jsou krátkodobě velmi účinná anacida, prokinetika zlepšují vyprazdňování horní části GIT a nejvýznamnější lékovou skupinou jsou léky systémově tlumící sekreci HCl. Starší skupinou jsou antagonisté H2 receptoru a nejúčinnější jsou pak inhibitory protonové pumpy, které byly do léčby zavedeny ve druhé polovině 80. let minulého století. Eradikace Heliobacter pylori nemá u RNJ opodstatnění (viz 9.2.1.4). Konzervativní léčba je dnes vysoce účinná a přináší úlevu většině nemocných, vyžaduje však trvalé udržovací podávání léků, protože spontánní zhojení bez recidivy je u RNJ málo časté.
9.8.2 Chirurgické léčení
9.8.2.1 Vývoj chirurgické léčby
Novodobá éra chirurgické léčby hiátových hernií a gastroezofageálního refluxu byla zahájena průkopnickou prací Allisona v roce 1951. Principem jeho metody byla rekonstrukce normálních anatomických poměrů. Z transtorakálního přístupu prováděl protětí změněné Laimerovy membrány a někdy i její částečnou resekci. Reponoval kardii pod bránicí a fixoval ji suturou frenoezofageální membrány ke spodině bránice za pomoci současné frenotomie. Součástí výkonu bylo sblížení obou krur hiátu za ezofagem. Správně zdůraznil, že cílem chirurgické léčby je zábrana GER, a nikoliv jen fixace kardie pod bránicí [165, 166] (viz kapitola 8 Hiátové hernie, obr. 11).
Podobných principů jako Allison, kladoucích důraz na rekonstrukci frenoezofageální membrány, využívají i jiné metody. Ve stejnou dobu začal obdobný princip v léčbě uplatňovat Lam [167]. Sweet (1948) z transtorakálního přístupu zřasujícími stehy obliteroval kýlní vak a jen u velkých hernií ho resekoval. Druhou řadou stehů fixoval bránici k jícnu nad tímto zřasením a zúžil hiátus. V roce 1953 podal zprávu o dobrých výsledcích u 130 operovaných [168]. Madden (1956) modifikoval Allisonův postup a prováděl fixaci frenoezofageální membrány k bránici z torakální strany [169]. Humphreys se spolupracovníky (1975) fixoval žaludek subdiafragmaticky dvěma řadami stehů. První fixuje subkardiální část žaludku k bránici a druhá okraj hiátu ke stěně jícnu [170]. Hlavní předností Haywardovy (1961) modifikace je, že zakládá fixační stehy na jícnu do nejpevnějšího místa, tj. úponu frenoezofageální membrány. Jejich pomocí pak fixuje kardii subdiafragmaticky k bránici. Techniku této operace propracoval a zlepšil Rapant [171, 172]. Prototypem výkonu kladoucího důraz na rekonstrukci Hisova úhlu a abdominálního jícnu je ezofagogastropexe, prováděná Lortat-Jacobem [173, 174] od roku 1953. Principem je fixace mediální části fundu na levou stranu abdominálního jícnu. Součástí výkonu je zúžení hiátu a fixace fundu k bránici.
Snaha o fixaci žaludku pod bránicí a dosažení správné konfigurace GES vedla k zavedení gastropexe k přední stěně břišní. Poprvé ji užil jako paliativního výkonu u paraezofageální hernie v roce 1946 Nissen. Později byla tato metoda převzata i do léčby skluzných hernií, kde byla fixace prováděna jen řadou stehů podél malé křiviny [175] (obr. 16).
Nezávisle užil Boerema [176] obdobného postupu označovaného jako gastropexia anterior geniculata. Našití malé křiviny žaludku k přední stěně tělní doplnil zúžením hiátu a fixací fundu k bránici. Své první zkušenosti zveřejnil v roce 1955. Kardiopexi k levému jaternímu laloku zajištuje Adler, Pedinieli a Rampal pomocí umbilikálního ligamenta. Po mobilizaci od stěny tělní je ligamentum terés provlečeno kolem kardie a vytvořená klička fixuje tahem k levému jaternímu laloku gastroezofageální spojení infradiafragmaticky.

Obr. 17
J. P. Angelchik (vlevo) s autorem knihy na kongresu v Chicagu (1989), kde propagoval svou chirurgickou metodu
Při nevhodných anatomických poměrech je možno kličku vytvořit z kožního štěpu nebo dakronového pruhu fixovaného k pochvě přímého svalu břišního [114]. Využití cizího materiálu – teflonové síťky – k rekonstrukci Hisova úhlu navrhl Adler (1958). Merendino a Dillard (1965) pomocí záplaty zpevňovali provedenou suturu ezofageálního hiátu [114]. Později začali užívat Angelchik a Cohen k léčbě skluzných HH a GER silikonovou válcovitou protézu, která obkružovala dolní část jícnu mezi žaludkem a bránicí. Metodu považovali za technicky nenáročnou a dobré výsledky publikovali u 46 operovaných [177] a prezentovali na řadě kongresů (obr. 17). Metoda však nedosáhla většího rozšíření.
Metody, které našly širší uplatnění v chirurgické léčbě RNJ
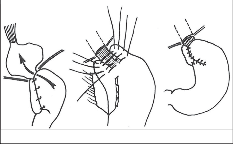
V roce 1937 provedl Nissen u nemocného po resekci kardie pro vřed s těžkou refluxní symptomatologií s dobrým efektem obalení jícnu na způsob manžety (viz portrét prof. Nissena a jeho žáka prof. Rossettiho v kap. 4. Specializace a interdisciplinární a mezinárodní spolupráce, obr. 4 a 6). V roce 1955 zavedl tuto metodu do terapie RNJ jako tzv. fundoplikaci. Původně byl postup rezervován pouze pro GER bez současné skluzné HH, u které byla prováděna přední gastropexe malé křiviny. Zkušenosti však ukázaly, že samotná gastropexe je sledována recidivou až ve 30%. V dalším vývoji byla proto fundoplikace kombinována s gastropexí malé křiviny (viz obr. 16). Dlouhodobé zkušenosti s touto operací dnes prokazují nutnost současné gastropexe jen u smíšených hernií přecházejících až v paraezofageální typ. Operace se provádí abdominální cestou a jen výjimečně si torakální přístup vyžadují komplikované stavy [178].
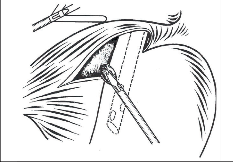
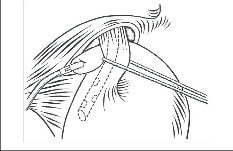
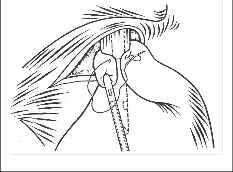
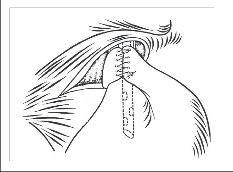
Podle původní techniky byl terminální jícen obalen žaludeční řasou z přední a zadní stěny fundu, které byly navzájem sešity na straně malé křiviny (obr. 18). Aby byla zajištěna stabilita manžety, zabíraly stehy i stěnu jícnu. Tento postup vyžadoval částečné protnutí ligamentum gastrohepaticum, a tím otevření horní části bursa omentalis, což bylo spojeno s nebezpečím poranění vagové inervace [175].
O rozpracování metody se zasloužil Nissenův žák Rossetti, který v roce 1966 navrhl modifikaci, která využívá k vytvoření manžety přední stěny žaludečního fundu [135] (obr. 19).
.
Vedle klasické fundoplikace užívají někteří autoři jen částečné obalení jícnu žaludečním fundem – hemifundoplikaci. Patřil mezi ně Toupet, Dor [179, 180], u nás tuto metodu doporučoval Lhotka [181] (obr. 20). Nevýhodou je nutnost fixace manžety pomocí stehů ke stěně jícnu, což je možným zdrojem komplikací. Hlavním cílem tohoto postupu je vyvarovat se dysfagických obtíží, se kterými se setkáváme po cirkulární fundoplikaci. Modifikací neúplné fundoplikace je i postup Thalův.
V modifikaci našel uplatnění především jako antirefluxní doplněk Hellerovy myotomie u achalázie (viz kap. 11 Neuromuskulární poruchy jícnu, obr. 23b). Thal ho však doporučuje i v léčbě skluzných hiátových hernií [182, 183].
Současně nezávisle na Nissenovi zavedl parciální fundoplikaci z transtorakálního přístupu v Anglii Belsey (viz portrét prof. Belseyho v kap. 4 Specializace, interdisciplinární a mezinárodní spolupráce, obr. 5). Poslední modifikace byla autorem označována jako operace Mark IV. Vytvořená manžeta obkružuje jícen pouze semicirkulárně v rozsahu 240 stupňů. I tato metoda našla značné rozšíření zejména v Americe [162, 184, 185] (obr. 21).
V roce 1967 uveřejnil Hill první zkušenosti se zadní gastropexí (obr. 22). Z abdominálního přístupu po subkardiální mobilizaci malé kurvatury je tato část fixována osmi stehy k preaortální fascii. Stehy na žaludku zabírají nejprve ventrální a pak dorzální okraj proťatého ligamenta ezofagogastrického a gastrohepatálního současně se seromuskulárním záběrem odpovídající části žaludku [186]. Bez ohledu na spory, týkající se variability a použitelnosti jednotlivých struktur, je možno fixaci prakticky vždy uskutečnit. Na úspěchu operace se značnou měrou podílí nejen provedená gastropexe, ale i invaginace kardie na způsob fundoplikace [187]. Toho se dosáhne vytvořením dostatečně velké řasy z přední a zadní stěny fundu, které se na straně malé křiviny spojí. Je tak vlastně vytvořena malá manžeta kolem části terminálního jícnu a zároveň je fixována k preaortální fascii.
 Obr. 22 |
.
Nepřímé výkony
Takzvané nepřímé operační výkony se snaží o zmenšení agresivity GER snížením žaludeční acidity a zlepšeným vyprazdňováním žaludku. Patří sem vagotomie, pyloroplastika a resekce žaludku [188, 189]. Tento typ operace se používá i v současnosti, zejména při selhání předchozí fundoplikace, kdy by další preparace v oblasti hiátu byla pro srůsty a změněný terén riziková.
Kombinované operace
Vagotomii je možno provést současně s fundoplikací jako tzv. „balanced operation“. Bývá tak označována kombinace fundoplikace a superselektivní vagotomie. Před zavedením vysoce účinné léčby systémově tlumící sekreci HCl, zejména nejúčinnějších léků této skupiny inhibitorů protonové pumpy, které byly do léčby zavedeny v druhé polovině 80. let minulého století, bylo při současném výskytu RNJ a duodenálního vředu možno oba stavy řešit současně chirurgicky kombinací vagotomie a fundoplikace [148]. Nejfyziologičtějším chirurgickým zásahem do patogenetického řetězce duodenálního vředu je proximální neboli superselektivní gastrická vagotomie. Předpokladem jejího užití je dobrá evakuační schopnost žaludku. Tam, kde tomu tak není, byla dávána přednost klasické resekci nebo kombinaci vagotomie s některým drenážním výkonem. Kombinovaný výkon býval v Olomouci indikován zejména při koincidenci RNJ s duodenálním vředem, při některých formách komplikované RNJ nebo při operacích pro recidivující RNJ. Podstatou operace je protětí jemných vagových větví předního Latarjetova nervu, které inervují kyselinotvornou oblast žaludku spolu s předním listem malého omenta. S disekcí se začíná nad drápovitým rozvětvením Latarjetova nervu těsně při stěně žaludku. Postupuje se orálně směrem ke kardii a pak na přední ploše kardie do Hisova úhlu. Obdobně se protíná i zadní list omentum minus spolu s vagovými vlákny. Po dokončení vagotomie se založí vlastní fundoplikace. Oba Latarjetovy nervy i vagové kmeny jsou odtaženy laterálně a jsou mimo manžetu. Topika vagových nervů vzhledem k fundoplikaci při současné proximální gastrické vagotomii a při založení fundoplikace bez současné proximálni gastrické vagotomie je patrná z obr. 23.
Při pouhém založení fundoplikace se nachází zadní kmen vagu vpravo a za manžetou. Přední kmen probíhá uvnitř fundoplikace po přední ploše abdominálního jícnu a kardie. Při současné proximální gastrické vagotomii jsou oba vagové kmeny dislokovány laterálně vpravo od vytvořené manžety. Správná anatomická orientace je velmi důležitá pro zdar operace a zachování inervace pyloroantrálního úseku při současné dokonalé denervaci kyselinotvorné oblasti žaludku. Často není orientace při operaci zdaleka jednoduchá, zvláště při horším anatomickém přístupu, u obézních nemocných nebo při vytvoření hematomu v průběhu vagových větví během preparace. V první polovině 90. let jsme provedli tuto operaci u několika nemocných i laparoskopicky. Po zavedení inhibitorů protonové pumpy do léčby duodenálního vředu se přestala superselektivní vagotomie provádět.
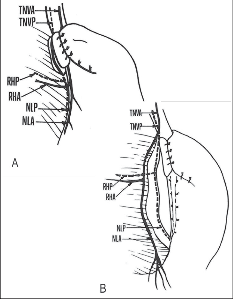
Obr. 23A – Topika vagových nervů při založení fundoplikace,
23B – při současné proximální selektivní vagotomii.
TNVA-P: truncus n. vagi anterior-posterior,
NLA-P: nervus Latarjet anterior-posterior,
RHA-P: rami hepatici anterior–posterior
Mechanizmus účinku antirefluxních operací
Pouhá anatomická rekonstrukce jícnového hiátu a frenoezofageální membrány a fixace terminálního jícnu do zvyklé polohy se pro zábranu gastroezofageálního refluxu ukázala jako nedostatečná. Pokud zúžení hiátu zůstává integrální součástí některých operačních postupů, je tomu tak z hlediska prevence herniace žaludku a zachování jeho optimální polohy. Zvýšený význam má sutura hiátu zvláště u smíšených a paraezofageálních hernií. Stále se klade důraz na rekonstrukci Hisova úhlu a dostatečně dlouhého abdominálního jícnu. Tlakové změny odehrávající se v této oblasti umožňují ventilový uzávěr kardie a uplatnění principu kolabovatelného jícnu. Tyto mechanické prvky nepozbyly ani z hlediska nejnovějších poznatků svého významu.
Je samozřejmé, že pozornost při hodnocení antirefluxních operací se zaměřila především na otázku, jakým způsobem navržené operace ovlivňují funkci DJS. Manometrické studie ukázaly, že u nemocných s projevy RNJ se předoperačně snížené hodnoty intraluminózního tlaku v oblasti DJS po operaci signifikantně zvyšují. Platí to jak o Nissen-Rossettiho fundoplikaci [190, 191], tak o postupech navržených Belseym [192] a Hillem [187]. Tyto studie ukazují, že vytvořená fundoplikace obnovuje tlakovou antirefluxní bariéru v oblasti DJS, stejně jako fyziologickou odpověď na mechanické a hormonální podněty.
Siewert v experimentech na psech zjistil, že izolovaná svalová vlákna z přední stěny žaludečního fundu v oblasti kardie mají podobnou schopnost reakce na gastrin jako svalovina z oblasti DJS [58, 193]). Představu, že vytvořená manžeta ze žaludečního fundu funkčně substituuje insuficientní DJS, podporují i anatomické studie o průběhu svalových vláken v oblasti fundu a kardie. Tyto poznatky mění dřívější čistě mechanickou představu o působení fundoplikace [194, 195] (obr. 24a).
Analyzujeme-li nejrozšířenější a nejúspěšnější operační postupy – Nissen-Rossetti, Belsey, Hill, ezofagogastropexe, Thal, zjišťujeme, že mají mnoho společných znaků. Základem je obalení terminálního jícnu přilehlou částí žaludečního fundu. Rozdíly jsou v rozsahu této plikace, v operačním postupu a technickém provedení. V podstatě jde o různé varianty fundoplikace (obr. 24b).
Tyto metody konstruují dostatečně dlouhý abdominální jícen a ostrý Hisův úhel. Navíc vytvářejí podmínky pro podporu, respektive substituci, funkce DJS vytvořenou manžetou fundu.
Pooperační komplikace
Nissen-Rossettiho fundoplikaci bývá vytýkán pooperační vznik dysfagie, nemožnost zvracení a odříhnutí a trvalý pocit přeplnění žaludku plynem – tzv. postfundoplikační syndrom (gas-bloat syndrom). Častou příčinou těchto obtíží je založení příliš těsné manžety. Poznatky o mechanizmu působení fundoplikace ukazují, že ji není třeba k její dobré funkci vytvářet příliš těsnou, je to naopak škodlivé. Při technicky správném postupu může být příčinou dysfagie vadná indikace. Jde sice o vzácné, ale přece existující stavy, kdy GER není spojen s hypotonií v oblasti DJS [4]. Příčinou pooperačních obtíží může být porucha vyprazdňování žaludku vzniklá poraněním vagových větví při operaci v oblasti kardie.
Jako teleskopický fenomén bylo Siewertem a spolupracovníky popsáno aborální shrnutí manžety fundu se současným teleskopickým protažením kardie směrem orálním (obr. 25).
Klinickým projevem je recidiva GER a dysfagie [196]. Předpokladem vzniku této vzácné komplikace je rozsáhlejší uvolnění fixačního aparátu kardie, jak se to provádělo u klasické Nissenovy fundoplikace. Při Rossettiho technice vytvářející manžetu z přední plochy fundu se rozsáhlejší mobilizace neprovádí a tento typ komplikace příliš nehrozí. Předpoklady by byly k této komplikaci vytvořeny nejčastěji při současné proximální selektivní vagotomii. Při kombinaci těchto dvou operací je proto doporučována fixace manžety k přední ploše kardie a terminálního jícnu. Dva distální stehy, spojující dolní okraj manžety, současně zabírají přední stěnu jícnu, jak tomu je u původní Nissenovy techniky. Fixaci manžety lze pojistit ještě založením stehů mezi dolním okrajem manžety a přední stěnou žaludku v blízkosti malé křiviny.
Častěji pozorovanou komplikací je dislokace části nebo celé manžety do hrudníku insuficientním hiátem. Funkce manžety nemusí být vždy porušena, zato může dojít k inkarceračním příznakům nebo ke vzniku žaludečního vředu v místě hiátu („vřed krčku“). Obdobnou symptomatologii typickou spíše pro paraezofageální hernie může vyvolat pseudodivertikulózní deformace části manžety.
Vznik perforace nebo arteficiální striktury jícnu se přičítá na vrub iatrogennímu poškození ezofagu při preparaci, jehož nebezpečí je zvyšováno zánětlivými změnami při pokročilé ezofagitidě. Pooperační zúžení jícnu může být i následkem příliš těsně vytvořené fundoplikace [197]. Poranění vzniklá v oblasti překryté založenou manžetou mohou zůstat asymptomatická.
9.8.2.2 Taktika a technika klasických operací
V období, kdy se takřka všechny antirefluxní operace provádějí miniinvazivně, se může zdát, že podrobnější popis klasických operačních postupů nemá význam, protože je nová generace chirurgů již nepotřebuje. Osmdesátá léta minulého století představovala v jícnové chirurgii vyvrcholení vývoje klasické jícnové chirurgie, kdy po zhodnocení dlouhodobých zkušeností se většina operačních postupů standardizovala. V Olomouci byly vypracovány přesné postupy pro chirurgickou léčbu RNJ, které se dodržovaly [198]. Dále je uvádíme, protože některé ověřené zkušenosti mohou najít své uplatnění i pro miniinvazivní postupy.
Klasický operační přístup: U většiny nemocných byla dávána přednost abdominální cestě, která je pro nemocného šetrnější než torakotomie, umožňuje výkon i u starých a rizikových nemocných a řešení častých současných intraabdominálních onemocnění, jako např. cholelitiázy. Nejvhodnější je horní střední laparotomie, přístup ke kardii a ezofageálnímu hiátu usnadňuje užití Rochardova rozvěrače (viz kap. 8 Hiátové hernie obr. 12). Jen tam, kde je nutné revidovat a mobilizovat ve větším rozsahu hrudní jícen, např. při podezření na malignitu nebo u vysokých striktur jícnu s jeho zkrácením, jsme dávali přednost přístupu z torakotomie. Výjimečně může být indikací k torakotomii i enormní obezita. Nejvhodnější je posterolaterální otevření hrudníku lůžkem 8. žebra vlevo. Po protětí lig. pulmonale až k dolní plicní véně, odsunutí dolního plicního laloku a otevření mediastinální pleury je jícen izolován z mediastina. Identifikaci a vybavení jícnu usnadní anesteziologem zavedená silnější sonda. Po skončení operace a repozici jícnu zpět do mediastina nerekonstruujeme Laimerovu membránu ani mediastinální pleuru a hrudní dutinu drénujeme.
Operační postupy: V Olomouci jsme získali největší praktické zkušenosti se dvěma metodami:
Nissen-Rossettiho Rossettiho fundoplikace:
Operační technika vycházela ze zásad stanovených Rossettim [135, 198] a lze ji shrnout do následujících bodů (viz obr. 19):
- Jícen se mobilizuje po protětí peritoneální řasy nad kardií v rozsahu terminálního jícnu v dostatečné vzdálenosti od jeho stěny převážně tupou preparací prsty při zavedené sondě. Neuvolňuje se malá křivina subkardiálně, jak to původně dělal Nissen, a úzkostlivě šetříme bloudivé nervy.
- Pokud přední stěna fundu, ze které vytváříme manžetu, není dostatečně prostorná a mobilní a vázne její protažení za jícnem, které provádíme zasunutým prstem, uvolňujeme v nezbytném rozsahu fundus žaludku protětím aa. breves při velkém zakřivení.
- Je výhodné hned na počátku operace ověřit poměry v oblasti velkého zakřive- ní a fundu žaludku, kde jsou často cípovité adheze ke slezině. Jejich odtržení při tahu za žaludek vede ke krvácení z pouzdra sleziny, jež by si někdy mohlo vynu- tit i splenektomii. Proto je lépe adheze bránící manipulaci s fundem hned na po- čátku operace přerušit.
- Dostatečná šíře manžety je 3–5 cm. Vytváříme ji při současném zavedení asi 15–20 mm silné jícnové sondy. Manžetu je nutno konstruovat natolik volnou, aby mezi jícen se sondou a vytvořenou manžetou bylo možno zavést volně ukazo-
vák. Podvlečení manžety, jejíž část za jícnem zachytíme do Babcockových kleští, usnadní založení elastického tahu gumové hadičky kolem terminálního jícnu hned po jeho uvolnění. - Suturu obou řas fundu vytvářejících manžetu jsme prováděli dvěma řadami atraumatických seromuskulárních stehů. Dbáme, aby steh nepronikal skrz sliznici a na druhé straně nebyl příliš povrchně založen a nehrozilo nebezpečí jeho prořezání. Přední stěnu jícnu přitom nezabíráme. Stabilitu manžety a především zamezení jejího teleskopického posunu po jícnu lze zajistit založením 2–3 stehů mezi dolním předním okrajem manžety a přední plochou žaludku při malém zakřivení.
- Drenáž dutiny peritoneální není třeba provádět s výjimkou, když došlo k poranění sleziny, kterou jsme ošetřili nebo jsme provedli splenektomii. Pak vkládáme Redonův drén do levého subfrenia k hilu sleziny a vyvedeme jej v levém podžebří mimo laparotomii.
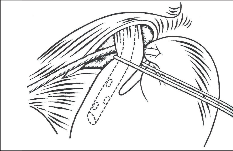
Belseyho operace Mark IV [184, 199] (viz obr. 21): Z levostranné torakotomie izo- lujeme 4–6 cm jícnu nad bránicí a podvlečeme pod něj gumovou hadičku. Ventrálně protneme Laimerovu membránu a po otevření peritoneální dutiny uvolníme kardii na jejím ventrálním obvodu.
Důležitou součástí operace je zúžení ezofageálního hiátu. V této fázi operace izolujeme jeho okraje a založíme silné stehy zabírající jeho fasciální kryt a svalové snopce a ponecháme je zavěšeny na peánech. Abychom při další preparaci neporanili kmeny vagů, je možné je vypreparovat a zavěsit na ligatury. Z ventrální plochy žaludečního fundu vytváříme manžetu, která obkružuje jícen pouze semicirkulárně, podle Belseyho v rozsahu 240 stupňů ventrálně [184]. Do hrudníku vtáhneme subkardiální část přední plochy žaludku a exstirpujeme tukové těleso kardie, které by bránilo našití žaludku na jícen. Polštář z nařaseného žaludku fixujeme k jícnu dvěma řadami „U“ stehů, které vedeme směrem ze žaludku na jícen a zpět. První řadu zakládáme tak, že vpichy situujeme na jícen a žaludek asi 2–3 cm od kardie. K fixaci žaludku na požadovaný obvod jícnu stačí 3–4 stehy, které po založení dotáhneme. Druhá řada se zakládá obdobně ve vzdálenosti 2–3 cm od první. Zabírá však i hiátovou část bránice a stehy uzlíme na její torakální straně, když jsme předtím celou plastiku šetrně reponovali do dutiny břišní. Při zakládání stehů do bránice je výhodné chránit nitrobřišní orgány před poraněním vsunutím lžíce do hiátu. Druhá řada stehů tak k sobě pevně spojí žaludek, jícen i hiátus. Operaci ukončíme dotažením stehů založených na zúžení hiátu. Mezi poslední dotažený steh a jícen se zavedenou silnou sondou musí být možné ještě volně zasunout prst, abychom nekomprimovali ezofagus.
Pokud je nutná současná dilatace striktury jícnu, provádí ji anesteziolog před založením fundoplikace za pohmatové kontroly jícnu operatérem dilatačními bužiemi. Při neúspěchu anesteziologa proniknout strikturou může dilataci provést operatér sám ze subkardiální gastrotomie bužií nebo prstem.
9.8.2.3 Laparoskopická funfoplikace
Koncem 80. let minulého století se většina abdominálních chirurgů přiklonila k užívání fundoplikace podle modifikovaného návrhu Nissen-Rossettiho, případně ve variantě částečné fundoplikace – hemifundoplikace v různých variantách původně navržených postupů Dora a Toupeta. Mnozí hrudní chirurgové, zvláště v Americe, dávali přednost Belseyho transtorakální fundoplikaci. Všem těmto diskuzím, která z metod je lepší a jaké má výhody, učinilo přítrž zavedení laparoskopické chirurgie od počátku 90. let minulého století. Laparoskopická fundoplikace, resp. hemifundoplikace se stala hned po laparoskopické cholecystektomii jednou z nejrozšířenějších laparoskopických operací. Miniinvazivní přístup pro výkony v oblasti jícnového hiátu se dnes stal zlatým standardem. Hned v první polovině 90. let minulého století byla publikována celá řada prací, které prezentovaly výborné zkušenosti s touto metodou [200–205].
Laparoskopická fundoplikace se rychle rozšířila i v České republice na řadě pracovišť, mezi něž patřila i Olomouc [206–214]. Mezi průkopníky této metody patřil v České republice V. Drahoňovský, který už v letech 1994 až 1995 provedl 94 antirefluxních operací [215].
Technika laparoskopické fundoplikace
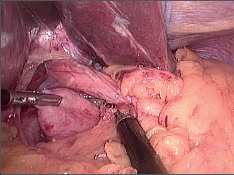
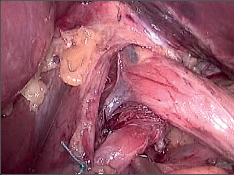
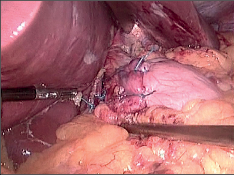
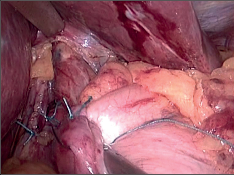
Operační přístup je obdobný pro všechny operace v oblasti jícnového hiátu. Obvykle se užívá 5 vpichů pro umístění trokárů. Podmínkou pro dobrý přístup do hiátu je elevace jater pomocí speciálního retraktoru, který se zavádí portem pod pravým žeberním obloukem, respektive vpichem pod processus xiphoides. Identifikaci a uvolnění jícnu usnadní zavedená silnější sonda. Preparace se zahajuje protětím peritonea nad terminálním jícnem, pomocí disektoru či tamponku se uvolní jícen. Preparace musí být šetrná, aby nedošlo k poranění vagu či stěny jícnu. Postupně jsou identifikována obě krura hiátu a jícen je cirkulárně izolován. K usnadnění založení manžety je vhodné zavěšení jícnu na hadičku a pak lze již okénkem vytvořenýmza jícnem pomocí vhodného nástroje protáhnout retroezofageálně žaludeční fundus a obě části manžety před jícnem sešít. Lze použít jednotlivé stehy či steh pokračující. Obdobně jako u otevřených operací je třeba dbát, aby manžeta byla dostatečně volná, což zajistí zavedení silnější sondy do jícnu při jejím zakládání. Součástí operace je retroezofageální zúžení hiátu dvěma až třemi stehy. Princip operace zůstává stejný jako při otevřené fundoplikaci. Obdobně jako je to i u jiných miniinvazivních operací, zjednodušuje se operační technika, aniž by se to projevilo na konečných krátkodobých či dlouhodobých výsledcích. Např. manžeta se šije jen jednou řadou stehů, nezakládají se stehy mezi dolním okrajem manžety a malou křivinou žaludku (obr. 26–32, videozáznam laparoskopické fundoplikace pro RNJ je dostupný v elektronické verzi – viz tiráž knihy).
|
|
Peroperační komplikace jsou v rukou zkušeného laparoskopického chirurga výjimečné, zejména je třeba se vyvarovat poranění vagové inervace a poranění stěny jícnu. Možné termické poranění při užití elektrokoagulace je dnes do značné míry vyloučeno, protože se při preparaci v okolí jícnu spíše používá harmonický skalpel. Je nutno také myslet na možnost poranění pleury při preparaci v oblasti hiátu. Frekvence nutné konverze na klasickou operaci obvykle nepřesahuje v laparoskopických centrech 1–2%. Z pooperačních komplikací je nejobávanější dysfagie. Její mírný stupeň, který obvykle provází založení každé fundoplikace, se upraví nejpozději během několika týdnů. Trvalejší dysfagie svědčí pro založení příliš těsné manžety nebo pro přehlédnutou funkční poruchu jícnu.
9.8.2.4 Chirurgická léčba komplikací gastroezofageálního refluxu
K řešení komplikací gastroezofageálního refluxu, jako je krvácení a plicní komplikace, obvykle postačuje provedení standardní antirefluxní operace. Ke zhojení vředových lézí jícnu stačí v reparabilním stadiu rovněž antirefluxní výkon. Chronické kalózní vředy s těžkými změnami si mohou vyžádat resekci podobně jako některé striktury.
Specifický přístup v léčbě a sledování vyžaduje především Barrettův jícen, brachyezofagus a striktury. Chirurgie těchto komplikovaných stavů musí vedle základního požadavku zábrany gastroezofageálního refluxu řešit i vzniklé lokální změny jícnu.
Barrettův jícen
Největším rizikem Barrettova jícnu je u části nemocných možnost maligní transformace junkčního epitelu [108, 109, 110, 111]. Projevem těchto změn je v histologickém obraze vznik dysplazie [112]. Podle stupně těchto změn se rozlišuje dysplazie nižšího a vyššího stupně (low-grade či high-grade) (viz kapitola 9.6.1). Léčba sleduje tři cíle: 1. léčbu gastroezofageálního refluxu, 2. endoskopické a bioptické sledování stupně dysplastických změn, 3. léčbu zjištěné dysplazie.
Strategie léčby GER u zjištěného Barrettova jícnu je obdobná jako u RNJ bez zjištěné metaplazie v terminálním jícnu. Jak účinná konzervativní terapie, tak antirefluxní operace vede k potlačení refluxní symptomatologie a k jistému stupni regrese metaplastických změn. Žádný z těchto léčebných postupů však nezaručuje ochranu proti malignímu zvratu. Samotný nález Barrettova jícnu u asymptomatického pacienta není indikací k operaci [216, 217].
Jako důvody pro pravidelné endoskopické a bioptické sledování nemocných s Barrettovým jícnem se uvádějí tyto: Pravidelné sledování (surveillance) spolehlivě detekuje dysplazii v Barrettově jícnu a léčba takto zjištěné dysplazie vede ke snížení úmrtnosti na adenokarcinom jícnu. Tato obecně přijímaná doporučení jsou však zatím jen neověřenými předpoklady, které nebyly dosud jednoznačně potvrzeny v řadě studií [218, 219, 220], i když toto sledování nepochybně vede ke zvýšené detekci časných nádorů jícnu [221]. Doporučená frekvence sledování nemocných s Barrettovým jícnem bez dysplazie, pokud je nález ověřen dvěma po sobě následujícími vyšetřeními, je provedení endoskopie po 3 letech, u nízkého stupně dysplazie je kontrolní endoskopie doporučována jednou ročně [222].
Při nálezu vysokého stupně dysplazie či známkách maligního zvratu je bezprostředně indikována léčba. Při zjištěném vysokém stupni dysplazie jsou tyto možnosti řešení: ezogagektomie, endoskopická ablační terapie, endoskopická mukosektomie nebo intenzivní endoskopické sledování. Ezofagektomie je nejspolehlivější způsob léčení těžké dysplazie jícnu. Histologické vyšetření exstirpovaného jícnu prokazuje ve 30–40% ložiska adenokarcinomu i u pacientů, kde byla předoperačně zjištěna jen dysplazie [223]. Ezofagektomie je ale náročnou operací s vyšším operačním rizikem, které je závislé na stavu pacienta a zkušenostech pracoviště, jak je o tom pojednáno v kapitole 13 o karcinomu jícnu, a únosnost tohoto výkonu musí být pro každého nemocného individuálně zvážena. Endoskopická ablační terapie využívá k destrukci metaplastického epitelu, případně i časného karcinomu jícnu tepelnou, fotochemickou či radiofrekvenční energii. Jde o jednoduchou, relativně snadno aplikovatelnou a bezpečnou metodu k ošetření Barrettova jícnu. Zatím však nejsou k dispozici větší a zejména dlouhodobější zkušenosti [224–228]. Endoskopická mukosektomie je specializovanou metodou určenou k odstranění změněné sliznice do submukózy. Po nastříknutí tekutinou dochází k elevaci sliznice, ta je nasáta do nádstavce endoskopu a odříznuta. Jiná technika odstraňuje sliznici pomocí elastické kličky, podobně jako u ligace jícnových varixů. I zde jde o jednoduchou a v rukou zkušeného endoskopisty i bezpečnou metodu, zatím s omezenými dlouhodobými výsledky jak u Barrettova jícnu, tak u časného karcinomu [229, 230]. Při endoskopické terapii Barrettova jícnu se vedle endoskopické mukózní resekce, případně endoskopické submukózní disekce, stále častěji využívá také radiofrekvenční ablace. V současnosti ostatní endoskopické metody ošetření Barrettova jícnu, jako argon plazma koagulace, fotodynamická terapie a kryoablace, ustupují do pozadí. Poměrně velký soubor pacientů s Barrettovým jícnem je v ČR už ošetřen tímto způsobem a olomoučtí gastroenterologové se na aplikaci této metody rovněž podílejí [276]. V letech 1995–2000 bylo na I. chirurgické klinice v Olomouci operováno 22 nemocných pro Barrettův jícen. U 18 nemocných s nízkým až středním stupněm dysplazie byla provedena laparoskopická fundoplikace a jsou dále sledováni. U 4 byla pro vysoký stupeň dysplazie a podezření na časný karcinom provedena ezofagektomie, která u 3 potvrdila nález malignity a u jednoho operovaného jen vysoký stupeň dysplazie [109]. Někteří autoři připouštějí i u vysokého stupně dysplazie možnost intenzivního sledování s endoskopickými kontrolami v 3–6měsíčních intervalech [231], což je samozřejmě spojeno s vysokým rizikem vzniku maligního zvratu [232]. Přístup k léčbě Barrettova jícnu by měl být vysoce individuální a měl by zohledňovat stav nemocného, jeho přání a stupeň dysplazie [109, 233]. Ezofagektomie by měla být určena pro mladší nemocné s vysokým stupněm dysplazie. U rizikových nemocných s lokalizovanou dysplazií se jeví jako výhodná resekce mukózy a její detailní vyšetření. Neprokáže-li histologie invazi do submukózy a přítomnost dysplazie v okrajích resekované sliznice, nejeví se ezofagektomie jako absolutně nutná [222].
Brachyezofagus
Při chirurgické úpravě sekundárního brachyezofagu vystačíme často s vydatnou mobilizací jícnu, která umožní repozici kardie infradiafragmaticky. Pro ireponibilní stavy navrhl Collis (1975) metodu vytvářející abdominální jícen z herniované části žaludku a rekonstruující Hisův úhel [234]. Mezi starší návrhy patřila transpozice jícnu ventrolaterálním směrem. Po protětí hiátu se jícen přesunul do oblasti brániční kupole [235]. Později se začala užívat Collisova plastika v kombinaci s Nissenovou nebo Belseyho fundoplikací [236, 237] (obr. 33). Tato metoda je některými chirurgy užívána dodnes. Z fundu žaludku se vytváří pomocí staplerů „neojícen“ a operaci je možno provést i laparoskopicky. Zábrana refluxu však není dokonalá a pooperační pH-metrie prokazuje kyselý reflux do jícnu až u 50% operovaných [238]. Počet pacientů, u kterých je tento výkon indikován, je velmi malý.
Striktury
Dysfagie následkem zúžení jícnu závisí i na průměru vzniklé striktury. Výraznější polykací obtíže a potřeba dilatací vzniká obvykle až při zúžení lumen jícnu na méně než 13 mm [239]. Se zavedením moderní terapie RNJ, zejména díky širokému rozšíření podávání blokátorů protonové pumpy, se od konce 80. let minulého století výskyt refluxních striktur dramaticky snížil. Pokud se s nimi setkáme, jsou zpravidla zvládnutelné dilatacemi [240]. K dilatacím se dříve užívaly takřka výhradně tuhé dilatační sondy a dilatace byly prováděny naslepo. Dnes jsou stále častěji využívané balonkové dilatace pod rentgenovou kontrolou. Před a po dilataci je indikována intenzivní léčba blokátory protonové pumpy. Jejich podávání snižuje nutnost opakovaných dilatací [124, 241]. Indikace k chirurgické léčbě striktur je dnes výjimečná.
Historický pohled na léčbu refluxních striktur
Zásadní otázkou v léčbě striktur bylo v minulosti především rozhodnutí, kdy se spokojit jen s antirefluxním výkonem, doplněným popřípadě dilatací, a kdy volit plastickou úpravu změněného místa, či dokonce resekci. Odpověď závisela na prvním místě na pokročilosti patologických změn, ale i na přístupu a radikalitě chirurga. Těžko lze jinak vysvětlit, že při velkých zkušenostech s touto problematikou jsme se dle starších publikací na jedné straně setkávali s téměř výhradním užíváním resekčních výkonů doplněných interpozicí kolon [199, 242], zatímco podle zkušeností jiných bylo stejně dobrých výsledků dosaženo pouhým antirefluxním výkonem doplněným dilatací. Rossetti a Allgower prováděli z levostranné torakotomie exploraci striktury a trunkální vagotomii a z laparotomie připojovali pyloroplastiku. Fundoplikace jako součást operace byla doporučována tehdy, když byla technicky proveditelná [243]. Dilatace striktury se prováděla peroperačně pomocí sondy nebo digitálně z gastrotomie. Dilataci bylo nutno většinou opakovat ještě několikrát po operaci. Výkon byl vždy doplňován některou z antirefluxních operací. Tento způsob navržený Haywardem byl úspěšně užíván celou řadou autorů [14, 126, 244]. Pro prstenčité striktury typu „lower oesophageal web“ bylo navrženo řešení cirkulární excizí se suturou slizničních okrajů nebo radiálními nářezy s příčnou suturou z gastrotomie. Excize nebo dilatace je možná i endoskopicky, což ovšem vylučuje připojení současné antirefluxní operace [245]. Pro řešení kratších striktur je vhodná již zmíněná Thalova plastika [123]. Vyžaduje-li stav resekci GES, je možno pokusit se o zábranu GER několikerým způsobem. Konstrukce kontinentní ezofagogastrické anastomózy byla navržena Nissenem v roce 1937 a řadou dalších autorů [246, 247]. Současné provedení resekce žaludku, protětí vagů a odstranění žaludečního antra sleduje především vyloučení působení kyselého žaludečního sekretu. Wangensteen navrhl horní polární resekci žaludku s pyloroplastikou [248], Ellis současnou resekci kardie a antra [249]. Poměrně rozšířeným, i když rovněž složitým výkonem se stala náhrada resekovaného úseku interponovanou částí tenkého [250] či tlustého střeva [242]. Na našem pracovišti byla vypracována Rapantem a Králíkem (1965) náhrada distálního jícnu trubicí vytvořenou z velkého zakřivení žaludku. Metoda klade důraz na prevenci GER [251] (obr. 33). Tyto metody byly užívány též v léčbě ezofagokardiální achalázie.
Současná úloha chirurgie v léčbě refluxních striktur
U naprosté většiny refluxních striktur je primární léčbou podávání vysokých dávek blokátorů protonové pumpy v kombinaci s dilatací [124]. Jako alternativa dlouhodobé medikamentozní léčby může být indikována fundoplikace s peroperační a pooperační dilatací. Ve vzácných případech, kdy je tato léčba neúspěšná, je indikována resekce jícnu s interpozicí tenké kličky či kolon, případně s náhradou resekované části jícnu transponovaným žaludkem.
9.8.2.5 Výsledky chirurgické léčby
Výsledky klasických operací a jejich hodnocení
Starší operační metody vycházející pouze z anatomické reparace skluzné HH byly opuštěny pro vysokou frekvenci recidiv, čítající 30% i více. Přiznává to v celoživotním shrnutí svých zkušeností i Allison [166] a potvrzují to zkušenosti dalších [252,
253, 254]. Ze stejného důvodu upouštějí Nissen a Rossetti od pouhé přední gastropexe u skluzných HH [178]. Zprávy o výsledcích těchto starších metod nejsou však zcela jednoznačné. Gahagam a Lam uveřejňují v roce 1976 zkušenosti s chirurgickou léčbou 562 nemocných modifikovanou Allisonovou technikou v letech 1947–1974. V 80% šlo o skluznou HH s GER, v 18% o paraezofageální a ve 2% o hernii infrakardiální burzy. Recidivu uvádějí pouze v 6%. Přiznávají však, že u 224 nemocných operovaných od roku 1962 nebylo systematické dlouhodobé sledování [70]. Boerema v roce 1969 při hodnocení 500 operovaných jím navrženou přední gastropexí uvádí 5% recidivu [255]. Dobré výsledky s přední gastropexí uvádějí i některé další práce z první poloviny 70. let [256, 257].
Mnohem příznivější, i dlouhodobé, výsledky jsou všeobecně udávány u operačních metod, jež jsou různými variantami fundoplikace. Vhodně indikovaná chirurgická léčba přináší výborné až velmi dobré výsledky u nekomplikovaných stavů téměř v 90%, zatímco počet recidiv klesá pod 10%. Starší studie srovnávající konzervativní a chirurgickou terapii mluvily ve prospěch operativního léčení [161], a to i po zavedení H2 blokátorů (Cimetidinu) do konzervativní léčby [258].
Daleko obtížnější je hodnocení výsledků u komplikovaných stavů. Procento úspěšnosti zde klesá. Srovnatelnost jednotlivých skupin a operačních postupů je vzhledem k malým číslům a složitosti klasifikace těchto patologických stavů značně problematická. Chirurgická terapie v té době většinou představovala jedinou efektivní léčbu.
Jedním z hlavních kritérií úspěšnosti operace je ústup subjektivních potíží nemocného, čemuž obvykle odpovídá i příznivý nález endoskopický, rentgenologický a manometrický. Rozhodující je vymizení GER. Při recidivě onemocnění se dalšímu výkonu podrobí jen necelých 50% nemocných, u kterých první operace selhala [184, 259]. Vyplývá to ze zvýšeného operačního rizika i menší naděje na dobrý výsledek. Jen málo pracovišť disponovalo většími zkušenostmi s reoperacemi, a to jak v minulosti, tak v současnosti [259, 260].
Vlastní zkušenosti z období klasické chirurgie
V 80. letech minulého století jsme hodnotili dlouhodobé výsledky operovaných s chorobami jícnu [114, 115]. Soubor operovaných pro RNJ představoval v té době jednu z největších sestav pacientů operovaných pro RNJ v Evropě. Stručnou prezentací těchto výsledků demonstrujeme vývoj chirurgické léčby RNJ ve druhé polovině minulého století.
Chirurgická léčba RNJ a HH prodělala i v Olomouci vývoj od operací odvozených od Allisonova principu k fundoplikacím [82, 258, 261, 262] (tab. 6). Od počátku 70. let minulého století se postupně standardní operací pro RNJ stávala Nissen-Rossettiho fundoplikace z nitrobřišního přístupu a v menší míře Belseyho transtorakální semifundoplikace.
| Tab. 6 Typy operací pro RNJ na I. chirurgické klinice FN v Olomouci v letech 1948–1982 u 395 nemocných |
|||
| Typ operace | Počet | ||
| 1948–1962 | 1970–1982 | celkem | |
| Allison | 13 | 13 | |
| Humpreys | 19 | 19 | |
| Hayward | 58 | 58 | |
| Ezofagogastropexe | 27 | 3 | 30 |
| Belsey | 34 | 21 | 55 |
| Nissen-Rossetti | 22 | 176 | 198 |
| Varia | 35 | 18 | 53 |
| Celkem | 208 | 218 | 426 |
.
| Tab. 7 Dlouhodobé výsledky chirurgické léčby primooperací u nekomplikované RNJ 1948–1977, n: 231 |
||
| Typ operace | Výsledek | |
| výborný–uspokojivý | neuspokojivý | |
| Nissen-Rossetti n: 89 | 94,7% | 5,6% |
| Belsey n: 42 | 78,6% | 21,4% |
| Ezofagogastropexe n: 30 | 90,0% | 10,0% |
| Allison, Humphreys, Hayward n: 81 | 74,0% | 26,0% |
| Varia n: 14 | 50,0% | 50,0% |
.
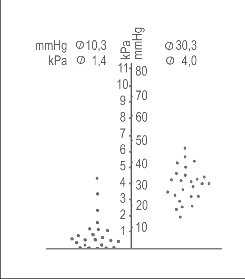
Obr. 34
Klidový tonus dolního jícnového svěrače při manometrickém vyšetření u nemocných s refluxní nemocí jícnu před operací (vlevo) a po ní u skupiny operovaných na počátku 80. let minulého století
Na počátku 80. let minulého století jsme tak měli možnost analyzovat soubor nemocných, operovaných v letech 1948–1982. Pro RNJ bylo operováno 395 a pro smíšené a paraezofageální hernie 75 nemocných. Doba sledování byla v průměru 7,3 roku a jen u 28% nemocných to byl interval 1–3 roky. Dlouhodobé výsledky jsme posuzovali u 88% souboru. Nejlepších výsledků bylo dosaženo u Nissen-Rossettiho fundoplikace (tab. 7, obr. 34).
Operační letalita u nekomplikované RNJ činila 1,85%. Standardním operačním postupem se pro nás stala Nissen-Rossettiho fundoplikace z abdominálního přístupu. Hrudní přístup byl považován za zdůvodněný u vysokých striktur a u podezření na malignitu. Z našeho rozboru vyplynuly určité závěry, které již byly uvedeny v předchozí subkapitole Taktika a technika klasických operací a v následujících letech jsme získané zkušenosti uplatňovali v chirurgické praxi.
V období klasické chirurgie byla jednou z nejčastějších komplikací refluxní ezofagitidy striktura. Olomoucké zkušenosti s touto problematikou shrnuje tab. 8.
| Tab. 8 Údaje o 51 operovaných na I. chirurgické klinice v Olomouci pro refluxní strikturu jícnu vyhodnocené v roce 1970 [123] a 1982 [115] |
||
| Rapant 1970 | Šerý, Duda 1982 | |
| Typ striktury | Počet nemocných | |
| Marginální – prstenčitá – tubulární |
. 11 7 |
. 26 4 |
| Vysoká striktura | 1 | 2 |
| Celkem | 19 | 32 |
| Typ operace | Počet výkonů | |
| Resekční výkon | 10 | 2 |
| Plastické výkony | 10 | 2 |
| Collis, Thal apod. | 1 | |
| Gastrostomie | 1 | |
| Dilatace + antirefluxní operace | 27 | |
| Celkem | 20 | 33 |
| Výsledek operací | ||
| Mortalita | 4 (20%) | 4 (12%) |
| Výborný–velmi dobrý | 7 (47%) | 14 (61%) |
| Uspokojivý | 5 (33%) | 7 (30%) |
| Neuspokojivý | 3 (20%) | 2 (9%) |
.
V letech 1986–1994 jsme operovali na II. chirurgické klinice 59 nemocných s RNJ a skluznou HH a 49 nemocných se smíšenou nebo paraezofageální HH. Letalita tohoto souboru operovaných byla 0,9%. U nekomplikované RNJ jsme vždy indikovali Nissen-Rossettiho fundoplikaci. U komplikované RNJ pokračoval nadále odklon od resekčních výkonů. Dávali jsme přednost kombinaci dilatace s antirefluxní operací.
Od počátku roku 1995 jsme RNJ a HH začali operovat laparoskopicky. Na II. chirurgické klinice jsme do května 1996 k laparoskopické operaci indikovali 21 nemocných a tato metoda se v dalších letech stala standardním postupem v léčbě RNJ [206, 207]. Od první poloviny 90. let minulého století se miniivazivní problematice RNJ věnovali i pracovníci I. chirurgické kliniky pod vedením Č. Neorala a v letech 1995 do února 1996 provedli prvních 18 laparoskopických fundoplikací [208]. Tento program úspěšně rozvíjeli a do roku 1999 bylo laparoskopicky operováno již 407 nemocných. Deset let po zahájení tohoto programu byl dotazníkovou anketou vyhodnocen náhodně vybraný soubor 102 operovaných. Z nich 90% hodnotilo výsledek operace jako vynikající či dobrý, 7% jako uspokojivý a 3% považovalo svůj stav za uspokojivý [209, 210, 211, 212]. Po organizačních změnách, které proběhly ve Fakultní nemocnici v Olomouci, od roku 2007 pokračuje I. chirurgická klinika v rozvíjení programu jícnové chirurgie jako jediné pracoviště v Olomouci i v současnosti [213, 214].
Výsledky laparoskopických operací
Protože podstata laparoskopické fundoplikace se proti otevřené chirurgii nezměnila, nepřekvapuje, že po získání dostatečných zkušeností s touto miniinvazivní technikou jsou výsledky srovnatelné s érou otevřené chirurgie. Řada studií uvádí výborné až velmi dobré výsledky této operace u 90% operovaných [211, 263, 264, 265].
Po operaci může být přechodná mírná dysfagie, která nejpozději do 3 měsíců vymizí. Trvalé obtíže může mít 5 až 20% operovaných. Jde buď o přetrvávající refluxní obtíže nebo nově vzniklou symptomatologii. Nejčastěji si pacienti stěžují na pyrózu nebo dysfagii. K bližšímu objasnění této symptomatologie je třeba provést rentgenovou pasáž, endoskopii, pH-metrii a případně i manometrii. Obtíže bývají označovány jako postfundoplikační syndromy [266]:
- recidiva refluxu, nejčastěji z částečného nebo úplného povolení manžety;
- dysfagie, někdy současně s pyrózou, může být způsobena nevhodným umístěním manžety, její částečnou nebo úplnou herniací do mediastina, teleskopickým syndromem či vznikem paraezofageální hernie;
- dysfagie z příliš těsné nebo příliš dlouhé manžety, těsný uzávěr hiátu nebo z přehlédnutí či nedocenění funkční poruchy motility jícnu;
- neurčité obtíže v epigastriu označované dříve jako denervační nebo Gas-bloat-syndrom byly přičítány porušení vagové inervace či před operací nerozpoznané funkční (psychosomatické) poruše zažívacího traktu.
Příčinou těchto stavů je nedokonalé předoperační vyšetření a nevhodná operační indikace nebo technické chyby při operaci. Řešení obtíží musí být stanoveno vždy na základě individuálního posouzení. Případná reoperace je zatížena daleko větší morbiditou (20 až 40%) a mortalitou (2%) než primární výkon. Jen asi u 70 až 80% pacientů lze očekávat dobrý nebo uspokojivý výsledek. U nemocných po laparoskopické fundoplikaci s refluxními obtížemi je proto lépe zvolit konzervativní medikamentózní léčbu blokátory protonové pumpy. Reoperace je pak indikována jen u zjištěné zjevné příčiny a mladších nemocných. U pacientů s pooperační trvalou dysfagií je zpravidla nutná chirurgická revize. Spektrum výkonů záleží na konkrétním nálezu a může být v rozsahu rozrušení srůstů, úpravy herniace, refundoplikace až po resekční výkon ezofagokardiálního spojení. V některých případech lze reoperaci provést laparoskopicky. Zejména u pacientů po opakovaných výkonech či fibrózních změnách v oblasti hiátu a při porušené funkci jícnu přichází v úvahu též nepřímý antirefluxní výkon (subtotální gastrektomie s rekonstrukcí pasáže Rouxovou „Y“ kličkou, případně s vagotomií a dilatací striktury jícnu). Reoperace patří v každém případě do center, která mají zkušenosti s jícnovou chirurgií [213, 263, 267].
9.8.2.6 Indikace k chirurgické léčbě
U nekomplikované a většinou i u komplikované RNJ zahajujeme léčbu vždy konzervativně. Se zavedením moderní medikamentózní léčby od konce 80. let minulého století se především díky blokátorům protonové pumpy stala medikamentózní léčba dominantní v terapii RNJ. Akutní refluxní obtíže i těžší formy erozivní ezofagitidy se po této léčbě zklidní obvykle nejpozději během 8 až 12 týdnů. Chirugická léčba tak ztratila svoje dominantní postavení, které si vydobyla v 80. letech minulého století. Nevýhodobu medikamentózní léčby je nutnost dlouhodobé udržovací léčby. Po jejím vysazení dochází u většiny nemocných k brzkému relapsu obtíží. K renesanci chirurgické léčby došlo až s rozvojem miniinvazivní chirurgie v průběhu 90. let minulého století. Laparoskopické založení fundoplikace se stalo bezpečnou jednorázovou alternativou k dlouhodobé, často celoživotní medikamentózní léčbě. Bylo provedeno několik srovnávacích randomizovaných studií dlouhodobé léčby Omeprazolem a laparoskopické fundoplikace, které ukázaly, že obě metody jsou přibližně stejně účinné [271–273]. Laparoskopická fundoplikace se tak jeví výhodnější zejméně pro mladší jedince s perspektivou dlouhého života, pro nemocné, kteří nejsou spokojeni s nutností dlouhodobé medikamentózní léčby, nebo pro pacienty s vedlejšími účinky podávání léků. Chirurgická léčba je častěji indikována u komplikované RNJ, i když není prokázáno, že by byl rozdíl ve zhojení nejtěžších forem ezofagitid, včetně jícnového vředu, mezi podáváním blokátorů protonové pumpy a antirefluxní operací. Stejně tak je chirurgická léčba častěji indikována u pacientů s atypickými projevy RNJ, zejména při známkách regurgitace a plicní a laryngeální symptomatologie z aspirace. Laparoskopická léčba je rovněž výhodná u kombinace RNJ s jinými onemocněními, kde je indikována chirurgická léčba (cholelitiáza).
Antirefluxní chirurgie má však také své vedlejší nepříznivé účinky, mezi něž někteří nemocní počítají nemožnost odříhnutí nebo zvýšenou flatulenci. Volba konzervativní či chirurgické léčby musí být vždy individuálně posouzena a projednána s každým nemocným. Do jisté míry lze predikovat, bude-li chirurgická léčba úspěšná, jsou-li splněny následující parametry:
- pacient má typickou symptomatologii,
- je pozitivní pH-metrie,
- má příznivou odezvu na podávání blokátorů protonové pumpy.
Za těchto okolností je 95% pravděpodobnost úspěšného efektu operace. Při přítomnosti pouze dvou z těchto faktorů je pravděpodobnost úspěchu operace nižší, asi kolem 70% [274].
Antirefluxní operace byla v jednom z největších německých center pro jícnovou chirurgii, na klinice prof. Siewerta v Mnichově, dle publikace Steina a spolupracovníků z roku 1998 [263] indikována z těchto důvodů, které se u jednotlivých pacientů různě kombinovaly:
- u 95% nemocných s recidivujícími refluxními obtížemi nebo těžkou ezofagitidou při medikamentózní léčbě,
- 80% nemocných ji zvolilo jako alternativu dlouhodobé medikamentózní léčby,
- 45% pacientů ji zvolilo pro vedlejší účinky medikamentózní terapie,
- 30% nemocných se rozhodlo pro operaci z důvodu laparoskopického přístupu a 10% se rozhodlo pro operaci z obavy o bezpečnost dlouhodobé léčby medikamenty.
9.8.3 Endoskopické metody v léčbě refluxní nemoci jícnu
Vedle medikamentózní a chirurgické léčby GER byl také vyvinut a v omezeném rozsahu zkoušen endoskopický způsob léčby. Využívá se techniky endoskopického založení stehů do oblasti gastroezofageálního přechodu a vytvoření chlopně k zábraně refluxu. Dalším způsobem je aplikace radiofrekvenční energie do gastroezofegeální junkce nebo injekce nerezorbovatelného polymeru do oblasti dolního jícnového svěrače [268, 269, 270]. Prozatímní zkušenosti s těmito metodami nejsou takové, aby se mohly stát alternativou medikamentózní či laparoskopické léčby.
Literatura
- Rossetti M. Die Refluxkrankheit des Oesophagus. Klinik, Komplikationen, Behandlung. Stuttgart: Hippokrates; 1966.
- Šetka J. Onemocnění jícnu v internistické a gastroenterologické praxi. Praha: Státní zdravotnické nakladatelství; 1970.
- Rapant V. Novodobé poznatky o podstatě refluxního syndromu a jejich podíl na standardizaci chirurgické léčby. Čs Gastroent Výž. 1976;30(1):42–46.
- Heitmann P. Der gastroesophageale Verschlussmechanismus bei Hiatusgleithernien. Internist. 1969;10(7):249–258.
- Cassela RR, Ellis FH Jr, Brown AL. Fine-structure changes in achalasia of the oesophagus. I. Vagus nerves. Ann Intern Med. 1975;83(3):390–401.
- Dodds WJ, Hogan WJ, Miller WN. Reflux Esophagitis. Digestive Diseases. 1976;21(1):49–67.
- Dlouhý M, Duda M, Minařík L. Přínos jícnové manometrie pro chirurgii esofagogastrického spojení. Čs Gastroent Výž. 1982;36(8):411–414.
- Siewert RJ, Blum AL, Waldeck F, editors. Funktionsstörungen der Speiseröhre. Berlin Heidelberg, New York: Springer-Verlag; 1976.
- Šetka J, Dvořáková P, Teisinger P, Jirásek V, Šimek J, Skála I. Kardioezofageální iritace, reflux, esofagitis a hiátová hernie (náhodná koincidence či řetěz příčin a následků?). Sborn Lék. 1974;76(3):77–82.
- Weiser HF, Lepsien G, Schattenmann G, Siewert R. Klinische Bedeutung der Hiatushernie. Zbl Chir. 1978;103(1):20–29.
- Edwards DAW, Thomson H, Shaw DG, Misiewicz JJ, Benett JR, Torance B. Symposium on gastroesophageal reflux and its complications. Gut. 1973;14(3):233–253.
- Prinsen JE. Hiatus Hernia in Infants and Children: A Long-Term Follow-up of Medical Treatment. J Pediat Surg. 1975;10:97–102.
- Vos A. Gastroesophageal Reflux in Infants and Children. Scand J Gastroent. 1971;6(6):369–370.
- Burkhardt K, Bahners W. Therapie peptischer Oesophagusstenosen im Kinderlater. Chirurg. 1975;46(11):507–512.
- Carveth SW, Schlegel JF, Code CF, Ellis FH Jr. Esophageal motility after vagotomy, phrenotomy, myotomy and myomectomy in dogs. Surg Gynec Obst. 1962;114(1):31–42.
- Grob M. Hiatushernien im Kindesalter. Langenbecks Arch Klin Chir. 1968;322(Kongressbericht):370–378.
- Steller F. Ezofagoskopie a dilatace pri peptických ezofageálných stenózách u dětí. Brat Lék listy. 1970;54(3):341–345.
- Olsen AM, Schlegel JF, Spencer Payne W. The Hypotensive Gastroesophageal Sphincter. Mayo Clin Proc. 1973;48(3):165–172.
- Dvořáková H, Potocký V, Šetka J, Vykusová B. Hiátová hernie po resekci žaludku. Čas Lék Čes. 1967;106(11):284–286.
- Iordnaskaja NI, Orlov VP. Ref luks-ezofagit posle operacij na želudke. Klin Med. 1974;52(7):77–79.
- Korhoň M, Krč C. K otázce nedostatečnosti kardie po resekci žaludku. Rozhl Chir. 1964;43(1):6–11.
- Mikuláš J, Ondruš B. Peptické stenózy ezofágu po resekciách žalúdka. Rozhl Chir. 1979;58(11):740–744.
- Rapant V, Schwarzer M. Skluzné kýly hiatu esophageálního. Čas Lék Čes. 1960;99(30-31): 946–952.
- Cohen S. Hypogastrinemia and Sphineter Incompetence. New Engl J Med. 1973;289(26): 215–226.
- Lipshutz WH, Gaskins RD, Lukasch WM, Sode J. Pathogenesis of Lower-Esophageal-Sphincter Incompetence. New Engl J Med. 1973;289(26):182–184.
- Farrel RL, Castel DO, McGuigan JE. Measurements and comparisons of lower esophageal sphincter pressures and serum gastrin levels in patients with gastroesophageal reflux. Gastroenterology. 1974;67(3):415–422.
- Donovan IA, Harding LK, Keighley MRB, Griffin DW, Collis JL. Abnormalities of gastric emptying and pyloric reflux in uncomplicated hiatus hernia. Br J Surg. 197;64(12):847–848.
- Gillison EW, DeCastro VAM, Nyhus LM, Kusakari K, Bomeck CT. The significance of bile in reflux esophagitis. Surg Gynecol Obst. 1972;134(2):419–424.
- Binder HJ, Bloom DL, Stern H. The effect of cervical vagotomy on esophageal function in the monkey. Surgery. 1968;64:1075–1083.
- Butterfield WC, Massi J. Gastric reflux in colon interposition. J Thorac Cardiovasc Surg. 1972;64(2):222–234.
- Mann CV, Hardcastle JD. The effect of vagotomy on the human gastro-esophageal sphincter. Gut. 1968;9:688–695.
- Martindi S, Müller C, Allgöwer M. Präund postoperative endomanometrische Befunde im Ösophagus bei proximal-selektiver Vagotomie. Helv Chir Acta. 1978;45:75–79.
- Oomen JP, Wittebol P, Gurts WJC, Akkermann LA. Lower oesophageal sphincter function after higly selective vagotomy. Arch Surg. 1979;114:908–910.
- Schattenmann G, Lepsien G, Siewert R. Kardiafunktion nach proximal-gastrischer Vagotomie. Langenbecks Arch Chir. 1979;348:231–241.
- Mandache F, Vasitin M, Popescu M. Oesophagusreflux nach chirurgischen Eingriffen wegen Magenund Zwölffingerdarmgeschwüren. Chirurgia (Buc). 1969;18:891.
- Siewert RJ, Koch A, Stuhler Th, Wallat H. Cardiafunction und gastroesophagealer Reflux nach distaler Magenresektion. Z Gastroent. 1974;12:583–590.
- Venkatachalm B, Da Costa LR, Beck IT. What is a normal esophageal-gastric junction? Gastroenterology. 1972;62(4):521–528.
- Winkelstein A. Peptic esophagitis: A new clinical entity. JAMA. 1935;104(11):906–909.
- Blum AL, Siewert R. Hiatushernie, Refluxkrankheit und Refluxösophagitis. Internist. 1977;18(8):423–435.
- Dvořáková H, Šetka J, Jekler J. Naše zkušenosti s léčením hiátových hernií, iritací a zánětů jícnu. Čas Lék Čes. 1965;104(24):645–650.
- Henderson RD, Wigle ED, Sample K, Marryatt G. Atypical Chest Pain of Cardiac and Esophageal Origin. Chest. 1978;73(1):24–27.
- Siegrist PW, Krejs GJ, Blum AL. Symptomatik der gastroesophagealen Reflux-krankenheit. Dtsch Med Wschr. 1974;99(42):2088–2094.
- Vinnik IE, Kern F. The effect of gastric intubation on esophageal pH. Gastroenterology. 1964;47(4):388–394.
- Casten DF. Peptic esophagitis, hiatal hernia and duodenal ulcer. Am J Surg. 1967;113(5): 638–641.
- Siewert RJ, Jennewein HM, Arnold R, Creutzfeldt W. Zum Verhalten des unteren Ösophagussphinkters beim Zollinger-Ellison-Syndrom. Dtsch Med Wschr. 1973;98(28):1381–1383.
- Boutelier PH, Béhar A. Étude comparative des rensignements fournis park les radiographies standards et le radio-cinéma dans les mal-positions cardio-tubérositaires et les hernies hiatales. Arch Fr Mal App Dig. 1971;60(1–2):5–12.
- Henderson RD, Pearson FG. Surgical management of esophageal sclerodermia. J Thorac Car diovasc Surg. 1973;66(5):686–692.
- Kiriluk LB, Merendino KA. Comparative sensitivity of mucosa of various segments of alimentary tract in dog to acid-peptic action. Surgery. 1954;35(4):547–556.
- Rossetti M. Enttäuschungen und Fortschritte in der Ösophaguschirurgie. Acta Univ Olomuc Fac Med. 1973;66:281–290.
- Singh P, Adamopoulos A, Taylor RH, Colin-James DG. Oesophageal motor function before and after healing of oesophagitis. Gastroenterology. 1993;33:1590.
- Holloway RH. The anti-reflux barrier and mechanisms of gastrooesophageal reflux. Bailliers Best Pract Res Clin Gastroenterol. 2000;14: 681.
- Locke GR, Talley NJ, Fett SL, et al. Prevalence and clinical spektrum of gastroesophagel reflux; a population-based study in Olmsted County, Minnesota. Gastroenterology.1997;112:1448.
- Stanghellini V. Thre-month prevalence rates of gastrointestinal symptoms and the influence of demographic factor: results from the Domestic/International Gastroenterology Surveillance Study (DIGEST). Scand J Gastroenterol Suppl. 1994;34:20.
- Dent J, El-Serag HB, Wallander MA, Johansson S. Epidemiology of gastro-oesophagel reflux disease: a systematic review. Gut. 2005;54:710.
- Enck P, Dubois D, Marquis P. Quality of life in patients with upper gastrointestinal symptoms: results from the Domestic/International Gastroenterology Surveillance Study (DIGEST). Scand J Gastroenterol Suppl. 1999;34:48.
- Chvojka J. Die Bedeutung der Ösophagoskopie in der Diagnostik der ösophagealen Hiatushernien. Zbl. Chir. 1966;91(19):713–716.
- Škeřík P, Tichý S. Esofagoskopická diagnostika a léčba nemocí jícnu. Praha: Avicenum zdravotnické nakladatelství; 1970.
- Siewert RJ, Blum AL, Waldeck F, editors. Funktionsstörungen der Speiseröhre. Berlin Heidelberg, New York: Springer-Verlag; 1976.
- Ottenjan R, Gruner HJ, Strauch M. Endoskopisch-bioptische Befunde bei Refluxösophagitis. Leber Magen Darm. 1972;2(2):48–52.
- Ollyo JB, Lang F, Fontolliet C, Monnier P. Savary-Miller’s new endoscopic grading of reflux-esophagitis: a simple, reproducible, logical, complete and useful classification. Gastroenterology. 1990;98:A100.
- Hetzel DJ, Dent J, Reed WD, et al. Healing and relapse of severe peptid esophagitis after treatment with omeprazole. Gastroenterology. 1998;95:903.
- Armstrong D, Bennett JR, Blum AL, et al. The endoscopic assessment of esophagitis: a progress report of observer agreement. Gastroenterology. 1996;111:85.
- Mařatka Z. The OMED Data Base-Standart for Nomenclature. Endoscopy. 1992;24: Suppl. 455–456.
- Šoustek Z. Peptická esofagitis. Čs Gastroent Výž. 1957;11(4):282–286.
- Korhoň M, Černý O. Vředová choroba jícnu. Čas Lék čes. 1967;106(7):169–174.
- Korhoň M, Králík J, Tichý A. Die Schleimhautadaptation im Anastomosengebiet nach Oesophagoplastik mit Hilfe eines plastisch gebildeten Magentubus im Experiment. Exper Chir. 1969;3(6):369–374.
- Krejs GJ, Seefeld U, Brändli HH. Gastroesophageal reflux disease: correlation of subjective symptoms with 7 objective esophageal function tests. Acta hepato-gastroenterol. 1976;23:130–136.
- Ismail-Begi F, Horton PF, Pope ChE II. Histological consequences of gastroesophageal reflux in man. Gastroenterology. 1970;58(2):163–174.
- Wenstein WM, Bogoch ER, Bowes KL. The normal human esophageal mucosa: A histological reappraisal. Gastroenterology. 1975;68(1):40–44.
- Funch-Jensen P, Kock K, Christensen LA, et al. Microscopic appearance of the esophageal mucosa in a consecutive series of patients submitted to microscopy: correlation with gastroesophageal reflux symptoms and microscopic findings. Scand J Gastroenterol. 1986;21:65.
- Riddell RH. The biopsy diagnosis of gastroesophageal reflux disease, „carditis“, and Barrett’s esophagus. Am J Surg Pathol. 1996;20:31.
- Dobbins JW, Sheahan DG, Behar J. Eosinophylic gastroenteritis with esophageal involvement. Gastroenterology. 1977;72:1312–1316.
- Liacouras CHA, Markowitz JE. Eosinophylic esophagitis. New York: Humana Press Springer Science+Business Media; 2012.
- Šetka J, Dvořáková P, Teisinger P, Jirásek V, Šimek J, Skála I. Kardioezofageální iritace, reflux, esofagitis a hiátová hernie (náhodná koincidence či řetěz příčin a následků?). Sborn Lék. 1974;76(3):77-82.
- Lam CR, Gahagan T. The Myth of the Short Esophagus. In: Nyhus LM, Harkins HN, editors. Hernia. Philadelphia: J. B. Lippincott; 1964.
- Winters C, Spurling TJ, Chokanian SJ, et al. Barrett’s esophagus: a prevalent occult complication of gastroesophagel reflux disease. Gastroenterology. 1987;92:118.
- Lind T, Havelund T, Carlsson R, et al. Hearthburn without esophagitis: efficacy of omeprazole therapy and features determining therapeutic response. Scand J Gastroenterol. 1997;32:974.
- Pace F, Santalucia F. Bianchi-Porro G. Natural history of gastroesophageal reflux disease without esophagitis. Gut. 1991;32:845.
- Labenz J, Nocom M, Lind T, et al. Prospective folow-up from the ProGERD study suggests that GERD is not a categorical disease. Am J Gastroenterol. 2006;101:2457.
- Barrett NR . Chronic peptic ulcer of the oesophagus and oesophagitis. Br J Surg. 1950;38(150):175–182.
- Barrett NR. The lower esophagus lined by columnar epithelium. Surgery. 1957;41(6):881–894.
- Barrett NR . B enign stricture in the lower esophagus. J. Thorac Cardiovasc Surg. 1962;43(6):703–715.
- Allison PR, Johnstone AS. The oesophagus lined with gastric mucous membrane. Torax. 1953;8(2):87–101.
- Cohen S, Wolf BS, Som ML, Janowitz HD. Correlation of manometric, oesophagoscopic and radiological findings in the columnar – lined gullet (Barrett syndrome). Gut. 1963;4:406–412.
- Lortat-Jacob JL. L’endobrachy-oesophage. Ann Chir. 1957;11(4):1247–1250.
- Hayward J. The lower end of the oesophagus. Torax. 1961;16(1):36–41.
- Wong J, Finckh ES. Heterotopia and ectopia of gastric epithelium produced by mucosal wounding in the rat. Gastroenterology. 1971;60(2):279.
- Burgess JN, Fayne WS, Andersen HA, Weiland LH, Carlson HC. Barrett Esophagus. The Columnar – Epithelial Lined Lower Esophagus. Mayo Clin Proc. 1971;46(11):728–734.
- Siewert R. Der Endobrachyoesophagus (Barrett-Syndrom). Chirurg. 1974;45(6):245–252.
- Skinner DB, Belsey RH. Surgical management of esophageal reflux and hiatus hernia. J. Thorac Cardiovasc Surg. 1967;53(1):33–54.
- Rossetti M, Huben R, Allgöwer M. Endobrachyösophagus end erworbener Brachyösophagus. Helv Chir Acta. 1974;41(1,2):109–113.
- Siewert RJ, Weiser HF, Lepsien G, Peiper HJ. Adenocarcinom der Speiseröhre. Chirurg. 1979;50:675–680.
- Korhoň M, Rapant V. Hiatushernien und Kardiakarzinom. Zentralbl Chir. 1966;91(18): 667–673.
- Spechler SJ. Barrett’s esophagus. N Engl J Med. 2002;346:836.
- British Society of Gastroenterology. Guidelines for the diagnosis and management of Barrett’s columnar-lined oesophagus. A Report of the Working Party of the British Society of Gastroenterology. August 2005. Available: http://www.bsg.org.uk.
- Spechler SJ. Intestinal metaplasia at the gastroesophageal junction. Gastroenterology. 2004;126:567.
- Stein HJ and panel of experts. Esophageal cancer: screening and surveillance. Results of a consensus conference. Dis Esoph. 1996;9(Suppl 1):3–19.
- Cameron AJ, Ott BJ, Payne WS. The incident of adenocarcinoma in columnar lined (Barrett’s) esophagus. N Engl J Med. 1985;313:857.
- Siewert JR, Stein HJ, Lordick F. Ösophaguskarcinom. In: Siewert JR, Rothmund M, Schumpelick V, Herausgeber. Praxis der Visceralchirurgie. Onkologische chirurgie. 2.Auflage. Heidelberg: Springer Verlag; 2006.
- Spechler SJ, Lee E, Ahnen D, et al. Long-term outcome of medical and surgical treatments for gastroesophageal reflux disease. Follow-up of randomized controlled trial. JAMA. 2001;285:2331.
- Sharma P, Falk GW, Weston AP, et al. Dysplasia and cancer in a large multicenter cohort of patiens with Barrett’s esophagus. Clin Gastroenterol Hepatol. 2006;4:566.
- Martinek J. Refluxní choroba jícnu – zamyšlení nad některými mýty. Bulletin Kliniky Hepatogastroenterologie IKEM. Praha. 2006;5(2):11–16.
- Cameron AJ. Epidemiology of columnar-lined esofagus and adenocarcinoma. Gastroenterol Clin N Am. 1997;26:487.
- Rex DK, Cummings OW, Shaw M, et al. Screening for Barrett’s esophagus in colonoscopy patiens with and without heartburn. Gastroenterology. 2003;125:1670.
- Ronkainen J, Aro P, Storkkrubb T, et al. Prevalence of Barrett’s esophagus in the general population: an endoscopic study. Gastroenterology. 2005;129:1825.
- Giuli R, Siewert JR, Couturier D, Scarpignato C, editors. Barretts Esophagus. Paris: John Libbey Eurotext; 2003.
- Chandrasoma PT, DeMeester TR. GERD Reflux to Esophageal Adenocarcinoma. Burlington, San Diego, London: Elsevier; 2006.
- Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000;100:57.
- Aujeský R, Neoral Č, Král V, Klein J. Oncological problems associated with Barrett’s oesophagus. Biomed Pap Fac Med Palacky Univ Olomouc. 2000;143:77
- Aujeský R, Hajdúch M, Neoral Č, Král V, Lubušká L, Bohanes T, Klein J, Vrba R, Dráč P. p 53 – Prognostic factor of malignant transformation of Barrett’s esophagus. Biomed Pap Fac Med Univ Palacky Olomouc. 2005;149(1):141–144.
- Mandys V, Lukás K, Revoltella R. Different patterns of cytokeratin expression in Barrett’s esophagus – what is beyond? Pathol Res Pract. 2003;199(9):581–587.
- Spechler SJ. Dysplasia in Barrett’s esophagus: limitations of current management strategies. Am J Gastroenterol. 2005;100:927.
- Goldblum JR. Barrett’s esofagus and Barrett’s-related dysplasia. Mod Pathol. 2003;16:316.
- Duda M. Chirurgická léčba refluxní nemoci jícnu. Kandidátská disertační práce. Olomouc, 1978.
- Duda M. Chirurgische Behandlung der Funktionsstörungen der Speiseröhre. Olomouc: Universita Palackého v Olomouci; 1984.
- Akerlund A. I. Hernia diaphragmatica Hiatus oesophagei vom anatomischen und röntgeologischen Gesichtspunkt. Acta Radiol. 1926;6:3–22.
- Johnson HD. The Cardia and Hiatus Hernia. London: Heinemann; 1968.
- Barrett NR. Hiatus Hernia. Br J Surg. 1954;42(173):231–234.
- Schatzki R, Gary JE. Dysphagia due to a diaphragm-like localized narrowing in the lower esophagus. Am J Rentgenol. 1953;70(6):911–922.
- Paulson DL. Gastroesophageal reflux. Am Surg. 1973;39(2):67–71.
- Sgouros SN, Vlachogiannakos J, Karamanolis G, et al. Long-term acid suppression therapy may prevent the relapse of lower esophageal (Schatzki’s) rings: a prospective, randomized, placebo-controlled study. Am J Gastroenterol. 2005;100:1924.
- Pearson FG. Surgical Management of Acquired Short Esophagus with Dilatable Peptic Stricture. World J Surg. 1977;1(4):463–473.
- Rapant V. K patologii a klinice stenóz jícnu následkem refluxní ezofagitidy. Čas Lék čes. 1973;112(20):622–629.
- Richter JE. Peptic stricture of the esophagus. Gastroenterol Clin North Am. 1999;28:875.
- El-Serag HB, Sonnengerg A. Association of esophagitis and esophageal strictures with disease treated with non-steroideal antiinflammatory drugs. Am J Gastroenterol. 1997;92:52.
- Hayward J. The treatment of fibrous stricture of the oesophagus associated with hiatal hernia. Thorax. 1961;16(1):45–55.
- Burkhardt K, Bahners W. Therapie peptischer Oesophagusstenosen im Kinderlater. Chirurg. 1975;46(11):507–512.
- Siewert RJ, Lepsien G, Schattenmann G, Weiser HF. Therapieergebnisse peptischer Oesophagusstenosen. Langenbecks Arch Chir. 1980;353:155–170.
- Siewert RJ, Peiper HJ, Niemann H, Emermann H, Backer HD. Klassifikation und Therapie peptischer Oesophagusstenosen. Langenbecks Arch Klin Chir. 1972;330:332–347.
- Chládek A. Peptické vředy jícnové. Čas. Lék. čes. 1968;107(36):1108–1110.
- Šístek V, Rychterová V, Horáček F. Barrettův vřed jícnu. Čs Gastroent Výž. 1966;20(5):347–350.
- Sandry G. The pathology of chronic oesophagitis. Gut. 1962;3(3):189–200.
- Brossard E, Monnier JB, Ollyo JB, et al. Serious complications – stenosis, ulcer and Barrett’s epithelium – develop in 21,6% of adults with erosive reflux esophagitis. Gastroenterology.1992;100:A36.
- Rejeb MR, Bouché O, Zeitoun P. Study of 47 consecutive patients with peptic esophageal stricture compared with 3880 cases of reflux esophagitis. Dig Dis Sci. 1992;37:7338.
- Rossetti M. Die Refluxkrankheit des Oesophagus. Klinik, Komplikationen, Behandlung. Stuttgart: Hippokrates; 1966.
- Da Costa N. Guillaume C, Merle C, et al. Bleeding reflux esophagitis: a prospective 1-year study in a university hospital. Am J Gastroenterol. 2001;96:47.
- Šerý Z, Duda M, Fischer J, Dlouhý M. Bleeding from oesophageal varices. Acta Univ Olomouc Fac Med. 1974;71:53–67.
- Belsey R. The pulmonary complications of esophageal disease. Br J Dis Chest. 1960;54: 342–348.
- Gvozdev MP. Legočnye osloženija u bolnych skolzjaščej gružej piščevodnogo otverstija diafragmy. Vest Chir. 1971;106(4):54–57.
- Siegrist PW, Krejs GJ, Blum AL. Symptomatik der gastroesophagealen Reflux-krankenheit. Dtsch Med Wschr. 1974;99(42):2088–2094.
- Richter JE. Extraesophageal presentations of gastroesophageal reflux disease. Am J Gastroenterol. 2000;25(Suppl):S1.
- Harding SM, Sontag SJ. Asthma and gastroesophageal reflux. Am J Gastroenterol. 2009;95(Suppl):S23.
- Irwin RS, Richter JE. Gastroesophageal reflux and cough. Am J Gastroenterol. 2000;95(Suppl): S39.
- Loveček M, Maňásková E. Možnosti 24hodinové pH-metrie horního jícnu v diagnostice ezofagofaryngeálního refluxu. Otorinolaryngol Foniatr. 2006;55(4):193–198.
- Lukáš K. Refluxní choroba, minimum pro praxi. Praha: Triton; 1997.
- Duda M, Šerý Z, Roček V. Das klinische Bild und die Differentialdiagnostik der Refluxkrankheit des Ösophagus und des Hiatushernienkomplex. Dt Z Verdau-Stoffwechselkr. 1980;40(6):209–218.
- Klauser AG, Schindlebeck NE, Muller-Lissner SA. Symptoms of gastroesophageal reflux disease. Lancet. 1990;335:205.
- Šerý Z, Duda M, Roček V, Dlouhý M. Vředová choroba duodena a refluxní nemoc jícnu. Čs Gastroent Výž. 1981;35(6):265–275.
- Fass R, Fennerty MB, Ofman JJ. The clinical and economic value of a short course of omeprazole in patients with non-cardiac chest pain. Gastroenterology. 1998;115:42.
- Fass R, Ofman JJ, Granelk I, et al. Clinical and economic assessment of the omeprazole test in patients with symptoms suggestive of gastroesophageal reflux disease. Arch Intern Med. 1999;159:2161.
- Ours TM, Kavuru MS, Schilz R, Richter JE. A prospective evaluation of esophageal testing and a double blind, randomized study of omeprazole in a diagnostic and therapeutic algorithm for chronic cough. Am J Gastroenterol. 1999;94:3131.
- Baker ME, Eistein DM, Hertz BR, et al. Integrating the barium esophagram before and after anti-reflux surgery. Radiology. 2007;243:329.
- De Meester TR, Johnson LF, Joseph GJ, et al. Pattern of gastroesophageal reflux in health and disease. An Surg. 1976;184:459.
- DeMeester TR, Wang CI, Wernly JA, et al. Technique, indications and clinical use of 24-hour esophageal pH monitoring. J Thorac Cardiovasc Surg. 1980;79:656–667.
- Hirano I, Richter JE. ACG practice guidelines: esophageal reflux testing. Am J Gastroenterol. 2007;102:668.
- Taghavi SA, Kgasedi M, Saberi-Firoozi M, et al. Symptom association probability and symptom sensitivity index: preferable but still suboptimal predictors of response of high dose omeprazole. Gut. 2005;54:1067.
- Pandolfino JE, Richter JE, Ours R, et al. Ambulatory esophageal pH monitoring using a wireless system. Am J Gastroenterol. 2003;98:740.
- Waring JP, Hunter JG, Oddsdottir M. The preoperative evaluation of patients considered for laparoscopic antireflux surgery. Am J Gastroenterol. 1995;90:35.
- Oleynikov D, Eubanks TR, Oelschlager BK, Pellegrini CA. Total fundoplication is the operation of choice for patients with gastroesophageal reflux and defective peristalsis. Surg Endosc. 2002;16:909.
- Blum AL, Siewert R. Hiatushernie, Refluxkrankheit und Refluxösophagitis. Internist. 1977;18(8)423–435.
- Blum AL, Siewert JR, editors. Refluxtherapie. Berlin-Heidelberg-New York: Springer-Verlag; 1981.
- Skinner DB, Belsey RH, Hendrix TR, Zuidema GD, editors. Gastroesophageal Reflux and Hiatal Hernia. Boston: Little, Brown and Company; 1972.
- Vancjan EN, Judin AA, Čussov VI. Koncervativnoe lečenie refluks-ezofagitida pri gružach piščevodnovo otverstija diafragmi. Klin Med. 1972;50(7):29–33.
- Duda M, Hildebrand T. Jícen a kardie. Neuromuskulární poruchy jícnu. Hiátové kýly. Záněty jícnu. Refluxní nemoc jícnu. Nádory jícnu. Jiné nemoci jícnu. In: Mařatka Z, et al., editors. Gastroenterologie. Praha: Karolinum; 1999. s. 43–104.
- Allison PR. Reflux oesophagitis, sliding hiatal hernia and the anatomy of repair. Surg Gyn Obst. 1951;92(4):419–431.
- Allison PR. Hiatus Hernia: (A 20-year Retrospective Survey). Ann Surg. 1973;178(3):273–276.
- Gahagam T, Lam CR. Esophageal Hiatus Hernia. Springfield: Thomas; 1976.
- Sweet RH. Analysis of one hundred-thirty cases of hiatus hernia treated surgically. JAMA. 1953;151(5):376–378.
- Maden JL. Anatomic and technical considerations in the treatment of oesophageal hiatal hernia. Surg Gynecol Obstet. 1956;102(2):187–194.
- Humphreys GH, Ferrer JM, Wiedel PD. Esophageal hiatus hernia of the diaphragm: An analysis of surgical results. J Thorac Surg. 1957;34(6):749–767.
- Hayward J. The phreno-oesophageal ligament in hiatal hernia repair. Torax. 1961;16(1):41–45.
- Rapant V, Králík J, Korhoň M, Holub E. Die Technik der Haywardschen Operation der Hiatushernien und ihre Spätergebnisse. Zbl Chir. 1966;91(19):708–713.
- Lortat-Jacob JL, Maillard JN. Le traitement chirurgical des maladies du relux gastro-oesophagien: malpositions cardiotuberositaires, hernies hiatales, brachyoesophages. Presse med. 1957;65(20):455–456.
- Lortat-Jacob JL, Robert F. Les malpositions cardio-tuberositaires. Arch Fr Mal App Dig. 1953;42(6):750–774.
- Nissen R, Rossetti M. Die Behandlung der Hiatushernien und Reflux-Oesophagitis mit Gastropexie und Fundoplicatio. Stuttgart: G. Thieme; 1959.
- Boerema I, Germs R. Gastropexia anterior geniculata wegen Hiatusbruch des Zwerchfells. Zbl Chir. 1955;80(39):1585–1590.
- Angelchik JP, Cohen R. A new Surgical Procedure for the Treatment of Gastroesophageal Reflux and Hiatal Hernia. Surg Gynecol Obstet. 1979;148(2):246–248.
- Nissen R, Rossetti M, Siewert R. 20 Jahre Behandlung der Refluxkrankheit mit Fundoplikation. Chirurg. 1977,48(10):634–639.
- Dor J, Humert P, Paoli JM, Noirclerc M, Aubert J. Traitement du reflux par la technique dite de Heller-Nissen modifiée. Presse méd. 1967,75(50):2563–2565.
- Toupet A. Techniques d’oesophagogastroplastie avec phrenogastropexie appligueée dans la cure radicale des hernies hiatales et comme complément de l’operation de Heller dans les cardiospasmes. Mem Acad Chir. 1963;89:394.
- Lhotka J, Borek Z, Dvořáková H, Langer L. Surgery for and Surgical Prevention of Reflux Esophagitis in Sliding Hiatus Hernia. Int Surg. 1969;51(5):371–377.
- Hatafuku T, Thal AP. The Use of the Onlay Gastric Patch with Experimental Perforations of the Distal Esophagus. Surgery. 1964;56:556–560.
- Thal AP, Hatafuku T, Kurtzman R. A New Method for Recontruction of the Esophago-gastric Junction. Surg Gynecol Obstet. 1965;120(6):1225–1231.
- Belsey R. Mark IV. Repair of Hiatal Hernia by the Transthoracic Approach. World J Surg. 1977;1(4):475–483.
- Orringer MB, Skinner DB, Belsey RHR. Long-term results of the Mark IV operation for hiatal hernia and analyses of recurrences and their treatment. J Thora. Cardiovasc Surg. 1972;62(1):25–31.
- Hill LD. Surgery and gastroesophageal reflux. Gastroenterology. 1972;63(1):183–185.
- Csendens A, Larrain A. Effect of posterior gastropexy on gastroesophageal sphincter pressure and symptomatic reflux in patients with hiatal hernia. Gastroenterology. 1972;63(1):19–24.
- Duda M, Roček V, Gryga A,. Dlouhý M. Nepřímé výkony pro komplikovanou refluxní nemoc jícnu a hiátové hernie. Čs Gastroent Výž. 1989;43(7):369–374.
- Vrba R, Neoral Č, Aujeský R, Loveček M. Nepřímý antirefluxní výkon u gastroezofageální refluxní nemoci. Rozhl Chir. 2007;86(9):490–492.
- Dlouhý M, Duda M, Minařík L. Přínos jícnové manometrie pro chirurgii esofagogastrického spojení. Čs. Gastroent. Výž. 1982;36(8):411–414.
- Siewert RJ, Wallat HJ, Krtsch H, Peiper HJ. Klinische Ergebnisse der Fundoplikatio. Langenbecks Arch. Chir. 1975;338(1):9–26.
- Skinner DB, Both DJ. Assessment of Distal Esophageal Function in Patients with Hiatal Hernia and /or Gastroesophageal Reflux. Ann. Surg. 1970;172(4):627–637.
- Siewert RJ, Jennewein HM, Waldeck F, Peiper HJ. Experimentale und klinische Untersuchungen zum Wirkungsmechanismus der Fundoplicatio. Langenbecks Arch. Chir. 1973;333(1): 5–22.
- Borst HG, Earlam R. Physiologie und Pathophysiologie der Kardia und des unteren Oesophagus. Langenbecks arch. Klin. Chir. 1968;322:340–349.
- Rossetti M. Bedeutung des ösophagogastrischen Winkels in der Physiologie und Pathophysiologie der Cardia. Schweiz. Med. Wschr. 1959;89(49):1280–1284.
- Siewert RJ, Lepsien G, Weiser HF, Weiser G, Schattenmaann G, Peiper HJ. Das Teleskop-Phänomen (Eine Komplikationsmöglichkeit nach Fundoplicatio). Chirurg. 1977;48(10):640–645.
- Utkin VV. Ocenka fundoplikacii po Nissenu pri lečenii gruž piščevodnovo otverstija diafragmi. Chirurgija. 1969;45(2):6–13.
- Duda M. Chirurgická léčba funkčních onemocnění jícnu. Taktika a technika operací. Rozhl Chir. 1982;61(10):657–667.
- Belsey R. Surgical treatment of gastro-oesophageal reflux and its complications. Acta Univ. Olomus. Fac. Med. 1974;71:23–32.
- Cushieri A, Shimi S, Nathauson LK. Laparoscopic reduction, crural repair and fundoplication of large hiatal hernia. Am J Surg. 1992;163(4):425–450.
- Bognato VJ. Laparoscopic Nissen Fundoplication. Surg Laparosc Endosc. 1992;2(3):188–190.
- Hinder AR, Filipi J. The Technique of laparoscopic Nissen fundoplication. Surg Laparosc Endosc. 1992;2(3):265–272.
- Collet D, Cadiere GB, et al. Conversions and Complications of Laparoscopic Treatment of Gastroesophageal Reflux Disease. Am J Surg. 1995;(163)4):622–626.
- Frantzides CT, Carlson MA. Laparoscopic Versus Conventional Fundoplication. J Laparoendosc Surg. 1995;5(3):137–143.
- Hallerback B, Glise H, Johansson B. Laparoscopic Rossetti fundoplication. Scand J Gastroenterol. 1995;30(Suppl208):58–61.
- Duda M, Dlouhý M, Gryga A, Köcher M. Možnosti laparoskopických a torakoskopických operací v chirurgii jícnu a žaludku. In: V. Říha et al., editor. Endoskopická chirurgie. Sborník prací III. celostátní konference o laparoskopické chirurgii; 22.–23. 4. 1994; Benešov u Prahy. s. 74–79.
- Duda M. Komentář k problematice refluxní nemoci jícnu a hiátovým herniím. In: Duda M, Czudek S, editors. Miniinvazivní chirurgie. Třinec: Nemocnice Podlesí Třinec; 1996.
- Neoral Č, Král V. Laparoskopická fundoplikace. Rozhl Chir. 1996;75(7):345–348.
- Neoral Č, Aujeský R, Král V. Místo antirefluxního výkonu v terapii refluxní nemoci jícnu – problém diagnostický, terapeutický a indikační. Čes a slov Gastroent. 1997;51(6):207–209.
- Loveček M, Gryga A, Herman J, Švach I, Duda M. Komplikace laparoskopické fundoplikace. In: Sborník abstrakt V. konference CMCIE. 7. 6. 2002, Brno. nestr.
- Neoral Č, Aujeský R, Král V, Vrba R. Hodnocení dlouhodobých výsledků operačního řešení gastroezofageální refluxní choroby. Slov Chir. 2003;2(7):4–6.
- Neoral Č, Aujeský R. Komplikácie a ich riešenie – iné pracovisko. In: Marko L’, editor. GER: Gastroezofageálny reflux: komplexný pohĺad. Banská Bystrica: MUDr. L’ubomír Marko, THK 25; 2002. s. 58–63.
- Aujeský R, Král V, Klein J, Vrba R, Bohanes T, Neoral Č. Reoperace po laparoskopické fundoplikaci. Rozhl Chir. 2004;83(10):503–505.
- Loveček M, Vrba R, Aujeský R, Neoral Č. Funkční změny kardioezofageální oblasti po laparoskopické fundoplikaci. Rozhl Chir. 2008;87(5):237–241.
- Drahoňovský V. Refluxní nemoc jícnu a hiátové hernie. In: Duda M, Czudek S, editors. Miniinvazivní chirurgie. Třinec: Nemocnice Podlesí Třinec; 1996.
- DeVault KR, Castell DO. American College of Gastroenterology. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol. 2005;100:190.
- Stein HJ, Feith M, Feussner H. The relationship between gastroesophageal reflux, development od Barrett’s epithelium and cancer of the esofagus. Langenbeck’s Arch Surg. 2000;385:309–316.
- Anderson LA, Murray LJ, Murphy SJ, et al. Mortality in Barrett’s esophagus: results from a population-based study. Gut. 2003;52:1081.
- Solaymani-Dodaran M, Logan RF, West j, Card T. Mortality associated with Barrett’s esophagus and gastroesophageal reflux disease diagnose – a population-based kohort study. Am J Gastroenterol. 2005;100:2616.
- Corley DA, Levis TR, Habel LA, et al. Surveillance and survival in Barrett’s adenocarcinomas: a population-based study. Gastroenterology. 2002;122:633.
- Siewert JR, Stein HJ, Lordick F. Ösophaguskarcinom. In: Siewert JR, Rothmund M, Schumpelick V, Herausgeber. Praxis der Visceralchirurgie. Onkologische chirurgie. 2. Auflage. Heidelberg: Springer Verlag; 2006.
- Sampliner RE and the Practice Parameters Committee of the American College of Gastroenterology. Updated guidelines for the diagnosis, surveillance, and therapy of Barrett’s esophagus. Am J Gastroenterol. 2002;97:1888.
- Collard JM. High-grade dysplasia in Barrett’s esophagus. The case for esophagectomy. Chest Surg Clin North Am. 2002;12:77.
- Simpliner RE. Endoscopic ablative therapy for Barrett’s esofagus. Gastrointest Endosc. 2004;59:66.
- Bergman JJ. Latest developments in the endoscopic management of gastroesophageal reflux disease and Barrett’s esophagus: an overview of the year’s literature. Endoscopy. 2006;8:122.
- Sharma VK, Wang KK, Overholt BF, et al. Balloon-based, circumferential, endoscopic radiofrequency ablation of Barrett’s esofagus: 1-year follow-up of 100 patients. Gastrointest Endosc. 2007;65.185.
- Martinek J, Suchánek Š, Stefanová M, Zavoral M. Radiofrekvenční ablace Barrettova jícnu. Současný stav a první vlastní zkušenosti. Folia Gastroenterol Hepatol. 2009;7(3,4):105–111.
- Falt P, Urban O, Fojtík P, Kliment M. Radiofrekvenční ablace v terapii Barrettova jícnu – naše první zkušenosti. Endoskopie.2009;18(3):118–123.
- Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc. 2003;57:567.
- Pech O, May A, Gossner L, et al. Management of pre-malignant and malignant lesions by endoscopic resection. Best Pract Res Clin Gastroenterol. 2004;18:61.
- Levine DS, Haggitt RC, Blount PL, et al. An endoscopic biopsy protokol can differentiate high-grade dysplasia from early adenocarcinoma in Barrett’s esophagus. Gastroenteorology. 1993;105:40.
- Reid BJ, Blount PL, Feng Z, Levine DS. Optimizing endoscopic biopsy detection of early cancers in Barrett’s high-grade dysplasia. Am J Gastroenterol. 2000;95:3089.
- Lightdale CJ. A balancing view: an individualized approach to high-grade dysplasia is key: esophagectomy, surveillance, or endoscopic therapy should all be considered. Am J Gastronterol. 2006;101:2193.
- Collis JL. An operation for hiatus hernia with short oesophagus. Thorax. 1957;12(3):181–188.
- Merendino KA, Varco RL, Wangesteen OH. Displacement of the esophagus into a new diaphragmatic orifice in the repair of para-esophageal and esophageal hiatus hernia. Ann. Surg. 1949;129(2):185–197.
- Ellis FH Jr., Leonardi HK, Dabuzhsky L, Crozier RE. Surgery for Short Esophagus with Stricture: An experimental and Clinical Manometric Study. Ann. Surg. 1978;188(3):341–350.
- Pearson FG. Surgical Management of Acquired Short Esophagus with Dilatable Peptic Stricture. World J Surg. 1977;1(4):463–473.
- Jobe BA, Horvath KD, Swanstrom LL. Postoperative function following laparoscopic Collis gastroplasty for shortened esophagus. Arch Surg. 1998;133:867–874.
- Dakkak M, Hoare RC, Maslin SC, et al. Oesophagitis is as important as oesophageal stricture diameter in determing dysphagia. Gut. 1993;34:152
- Riley SA, Attwood SEA. Guidelines on the use of esophageal dilatation in clinical practise. Gut. 2004;55:1.
- Marks RD, Richter JE, Rizzo J, et al. Omeprazole vs H2RAs in treating patients with peptic stricture and esophagitis. Gastroenterology. 1994;106:907
- Belsey R. Reconstruction of the esophagus with left colon. J. Thorac. Cardiovasc. Surg. 1965;49(1):33–55.
- Rossetti M, Hell K, Allgöwer M. Surgical therapy of reflux esophagitis. Chir. Gastroent. 1971;5(1):5–21.
- Schildberg FW, Witte J, Stücker FJ. Refluxbedingte Oesophagusstenosen. Chirurg. 1978;49(4): 146–154.
- Steller F. Ezofagoskopie a dilatace pri peptických ezofageálných stenózách u dětí. Brat. Lék. listy, 1970;54(3):341–345.
- Lortat-Jacob JL, Maillard JN, Fekete F. La prévention de reflux apres résection oesophagogastrique par un procédé d’anastomose continente. Mem. Ac. Chir. 1958;84:840–849.
- Nissen R. Die transpleurale Resektion der Kardia. Dtsch. Z. Chir. 1937;249:311.
- Wangensteen OH. Physiologic Operation for Mega-Esophagus (Dystonia, Cardiospasm, Achalasia). Ann Surg. 1951;134(3):301–318.
- Ellis FH Jr. Experimental Aspects of the Surgical Treatment of Reflux Esophagitis and Esophageal Stricture. Ann Surg. 1956;143(4):465–470.
- Merendion KA, Dillard DH. Concept of sphincter substitution by an interposed jejunal segment for anatomic and physiologic abnormalites at the esophagogastric junction. Ann. Surg. 1955;142(3):486–509.
- Rapant V, Králík J. Der Ersatz der Speiseröhre mit Hilfe des tubulierten Magenfundus. Chirurg. 1967;38(1):24–30.
- Edwards DA, Philips SF, Rowlands EN. Clinical and radiological results of repair of hiatus hernia. Br Med J. 1964;II:714–718.
- Pearson JB, Gray JG. Oesophageal hiatus hernia: Long-term results of the conventional thoracic operation. Br J Surg. 1967;54(6):530–533.
- Woodward ER, Thomas HF, McAlhany JC. Comparsion of Crural Repair and Nissen Fundoplication in the Treatment of Esophageal Hiatus Hernia with Peptic Esophagitis. Ann. Surg. 1971;173(5):782–792.
- Boerema I. Hiatus hernia: repair by right-sided, subhepatic, anterior gastropexy. Surgery. 1969;65(5):884–893.
- Magary CJ. The results of 101 operations for symptomatic hiatus hernia: a comparison of two different methods. Br J Surg. 1972;58(6):432–436.
- Schumann J, Wehling H. Die Gastropexie bei Hiatushernien unter neuen funktionellen Gesichtspunkten. Chir Praxi. 1973;17(1):33–41.
- Behar J, Brand D, Brown FC, Castell DO, Cohen S, Crossley RJ, et al. Cimetidine in the treatment of symptomatic gastroesophageal reflux. A double blind controled trial. Gastroenterology. 1978;74(3):441–448.
- Šerý Z, Duda M. Reoperace pro refluxní nemoc jícnu. Rozhl Chir 1980;59(11):740–746.
- Pafko P, Kabát J. Reoperace po operacích pro gastroesofageální reflux. Rozhl Chir. 1996;75(5):230–233.
- Arndorfer RG, Stef JJ, Dodds WJ, Linehan JH, Hogan WJ. Improved infusion system for intraluminal esophageal manometry. Gastroenterology. 1974;73:23–27.
- Atkinson M. Mechanism protecting against gastrooesophageal reflux. Gut.1962;3(1):1–15.
- Stein HJ, Feussner H, Siewert JR. Indikationen zur Antirefluxchirurgie des Ösophagus. Chirug. 1998;69:132–140.
- Watson DI, Jamieson GG. Antireflux surgery in the laparoscopic era. Br J Surg. 1998;85: 1173–1184.
- Dallemagne B, Weerts J, Markiewicz S, et al. Clinical results of laparoscopic fundoplication at ten years after surgery. Surg Endosc. 2006;20:159–165.
- Hunter JG, Smith CD, Branum GD, Waring JP, Trus TL, Cornwell M, Galloway K. Laparoscopic fundoplication failures: patterns of failure nad response tu fundoplication revision. Ann Surg. 1999;230:595–604.
- Stein HJ, Feussner H, Siewert JR. Failure of antireflux surgery: Causes and management strategies. Am J Surg. 1996;171:36–40.
- Kahrilas PJ. Radiofrequency therapy for the lower esophageal sphincter for the treatment fo GERD. Gastrointest Endosc. 2003;57:723.
- Fennerty MB. Endoscopic suturing for the treatment of GERD. Gastrointest Endosc. 2003;57:390.
- Edmundowicz SA. Injection therapy for the lower esophageal sphincter for the treatment of GERD. Gastrointest Endosc. 2004;59:542.
- Spechler SJ: Comparison of Medical and Surgical Therapy for Complicated Gastroesophageal Reflux Disease in Veterans. N Engl J Med. 1992;326(12):786–792.
- Spechler SJ, Lee E, Ahmen D. Long term outcome of medical and surgical therapies for gastroesophageal reflux disease: Follow-up of a randomized controlled trial. JAMA. 2001;285:2331.
- Lundell L, Miettinen P, Myrvold HE, et al. Continued (5-year) follow-up of randomized clinical study compairing antireflux surgery and omeprazole in gastroesophageal reflux disease. J Am Coll Surg. 2001;192:172.
- Campos GM, Peters JH, DeMeester TR, et al. Multivariate analysis of factors predicting outcome after laparoscopic Nissen fundoplication. J Gastrointest Surg. 1999;3:292–300.
- Gregar J, Procházka V, Lužná P, Ehrmann J jr. Využití NBI v diagnostice a sledování pacientů s Barrettovým jícnem. Gastroent Hepatol. 2012;66(2):126–132.
- Martínek J, Falt P, Gregar J, Suchánek Š, Urban O, Procházka V, Zavoral M. Radiofrekvenční ablace v gastrointestinálním traktu – současný stav ve světě a v ČR. Gastroent Hepatol. 2011;65(5):279–285.
- Luzna P., Gragar J, Überall I, Radova L, Prochazka V, Ehrmann J. Changes of microRNAs-192, 196a and 203 correlate with Barrett’s esophagus diagnosis and its progression compared to normal healthy individuals. Diagn Pathol. 2011;6:114.
- Luzna P, Gregar J, Uberall I et al. Micro RNA Assessment as a New Diagnostic and Prognostic Tool of Barretts Esophagus. Pilot Study. Gastroenterology. 2011;140(5):219.
- Gregar J. Barrettův jícen. In: Černoch J, et al. Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada; 2011.
- Martinek J, Kužela L, Špičák J, Vavrečka A. The clinical influence of Helicobacter pylori in effective acid suppression implications for the treatment of gastroesophageal reflux disease. Aliment Pharmacol Ther. 2000;14:979–990.



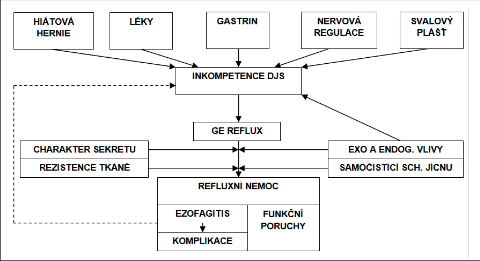
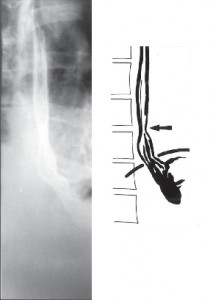

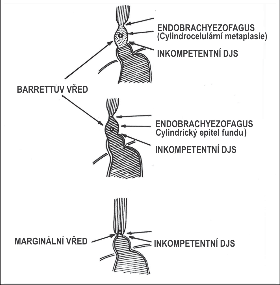
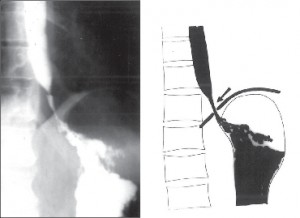
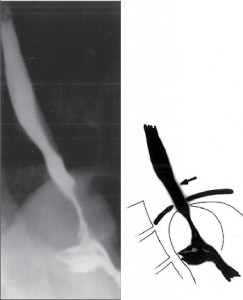
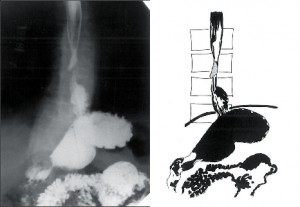
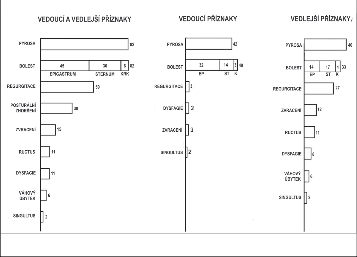
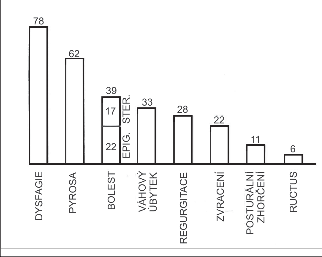
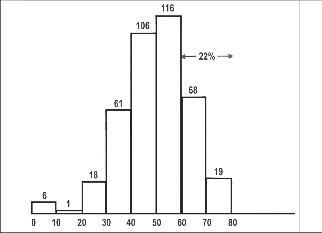
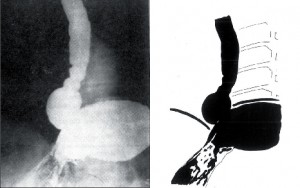
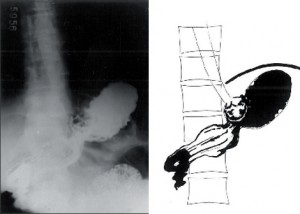
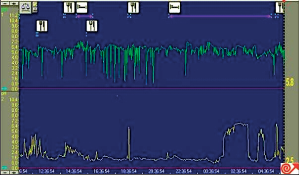
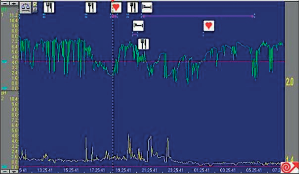
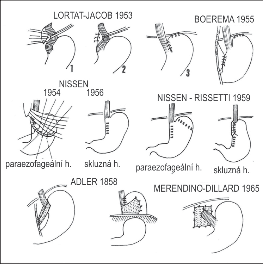
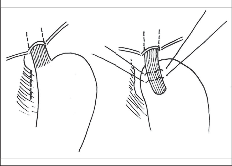
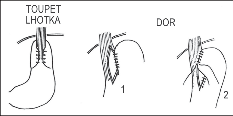
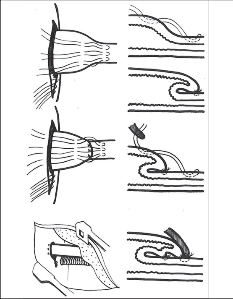
![Obr. 24a – Průběh svalových vláken v oblasti žaludečního fundu podle D. Liebermann-Mefferet [58] a představa, jak funkčně nahradí DJS při založení fundoplikace Obr. 24a – Průběh svalových vláken v oblasti žaludečního fundu podle D. Liebermann-Mefferet [58] a představa, jak funkčně nahradí DJS při založení fundoplikace](https://eportal.chirurgie.upol.cz/portal_final/wp-content/uploads/2013/03/Image_254.png)