10 Onemocnění žil a lymfatických cév
10.4 Léčba žilních onemocnění
10.4.1 Konzervativní léčba – venofarmaka
Venofarmaka jsou přírodní, polosyntetické nebo syntetické látky používané v léčbě žilních onemocnění (tab. 1 na str. 106). Jejich léčebný účinek je založený na protizánětlivém, antioxidačním, antiedematózním a proteolytickém působení ve tkáních, na snižování propustnosti stěny kapilár a na zvyšování tonu stěn žil a lymfatických cév. Od farmakologické léčby lze očekávat úlevu od subjektivních potíží spojených s žilní insuficiencí (pocity napětí, tlaku a bolesti) a ústup otoků dolních končetin. Venofarmaka nepředstavují prevenci rozvoje varixů, trofických změn kůže a podkoží nebo prevenci žilní trombózy, povrchové nebo hluboké.
10.4.2 Antikoagulační léčba
Antikoagulační léčba je od čtyřicátých let 20. století primární léčbou tromboembolické nemoci a svou významnou roli od devadesátých let 20. století hraje také ve farmakoterapii tromboflebitidy. U tromboembolické nemoci při včasném nasazení snižuje riziko plicní embolie, brání šíření trombózy a snižuje pravděpodobnost její recidivy. Antikoagulancia jsou podávána celkově intravenózně, subkutánně nebo perorálně. V současné klinické praxi se v antikoagulační léčbě používají hepariny, antagonisté vitaminu K (perorální antikoagulancia), přímé inhibitory trombinu (syntetické deriváty hirudinu/lepirudin, bivalirudin, desirudin/, argatroban a gatrany) a přímé inhibitory aktivovaného faktoru X (rivaroxaban, apixaban, otamixaban).
HEPARINY
Heparin je směs polysacharidů, přírodní antikoagulační látka, produkována některými živočišnými tkáněmi, bílými krvinkami (bazofilní leukocyty) a mastocyty (žírné buňky, heparinocyty). Nefrakcionovaný heparin obsahuje sacharidové polymery (polysacharidy) s molekulovou hmotností 5000–35 000 daltonů (průměrně 13 000–20 000 D). Funguje jako nepřímý neselektivní inhibitor trombinu a aktivovaného faktoru X. Léčba je zahajována úvodní nitrožilní aplikací bolusu (5000–10 000 j. ) a pak následuje kontinuální podávání, nejčastěji v dávce 20 000–40 000 j. /24 hod. infuzní pumpou nebo injektorem. Účinnost léčby je kontrolována stanovením aPTT (prodloužení aPTT 1,5–2krát proti kontrole). Současně s podáváním heparinu zahajujeme perorální antikoagulační léčbu warfarinem. Heparin je vysazen při dosažení INR 2–3 ve dvou po sobě následujících dnech. Antidotem heparinu je protamin sulfát, který je podáván jen při masivním krvácení v dávce 1 mg na 100 j. heparinu aplikovaných v posledních 8–12 hodinách. Při léčbě heparinem se mohou asi u 1% nemocných vytvořit protilátky proti destičkám s následným rozvojem trombocytopenie. Po 2–7 dnech léčby se proto doporučuje kontrola počtu trombocytů a při jejich poklesu pod 100.109/l je nutné heparin zaměnit za perorální antikoagulancia nebo jiné inhibitory trombinu. V současnosti je nefrakcionovaný heparin nahrazován nízkomolekulárními hepariny (LMWH). Nízkomolekulární hepariny (LMWH, Low Molecular Weight Heparins) jsou heparinové frakce (produkty enzymového štěpení standardního heparinu) o průměrné molekulové hmotnosti 3500–5000 daltonů, které inaktivují zejména faktor Xa a jen málo trombin (f. II). Lze je podávat ve fixní dávce podle tělesné hmotnosti, většinou bez laboratorního monitorování. Jsou účinnější a bezpečnější než nefrakcionovaný heparin, podávaný podle aktuálních hodnot aPTT. Mezi výhody LMWH patří nižší riziko krvácení, menší protidestičková aktivita (souvisí s nižším rizikem krvácení) (tab. 2 a 3). Rozdíly mezi jednotlivými LMWH spočívají především v různé molekulové hmotnosti a z toho vyplývajících rozdílů ve farmakodynamice a farmakokinetice. Terapeutické dávkování je u každého preparátu různé a závisí na hmotnosti nemocného (tab. 4). Úprava dávkování a monitorování plazmatické antiXa aktivity jsou potřebné u pacientů s tělesnou hmotností pod 40 kg nebo nad 150 kg, u těhotných žen (tab. 5) a nemocných s renálním selháním. Pro sekundární profylaxi tromboembolické nemoci u pacientů s nádorem v jakémkoliv stadiu onemocnění je dlouhodobé podávání fixní dávky LMWH efektivnější a bezpečnější než podávání warfarinu. Optimální délka léčby zatím není jasná, ale pacienti s aktivním nádorem jsou pacienti se získanou trombofilií, a proto je u nich většinou doporučována trvalá léčba.
| Tabulka 2 Hepariny |
|
.
| Tabulka 3 Vlastnosti nízkomolekulárních heparinů (LMWH) |
|
.
| Tabulka 4 Dávkování nejčastěji používaných LMWH v ČR |
||
| Účinná látka (přípravek) | Dávkování (anti-Xa aktivita) | Dávkování (mg nebo ml/kg) |
| Enoxaparin (Clexane) | 100 IU/kg 2× denně s.c. | 1 mg/kg 2× denně s.c. |
| Enoxaparin (Clexane Forte) | 150 IU/kg 1× denně s.c. | 1,5 mg/kg 1× denně s.c. |
| Nadroparin (Fraxiparine) | 95 IU/kg 2× denně s.c. | 0,1 ml/10 kg 2× denně s.c. |
| Nadroparin (Fraxiparine Forte) | 190 IU/kg 1× denně s.c. | 0,1 ml/10 kg 1× denně s.c. |
| Dalteparin (Fragmin) | 100–120 IU/kg 2× denně s.c. | 0,1 ml/10 kg 2× denně s.c. |
| (Broulíková, 2008) | ||
.
| Tabulka 5 Doporučené dávkování LMWH u těhotných žen podle tělesné hmotnosti a rizika TEN |
||||
| LMWH | Tělesná hmotnost | |||
| pod 50 kg | 50–90 kg | nad 90 kg | velmi vysoké riziko TEN | |
| Enoxaparin | 20 mg/den | 40 mg/den | 40 mg/12 hod. | 0,5–1,0 mg/kg/12 hod. |
| Dalteparin | 2500 U/den | 5000 U/den | 5000 U/12 hod | 0–100 U/kg/12 hod. |
| Tinzaparin | 3500 U/den | 4500 U/den | 500 U/12 hod. | 4500 U/12 hod. |
| (Marik, 2008) | ||||
.
ANTAGONISTÉ VITAMINU K
(PERORÁLNÍ ANTIKOAGULANCIA)
Existují dva typy antagonistů vitaminu K, kumariny (deriváty dikumarolu) a indanediony. Působí v játrech jako antagonisté vitaminu K, kde antagonizují syntézu koagulačních faktorů závislých na vitaminu K (II, VII, IX, X). Již vytvořené koagulační faktory nejsou ovlivněny, proto antikoagulační účinek plně nastupuje s latencí, která je závislá na rychlosti přirozeného zániku těchto faktorů (u warfarinu za 4–5 dnů). Deriváty dikumarolu mají úzké terapeutické rozmezí a četné lékové i dietní interakce. Při jejich léčbě jsou nutná dietní opatření a opakované monitorování protrombinového času (Quickův test) nebo lépe INR (International Normalized Ratio – poměr protrombinového času pacienta ke kontrolnímu normálu používajícímu mezinárodní referenční preparát). Cílem podávání warfarinu je INR mezi 2 a 3.
Perorální antikoagulancia jsou absolutně kontraindikována u těžké nekontrolované arteriální hypertenze, netromboembolické CMP, u aktivní peptické ulcerace, při těžké jaterní nebo ledvinové nedostatečnosti, u preexistujících defektů hemostázy a u nespolupracujících pacientů. Pro svou teratogenitu a nebezpečí fetálního krvácení nesmějí být použity také v těhotenství.
PŘÍMÉ INHIBITORY TROMBINU
-
Syntetické deriváty hirudinu (lepirudin, desirudin, bivalirudin)
Extrakt se slin pijavky lékařské (Hirudo medicinalis) brání srážení krve díky peptidu hirudinu, přímému ireverzibilnímu inhibitoru trombinu. Hirudin sám nemohl být v humánní medicíně pro svou toxicitu nikdy využitý. Ke slovu přišly až jeho syntetické deriváty lepirudin, bivalirudin, desirudin, jejichž působení může být monitorováno pomocí aPTT. Jsou vylučovány ledvinami, proto je nutná opatrnost při renální insuficienci. Lepirudin (Refludan) se používá pro léčbu HIT a spolu s kyselinou acetylsalicylovou u akutního koronárního syndromu. Desirudin (Revasc) ke krátkodobé tromboprofylaxi při totální endoprotéze kyčelního kloubů ve 20 evropských zemích a bivalirudin (syntetický polypeptidový analog hirudinu) je schválený FDA (US Food and Drug Administration) u pacientů po PTCA pro akutní koronární syndrom. -
Argatroban
Tento nízkomolekulární derivát argininu se nekovalentně váže na aktivní místo trombinu, s nímž vytváří reverzibilní komplex. Plazmatický poločas argatrobanu je 45 minut a lék je metabolizován játry, proto musí být u onemocnění jater podáván s velkou opatrností. Naopak bezpečně ho lze použít u renální insuficience. Indikací argatrobanu je HIT. -
Gatrany
Z této skupiny přímých reverzibilních inhibitorů trombinu se v běžné klinické praxi zatím používá dabigatran etexilát (Pradaxa).
PŘÍMÉ INHIBITORY AKTIVOVANÉHO FAKTORU X (XABANY)
Aplikují se buď perorálně (rivaroxaban, apixaban) nebo parenterálně (otamixaban). Jejich předností je vysoká selektivita pro aktivovaný faktor X (f. Xa) a podávání jednou nebo dvakrát denně. Další výhodou je duální vylučování močí i stolicí. Rivaroxaban (Xarelto) v dávkovém rozmezí 5–20 mg denně prokázal v profylaxi tromboembolické nemoci u ortopedických pacientů stejný terapeutický a krvácivý potenciál jako enoxaparin.
HEPARINEM VYVOLANÁ TROMBOCY TOPENIE (HIT = HEPARININDUCED THROMBOCY TOPENIA)
Heparinem vyvolaná trombocytopenie (HIT) je závažným nežádoucím účinkem heparinu s velkým rizikem vzniku trombotických komplikací. Příčinou je tvorba autoprotilátek proti heparinové molekule, která vede k aktivaci trombocytů a tvorbě trombinu. Přestože se protilátky proti heparinu tvoří u 10–20% pacientů léčených heparinem, u většiny z nich nikdy nevznikne HIT. Protilátky jsou přechodné a z cirkulace vymizí průměrně během 85 dnů po ukončení léčby. Diagnóza spočívá na klinických a laboratorních nálezech. Klinicky asi v 50% případů vzniká nová akutní žilní trombóza. Arteriální trombóza je méně častá (uzávěry končetinových tepen, CMP, infarkt myokardu). Atypickými projevy mohou být kožní nekrózy (10–20%), žilní končetinová gangréna a anafylaktická reakce (po bolusové dávce nefrakcionovaného heparinu). Trombocytopenie může předcházet nebo následovat klinické projevy. Počet trombocytů většinou klesá pod 50% původních hodnot, v některých případech ale nemusí poklesnout pod 100000mm3. Pokles trombocytů v typických případech začíná 5–10 dnů od začátku podávání heparinu a pokračuje 2–4 dny. Jindy se trombocytopenie může objevit až po 20 dnech nebo naopak náhle, do 24 hodin od začátku podávání heparinu. Diagnózu HIT potvrdí průkaz protilátek proti heparinu (funkční testy – vyšetření uvolňování serotoninu, vyšetření heparinové aktivace trombocytů a vyšetření agregace trombocytů). Léčba spočívá v okamžitém vysazení heparinu (nefrakcionovaného i nízkomolekulárního) a v podávání přímých inhibitorů trombinu (lepirudin, bivalirudin, argatroban, dabigatran).
10.4.3 Chirurgická terapie
10.4.3.1 Chirurgie povrchových žil
Při terapii varixů dolních končetin je nutno vyjít z přesné diagnózy, jejímž základem je důkladné klinické vyšetření spolu s pečlivým odběrem anamnézy, podpořené vyšetřením duplexní sonografií a vzácně pak flebografií. Cílem chirurgické léčby je vyřazení patologického refluxu v epifasciálním žilním systému, případně přerušení inkompetentních perforátorů a resekce inkompetentních žilních úseků. Zásadní význam mají insuficientní ústí obou safen, ale téměř u 10% nemocných je reflux přítomen v žilách přívodných a ne v kmenových. Počet insuficientních přívodných žil se pohybuje od jedné do pěti na jedné končetině. Nejčastěji je postižena v. arcuata posterior, poté v. saphena accessoria medialis a v. arcuata anterior. Tento reflux je přítomen bez insuficience VSM, VSP, perforátorů i hlubokého žilního systému a může se vyvinout v kterékoliv véně bez zjevného zdroje. Při indikaci typu výkonu je třeba si uvědomit, že všechny tři systémy, tj. epifasciální, spojkový a hluboký, spolu souvisejí a tvoří funkční jednotku. Změny v jednom systému mají za následek změny v ostatních.
INDIKACE K CHIRURGICKÉ LÉČBĚ:
-
subjektivní potíže nemocného,
-
předejití komplikacím varixů,
-
kosmetické hledisko,
-
thrombophlebitis superficialis.
KONTRAINDIKACE:
-
akutní hluboká žilní trombóza,
-
zánětlivý proces kůže dolních končetin,
-
gravidida,
-
věk nad 70 let,
-
těžké aterotrombotické změny tepen dolních končetin,
-
všeobecné kontraindikace operace,
-
(akutní tromboflebitida).
Akutní tromboflebitida je indikací k chirurgickému řešení tehdy, jednáli se o flebitis VSM, která se propaguje k ústí do v. femoralis. Zde je nebezpečí embolizace.
PŘEDOPERAČNÍ PŘÍPRAVA
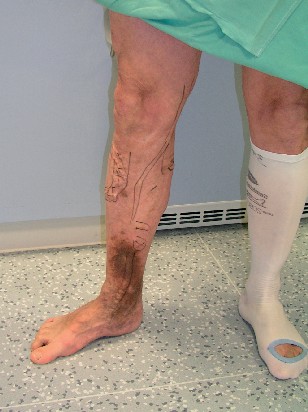
Před operací je pacientovi oholena celá operovaná končetina a oblast třísla. Vzhledem k tomu, že při holení vznikají drobná traumata s možností infekce, je pacient oholen těsně před operací. Poté operatér na stojícím nemocném nesmývatelnou tužkou označí varixy, neboť v horizontální poloze na operačním stole dojde ke kolapsu a vyprázdnění vén a ty již nejsou vidět. Peroperační vyhledání neoznačených vén také zhoršuje použití barevného dezinfekčního roztoku (obr. 10).
10.4.3.1.1 Striping VSM
Pacient je na operačním stole uložen v poloze na zádech. Provádíme toiletu operačního pole a jeho zarouškování s důrazem na oblast genitálu. Řez je veden v třísle, mediálně od hmatné pulzace femorální tepny,dostatečně vysoko, téměř v ohybové rýze, paralelně s ní. Je třeba se vyvarovat nízko uloženého řezu. Je nebezpečí ponechání větve safeny, která pak může být zdrojem recidivy. Velký význam má pečlivá preparace v třísle a podvaz všech větví bulbu. Je vhodné vypreparovat ústí safeny do v. femoralis, aby nedošlo k přehlédnutí eventuálně samostatně ústící větévky do femorální žíly. Myslíme i na řadu anatomických variant, zejména na tzv. Hvariantu, kdy inguinální nebo abdominální vény komunikují se žílami stehna, aniž by ústily do hvězdice VSM. Po vypreparování velké safeny a ligatuře jejich přítoků je tato mezi dvěma peány proťata a centrální pahýl dvakrát ligován nevstřebatelným vláknem. Hovoříme o tzv. krosektomii (z franc. crosse – biskupská berla, kterou ústí VSM do VF připomíná). Název krosektomie se používá i pro výkon v oblasti vyústění VSP, i když zde je morfologie odlišná. Krosektomii musíme odlišit od vysoké ligatury VSM, při které jsou její větve ponechány. V praxi ale nejsou oba termíny důsledně rozlišovány. Provádíme-li totální striping, tj. odstraňujeme-li celou VSM, pronikneme lankem striperu až k vnitřnímu kotníku. Retrográdní pronikání může být obtížné, a někdy je proto vhodnější vyhledat počátek VSM před vnitřním kotníkem. Sondu pak zavádíme z periferie směrem do třísla. Průběh lanka striperu kontrolujeme palpačně i vizuálně, abychom se přesvědčili o jeho epifasciálním průběhu. Zejména při pronikání sondou z periferie směrem centrálním může dojít k jejímu sklouznutí do hlubokého žilního systému. Olivku pak hmatáme v třísle ve v. femoralis. Pokud bychom to přehlédli, mohlo by dojít k jejímu poranění. Striping VSM je vhodné provádět až na konec operace, tj. po odstranění uzlů a/nebo stripingu malé safeny, současně s naložením elastické bandáže od špiček prstů přes patu až po tříslo. Véna je stripována pomalým stálým tahem směrem kraniálním. Cílem tohoto postupu je zabránit tvorbě hematomu. Je samozřejmě možné stripovat směrem periferním. Upřednostňujeme limitovaný striping před odstraněním celé safeny, pokud je to možné. Z třísla retrográdně zavedeme sondu pod kolenní kloub. Zde z malé incize vyhledáme velkou safenu, protneme ji, periferní část ligujeme vstřebatelným materiálem a ponecháváme in situ, centrální stripujeme. Retrográdní pronikání sondou je obtížnější vzhledem k přítomnosti chlopní, po získání cviku ale nečiní větší potíže. Neníli přece jenom možné takto sondu zavést, pak je nutno velkou safenu vyhledat pod kolenem na ventromediální ploše bérce a zavést ji z periferie směrem centrálním. V distální části bérce má VSM intimní vztah k n. saphenus. Při stripingu může dojít k jeho traumatizaci s následnou několikaměsíční až trvalou anestezií nebo parestezií v oblasti vnitřního kotníku. Limitovaný striping ponechává periferní nepostiženou VSM in situ, což má význam i pro případný rekonstrukční tepenný výkon v budoucnosti, neboť VSM je stále ideální materiál pro rekonstrukční výkony. Při limitovaném stripingu je vhodné vést řez pod kolenním kloubem. Z tohoto místa lze dobře odstranit uzly stehna i bérce Smetanovým nožem. Velké varikózní uzly se odstraňují z malých incizí, buď za použití Smetanova nože, nebo je možno použít více malých incizí s vědomím horšího kosmetického efektu a uzly exstirpovat pomocí peánů. Z jednoho řezu lze často získat přístup k více oblastem a vyvarovat se tak zbytečně mnoha incizí. Velké uzly a konvoluty lze touto technikou snadno odstranit, aniž by došlo k poškození jiných struktur. Exstirpovat velké uzly z jednotlivých incizí je kosmeticky méně příznivé. Kosmetické hledisko ale musí ustoupit při rozsáhlých varixech a již počínajících trofických změnách. Kožní řez má být tak velký, jak je nutné, a tak malý, jak je možné.
10.4.3.1.2 Striping VSP
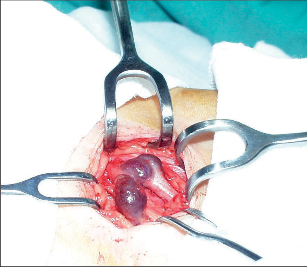
Chirurgie VSP spočívá v krosektomii (i když není tento termín pro VSP zcela správný) a parciální nebo kompletní resekci kmene VSP. Striping malé skryté žíly se řídí stejnými pravidly jako striping velké. V blízkosti vyústění VSP do v. poplitea jsou a. poplitea a n. tibialis. Navíc zde mohou být variace vyústění VSP. Důležité je vysoké vyústění. Pokud je přehlédnuto, má za následek ligaturu umístěnou příliš nízko s ponecháním větví VSP, které pak mohou být zdrojem recidivy. Před operací je nutno zjistit typ ústí VSP. To můžeme provést až na operačním sále u pacienta ležícího na boku nebo na břiše s mírným sklopením stolu hlavou dolů. Po punkci větve VSP aplikujeme kontrastní látku a na obrazovce identifikujeme místo ústí VSP. Tento postup prodlužuje operaci a je zatěžující z hlediska radiační hygieny. Za vhodnější považujeme vyšetření duplexní ultrasonografií před operací, nejlépe operatérem. Výkon provádíme v poloze nemocného na břiše s mírně podloženou nohou v oblasti nártu, méně vhodná je poloha na boku. Jeli současně prováděn výkon i na VSM, pak operujeme v poloze na zádech s tím, že asistent elevuje končetinu a po celou dobu preparace ji drží v této poloze, nebo během operace pacienta obrátíme z polohy na zádech do polohy na břiše a zpět. Je nutná nová toileta operačního pole a přerouškování. Vedeme příčný řez ve fossa poplitea, při vysokém ústí výše, dle předoperačního klinického a zejména ultrazvukového vyšetření. Příčně protneme fascii, pod kterou najdeme VSP. VSP protneme, provedeme ligaturu centrálního pahýlu a do periferního zavedeme striper, kterým pronikneme do poloviny bérce nebo až nad kotník. Je možný i postup obrácený, kdy z malé incize za zevním kotníkem vyhledáme počátek VSP. Vénu protneme, periferní pahýl uzavřeme jemnou vstřebatelnou ligaturou a do centrálního zavedeme striper, kterým pronikneme až do fossa poplitea. Zde nad hmatnou sondou vedeme příčnou incizi, vyhledáme ústí malé safeny do v. poplitea a malou skrytou žílu protínáme a ligujeme (obr. 11). Před suturou kůže uzavřeme fascii ve fossa poplitea. I při operaci VSP upřednostňujeme limitovaný striping, čímž se vyhneme poranění periferních nervů s následnými nepříjemnými paresteziemi v inervační oblasti n. suralis.
FLEBEKTOMIE Z MINIINCIZÍ
10.4.3.1.3 Jednodenní a ambulantní chirurgie
Ne každý pacient je postižen velkými uzlovými varixy, které zasahují celou dolní končetinu a vyžadují pooperační hospitalizaci. Tam, kde je ze strany pacienta zájem a klinický nález to dovolí, lze od pobytu ve zdravotnickém zařízení upustit, nebo jej zkrátit. V rámci jednodenní chirurgie je pacient operován v nemocnici a je propuštěn v den operace nebo následující den, při ambulantní chirurgii nemá pacient k dispozici zázemí nemocnice. Veškerá předoperační vyšetření jsou provedena ambulantně, pacient přichází lačný a po označení varixů jde na operační sál. Výkon je prováděn v místní, spinální nebo celkové anestezii. Může být použit blok n. femoralis pro operaci na ventromediální ploše stehna nebo blok n. cutaneus femoris lateralis, který inervuje laterální stranu stehna. Celková anestezie je většinou indikována při stripingu VSM, i když i tento výkon lze provádět v lokální anestezii nebo za použití bloku n. femoralis. U endovenózních metod typu RF nebo laserové okluze je používána perivenózní tumescentní anestezie. V pooperačním období jsou sledovány oběhové parametry a operovaná končetina, nedocházíli k prosakování. Pacient je pak propuštěn podle rozsahu operace týž den, následující nebo i později. Operace varixů v rámci ambulantní či jednodenní chirurgie může mít mnoho variant a každé pracoviště si vytvoří vlastní postup.
10.4.3.1.4 Chirurgie perforátorů
Názory na význam perforátorů nejsou zcela jednotné a diskuze na toto téma se oživila s nástupem miniinvazivních postupů. Počáteční nadšení bylo postupně opuštěno a v současné době je patrná snaha o nalezení konsenzu v indikaci přerušení perforátorů. Na perforátory nelze nahlížet izolovaně, ale vždy v souvislosti s povrchovým a hlubokým žilním systémem. Základní podmínkou je vyšetření duplexní sonografií, která posoudí funkci chlopenního aparátu. Chlopenní nedostatečnost je příčinou refluxu, který je možno barevnou duplexní sonografií nejen zjistit, ale do jisté míry i kvantifikovat. Jeli přítomen typ postižení žilního systému, při kterém je indikováno přerušení perforátorů, pak metodou volby je dnes endoskopická varianta. Je všeobecně dostupná, není náročná na materiální vybavení a má příznivé výsledky. Zkracuje dobu hospitalizace a eliminuje sekundární hojení ran u pacientů v pokročilých stadiích chronické venózní insuficience.
POSTUPY UŽÍVANÉ K ELIMINACI PERFORÁTORŮ:
- Otevřená ligatura (modifikováno dle Cocketta)
- Endoskopická subfasciální disekce perforátorů – ESDP (Subfascial Endoscopic Perforator Surgery – SEPS, Endoscopic Subfascial Division of Perforating veins – ESDP, die endoskopische subfasziale Diszision der Perforansvenen – ESDP)
- Sklerotizace
- Otevřená ligatura
Subfasciální disekci a ligaturu perforátorů poprvé popsal Linton v roce l938 jako metodu vhodnou k léčbě pokročilých stadií chronické venózní insuficience. Provedl ligaturu v. femoralis superficialis,striping celé VSM, striping VSP od fossa poplitea až k zevnímu kotníku a subfasciální ligaturu všech vv. perforantes na bérci z dlouhého podélného řezu. Výkon zakončil resekcí části fascie a jejím stehem. Linton podvazuje perforátory subfasciálně, Cockett extrafasciálně. Cockett vede dlouhý řez na mediální ploše distální třetiny bérce, za hranou tibiae. Je-li přítomen ulcus cruris, tak jej exciduje. Celý výkon je extrafasciální. Tato metoda byla mnoha dalšími autor y modifikována. Doddova modifikace spočívala v subfasciálním podvazu perforátorů. Rozšířená je segmentální Cockettova operace, kdy je insuficientní perforátor vypreparován z malého řezu a subfasciálně ligován. K přerušení perforátorů se používala i různá dlátka a tzv. komunikotom.
V roce 1955 popsal Felder operaci perforátorů ze zadního přístupu. Výkon prováděl v celkové nebo spinální anestezii, v poloze nemocného na břiše. Incizi vedl v celé délce lýtka v linii punčochového švu od fossa poplitea po úroveň kotníků a v případě potřeby ji prodloužil pod vnitřní kotník. Proťal fascii v celé délce kožní rány a odstranil celou VSP. Tupou disekcí oddělil fascii od svalu a postupně přitom podvazoval všechny perforátory. Výkon ukončil suturou fascie, podkoží a kůže, naložil krytí a pacientovi naordinoval klid na lůžku po dobu deseti dnů. - Endoskopická disekce
Předchůdcem dnešních endoskopických postupů byla endoskopická obliterace Cockettových perforátorů pomocí laryngoskopu, kterou v roce l972 popsal Bentley.
Výkon prováděl v celkové anestezii, z podélného řezu, asi 4 cm dlouhého, jenž byl veden 3 cm mediálně za hranou tibie, přibližně 10–15 cm pod kolenním kloubem. Rovněž tak fascii natínal podélně a osvětleným laryngoskopem ji elevoval. Perforátory uzavíral Cushingovými klipy.
Metoda však doznala většího rozšíření až v roce l985 díky Hauerovi, který použil nově vyvinuté instrumentarium firmy Wolf. V současnosti je aparatura nabízena více firmami, přičemž mezi nimi nejsou podstatné rozdíly. Až na výjimky jsou všechny přístroje napojeny na obrazovku s možností videozáznamu.
Operatér s asistentem stojí na straně operované končetiny, video pak u nohou pacienta. Incizi, cca 3 cm dlouhou, provedeme na ventromediální ploše bérce v jeho horní polovině. Musí být umístěna do zdravé kůže, prosté trofických změn, které jsou vždy přítomny u pacientů s CVI indikovaných k ESDP. Vhodné je incidovat kůži nad varikózním uzlem, který je současně odstraněn. Pronikáme k fascii a po jejím ozřejmění ji podélně protínáme.Digitálně pronikáme do subfasciálního prostoru, kde vytváříme dostatek prostoru pro zavedení endoskopu. Toho lze docílit i pomoci firemních balonů, výsledek je stejný, operace se ale prodražuje. Nejdříve zavádíme tubus mezi fascii a sval a tupě je od sebe oddělujeme, poté je do tubusu zasunuta kamera. Aplikujeme kysličník uhličitý, následkem čehož je operační pole velmi dobře přehledné. Perforátory jsou patrné jako vény probíhající mezi svalem a fascií. Pod přímou kontrolou zrakem je koagulujeme a protínáme.
Za indikaci k ESDP považujeme přítomnost insuficientních perforátorů v terénu poškozené kožní trofiky, kde klasický postup nezaručuje optimální výsledky. Jedná se o pacienty ve stadiu C4–C6 chronické venózní insuficience. - Sklerotizace
Sklerotizaci perforátorů neprovádíme pro riziko průniku sklerotizačního roztoku do hlubokého žilního systému.
10.4.3.1.4 Chirurgie perforátorů
Názory na význam perforátorů nejsou zcela jednotné a diskuze na toto téma se oživila s nástupem miniinvazivních postupů. Počáteční nadšení bylo postupně opuštěno a v současné době je patrná snaha o nalezení konsenzu v indikaci přerušení perforátorů. Na perforátory nelze nahlížet izolovaně, ale vždy v souvislosti s povrchovým a hlubokým žilním systémem. Základní podmínkou je vyšetření duplexní sonografií, která posoudí funkci chlopenního aparátu. Chlopenní nedostatečnost je příčinou refluxu, který je možno barevnou duplexní sonografií nejen zjistit, ale do jisté míry i kvantifikovat. Jeli přítomen typ postižení žilního systému, při kterém je indikováno přerušení perforátorů, pak metodou volby je dnes endoskopická varianta. Je všeobecně dostupná, není náročná na materiální vybavení a má příznivé výsledky. Zkracuje dobu hospitalizace a eliminuje sekundární hojení ran u pacientů v pokročilých stadiích chronické venózní insuficience.
POSTUPY UŽÍVANÉ K ELIMINACI PERFORÁTORŮ:
- Otevřená ligatura (modifikováno dle Cocketta)
- Endoskopická subfasciální disekce perforátorů – ESDP (Subfascial Endoscopic Perforator Surgery – SEPS, Endoscopic Subfascial Division of Perforating veins – ESDP, die endoskopische subfasziale Diszision der Perforansvenen – ESDP)
- Sklerotizace
- Otevřená ligatura
Subfasciální disekci a ligaturu perforátorů poprvé popsal Linton v roce l938 jako metodu vhodnou k léčbě pokročilých stadií chronické venózní insuficience. Provedl ligaturu v. femoralis superficialis,striping celé VSM, striping VSP od fossa poplitea až k zevnímu kotníku a subfasciální ligaturu všech vv. perforantes na bérci z dlouhého podélného řezu. Výkon zakončil resekcí části fascie a jejím stehem. Linton podvazuje perforátory subfasciálně, Cockett extrafasciálně. Cockett vede dlouhý řez na mediální ploše distální třetiny bérce, za hranou tibiae. Je-li přítomen ulcus cruris, tak jej exciduje. Celý výkon je extrafasciální. Tato metoda byla mnoha dalšími autor y modifikována. Doddova modifikace spočívala v subfasciálním podvazu perforátorů. Rozšířená je segmentální Cockettova operace, kdy je insuficientní perforátor vypreparován z malého řezu a subfasciálně ligován. K přerušení perforátorů se používala i různá dlátka a tzv. komunikotom.
V roce 1955 popsal Felder operaci perforátorů ze zadního přístupu. Výkon prováděl v celkové nebo spinální anestezii, v poloze nemocného na břiše. Incizi vedl v celé délce lýtka v linii punčochového švu od fossa poplitea po úroveň kotníků a v případě potřeby ji prodloužil pod vnitřní kotník. Proťal fascii v celé délce kožní rány a odstranil celou VSP. Tupou disekcí oddělil fascii od svalu a postupně přitom podvazoval všechny perforátory. Výkon ukončil suturou fascie, podkoží a kůže, naložil krytí a pacientovi naordinoval klid na lůžku po dobu deseti dnů. - Endoskopická disekce
Předchůdcem dnešních endoskopických postupů byla endoskopická obliterace Cockettových perforátorů pomocí laryngoskopu, kterou v roce l972 popsal Bentley.
Výkon prováděl v celkové anestezii, z podélného řezu, asi 4 cm dlouhého, jenž byl veden 3 cm mediálně za hranou tibie, přibližně 10–15 cm pod kolenním kloubem. Rovněž tak fascii natínal podélně a osvětleným laryngoskopem ji elevoval. Perforátory uzavíral Cushingovými klipy.
Metoda však doznala většího rozšíření až v roce l985 díky Hauerovi, který použil nově vyvinuté instrumentarium firmy Wolf. V současnosti je aparatura nabízena více firmami, přičemž mezi nimi nejsou podstatné rozdíly. Až na výjimky jsou všechny přístroje napojeny na obrazovku s možností videozáznamu.
Operatér s asistentem stojí na straně operované končetiny, video pak u nohou pacienta. Incizi, cca 3 cm dlouhou, provedeme na ventromediální ploše bérce v jeho horní polovině. Musí být umístěna do zdravé kůže, prosté trofických změn, které jsou vždy přítomny u pacientů s CVI indikovaných k ESDP. Vhodné je incidovat kůži nad varikózním uzlem, který je současně odstraněn. Pronikáme k fascii a po jejím ozřejmění ji podélně protínáme.Digitálně pronikáme do subfasciálního prostoru, kde vytváříme dostatek prostoru pro zavedení endoskopu. Toho lze docílit i pomoci firemních balonů, výsledek je stejný, operace se ale prodražuje. Nejdříve zavádíme tubus mezi fascii a sval a tupě je od sebe oddělujeme, poté je do tubusu zasunuta kamera. Aplikujeme kysličník uhličitý, následkem čehož je operační pole velmi dobře přehledné. Perforátory jsou patrné jako vény probíhající mezi svalem a fascií. Pod přímou kontrolou zrakem je koagulujeme a protínáme.
Za indikaci k ESDP považujeme přítomnost insuficientních perforátorů v terénu poškozené kožní trofiky, kde klasický postup nezaručuje optimální výsledky. Jedná se o pacienty ve stadiu C4–C6 chronické venózní insuficience. - Sklerotizace
Sklerotizaci perforátorů neprovádíme pro riziko průniku sklerotizačního roztoku do hlubokého žilního systému.
10.4.3.1.5 Komplikace chirurgické terapie
Komplikace v chirurgii žilního systému jsou vzácné a většinou výrazně neohrožují pacienta. Můžeme se s nimi setkat jak při operaci, tak po ní.
PEROPERAČNÍ KOMPLIKACE
- Krvácení
Striping VSM/VSP je doprovázen krvácením z jejích větví. Toto krvácení ustane po naložení elastické bandáže. Proto provádíme striping až na konci operace a současně s ním nakládáme elastickou bandáž. Při invaginačním stripingu bývá krvácení menší. Každé krvácení je nutno pečlivě ošetřit z hlediska prevence vzniku hematomu v ráně. - Poranění velkých cév
Se závažnějším peroperačním krvácením se setkáváme většinou při preparaci v oblasti bulbu VSM nebo ve fossa poplitea. Může nastat jednak méně
závažné krvácení z poranění větví bulbu či samotné safeny, tak hrozivější krvácení při poranění femorálních cév, častěji vén. Poranění vény je 5× častější než tepny. Je popsána ligatura femorální i popliteální arterie i striping tepny.
Poranění větví bulbu a samotné safeny řešíme ligaturou, poranění femorálních cév pak stehem.
Při stavění krvácení je nutno postupovat velmi šetrně, abychom nezpůsobili další škody, například naložením peánů naslepo. Krvácení vždy nejdříve zastavíme tlakem prstu a určíme jeho zdroj, v případě potřeby zvětšíme ránu. Steh nakládáme na nekrvácející vénu při její kompresi dvěma tampony nad a pod lézí. Při větším poškození, podvazu nebo protětí hluboké vény se řídíme zásadami cévní chirurgie. Poranění velkých cév by se nemělo vyskytovat. Vždy musíme pečlivě vypreparovat ústí VSM/VSP do hlubokého žilního systému. Jsme-li na pochybách, nikdy nesmíme vénu podvázat, nebo dokonce stripovat. - Vniknutí cizího tělesa do hlubokého žilního systému
S touto komplikací jsme se sami setkali pouze jedenkrát (Herman, 2000). Jednalo se o odlomení konce stripovací sondy a její vycestování do v. iliaca interna, což si vyžádalo operační revizi s vypreparováním ilických vén. Alternativním postupem by bylo odstranění metodami intervenční radiologie. Častěji se s cizím tělesem v hlubokém žilním systému můžeme setkat v souvislosti s intervenční radiologií.
POOPERAČNÍ KOMPLIKACE
- Hematom
Hematom se nejčastěji vyskytuje v oblasti ventromediální plochy bérce a stehna, tj. v průběhu velké safeny. Jsou-li hematomy malé, vstřebají se bez větších problémů. U rozsáhlejších hematomů dochází ke vzniku infiltrátů, často bolestivých, s nebezpečím jejich infekce. Vstřebávání trvá delší dobu a vedle aplikace mastí a obvazů si může vyžádat i incize a evakuace.
Prevencí je šetrná operační technika, nakládání elastické bandáže současně se stripingem tam, kde je to možné. U rozsáhlejších výkonů je nutná peroperační komprese, ať již asistentem longetou přes kůži nebo vsunutím longety do rány. Velkou i malou skrytou žílu stripujeme vždy až na konec operace a jen v takovém rozsahu, kam až sahají patologické změny (limitovaný striping).
Hematom v třísle může vzniknout při nešetrné preparaci v této oblasti z poranění větví bulbu nebo samotné safeny, vzácněji pak z poranění femorálních cév. Další příčinou může být sklouznutí ligatury.
Je zde nebezpečí jeho infekce, a proto je nutné oblast třísla na konci operace důkladně zkontrolovat a vysušit. Musíme myslet i na tzv. „zatečenou“ krev z kanálu po odstraněné velké safeně. - Neurologické komplikace
Nejčastější neurologickou komplikací jsou parestezie v distální části ventromediální plochy bérce, způsobené poraněním n. saphenus. Výskyt parestezií je udáván od 4,2% po 39%. Nižší procento je přítomno u tzv. limitovaného stripingu, kdy je VSM stripována jen pod koleno. Vyšší procento pak u kompletního stripingu od hlezna po tříslo. Holme našel 6× vyšší výskyt léze nervu u kompletního stripingu proti limitovanému při 10% recidivě v obou skupinách. Větší nebezpečí poranění n.saphenus je při ortográdním než při retrográdním stripingu. - Vzácnou, ale závažnou komplikací je léze n. peroneus communis, který probíhá po mediálním okraji m. biceps femoris a nejsnáze zranitelný je v oblasti caput fibulae. Zde probíhá povrchově a je kryt pouze fascií a kůží. Tuto komplikaci popsalritchley při operaci VSP. Ústí do v. poplitea bylo 6 cm nad popliteální řasou a při jeho preparaci bylo nutno retrahovat nerv s cílem dosáhnout vysoké ligatury VSP. Komplikace se projevila znecitlivěním dorza nohy, váznutím extenze prstů a dorzální flexe nohy v hleznu. Potíže přetrvávaly dva roky.
- Lymfatická píštěl
Lymfatická píštěl se vyskytuje v třísle, častěji u reoperací než u primárních výkonů. Příčinou bývají dlouhé příčné incize v jizevnaté tkáni. Léčba spočívá v revizi a sutuře v lokální anestezii nebo v kompresi třísla současně s klidovým režimem.Lymfatická píštěl může být přítomna i v místě flebektomie. - Dehiscence rány
Dehiscence rány v třísle je komplikací vzácnou. Nevýhodou je prodloužení doby léčení. Častější může být výskyt komplikovaného hojení rány na bérci, zejména u pacientů s CVI v pokročilém stadiu, kde jsou již přítomny trofické změny. V takových případech je nutno pacienty na možnost sekundárního hojení rány upozornit před operací. - Tromboflebitida
Vzácně může postihnout periferní část kmene VSM/VSP při limitovaném stripingu nebo podvazu VSM nebo varixy, které nebyly kompletně odstraněny. Koagulum z vény exprimujeme po její incizi nebo vénu v lokální anestezii exstirpujeme. Je-li proces rozsáhlejší, aplikujeme lokálně antiflogistika a kompresivní bandáž. - Flebotrombóza a plicní embolie
Incidence hluboké žilní trombózy po operaci varixů je udávána v rozmezí 0,15–0,5% a plicní embolie 0,06% až 0,16%. Pravděpodobně zde není souvislost s užíváním hormonálních preparátů, včetně kontraceptiv. - Tetováž
Při použití inkoustových tužek k předoperačnímu značení varixů je možno se setkat se vznikem tetováže. Sami jsme takovouto komplikaci nezaznamenali.
10.4.3.1.6 Reoperace
Recidiva postihuje přibližně 20–30% pacientů operovaných pro varixy dolních končetin. Při dlouhodobém sledování je udávána recidiva až u 80%. Jones našel při vyšetření duplexní ultrasonografií recidivu za dva roky u 43% pacientů po krosektomii VSM a u 25% pacientů po krosektomii se stripingem, i když 89% pacientů bylo s výsledkem operace spokojeno. Rekurence narůstá s časem. Průměrná doba mezi první a druhou operací je 6–20 let. Vyšší procento reoperací je pozorováno po operacích provedených všeobecným chirurgem ve srovnání s operacemi, které provedl cévní chirurg. Recidiva je jednak nepříjemná pro pacienta, jednak zatěžující pro chirurgické pracoviště i pro pojišťovnu.
Krajíček s Vaňkem rozlišují reziduální městky, tj. takové, které byly ponechány při operaci, pravé recidivy, způsobené nedomykavou přímou či nepřímou spojkou, a nepravé recidivy, vznikající následkem progrese onemocnění ve formě novotvořených primárních varixů nebo sekundárních v důsledku rekanalizace po proběhlé hluboké žilní trombóze. Ta má za následek vznik nedomykavých spojek a následně varixů.
Za recidivu lze označovat ty stavy, kdy je přítomen centrifugální reflux z hlubokého do povrchového žilního systému, eventuálně z výše uložené větve povrchového systému do nižších větví. Není-li přítomen reflux, nejedná se o recidivu, ale o progresi choroby. Recidivu definujeme jako přítomnost varikózních žil na dolní končetině pro varixy již dříve operované. Většinou je příčina v ponechaném refluxu v safenofemorální junkci. Závažnou chybou je nízké uložení řezu na stehně, distálně od sulcus genitofemoralis. Může být ponechána celá VSM, když chirurg při operaci odstranil akcesorní safenu a hlavní kmen ponechal in situ. Tato situace nastává tehdy, jestliže chirurg nesleduje VSM až k jejímu ústí do v. femoralis. I při odstranění VSM může dojít k recidivě, a to tehdy, je-li ponechán její pahýl dlouhý. Z pahýlu může odstupovat větev, která se v důsledku refluxu dilatuje a je příčinou vzniku varixů. Suchý s Rečkem popisují recidivu, kdy krev proudí z jedné větve v epifasciálním žilním systému do druhé, pro kterou navrhli označení „hitch-hike“, převzatý z chirurgie tepenného systému. Nejde o reflux z hlubokého do povrchového systému. Takové uspořádání v oblasti bulbu bývá označováno jako tzv. H-varianta.
VSM stripujeme až pod koleno, čímž současně eliminujeme stehenní perforátor, který může být zdrojem refluxu. Proto samotná vysoká ligatura VSM má až 45% výskyt recidivy ve VSM na bérci, jejíž příčinou je většinou přítomnost stehenního perforátoru. Striping dává lepší výsledky než vysoká ligatura kombinovaná se sklerotizací.
Z části recidivy je obviňován proces označovaný jako neovaskularizace. Při ní dochází k tvorbě nových tenkostěnných vinutých žil, což je běžný doprovodný jev při hojení ran. Tyto nově vytvořené vény pak mohou spojit femorální vénu s epifasciální vénou nebo přímo s ponechanou safenou. K zabránění neovaskularizace byly navženy postupy, při kterých je safenofemorální pahýl zanořen, překryt transpozicí fascie m. pectineus nebo syntetickým materiálem. Tyto operace se nerozšířily.
Příčinou recidivy může být ponechaný insuficientní perforátor, i když názory na jeho význam se v poslední době mění. Dle našeho názoru je indikace ke zrušení perforátorů tehdy, je-li postižen hluboký žilní systém. Při izolovaném refluxu v epifasciálním systému pouze tehdy, je-li perforátor širší než 3 mm. V takovém případě se jeho funkce většinou neobnoví, ani když eliminujeme reflux v povrchovém žilním systému. S tímto názorem ale ne všichni souhlasí a doporučují přerušit každý insuficientní perforátor.
Inkompetence VSP je méně častá než u VSM, proto je i recidiva v jejím povodí vzácnější. Chceme-li zabránit recidivě, musíme vyhledat ústí VSP subfasciálně. Předoperačně nám pomůže vyšetření duplexní sonografií. Pacienti s recidivou v povodí VSP se dostavují k reoperaci dříve (50% za 6 let) než pacienti s recidivou v povodí VSM (50% za 12 let). K recidivě varixů může přispět i inkompetence ovariálních žil. Při jedné operaci může vzniknout více chyb. Proto je důležité každého pacienta před reoperací důkladně vyšetřit jak klinicky, tak duplexní sonografií.
V malém procentu se příčina recidivy nezjistí. Chceme-li zabránit vzniku recidivy, měli bychom dodržovat následující zásady:
- Před operací pacienta důkladně vyšetříme (vždy operatér) a označíme varixy a zejména místa refluxu nesmývatelnou tužkou.
- Každého pacienta vyšetříme duplexní sonografií, kterou provádí sám operatér nebo jeden zkušený lékař. Vyšetření duplexní sonografií je považováno za zlatý standard, je zde ale možnost různé interpretace výsledků vyšetření.
- Pokud operaci neprovádí erudovaný nebo cévní chirurg, měl by jí alespoň asistovat. Recidivu musí operovat zkušený nebo cévní chirurg.
- Vyhledání počátku VSM při vnitřním kotníku, zavedení sondy až do třísla, vytažení sondy z malé incize nad jejím hmatným proximálním koncem a následný striping je postup sice rychlý, ale opuštěný. Je zde nebezpečí ponechání větví VSM při jejím ústí, navíc je stripována celá véna, což nebývá většinou nutné, a vede častěji k neurologickým komplikacím. Preparaci zahájíme v třísle, vyhledáme ústí VSM do VF a podvážeme všechny větve bulbu. Poté provedeme vysokou ligaturu VSM a do jejího periferního pahýlu avedeme sondu a pronikneme tak distálně, kam až sahá insuficience kmene VSM (zjištěno klinicky a duplexní sonografií) – tj. pod kolenní kloub nebo ještě distálněji. Výskyt recidiv lze snížit správnou krosektomií, při níž sledujeme VSM až k jejímu ústí do VF
- Ponecháváme-li VSP in situ, musíme si být jisti kompetencí jejího ústí.
REOPERACE
V terapii recidivujících varixů lze použít léčbu chirurgickou, sklerotizační i jejich kombinaci. K podpůrné terapii patří léčba medikamentózní a kompresivní. Zásadní význam v terapii recidiv má předoperační vyšetření, které určí místo nebo místa refluxu. Ta je nutno liminovat. Prosté odstranění varixů bez ohledu na zdroj refluxu má jen dočasný efekt a je příčinou další recidivy. Není tedy jeden typ operace pro recidivu, ale vždy se zaměřujeme na zdroje refluxu. Jen pokud tato místa neurčíme, provedeme prostou exstirpaci varikozit.
Dlouhodobá úspěšnost reoperací závisí také na příčině recidivy. Bude lepší u primárních varixů, s horšími výsledky lze počítat u posttrombotických stavů.
Preparace v třísle při reoperaci představuje vyšší riziko vzniku hematomu, infekce, lymfatické píštěle nebo poranění velkých cév, než je tomu u primární operace. Obávanou komplikací je vznik lymfedému. Proto je nutné důkladné předoperační vyšetření, včetně duplexního ultrazvuku, k určení příčiny recidivy, a není-li tato v ponechané velké či akcesorní safeně, v třísle neoperujeme. Preparace v třísle při reoperaci je v jizevnaté tkáni s křehkými, snadno krvácejícími vénami velmi obtížná. Je proto vhodné zvolit laterální přístup, při kterém vedeme řez laterálně od původního a pronikáme směrem mediálním k femorální tepně. Její pulzace nám slouží jako vodítko. Mediálně od ní pak vyhledáme VF spolu s ponechaným ústím VSM. Vypreparujeme safenofemorální ústí, naložíme vysokou ligaturu (flush ligature) a VSM protneme.
Je možno použít i mediální přístup. Řez je veden v třísle mediálně a nad původní jizvou. Pronikneme přímo k přední ploše VF a ligujeme VSM. Operatér stojí na opačné straně, než je operovaná končetina.
Přístup ze standardního řezu v třísle zvolíme, je-li původní řez umístěn atypicky, nejčastěji distálně na stehně. Nepreparujeme v jizevnaté tkáni a výkon probíhá jako primární operace.
Vychází-li recidiva z fossa poplitea, preparace je obtížnější jednak vzhledem k těsnému vztahu VSP k okolním strukturám (a. et v. poplitea, n. tibialis), jednak pro variabilitu ústí VSP do VP. Důležité je správné umístění kožního řezu, nejlépe na podkladě předoperačního ultrazvukového vyšetření. Ústí-li VSP výše, můžeme si pomoci flexí v kolenním kloubu. Tím se incize posune kraniálněji.
VSP, resp. její ponechaný pahýl, vypreparujeme až k ústí do VP a zde jej ligujeme. Vychází-li z pahýlu VSP větev, běžící podkožně k VSM, můžeme ji vystripovat. Zavádění sondy kontrolujeme vizuálně i palpací, abychom si byli jisti jejím epifasciálním průběhem.
10.4.3.2 Chirurgie hlubokého žilního systému
10.4.3.2.1 Rekonstrukce hlubokého žilního systému
10.4.3.2.1.1 Rekonstrukce pro uzávěry
Rekonstrukce jsou indikovány, jestliže předcházela alespoň roční intenzivní konzervativní terapie, která nedokáže zabránit zhoršování stavu a pacient je významně omezován.
UZÁVĚR SPOLEČNÉ PÁNEVNÍ VÉNY (PALMOVA OPERACE)
Operace je indikována, je-li uzavřena jen společná a zevní pánevní tepna bez trombotických změn pod tříselným vazem a je-li pacient svým onemocněním výrazně omezován. Velká safena druhé strany je suprapubicky vedena na druhou stranu a našita end to side na vhodnou žílu v třísle – v. femoralis, safenofemorální junkci nebo na v. femoralis superficialis. Inkompetence použité velké safeny nebrání jejímu použití. Není-li VSM na druhé straně, je možno použít stejnostrannou, ale reverzně nebo po valvulotomii.
Další možností je použít PTFE protézu jdoucí pod tříslem, pod svaly preperitoneálně, a anastomózovat ji end to side s v. iliaca externa. Protéza by měla mít 8 mm v průměru a měla by být opatřena kroužky, aby nedošlo k jejímu stlačení. Doporučuje se založení A-V píštěle za pomoci větve VSM na dobu 3 měsíců .
POST TROMBOTICKÝ UZÁVĚR VENA
FEMORALIS SUPERFICIALIS (MAY-HUSNI OPERACE)
Při této operaci využijeme VSM. Protneme ji a spojíme s v. poplitea nad nebo pod kolenem. Jsou možné dva způsoby rekonstrukce:
- end to side,
- end to end – po protětí v. poplitea.
10.4.3.2.1.2 Rekonstrukce pro inkompetenci vena poplitea a vena femoralis superficialis
Základním principem léčby je eliminovat reflux v hlubokém žilním systému.
Transpozice hluboké femorální žíly do sousední žíly s chlopněmi
Transpozice je indikována spíše u posttrombotických stavů, kdy jsou chlopně destruovány flebitickým procesem a valvuloplastika nedává tak dobré výsledky jako u primární insuficience. Při významném refluxu v důsledku inkompetence VP a VFS, není-li přítomna obstrukce, je možno použít chlopně ve VFP nebo v jejich větvích, případně i v horní části VSM.
Při předoperačním vyšetření je nutno chlopně lokalizovat a zjistit jejich kompetenci.
Vyústění VFS je transponováno na VSM nebo VPF. Jsou-li obě kompetentní, pak je lepší VSM. Existence široké komunikace mezi inkompetentní VFP a VP je kontraindikací k transplantaci venózního segmentu s chlopní na úrovni VFS nebo k transpozici VFS na VSM.
Autotransplantace segmentu vény s chlopní (Taheri)
Pro tuto rekonstrukci platí stejná indikace jako pro předchozí, tj. významná inkompetence VP a VFS způsobená předchozí trombózou nebo deficitem chlopní. Zdrojem je v. axillaris, v. brachialis nebo horní část druhostranné VSM.
Valvuloplastika
- Vnitřní
U Kistnerovy operace se vyberou při flebografii vhodné chlopně, zpřístupní se flebotomií, při které nesmí být poškozeny jejich cípy, a stehy se naloží na každý konec chlopní s cílem zkrátit nadbytečné okraje cípů a dosáhnout symetrie. Véna je pak uzavřena a kompetence chlopně se ověří tak, že se nejdříve povolí horní svorka a pozoruje se, je-li segment pod chlopní prázdný. Raju a Sottiurai modifikovali původní Kistnerovu metodu a provádějí vnitřní plastiku ze upravalvulární venotomie.Nevýhodou metody je její časová náročnost a obtížná proveditelnost u žil malého průsvitu. V takovém případě jsou vhodnější metody jako zevní valvuloplastika nebo límec in situ, které jsou rychle proveditelné a nevyžadují venotomii. - Zevní
Metodu popsal Kistner v roce 1990. Jde o obnovení funkce chlopně naložením stehů v podélné ose vény v místě úponu cípů chlopně. Není nutná venotomie, je menší traumatizace žilní stěny. Metoda je rychlá, avšak nepřesná. Zužuje chlopenní sinus, ale nekoriguje nadbytečné cípy chlopní. - Valvuloplastika za použití angioskopu
Spojuje výhody zevní a vnitřní metody. Valvuloplastika je realizována bez venotomie za přímé kontroly zrakem pomocí angioskopu. Ten je zaveden přes VSM nebo její větev až do oblasti bifurkace VF. Nakládání stehů je navíc usnadněno prosvícením žilní stěny světlem angioskopu. Po zhotovení plastiky je provedena kontrola kompetence chlopně irigací kanálem angioskopu. Poté je aplikován límec z PTFE kolem plastiky s cílem zabránit pozdější dilataci a následné sekundární inkompetenci.
Konstrukce zevní popliteální chlopně (Psathakis) Tento postup užívá silastikovou smyčku připevněnou k flexorům kolene umístěnou kolem popliteální vény. Záměrem je stažení kličky kolem vény, a tím zabránění refluxu v ní v okamžiku kontrakce flexorů, když se noha zvedá ze země při každém kroku.
V originální operaci byla užita šlacha m. gracilis, oddělená distálně a připojená napříč přes fossa poplitea k m. biceps femoris. Později byla použita silastiková smyčka. Operace se neujala.
K rekonstrukci chlopní je indikováno jen velmi málo pacientů v pokročilých stadiích chronické venózní insuficience, kde jiná terapie selhala. Nelze provádět rekonstrukci, jsou-li žíly nad a pod místem insuficience také těžce poškozeny. Je rovněž málo pravděpodobné, že interpozice jedné nebo dvou chlopní přinese velké změny u stavu s povšechnou chlopenní insuficiencí.
VENÓZNÍ TROMBEKTOMIE
První trombektomii pro ileofemorální žilní trombózu provedl v roce 1937 Lawen. Chirurgická léčba hluboké žilní trombózy však nedoznala většího rozšíření, i když správně indikovaná má své přednosti. Je jednak prevencí fatální embolizace do plic, jednak posttrombotického syndromu, neboť zachovává normální funkci chlopní a průchodnost vén.
Chirurgická léčba
Pacienta uložíme do anti-Trendelenburgovy polohy. Z podélné incize v třísle vyhledáme za pomoci VSM stehenní vénu a vedeme příčnou nebo šikmou venotomii. Výkon provádíme za celkové heparinizace. Krvácení kontrolujeme pouze tlakem tamponu, snažíme se nepoužívat kovové svorky. Zavedeme Fogartyho katétr nad trombus, katétr nafoukneme a trombus stáhneme. Celý proces opakujeme, až nezískáme žádný trombotický materiál. Zpětný tok není spolehlivou známkou odstranění trombu. Může být vydatný při průchodné vnitřní ilické véně. Proto provádíme kontrolní flebografii. Z periferie odstraňujeme trombus kombinací Fogartyho manévru a manuální komprese končetiny. Navíc přikládáme elastické obinadlo od periferie směrem centrálním. Snažíme se tak odstranit tromby z větví trombozované vény. Proces komprese opakujeme, až z periferie nelze odstranit žádné tromby. Venotomii uzavíráme monofilamentním vláknem, někteří autoři doporučují založit dočasnou arteriovenózní píštěl za pomoci proťaté VSM, jejíž konec anastomózují ke straně povrchové stehenní tepny. Píštěl ruší za 6 týdnůPři postižení i VCI je možno trombus odstranit přímo z duté žíly, buď transperitoneální nebo extraperitoneální cestou ze subkostálního řezu. Po mobilizaci colon ascendens a duodena nasadíme na VCI svorku pod renálními vénami. Z kavotomie odstraníme trombus a kavotomii uzavřeme. V pooperačním období je pacient heparinizován, poté následuje warfarinizace na dobu 6 měsíců. Plné rozvinutí posttrombotického syndromu trvá řadu let, proto první hodnocení úspěšnosti trombektomie můžeme provést nejdříve za 5–10 let.
Dominantním postupem u akutní ileofemorální trombózy je fibrinolytická léčba.
KOMPRESIVNÍ SKLEROTIZACE
Kompresivní skleroterapie je efektivní a bezpečná metoda v léčbě varixů dolních končetin. Je rychlá, nevyžaduje hospitalizaci ani pracovní neschopnost a dá se opakovat. Je však třeba dodržet indikace a mít s metodou dostatek vlastních zkušeností. Stejně jako všechny ostatní postupy používané v terapii varixů, včetně chirurgie, jedná se o léčbu paliativní, ne etiologickou.
Před každou skerotizací je nutno pacienta vyšetřit jak klinicky, tak duplexní ultrasonografií k vyloučení insuficience ústí VSM a VSP. Jsou-li tato ústí insuficientní, pak je naděje na trvalý úspěch sklerotizace nepatrná. Je možno dosáhnout uzávěru vény, avšak v průběhu několika let dojde k rekanalizaci. Proto je v takovém případě indikována léčba chirurgická.
Indikace:
- odstranění subjektivních potíží,
- zabránění komplikacím,
- kosmetické hledisko.
Kontraindikace:
- alergie na sklerotizační látku,
- hluboká žilní trombóza,
- celková nebo místní infekce,
- kritická ischemie dolních končetin,
- otoky dolních končetin,
- nemožnost naložit kompresivní obvaz,
- imobilní pacient,
- hyperkoagulabilita (deficit proteinu C a S),
- angiodysplazie (Klippel-Trénaunaysy), kdy jsou přítomny A-V píštěle,
- gravidita.
Malé varixy (retikulární a teleangiektázie)
V léčbě malých varixů má sklerotizace dominantní postavení. Indikace je většinou kosmetická, i když i tyto varixy mohou působit potíže, zejména v období menstruace. Je však nutno vyloučit současné postižení skrytých žil.
Velké nekmenové varixy (perforátory, varixy v povodí přítoků, lokální varixy a recidivující varixy) Sklerotizace je indikovaná po důkladném vyšetření, zejména u recidivujících varixů. Je možná jak chirurgická, tak sklerotizační léčba. Záleží na zkušenosti lékaře a velikosti varixů. Stran perforátorů není jednotný názor na sklerotizaci, my sami se přikláníme k léčbě chirurgické.
Kmenové varixy VSM
Není jednotný názor, zda varixy v povodí velké safeny sklerotizovat či operovat. Pokud se rozhodneme pro sklerotizaci, musíme počítat s vysokým procentem recidivy, které je vyšší než u pacientů léčených chirurgicky. Na našem pracovišti považujeme kmenové varixy v povodí VSM za indikaci k operaci a sklerotizaci zde neprovádíme, a to ani pod kontrolou ultrazvukem. I když je pacient starý nebo ne zcela v dobrém stavu, je možno operovat ve spinální anestezii nebo v lokální anestezii provést krosektomii VSM s následnou sklerotizací.
Kmenové varixy VSP
Ani zde nepanuje jednotný názor, zavísí i na šířce insuficientního ústí VSP do v. poplitea a velikosti refluxu. Upřednostňujeme chirurgické řešení.
Je několik technik sklerotizace:
- švýcarská – Sigg: sklerotizuje se z periferie směrem centrálním bez ohledu na místo refluxu. Varix je punktován u stojícího nemocného, k aplikaci sklerotizačního roztoku dochází až po jeho uložení do horizontální polohy;
- francouzská – Tournay: postupuje směrem opačným než švýcarská technika, tj. z proximálních partií distálně. Obliterací proximálních žil se snaží snížit hydrostatický tlak v distálních vénách a urychlit tak proces jejich fibrotizace. Punkce i sklerotizace jsou prováděny v horizontální poloze;
- irská – Fegan: hlavní příčinu varixů vidí v inkompetentních perforátorech, které sklerotizuje.
- sklerotizace pod kontrolou ultrazvukem. Při tomto postupu je aplikace sklerotizační látky kontrolována ultrazvukem. Používá se ke sklerotizaci ústí VSM, ke sklerotizaci perforátorů nebo u obézních pacientů, kde je detekce varixů obtížná. I zastánci této metody udávají horší výsledky, je-li průměr VSM větší než 20 mm. Chybí dlouhodobé výsledky.
Cílem sklerotizace je eliminovat patologický reflux a viditelné varixy.
Sklerotizaci provádíme vleže, i když řada flebologů aplikuje sklerotizační látku stojícímu pacientovi. Poloha vleže nebo s mírnou elevací končetiny je pro pacienta příznivější a dojde při ní k vyprázdnění žil (technika prázdné žíly). To má za následek lepší kontakt žilní stěny se sklerotizačním roztokem, než je tomu u krví naplněného varixu vestoje. Aplikací kompresivní bandáže ihned po sklerotizaci, ještě u ležícího pacienta, zajišťujeme zachování prázdné vény. Není-li žíla prázdná, vytváří se trombus, který postupně rekanalizuje a dochází tak k recidivě. Navíc bývá bolestivý a kosmeticky rušivý. Dříve užívaná „air – bolus“ nebo „air – block“ technika je nyní již opuštěna. Spočívala v aplikaci vzduchu před sklerotizačním agens s cílem vyprázdnit vénu, a umožnit tak kontakt látky se stěnou. Radiologické studie ale prokázaly, že injekce vzduchu do VSM nezajistí odstranění krve, a to ani při aplikaci 0,5 ml vzduchu. Foam sklerotizace je aplikace sklerotizační látky ve formě pěny. Ta se připraví opakovaným rychlým přesunem roztoku sklerotizačního agens pod tlakem mezi dvěma spojenými injekčními stříkačkami. Výhodou pěny by mělo být delší působení agens na žilní stěnu, než je tomu u běžného roztoku, který je rychle odplaven. Sklerotizační roztok ve formě pěny má větší objem, snižuje se tak jeho množství potřebné ke sklerotizaci. Aplikaci pěny můžeme snadno sledovat pod kontrolou ultrazvukem, protože je částečně echogenní.
Tam, kde je punkce varixu obtížná, můžeme ji provést vestoje a poté pacienta položit do horizontální polohy. K tomu účelu jsou zhotoveny speciální polohovací stoly. Tento postup není vhodný u malých žil, kde je nebezpečí dislokace jehly a následného paravenózního podání látky.
Po aplikaci přikládáme nad sklerotizovanou vénu podélně longetu a následně kompresivní obvaz. Cílem komprese po sklerotizaci do vyprázdněné vény je zúžit žílu co možná nejvíce, a zabránit tak vzniku intravaskulárních trombů, které mohou způsobit zánět a časnou rekanalizaci. Doba komprese kolísá dle jednotlivých autorů mezi 3 až 6 týdny. Klasicky byla doporučována komprese na dobu 6 týdnů, v současnosti se většina kloní k třítýdenní kompresi po sklerotizaci. Komprese je odůvodněná i u léčby teleangiektázií, kdy snižuje výskyt pigmentací i perimaleolárních a lýtkových otoků. Pacientovi doporučujeme dostatečnou pohybovou aktivitu.
Chirurgickou léčbu a sklerotizaci nepovažujeme za metody navzájem si konkurující, ale spíše se doplňující. Drobné varixy lze s úspěchem odstranit sklerotizací a ušetřit pacienta operace, byť v lokální anestezii a v rámci jednodenní chirurgie. Na straně druhé insuficienci ústí safen je vhodné řešit chirurgicky a drobné retikulární varixy eliminovat sklerotizací v pooperačním období.
Komplikace sklerotizace
Cílem sklerotizace je chemické postižení stěny žilní s její následnou fibrotizací. Toto toxické působení ale není specifické jen na žilní stěnu, může dojít k poškození okolních struktur. Dochází k tomu při aplikaci sklerotizační látky paravenózně, nebo dokonce intraarteriálně. Komplikace ale mohou nastat i při intravenózní aplikaci, závisí na množství a koncentraci roztoku.
- Bolest – v místě aplikace sklerotizačního roztoku.Příčinou bývá paravenózní aplikace s následným toxickým poškozením nervu.
- Povrchová flebitis – vzniká při aplikaci do nevyprázdněné vény, při aplikaci příliš velkého množství roztoku nebo nepřiměřené koncentrace. Podílí se i nedostatečná komprese. Intravarikózní koagulum bývá bolestivé a kosmeticky rušivé. Terapie spočívá v jeho aspiraci stříkačkou nebo v evakuaci po punkci jehlou či skalpelem. Zánětlivý proces může přesahovat i na okolní tkáně a vést k tzv. arteficiální periflebitidě.
- Nekróza – je zapříčiněna aplikací sklerotizačního roztoku paravenózně, do rteriovenózní píštěle, rupturou stěny varixu, zejména při aplikaci pod velkým tlakem, nebo při sklerotizaci v méně kvalitní tkáni. Rozsah nekrózy závisí na množství a koncentraci aplikované látky. Polidocanol v koncentraci 0,25% je možno aplikovat perivaskulárně u teleangiektázií, které nelze sklerotizovat intravaskulárně. Jeho vyšší koncentrace ale již vedou k nekrózám. Je-li tato komplikace zpozorována, doporučuje se aplikovat do postiženého místa směs lokálního anestetika a yziologického roztoku. V průběhu jednoho až dvou týdnů se vytvoří krusta s okolním erytémem. Samotné hojení trvá několik měsíců a zanechává hypopigmentovanou jizvu. V době hojení je vhodné eliminovat sluneční expozici, jinak hrozí hyperpigmentace. Jelikož je spontánní průběh velmi zdlouhavý, je lepší nekrózu excidovat.
- Pigmentace – kosmeticky nepříznivá komplikace, která se zdlouhavě hojí v průběhu mnoha měsíců. V důsledku poškození žilní stěny (ruptura následkem vysokého tlaku injikované látky, natržení jehlou) dochází k extravazaci. Vlastní příčinou jsou depozita hemosiderinu. Její výskyt se dá omezit správnou technikou. Léčba je problematická, nejlepších výsledků dosahuje laser.
- Dysestezie, hypestezie – jsou způsobeny poškozením kožního nervu při sklerotizaci. Mizí do několika měsíců. Závažnější nebo trvalé léze jsou vzácné. Poškození motorických nervů při sklerotizaci epifasciálních žil je nepravděpodobné.
- Intraarteriální aplikace – nejobávanější komplikace s nepříznivými následky. Vzhledem k množství provedených sklerotizací a jen ojedinělým kazuistikám popisujícím intra-arteriální aplikaci se jedná o extrémně vzácnou komplikaci. Její nebezpečí hrozí při sklerotizaci v těch oblastech, kde jsou arterie a véna v těsné blízkosti. To je oblast třísla (a. femoralis, a. pudenda externa), podkolenní jamky (a. poplitea, a. suralis medialis et lateralis, vyživující m. gastrocnemius), oblast vnitřního kotníku (a. tibialis posterior), oblast hřbetu nohy (a. dorsalis pedis) a zejména v okolí bércového vředu, kdy je nebezpečí aplikace do a. tibialis posterior. Známky intraarteriální aplikace mohou být různé – Oesch udává u všech svých čtyř komplikací náhle vzniklé silné bolesti, které nepolevují, ba naopak, v noci zesilují. U všech pacientů byla látka aplikována v oblasti vnitřního kotníku. Bolest většinou nastává v průběhu sklerotizace, je ohraničena na oblast distálně od místa vpichu a je provázena zblednutím nebo cyanózou periferie. Nastane-li tato situace, ponecháme jehlu in situ, odstraníme stříkačku a podle charakteru vytékající krve se přesvědčíme o tom, je-li jehla v tepně či véně. V prvním případě aplikujeme heparin a anestetikum (např. mesocain) i v. zavedenou jehlou. Podmínkou je ovšem rychlá dostupnost heparinu v ambulanci a spolupráce pacienta, což při intenzivní bolesti nemusí být vždy splnitelné. Končetinu ochladíme ledem k zamezení tkáňové hypoxie a pacienta předáme do péče chirurga s cévní specializací. Následuje heparinizace, případně fibrinolytická léčba. Terapie bývá dlouhodobá a téměř vždy zanechává následky, jako přecitlivělost na chlad, amputace prstů, nebo dokonce i v bérci.
- Alergická reakce na sklerotizační roztok je poměrně vzácná. Může být mírná, střední nebo těžká.Příznaky mírné reakce jsou rush, urtika a svědění. Generalizovanou kopřivku je třeba odlišit od lokalizované, která se může normálně objevit v místě vpichu v důsledku reakce endotelu na sklerozující látku. Střední reakce se může projevit otokem laryngu se stridorem a sípotem následkem bronchospazmu. U nejzávažnější alergické reakce dochází ke kardiovaskulárnímu selhání v důsledku periferní vazodilatace. Léčba spočívá v zajištění žilní linky, aplikaci adrenalinu, kortikoidů a antihistaminik.
- Hluboká žilní trombóza a embolizace do a. pulmonalis – jsou komplikace velmi vzácné. Příčina jejich vzniku po sklerotizaci není spolehlivě objasněna. V prevenci je doporučováno zredukovat množství sklerozujícího agens maximálně na 1 ml na jeden vpich. Tím se zabrání jeho průniku do hlubokého žilního systému. Význam má komprese a dostatečná pohybová aktivita. Kritické období pro vznik trombu je přibližně 9 hodin po sklerotizaci, proto má význam komprese noc po výkonu.
- Vzduchová embolie – teoreticky lze uvažovat o možnosti vzduchové embolie při použití air-block techniky nebo sklerotizace s agens ve formě pěny. Avšak tak malá množství vzduchu jsou rozpuštěna v krvi dříve, než se dostanou do plicního oběhu. Aby došlo ke smrtelné vzduchové embolizaci, je třeba aplikovat do žilního systému 480 ml vzduchu v průběhu 20 až 30 sekund u osoby vážící 60 kg.
- Vzhledem k možným komplikacím je nutno mít ve flebologické ambulanci k dispozici adrenalin, hydrokortison, antihistaminikum a prostředky pro endotracheální intubaci.
REHABILITAČNÍ TERAPIE
V důsledku chronické žilní insuficience vázne žilní návrat. Část krve z dolních končetin není odváděna zpět k srdci, ale refluktuje insuficientními body (SFJ, SPJ, perforátory). Dochází k přetěžování žilně-svalové pumpy, která zvětšený objem krve není schopna transportovat.
Fyzikální terapie přináší nemocnému úlevu. Vede k redukci nebo vymizení edému a pocitu těžkých nohou. Má význam jak v terapii, tak v profylaxi žilních onemocnění.
Sedavý způsob života je faktor výrazně zhoršující CVI. Důležitá je intermitentní komprese plantárních žil, která příznivě ovlivňuje žilní návrat směrem k srdci, stejně jako aktivní pohyb v hlezenném ale i kolenním a kýčelním kloubu. Některé stavy, jako porucha klenby nožní a ztuhlost hlezenného kloubu, omezují činnost žilně-svalové pumpy a musí být korigovány. Než dojde k nápravě nebo není-li náprava možná, pak doporučujeme ruční masáže nohou, které aktivují žilní návrat a stimulují cirkulaci. Lze je použít i v prevenci hluboké žilní trombózy u ležících pacientů.
Nejjednodušším a nejfyziologičtějším cvičením je prostá chůze. Je-li stání či sezení nevyhnutelné (cestování), pak žilně-svalovou pumpu aktivujeme cvičením. Vhodné je střídání plantární flexe s dorzální extenzí, opakovaný stoj na špičky, vleže pak procvičení jak velkých kloubů, tak prstů nohou.
Je nutno dodržovat některé zásady: zredukovat hmotnost, omezit sezení či strnulé stání, zvolit vhodný sport. Pacientům s žilním onemocněním doporučujeme sporty jako plavání, cyklistika, běh a běh na lyžích. Za méně vhodné jsou považovány aktivity, při nichž dochází ke zvýšení nitrobřišního tlaku (zvedání těžkých břemen) nebo fixaci hlezenného kloubu (sjezdové lyžování).
Doporučujeme podložení postele u nohou, což příznivě ovlivní žilní návrat a může přispět k redukci otoků přes noc. Příznivě působí chladné koupele dolních končetin. Chlad vede jednak k vasokonstrikci, jednak tlumí zánětlivý proces. Poté, co přestane působit, musíme počítat s reaktivní hyperemií. Naopak horké prostředí může potíže zhoršovat. Tolerance sauny je individuální. Snáší-li ji pacient, pak mu ji nezakazujeme.
Pacienta s chronickou žilní insuficiencí seznámíme se základními patofyziologickými principy onemocnění a aktivně ho do léčby zapojíme. Jeho spolupráce je nutná zejména tehdy, není-li možné potíže odstranit chirurgicky.
10.4.4 Kompresivní terapie v prevenci a léčbě žilních onemocnění dolních končetin
Kompresivní terapie je účinnou metodou v léčbě onemocnění žilního i lymfatického systému dolních končetin. Podporuje nebo nahrazuje nedostatečnou žilně-svalovou pumpu. Jejím cílem je zabránit žilnímu městnání a jeho následkům. Při aplikaci zevní komprese klesá reflux v hlubokém žilním systému. Inkompetentní chlopně se přiblížením svých cípů mohou stát kompetentními. Komprese ur ychluje žilní tok, zvyšuje fibrinolytickou aktivitu žilní stěny a zmenšuje riziko trombózy. Správně aplikovaná zevní komprese má nejvyšší tlak v oblasti hlezna, směrem proximálním tlak klesá. Jedná se o tzv. graduovanou kompresi.
Při kompresivní terapii rozlišujeme fázi terapeutickou a udržovací. Terapeutická trvá tak dlouho, až již nelze dosáhnout další redukce edému, nebo do zhojení vředu. V terapeutické fázi jsou vhodnější neelastická obinadla. Na terapeutickou fázi navazuje fáze udržovací, jejímž cílem je zachovat stav dosažený ve fázi terapeutické. Lze užít elastické materiály. Elastický materiál vykazuje menší efekt na hluboký žilní systém a menší pracovní tlak. Na noc jej sundáváme. Naopak neelastický materiál má vyšší pracovní tlak a lepší efekt na hluboký žilní systém. Zůstává přiložen delší dobu. Významná redukce průměru VSM a hlubokých femorálních žil se projeví až při tlaku od 40 mm Hg. Tlak 40–60 mm Hg na stehně lze docílit správně naloženou krátkotažnou bandáží. Stehenní punčochy II. kompresivní třídy vykazují tlak na stehně kolem 15–20 mm Hg, což nestačí k ovlivnění hemodynamiky širokých povrchových a hlubokých žil stehna.
Kompresivní terapie u pacientů s oboustrannými otoky dolních končetiny vede k nárůstu centrálního objemu krve až o 20%. Hrozí tak přetížení srdce u predisponovaných nemocných.
KOMPRESIVNÍ BANDÁŽ
O účinnosti kompresivní bandáže rozhodují čtyři faktory:
- tlak
Účinná komprese musí mít správný tlak, tj. příliš nízký tlak má za následek neúčinnost komprese a končetinu spíše jen zahřívá, což není pro pacienty s žilním onemocněním optimální. Naopak příliš vysoký tlak může způsobit škody svému nositeli a bývá špatně tolerován. - vrstvy
Každá bandáž je přikládána tak, aby se jednotlivé vrstvy překrývaly, proto vlastně neexistuje jednovrstevná bandáž. Dvouvrstevná bandáž je charakterizována 50% překrytím, vícevrstevná bandáž má překrytí větší nebo je složena z více vrstev. Vícevrstevná bandáž je tvořena více než dvěma vrstvami stejného materiálu nebo více vrstvami různých materiálů. - komponenty
Komponentami rozumíme různé materiály užité ke kompresivní bandáži. Tyto materiály mohou mít různou funkci (ochrana, retence, podložení). Kombinace různých materiálů ovlivňuje tlak a tuhost bandáže. - elasticita
Materiály mohou být elastické (dlouhotažné) a neelastické (krátkotažné). Elasticita je definována jako procento prodloužení bandáže síly 10 N/cm šířky. Kompresivní terapie může být realizována kompresivní bandáží, kompresivní punčochou (KP) nebo intermitentní pneumatickou kompresí.Kompresivní bandáž bérce sahá od prstů až pod koleno, kompresivní bandáž stehna až do proximální části stehna. Vždy zakrývá i patu, jinak je nebezpečí vzniku otoku kolem kotníků. Obvaz přikládáme při dorzální flexi v hlezenním kloubu. Nesmí způsobovat otlaky, zářezy ani působit bolest. Při nakládání obvazu respektujeme Laplaceův zákon, ze kterého vyplývá, že při stejném napětí obvazu je tlak větší nad částmi končetiny s menším poloměrem (hrana tibie) a menší u rovných ploch.Kompresivní bandáže jsou vhodné zejména v léčbě žilních ulcerací, akutní hluboké žilní trombózy (HŽT) a lymfedému, redukují krvácení po operaci varixů. Jejich nevýhodou je ztráta tlaku, takže je nutné je během dne znovu nakládat. Rozlišujeme obinadla krátkotažná (s protažitelností do 70%), střednětažná (s protažitelností do 140%) a dlouhotažná (s protažitelností nad 140%).Obvazy mohou být dočasné nebo trvalé. Dočasné si přikládají pacienti sami, nejlépe, stejně jako KP, ještě na lůžku ráno a snímají je večer, opět na lůžku. Většinou se jedná o středněnebo dlouhotažná obinadla. Jsou indikována zejména tam, kde je třeba častějších převazů, jako například u bércových ulcerací, a tam, kde není dostupný školený personál. Používají se obinadla šíře 8–12 cm, pro bandáž bérce jsou potřeba většinou dvě. V oblasti hlezna použijeme spíše užší, aby nebránila pohybu v kloubu. Příliš úzká obinadla se zařezávají. Obvaz začínáme nakládat na nártu, jde i přes patu směrem proximálním. Musí být pod stálým tahem, což podporujeme silnějším popotažením na laterální a mediální straně, tj. dvakrát během jedné otáčky. Trvalé obvazy zůstávají i při spánku a bývají přiloženy několik dnů až týdnů. Používají se krátkotažná obinadla. Jejich nevýhodou je to, že je musí vždy přikládat školený pracovník a hůře se zajišťuje hygiena pod obvazem.
INTERMITENTNÍ PNEUMATICKÁ KOMPRESE
Intermitentní pneumatická komprese je vhodná v prevenci pooperační trombózy, v léčbě posttrombotického syndromu a lymfedému. Spočívá v rytmické zevní kompresi dolní končetiny, ideálně každou 10. minutu, tlakem kolem 40 mm Hg. Zrychluje krevní tok v žilním systému a zabraňuje stáze.
KOMPRESIVNÍ PUNČOCHY
Kompresivní punčochy jsou základním terapeutickým prvkem v léčbě onemocnění žilního a lymfatického systému. Jsou vyráběny ze zátažné výplňkové pleteniny na plochých (se švem) nebo okrouhlých (bezešvé) pletacích strojích. Základ pružného vlákna tvoří lastodien nebo elastin. Pro kompresi má význam výplňková nit tvořená zpravidla opředeným pružným jádrem a jako opřed se používá příze (upředená nit z přírodních nebo syntetických vláken o určité délce – staplu) nebo hedvábí (nekonečné vlákno přírodní nebo syntetické). Základní nit se skládá ze svazku vláken (fibril). Jemnost nitě se udává v dtex (tex – váha 1 km příze v gramech, dtex = decitex). Pokud je množství fibril větší než číslo jemnosti udané v dtex, říkáme o materiálu, že je to mikrovlákno. Z přírodních vláken se nejčastěji používá bavlna a ze syntetických polyamid. Pro zlepšení mechanických vlastností se používá kadeřený polyamid (teplem nebo protažením přes ostrou hranu).
Kompresivní punčochy musí odpovídat normě (t. č. se využívá německá norma RAL). Mají různé délky (lýtková, stehenní, kalhotové punčochy). Mohou být s otevřenou či zavřenou špicí, oblast špice by měla být elastická, aby se zabránilo konstrikci. V nenataženém stavu mají tloušťku 0,5–1,4 mm a obsahují polyamid, elastan, bavlnu, elastodien, viskózu a mikrovlákna.
Punčochy s nízkým tlakem (10–15 mm Hg) mají význam pro redukci otoku po delším sezení nebo stání a zrychlují tok krve u ležících. Zmírňují příznaky žilního onemocnění, jako pocit těžkých dolních končetin u pacientů s lehčím postižením žilního systému a v graviditě. Mohou být také použity k fixaci krytí naloženého na bércovou ulceraci. Mají význam v prevenci TEN u ležících pacientů, zvláště po operaci.
Punčochy s vyššími tlaky (20–30 mm Hg) jsou indikovány pro vzpřímenou polohu. U pacientů s chronickou žilní insuficiencí snižují reflux a podporují žilně-svalovou pumpu. Jsou indikovány po sklerotizaci varixů, v těhotenství, pro léčbu akutní HŽT. Vysoké tlaky (30–40 mmHg) jsou vhodné pro redukci lipodermatosklerózy, pro léčbu lymfedému a prevenci recidivy bércových ulcerací žilní etiologie a snižují výskyt posttrombotického syndromu.
Vysoké tlaky mohou vést k poškození kůže. Stálý tlak vyšší než 70 mm Hg, zejména nad kostními prominencemi, je považován za horní hranici. Při použití intermitentní pneumatické komprese lze užít i tlaky vyšší než 120 mm Hg. Zásadní význam při předpisu kompresivní punčochy má přesné změření měr definovaných míst, tj. obvod nad kotníkem a dalšími místy dolní končetiny. V případě, že se míry u pacienta vymykají běžným rozměrům, každý výrobce zhotoví punčochu na míru. V akutní fázi je vhodný kompresivní obvaz (Kaletová, 2006). Po stabilizaci stavu (ústup otoku, zhojení ulcerace) lze předepsat KP. V pokročilých stadiích chronické venózní insuficience bývá postižena i kůže, která může být citlivá na různé materiály. U takových pacientů lze volit punčochy v antimikrobiální úpravě.
Kontraindikace KP: pokročilá stadia ischemické choroby dolních končetin, kritická končetinová ischemie, dekompenzovaná kardiální insuficience, dermatózy s výraznou exsudací, intolerance některé komponenty punčochy. Nevhodně zvolená KP může být neúčinná nebo může způsobit tlakové poškození kůže a periferních nervů.
Většinou je častěji předepisována lýtková kompresivní punčocha. Na lýtku se manifestují známky chronické žilní insuficience (CVI) a lokální komprese zlepšuje mirkocirkulaci v nejvíce postižené oblasti. Měření ukázala, že stehenní KP nezvýší množství vypuzené krve ve srovnání s lýtkovou KP (Partsch,
1984). Stehenní punčocha může svému nositeli způsobovat určitý diskomfort v oblasti fossa poplitea při sezení.
Je-li indikována komprese > 40 mm Hg, je vhodnější použít krátkotažné neelastické materiály než KP. KP o hodnotách tlaku 40 mm Hg se špatně aplikují a nejsou dobře tolerovány. Neelastická bandáž má lepší hemodynamický efekt než elastická. Je to způsobeno vyšším pracovním tlakem. Tlak bandáže a technika jejího naložení jsou výrazně závislé na osobě, která bandáž přikládá.
INDIKACE KOMPRESIVNÍ TERAPIE
- Kompresivní terapie u pacientů s hlubokou žilní trombózou
V terapii akutní hluboké žilní trombózy je tradiční klid na lůžku nahrazen kompresivní terapií s chůzí. Tato léčba nezvyšuje riziko PE, vykazuje rychlejší ústup bolesti a otoku a je i lepší kvalita života. Komprese s pohybem redukuje šíření trombu a má význam v prevenci posttrombotického syndromu. Tuto léčbu lze provádět ambulantně. Samozřejmostí je antikoagulační léčba (LWMH, warfarin). Účinná konzervativní léčba (antikoagulační, kompresivní) v prvních 24 hodinách po diagnóze HŽT má zásadní význam pro snížení pravděpodobnosti recidivy. Klid na lůžku v prvních 24 hodinách podporuje propagaci trombu – viz Virchowova tria. U některých diagnóz může být klid na lůžku dokonce škodlivý.Nezávisle na lokalizaci trombu zahajujeme antikoagulační léčbu (LMWH, warfarin), indikujeme pohyb a kompresi. Vhodná je pevná, neelastická bandáž nebo KP II.–III. třídy. Měla by být ponechána alespoň jeden rok. - Kompresivní terapie v prevenci posttrombotického syndromu
Definice posttrombotického syndromu není jednotná (kritéria pro dg. posttrombotického syndromu: flebotrombóza v anamnéze, klinické známky a symptomy a objektivní potvrzení chlopenní dysfunkce – DUS, pletyzmograficky), všeobecně jím rozumíme přítomnost trofických kožních změn (C4 a více dle CEAP klasifikace) spolu se subjektivními obtížemi nemocného (bolest, pocit těžkých nohou, pocit horka, napětí, únavnost) po prodělané hluboké žilní trombóze. Prolongované (déle než 6 měsíců trvající) nošení kompresivních punčoch po hluboké žilní trombóze signifikantně redukuje příznaky a může předcházet rozvoji posttrombotických kožních změn. - Kompresivní terapie u pacientů s tromboflebitidou
Nezávisle na tom, zda je postižena varikózně změněná véna či zdravá véna, převažuje-li složka zánětlivá či trombogenní a je-li proces omezen pouze na samotnou vénu nebo i na její okolí (periphlebitis), je základním terapeutickým principem komprese a mobilizace. Komprese má za následek regresi zánětlivého procesu, ústup bolesti a redukci otoku. Vhodná je KP II. třídy nebo bandáž. - Kompresivní terapie v letecké dopravě
Vztah mezi dlouhým sezením a plicní embolií (PE) je znám již z dob druhé světové války, kdy nucené dlouhodobé sezení v protileteckých krytech mělo za následek fatální PE. Stejně tak se jeví spojitost mezi dlouhými lety a vznikem HŽT. U pacientů, kteří nemají rizikové faktory pro HŽT, je její incidence kolem 1,6%, u pacientů s rizikovými faktory dosahuje až 5%. Za rizikové faktory se považuje anamnéza HŽT, vyšší věk, trauma v nedávné minulosti, varixy dolních končetin, obezita, srdeční onemocnění, maligní onemocnění, hormonální terapie, omezení hybnosti pro postižení kostí nebo kloubů, těhotenství.
V prevenci má význam kompresivní punčocha s tlakem u kotníku (obvod „b“) 14–30 mm Hg, která současně redukuje otok končetiny. Snad by mohlo být nižší riziko vzniku HŽT u pacientů sedících v uličce než u pacientů u okna nebo na středním
sedadle, pravděpodobně pro snazší možnost pohybu. Zatímco přínos kompresivní punčochy a aplikace LMWH lze považovat za prokázaný, ostatní preventivní opatření spíše předpokládáme – dostatek tekutin, minimum alkoholu a kávy, pravidelné protažení dolních končetin, střídání plantární/dorzální flexe v hlezenním kloubu, krátká chůze každou hodinu. Riziko vzniku PE je vyšší u letů delších než 5000 km nebo trvajících déle než 5 hodin. Incidence PE se v těchto případech udává 1,5 až 2,57 na milion cestujících. V medikamentózní prevenci má význam LMWH, anopyrin nikoliv. - Kompresivní terapie v těhotenství a šestinedělí
V těhotenství se riziko vzniku tromboembolické nemoci, ve srovnání s netěhotnými ženami, zvyšuje třiaž šestkrát, v šestinedělí dokonce čtrnáctkrát. Riziko vzniku trombózy je nejvyšší ve třetím trimestru a po porodu. Kompresivní punčochy redukují symptomatologii žilní insuficience a snižují reflux v safenofemorální junkci. Vhodné jsou KP I. nebo II. třídy. - Kompresivní terapie po operaci varixůAplikace kompresivní bandáže po operaci varixů je standardním úkonem. Snižuje výskyt tromboflebitidy, HŽT, zlepšuje hojení ran, redukuje bolest a vznik hematomu. Není jednotný názor na to, jak dlouho po operaci zachovat kompresi, pravděpodobně stačí týden, závisí ale na stadiu choroby a rozsahu operace.
- Kompresivní terapie u aktivní bércové ulcerace (C6)
Kompresivní terapie je považována za základní stavební kámen při léčbě bércové ulcerace. Zásadní význam zde má neelastické obinadlo s vysokým pracovním a nízkým klidovým tlakem. Pro vyrovnání nerovností nebo pro zvýšení lokálního tlaku lze použít pod bandáž houbičku. Bércovou ulceraci žilní etiologie je možné zhojit pouhou bandáží. V léčbě bércové ulcerace lze použít i kompresivní punčochu, přestože je elastická. Buď běžnou,která se obtížně nakládá a hůře se udržuje její čistota při floridní ulceraci, nebo speciální punčochy pro léčbu ulcerací se zipem. Nověji se aplikuje zevní komprese v podobě více pásů (Deona fast – obr. 12). - Kompresivní terapie u zhojené bércové ulcerace (C5)
U zhojené bércové ulcerace má kompresivní terapie význam pro zachování dosaženého stavu, a to
zejména tam, kde již není možná léčba chirurgická.
Doporučuje se KP III. třídy.
- Kompresivní terapie u kožních změn (ekzém, pigmentace) žilní etiologie (C4a)
Kompresivní terapie u kožních změn typu ekzém a pigmentace, tj. ve stadiu C4a, není tak významná, jako u jiných onemocnění žilní etiologie. Jelikož ale tyto změny vznikají následkem žilní hypertenze, i zde je komprese indikována. Dostačující je KP II. třídy. - Kompresivní terapie u kožních změn (lipodermatoskleróza, atrophie blance) žilní etiologie (C4b)
Kompresivní terapie je indikována u lipodermatosklerózy a atrophie blanche, neboť výrazně redukuje tyto kožní změny. Doporučené jsou KP III. třídy. - Kompresivní terapie u žilního otoku (C3)
Otoky žilní etiologie jsou základní a nejčastější indikací kompresivní terapie. Otok zhoršuje cirkulaci v kůži, zásobování kyslíkem a živinami. Pacienti s otoky udávají pocit těžkých končetin, tenzi a bolesti. Kompresivní terapie zlepší žilní hemodynamiku, tj. redukuje žilní reflux a žilní hypertenzi. Vhodné jsou KP II. třídy. - Kompresivní terapie u velkých symptomatických varixů C2S
U symptomatických pacientů (pocit těžkých nohou, bolesti, svědění) bývá kompresivní terapie účinná, záleží na pacientovi, je-li
ochoten ji tolerovat.
- Kompresivní terapie u velkých asymptomatických varixů C2A
U pacientů s velkými varixy bývá kompresivní terapie často doporučována s cílem prevence progrese choroby a komplikací. Takovýto efekt kompresivní terapie však nebyl prokázán.Kompresivní terapie je indikována i po sklerotizaci, jejíž je nedílnou součástí, proto kompresivní skleroterapie a po endovenózních laserových nebo RF operacích.
- Kompresivní terapie u lymfatických otoků
Při terapii lymfedému jsou v počátku indikována neelastická, krátkotažná obinadla. Jejich účinek je, zejména při vícevrstevném použití, výraznější než při aplikaci kompresivních elastických punčoch.I když není stanovena přesná hodnota tlaku, který by měl být u lymfedému aplikován, obecně se doporučují tlaky vyšší než u otoků čistě žilní etiologie. Většinou se jedná o tlaky kolem 45 mm Hg i více,
pouze u pacientů s nižším ABI (ABI méně než 0,5) nebo při subjektivní nesnášenlivosti vyšších tlaků lze aplikovat hodnoty nižší. U pacientů s lymfedémem však bývá měření ABI problematické. Léčba je dlouhodobá a většinou se po několika měsících přechází z obinadel ke KP. Výjimku tvoří pacienti s intolerancí KP a s křehkou kůží, která se při aplikaci KP poškozuje. Velmi důležitá je kvalita punčoch. Kompresivní punčochy mohou mít nižší než ožadovaný tlak nebo i obrácené tlakové gradienty, což způsobuje žilní kongesci a zvyšuje riziko vzniku HŽT.